Манноза - Mannose
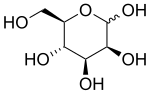 D-Маннопираноза | |
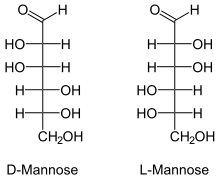 Проекции Фишера | |
| Идентификаторы | |
|---|---|
| ЧЭМБЛ | |
| ChemSpider |
|
| ECHA InfoCard | 100.007.705 |
| MeSH | Манноза |
PubChem CID | |
| UNII | |
| Характеристики | |
| C6ЧАС12О6 | |
| Молярная масса | 180.156 г · моль−1 |
| -102.90·10−6 см3/ моль | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Манноза это сахар мономер из альдогексоза серия углеводы. Это C-2 эпимер из глюкоза. Манноза важна для человека метаболизм, особенно в гликозилирование определенных белки. Несколько врожденные нарушения гликозилирования связаны с мутациями в ферменты участвует в метаболизме маннозы.[1]
Манноза не необходимое питательное вещество; он может вырабатываться в организме человека из глюкозы или превращаться в глюкозу. Манноза обеспечивает 2-5 ккал /грамм. Частично выводится с моча.
Структура
Манноза обычно существует в виде двух колец разного размера, пираноза (шестичленная) форма и фураноза (пятичленная) форма. Каждое замыкание кольца может иметь альфа- или бета-конфигурацию на аномерный позиция. Химикат быстро подвергается изомеризация среди этих четырех форм.
 α-D-Маннофураноза | |
 α-D-Маннопираноза 67% | 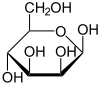 β-D-Маннопираноза 33% |
Метаболизм

Хотя считается, что большая часть маннозы, используемой при гликозилировании, происходит из глюкозы, в культурный гепатома клетки (раковые клетки печени), большая часть маннозы для биосинтеза гликопротеинов поступает из внеклеточной маннозы, а не из глюкозы.[2] Многие гликопротеины, производимые в печени, секретируются в кровоток, поэтому манноза с пищей распределяется по всему телу.[3]
Манноза присутствует во многих гликоконъюгатах, включая N-связанное гликозилирование белков. C-Маннозилирование также широко распространено и может быть обнаружено в коллагеноподобных областях.
Переваривание многих полисахаридов и гликопротеинов дает маннозу, которая фосфорилируется гексокиназа с образованием маннозо-6-фосфата. Манноза-6-фосфат превращается в фруктозо-6-фосфат, ферментом фосфоманнозоизомераза, а затем входит в гликолитический путь или преобразован в глюкозо-6-фосфат посредством глюконеогенный путь из гепатоциты.
Манноза является доминирующим моносахаридом в N-связанное гликозилирование, которое представляет собой посттрансляционная модификация белков. Он инициирован в блоке перенос на Glc3Man9GlcNAc2 к возникающим гликопротеинам в эндоплазматическом ретикулуме ко-трансляционным способом, когда белок поступает через транспортную систему. Глюкоза - это гидролизованный на полностью свернутом белке, и маннозные фрагменты гидролизуются ER и маннозидазами, резидентными по Гольджи. Обычно зрелые гликопротеины человека содержат только три остатка маннозы, скрытые при последовательной модификации GlcNAc, галактозой и сиаловой кислотой. Это важно, поскольку врожденная иммунная система у млекопитающих приспособлена к распознаванию открытых остатков маннозы. Эта активность обусловлена преобладанием остатков маннозы в форме маннанов на поверхности дрожжей. Вирус иммунодефицита человека отображает значительное количество остатков маннозы из-за плотной кластеризации гликанов в его вирусном шипе.[4][5] Эти остатки маннозы являются мишенью для широко нейтрализующих антител.[6]
Биотехнологии
Рекомбинантные белки, продуцируемые дрожжами, могут подвергаться добавлению маннозы по образцам, отличным от тех, которые используются клетками млекопитающих.[7] Это отличие рекомбинантных белков от белков, которые обычно образуются в организмах млекопитающих, может влиять на эффективность вакцин.
Формирование
Манноза может быть образована окислением маннитол.
Он также может быть образован из глюкозы в Преобразование Лобри-де-Брюн-ван Экенштейна.
Этимология
Корень слов "манноза" и "маннитол " является манна, который Библия описывает как пищу, доставленную израильтянам во время их путешествия по региону Синай. Некоторые деревья и кусты могут производить вещество, называемое манной, например, «манновое дерево» (Fraxinus ornus ), из секрета которого первоначально был изолирован маннит.
Использует
Манноза (D-манноза) используется в качестве пищевой добавки, упакованной как «d-манноза», для предотвращения рецидивирующих инфекций мочевыводящих путей. [8]
Конфигурация
Манноза отличается от глюкозы инверсией C-2 хиральный центр. Манноза отображает морщинка в форме кольца раствора. Это простое изменение приводит к совершенно разной биохимии двух гексоз. Это изменение оказывает такое же влияние на другие альдогексозы, также.
Пермеаза маннозы PTS

PEP-зависимая система транспортировки сахара фосфотрансферазы транспортирует и одновременно фосфорилирует свои сахарные субстраты. Манноза XYZ пермеаза является членом семейства, при этом этот особый метод используется бактериями для поглощения сахара, особенно экзогенных гексоз, в случае маннозы XYZ, для высвобождения сложных эфиров фосфата в цитоплазму клетки при подготовке к метаболизму, главным образом, путем гликолиза.[9] Транспортный комплекс MANXYZ также участвует в инфицировании Кишечная палочка бактериофагом лямбда, причем субъединицы ManY и ManZ достаточно для инфицирования собственно лямбда-фагом.[10]MANXYZ имеет четыре домена в трех полипептидных цепях; ManX, ManY и ManZ. Субъединица ManX образует гомодимер, локализованный на цитоплазматической стороне мембраны. ManX содержит два домена IIA и IIB, связанных шарнирным пептидом с каждым доменом, содержащим сайт фосфорилирования, и перенос фосфорила происходит между обеими субъединицами.[11] ManX может быть мембраносвязанным или нет.[10] Субъединицы ManY и ManNZ представляют собой гидрофобные интегральные мембранные белки с шестью и одним трансмембранным альфа-спиральным гаечным ключом (ключами).[12] [13]Фосфорильная группа PEP передается импортируемому сахару через фермент 1, носитель гистидин-протеинфосфата, а затем субъединицы ManX, ManY и ManZ транспортного комплекса ManXYZ, который фосфорилирует поступающий сахар гексозы, создавая гексозу-6- фосфат.
Смотрите также
- α-маннозидаза
- Рецептор маннозы
- Пищевые добавки на основе маннановых олигосахаридов
- Рамноза, 6-дезокси-L-манноза
Рекомендации
- ^ Freeze, H.H .; Шарма, В. (2010). «Метаболические манипуляции с нарушениями гликозилирования у людей и животных». Семинары по клеточной биологии и биологии развития. 21 (6): 655–662. Дои:10.1016 / j.semcdb.2010.03.011. ЧВК 2917643. PMID 20363348.
- ^ Alton, G .; Хасилик, М .; Niehues, R .; Panneerselvam, K .; Etchison, J. R .; Fana, F .; Фриз, Х. Х. (1998). «Прямое использование маннозы для биосинтеза гликопротеинов млекопитающих». Гликобиология. 8 (3): 285–295. Дои:10.1093 / гликоб / 8.3.285. PMID 9451038.
- ^ Дэвис, Дж. А .; Фриз, Х. Х. (2001). «Исследования метаболизма маннозы и последствий длительного употребления маннозы у мышей». Biochimica et Biophysica Acta (BBA) - Общие предметы. 1528 (2–3): 116–126. Дои:10.1016 / S0304-4165 (01) 00183-0. PMID 11687298.
- ^ Причард, Лаура К .; Спенсер, Дэниел И. Р .; Ройл, Луиза; Бономелли, Камилла; Сибрайт, Джемма Э .; Беренс, Анна-Янина; Kulp, Daniel W .; Менис, Сергей; Крумм, Стефани А. (24.06.2015). «Кластеризация гликанов стабилизирует маннозный участок ВИЧ-1 и сохраняет уязвимость для широко нейтрализующих антител». Nature Communications. 6: 7479. Bibcode:2015НатКо ... 6.7479P. Дои:10.1038 / ncomms8479. ЧВК 4500839. PMID 26105115.
- ^ Причард, Лаура К .; Васильевич, Снежана; Озоровский, Габриэль; Сибрайт, Джемма Э .; Купо, Альберт; Ринге, Раджеш; Ким, Хелен Дж .; Сандерс, Роджер В .; Дур, Кэти Дж. (2015-06-16). «Структурные ограничения определяют гликозилирование тримеров оболочки ВИЧ-1». Отчеты по ячейкам. 11 (10): 1604–1613. Дои:10.1016 / j.celrep.2015.05.017. ISSN 2211-1247. ЧВК 4555872. PMID 26051934.
- ^ Криспин, Макс; Дур, Кэти Дж. (2015-04-01). «Нацеливание на гликаны, полученные из хозяина, на вирусы с оболочкой для разработки вакцины на основе антител». Текущее мнение в вирусологии. Вирусный патогенез • Профилактические и лечебные вакцины. 11: 63–69. Дои:10.1016 / j.coviro.2015.02.002. ЧВК 4827424. PMID 25747313.
- ^ Vlahopoulos, S .; Gritzapis, A.D .; Perez, S.A .; Cacoullos, N .; Папамихаил, М .; Баксеванис, К. Н. (2009). "Добавление маннозы дрожжами Pichia pastoris на рекомбинантном белке HER-2 ингибирует распознавание моноклональным антителом герцептин ». Вакцина. 27 (34): 4704–4708. Дои:10.1016 / j.vaccine.2009.05.063. PMID 19520203.
- ^ Porru, D .; Parmigiani, A .; Tinelli, C .; Barletta, D .; Choussos, D .; Di Franco, C .; Роверето, Б. (2014). «Пероральный прием D-маннозы при рецидивирующих инфекциях мочевыводящих путей у женщин: пилотное исследование». Журнал клинической урологии. 7 (3): 208–213. Дои:10.1177/2051415813518332. S2CID 73362601.
- ^ Postma, P.W .; Lengeler, J. W .; Якобсон, Г. Р. (1993). «Фосфоенолпируват: углеводные фосфотрансферазные системы бактерий». Микробиологические обзоры. 57 (3): 543–594. Дои:10.1128 / MMBR.57.3.543-594.1993. ЧВК 372926. PMID 8246840.
- ^ а б Эрни, Б .; Занолари, Б. (1985). «Манноза-пермеаза бактериальной фосфотрансферазной системы. Клонирование генов и очистка ферментного комплекса IIMan / IIIMan. кишечная палочка". Журнал биологической химии. 260 (29): 15495–15503. PMID 2999119.
- ^ Эрни, Б .; Zanolari, B .; Graff, P .; Кочер, Х. П. (1989). «Маннозная пермеаза Escherichia coli. Доменная структура и функция фосфорилирующей субъединицы». Журнал биологической химии. 264 (31): 18733–18741. PMID 2681202.
- ^ Huber, F .; Эрни, Б. (1996). "Мембранная топология переносчика маннозы кишечная палочка К12 ". Европейский журнал биохимии / FEBS. 239 (3): 810–817. Дои:10.1111 / j.1432-1033.1996.0810u.x. PMID 8774730.
- ^ Лю, Сюэли; Цзэн, Цзяньвэй; Хуанг, Кай; Ван, Цзявэй (17.06.2019). «Структура переносчика маннозы бактериальной фосфотрансферазной системы». Клеточные исследования. 29 (8): 680–682. Дои:10.1038 / s41422-019-0194-z. ISSN 1748-7838. ЧВК 6796895. PMID 31209249.


