ДНК-гликозилаза - Википедия - DNA glycosylase
ДНК гликозилазы семья ферменты участвует в базовая эксцизионная пластика, классифицированный как Номер ЕС EC 3.2.2. Базовая эксцизионная пластика это механизм, с помощью которого поврежденные базы в ДНК удаляются и заменяются. ДНК-гликозилазы катализируют первую стадию этого процесса. Они удаляют поврежденное азотистое основание, оставляя сахарно-фосфатный остов нетронутым, создавая апуриновый / апиримидиновый сайт, обычно называемый Сайт AP. Это достигается листать поврежденное основание из двойной спирали с последующим разрывом N-гликозидная связь.[1]
Гликозилазы были впервые обнаружены у бактерий, а с тех пор были обнаружены во всех царствах жизни. Помимо своей роли в эксцизионной репарации оснований, ферменты ДНК-гликозилазы участвуют в подавлении сайленсинга генов в A. thaliana, N. tabacum и другие растения путем активного деметилирования. Остатки 5-метилцитозина вырезаются и заменяются неметилированными цитозинами, обеспечивая доступ к структуре хроматина ферментов и белков, необходимых для транскрипции и последующей трансляции.[2][3]
Монофункциональные против бифункциональных гликозилаз
Существует два основных класса гликозилаз: монофункциональные и бифункциональные. Монофункциональные гликозилазы обладают только гликозилазной активностью, тогда как бифункциональные гликозилазы также обладают AP. лиазе деятельность, которая позволяет им сократить фосфодиэфирная связь ДНК, создавая однонитевой разрыв без необходимости Эндонуклеаза AP. β-Удаление АР-сайта гликозилазой-лиазой дает 3 'α, β-ненасыщенный альдегид, соседний с 5' фосфатом, который отличается от продукта расщепления АР-эндонуклеазой.[4] Некоторые гликозилаза-лиазы могут дополнительно выполнять -элиминирование, которое превращает 3'-альдегид в 3'-фосфат.
Биохимический механизм
Первый Кристальная структура ДНК-гликозилазы был получен для E. coli Nth.[5] Эта структура показала, что фермент переворачивает поврежденное основание из двойной спирали в карман активного сайта, чтобы вырезать его. С тех пор было обнаружено, что другие гликозилазы следуют той же общей парадигме, включая человеческий UNG, изображенный ниже. Чтобы расщепить N-гликозидную связь, монофункциональные гликозилазы используют активированную молекулу воды для атаки на углерод 1 субстрата. Бифункциональные гликозилазы вместо этого используют остаток амина в качестве нуклеофила для атаки того же углерода, проходя через База Шиффа средний.
Типы гликозилаз
Кристаллические структуры многих гликозилаз были решены. На основании структурного сходства гликозилазы разделены на четыре суперсемейства. В UDG и AAG семейства содержат небольшие компактные гликозилазы, тогда как MutM / Fpg и HhH-GPD семейства включают более крупные ферменты с множеством доменов.[4]
Широкий спектр гликозилаз эволюционировал для распознавания различных поврежденных оснований. В таблице ниже суммированы свойства известных гликозилаз в обычно изучаемых модельных организмах.
| Кишечная палочка | B. cereus | Дрожжи (С. cerevisiae) | Человек | Тип | Субстраты |
|---|---|---|---|---|---|
| AlkA | AlkE | Mag1 | MPG (N-метилпурин ДНК-гликозилаза) | монофункциональный | 3-meA (3-алкиладенин), гипоксантин |
| UDG | Ung1 | UNG | монофункциональный | урацил | |
| Fpg | Ogg1 | часOGG1 | бифункциональный | 8-oxoG (8-оксогуанин), FapyG | |
| Nth | Ntg1 | часNTH1 | бифункциональный | Tg, hoU, hoC, мочевина, FapyG (2,6-диамино-4-гидрокси-5-формамидопиримидин) | |
| Ntg2 | |||||
| Nei | Нет | hNEIL1 | бифункциональный | Tg, hoU, hoC, мочевина, FapyG, FapyA (4,6-диамино-5-формамидопиримидин) | |
| hNEIL2 | AP site, hoU | ||||
| hNEIL3 | неизвестный | ||||
| MutY | Нет | hMYH | монофункциональный | А: 8-oxoG | |
| Нет | Нет | hSMUG1 | монофункциональный | U, hoU (5-гидроксиурацил), hmU (5-гидроксиметилурацил), fU (5-формилурацил) | |
| Нет | Нет | TDG | монофункциональный | T: G неправильная пара | |
| Нет | Нет | MBD4 | монофункциональный | T: G неправильная пара | |
| AlkC | AlkC | Нет | Нет | монофункциональный | Алкилпурин |
| AlkD | AlkD | Нет | Нет | монофункциональный | Алкилпурин |
ДНК-гликозилазы можно разделить на следующие категории в зависимости от их субстрата (субстратов):
Урацил ДНК гликозилазы

В молекулярной биологии белок семья, Урацил-ДНК гликозилаза (UDG) - это фермент что возвращается мутации в ДНК. Самая распространенная мутация - это дезаминирование из цитозин к урацил. UDG исправляет эти мутации. UDG имеет решающее значение в Ремонт ДНК, без него эти мутации могут привести к рак.[8]
Эта запись представляет различные урацил-ДНК-гликозилазы и родственные ДНК-гликозилазы (EC ), такие как урацил-ДНК-гликозилаза,[9] теплолюбивый урацил-ДНК гликозилаза,[10] G: ДНК-гликозилаза, специфичная для несоответствия T / U (Mug),[11] и одноцепочечная селективная монофункциональная урацил-ДНК-гликозилаза (SMUG1).[12]
Урацил ДНК-гликозилазы удаляют урацил из ДНК, которые могут возникнуть либо в результате спонтанного дезаминирования цитозина, либо в результате неправильного включения dU напротив dA во время Репликация ДНК. Прототипом этого семейства является UDG E. coli, который был среди первых обнаруженных гликозилаз. В клетках млекопитающих идентифицированы четыре различных активности урацил-ДНК-гликозилазы, в том числе UNG, SMUG1, TDG, и MBD4. Они различаются по субстратной специфичности и субклеточной локализации. SMUG1 предпочитает одноцепочечную ДНК в качестве субстрата, но также удаляет U из двухцепочечной ДНК. Помимо немодифицированного урацила, SMUG1 может вырезать 5-гидроксиурацил, 5-гидроксиметилурацил и 5-формилурацил с окисленной группой в кольце C5.[13] TDG и MBD4 строго специфичны для двухцепочечной ДНК. TDG может удалять тимингликоль, когда он присутствует напротив гуанина, а также производные U с модификациями у углерода 5. Текущие данные свидетельствуют о том, что в клетках человека TDG и SMUG1 являются основными ферментами, ответственными за восстановление неправильных пар U: G, вызванных спонтанное дезаминирование цитозина, тогда как с урацилом, возникающим в ДНК в результате неправильного включения dU, в основном занимается UNG. Считается, что MBD4 исправляет несовпадения T: G, возникающие в результате дезаминирования 5-метилцитозина до тимина в сайтах CpG.[14] Мыши с мутантами MBD4 развиваются нормально и не проявляют повышенной восприимчивости к раку или снижения выживаемости. Но они приобретают больше мутаций C T в последовательностях CpG в эпителиальных клетках тонкой кишки.[15]
Структура UNG человека в комплексе с ДНК показала, что, как и другие гликозилазы, он переворачивает целевой нуклеотид из двойной спирали в карман активного сайта.[16] UDG претерпевает конформационные изменения из «открытого» несвязанного состояния в «закрытое» состояние, связанное с ДНК.[17]
| UDG | |||||||||
|---|---|---|---|---|---|---|---|---|---|
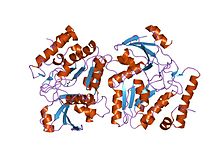 Урацил-ДНК-гликозилаза вируса Эпштейна-Барра в комплексе с ugi из pbs-2 | |||||||||
| Идентификаторы | |||||||||
| Символ | UDG | ||||||||
| Pfam | PF03167 | ||||||||
| ИнтерПро | IPR005122 | ||||||||
| PROSITE | PDOC00121 | ||||||||
| SCOP2 | 1 судья / Объем / СУПФАМ | ||||||||
| CDD | cd09593 | ||||||||
| |||||||||
История
Линдал был первым, кто наблюдал за восстановлением урацила в ДНК. УДГ очищен от кишечная палочка, и это гидролизовало N-гликозидная связь соединение основания с дезоксирибозным сахаром основной цепи ДНК.[8]
Функция
Функция UDG заключается в удалении мутаций в ДНК, а точнее в удалении урацила.
Структура
Эти белки иметь 3-слойную альфа / бета / альфа структура.Полипептидная топология UDG - это классический альфа / бета-белок. Структура состоит в основном из центрального, четырехцепочечного, полностью параллельного бета-листа, окруженного с обеих сторон в общей сложности восемью альфа-спиралями, и называется параллельным бета-листом с двойной намоткой.[9]
Механизм
Урацил-ДНК-гликозилазы восстанавливают ДНК ферменты этот акциз урацил остатки из ДНК путем расщепления N-гликозидной связи, инициируя базовая эксцизионная пластика путь. Урацил в ДНК может возникать либо в результате дезаминирования цитозин образовывать мутагенные U: G неправильные пары или за счет включения dUMP ДНК полимераза образовать U: A пары.[18] Эти аберрантные остатки урацила генотоксичны.[19]
Локализация
В эукариотический клеток, активность УНГ обнаруживается как в ядро и митохондрии. Человек Белок UNG1 транспортируется как в митохондрии и ядро.[20]
Сохранение
В последовательность урацил-ДНК гликозилазы очень хорошо консервированный[21] в бактерии и эукариоты а также в вирусы герпеса. Более отдаленные родственные урацил-ДНК-гликозилазы также обнаружены в поксвирусы.[22]N-терминал 77 аминокислоты UNG1, кажется, требуется для митохондриальный локализация, но наличие митохондриальный транзит пептид не было продемонстрировано напрямую. Самый N-концевой консервированный регион содержит аспарагиновая кислота остаток который был предложен на основе рентгеновский снимок структуры[23] действовать как общая база в каталитический механизм.
Семья
Существует два семейства UDG, называемых семейством 1 и семейством 2. Семейство 1 активно против урацила в оцДНК и дцДНК. Семейство 2 акцизный урацил из несоответствий с гуанин.[8]
Гликозилазы окисленных оснований

Разнообразные гликозилазы эволюционировали для распознавания окисленных оснований, которые обычно образуются реактивными формами кислорода, образующимися во время клеточного метаболизма. Наиболее частыми поражениями, образованными на остатках гуанина, являются 2,6-диамино-4-гидрокси-5-формамидопиримидин (FapyG) и 8-оксогуанин. Из-за неправильного спаривания с аденином во время репликации 8-oxoG обладает сильным мутагенным действием, что приводит к трансверсиям G в T. Ремонт этого поражения инициируется бифункциональной ДНК-гликозилазой. OGG1, который распознает 8-oxoG в паре с C.hOGG1, представляет собой бифункциональную гликозилазу, которая принадлежит к семейству спираль-шпилька-спираль (HhH). MYH распознает аденин, неправильно спаренный с 8-oxoG, но удаляет A, оставляя 8-oxoG нетронутым. Мыши с нокаутом OGG1 не показывают увеличения заболеваемости опухолями, но с возрастом накапливают 8-oxoG в печени.[24] Аналогичный фенотип наблюдается при инактивации MYH, но одновременная инактивация как MYH, так и OGG1 вызывает накопление 8-oxoG во многих тканях, включая легкие и тонкий кишечник.[25] У людей мутации MYH связаны с повышенным риском развития полипы толстой кишки и рак толстой кишки. Помимо OGG1 и MYH, клетки человека содержат три дополнительных ДНК-гликозилазы, NEIL1, NEIL2, и NEIL3. Они гомологичны бактериальному Nei, и их присутствие, вероятно, объясняет умеренные фенотипы мышей с нокаутом OGG1 и MYH.
Гликозилазы алкилированных оснований
В эту группу входят E. coli AlkA и родственные белки высших эукариот. Эти гликозилазы являются монофункциональными и распознают метилированные основания, такие как 3-метиладенин.
AlkA
AlkA относится к 3-метиладенин ДНК-гликозилаза II.[26]
Патология
- ДНК-гликозилазы, участвующие в базовая эксцизионная пластика (BER) может быть связан с риском рака у BRCA1 и BRCA2 носители мутации.[27]
Эпигенетическая недостаточность при раке
Эпигенетический Изменения (эпимутации) генов ДНК-гликозилазы только недавно начали оцениваться при некоторых видах рака, по сравнению с многочисленными предыдущими исследованиями эпимутаций в генах, действующих в других путях репарации ДНК (таких как MLH1 в ремонте несоответствия и MGMT при прямом развороте).[нужна цитата ] Ниже приведены два примера эпимутаций генов ДНК-гликозилазы, которые возникают при раке.
MBD4

MBD4 (белок 4 метил-CpG-связывающего домена) представляет собой гликозилазу, используемую на начальной стадии эксцизионной репарации оснований. Белок MBD4 предпочтительно полностью связывается метилированные сайты CpG.[28] Эти измененные основания возникают в результате частого гидролиза цитозина до урацила (см. Изображение) и гидролиза 5-метилцитозин к тимину, образуя пары оснований G: U и G: T.[29] Если неподходящие урацилы или тимины в этих парах оснований не удалить до репликации ДНК, они вызовут переход мутации. MBD4 специфически катализирует удаление T и U, спаренных с гуанином (G) в сайтах CpG.[30] Это важная ремонтная функция, так как примерно 1/3 всех внутригенный мутации одной пары оснований при раке человека происходят в динуклеотидах CpG и являются результатом переходов G: C в A: T.[30][31] Эти переходы включают наиболее частые мутации при раке человека. Например, почти 50% соматических мутаций гена-супрессора опухоли p53 в колоректальный рак это переходы от G: C к A: T внутри сайтов CpG.[30] Таким образом, снижение экспрессии MBD4 может вызвать увеличение канцерогенный мутации.
Экспрессия MBD4 снижена почти во всех колоректальных новообразования из-за метилирование из промоутер регион МБД4.[32] Также MBD4 недостаточен из-за мутации примерно в 4% случаев колоректального рака,[33]
Большинство гистологически нормальных полей, окружающих новообразования (аденомы и рак толстой кишки) в толстой кишке, также демонстрируют сниженную экспрессию мРНК MBD4 (a полевой дефект ) по сравнению с гистологически нормальной тканью людей, у которых никогда не было новообразований толстой кишки.[32] Это открытие предполагает, что эпигенетические заглушить MBD4 - это ранний шаг в колоректальном канцерогенез.
В китайской популяции, которая была оценена, MBD4 Glu346Lys полиморфизм был связан примерно с 50% снижением риска рака шейки матки, предполагая, что изменения в MBD4 важны при этом раке.[34]
NEIL1
Nei-подобный (NEIL) 1 представляет собой ДНК-гликозилазу семейства Nei (которая также содержит NEIL2 и NEIL3).[35] NEIL1 является компонентом репликационного комплекса ДНК, необходимого для наблюдения за окисленными основаниями перед репликацией, и, по-видимому, действует как «ловец коров» для замедления репликации до тех пор, пока NEIL1 не сможет действовать как гликозилаза и удалять окислительно поврежденное основание.[35]
NEIL1 белок распознает (нацеливается) и удаляет определенные окислительно -поврежденные основания, а затем надрезают базовый сайт через удаление β, δ с оставлением 3 'и 5' фосфатных концов. NEIL1 распознает окисленные пиримидины, формамидопиримидины, тимин остатков, окисленных по метильной группе, и оба стереоизомера тимингликоль.[36] Лучшими субстратами для человеческого NEIL1, по-видимому, являются гидантоин поражения, гуанидиногидантоин и спироиминодигидантоин, которые являются продуктами дальнейшего окисления 8-oxoG. NEIL1 также способен удалять повреждения из одноцепочечной ДНК, а также из пузырьковых и разветвленных структур ДНК. Дефицит NEIL1 вызывает усиление мутагенеза на участке пары 8-оксо-Gua: C, при этом большинство мутаций представляют собой трансверсии G: C в T: A.[37]
Исследование 2004 г. показало, что в 46% случаев первичного рака желудка наблюдается снижение экспрессии NEIL1. мРНК, хотя механизм уменьшения не был известен.[38] Это исследование также показало, что в 4% случаев рака желудка имелись мутации в гене NEIL1. Авторы предположили, что низкая активность NEIL1, обусловленная сниженной экспрессией и / или мутацией гена NEIL1, часто участвует в канцерогенезе желудка.
Скрининг 145 генов репарации ДНК на аберрантное метилирование промотора был проведен на тканях плоскоклеточной карциномы головы и шеи (HNSCC) у 20 пациентов и на образцах слизистой оболочки головы и шеи у 5 пациентов, не страдающих раком.[39] Этот скрининг показал, что ген NEIL1 имел существенно повышенное гиперметилирование, а из 145 оцениваемых генов репарации ДНК NEIL1 имел наиболее значительно отличающуюся частоту метилирования. Кроме того, гиперметилирование соответствовало снижению экспрессии мРНК NEIL1. Дальнейшая работа с 135 опухолевыми и 38 нормальными тканями также показала, что 71% образцов ткани HNSCC имели повышенное метилирование промотора NEIL1.[39]
Когда 8 генов репарации ДНК были оценены в немелкоклеточный рак легкого (NSCLC) 42% опухолей были гиперметилированы в промоторной области NEIL1.[40] Это была самая частая аномалия репарации ДНК среди 8 протестированных генов репарации ДНК. NEIL1 также был одним из шести генов репарации ДНК, которые были гиперметилированы в их промоторных областях в колоректальный рак.[41]
Рекомендации
- ^ Линдал, Т. (1986). «ДНК-гликозилазы в репарации ДНК». Механизмы повреждения и восстановления ДНК. 38: 335–340. Дои:10.1007/978-1-4615-9462-8_36. ISBN 978-1-4615-9464-2. PMID 3527146.
- ^ Aguis, F .; Капур, А; Чжу, JK (2006). «Роль ДНК-гликозилазы / лиазы ROS1 Arabidopsis в активном деметилировании ДНК». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 103 (31): 11796–11801. Bibcode:2006PNAS..10311796A. Дои:10.1073 / pnas.0603563103. ЧВК 1544249. PMID 16864782.
- ^ Choi, C-S .; Сано, Х. (2007). «Идентификация генов табака, кодирующих белки, обладающие активностью удаления 5-метилцитозинов из интактной ДНК табака». Биотехнология растений. 24 (3): 339–344. Дои:10.5511 / plantbiotechnology.24.339.
- ^ а б Фромм Дж. С., Банерджи А., Вердин Г. Л. (февраль 2004 г.). «Распознавание и катализ ДНК-гликозилазы». Текущее мнение в структурной биологии. 14 (1): 43–9. Дои:10.1016 / j.sbi.2004.01.003. PMID 15102448.
- ^ Куо С.Ф., Макри Д.Е., Фишер С.Л., О'Хэндли С.Ф., Каннингем Р.П., Тайнер Дж. А. (октябрь 1992 г.). «Атомная структура фермента репарации ДНК [4Fe-4S] эндонуклеазы III». Наука. 258 (5081): 434–40. Bibcode:1992Научный ... 258..434K. Дои:10.1126 / science.1411536. PMID 1411536.
- ^ Ide H, Kotera M (апрель 2004 г.). «Человеческие гликозилазы ДНК, участвующие в репарации окислительно поврежденной ДНК». Биол. Pharm. Бык. 27 (4): 480–5. Дои:10.1248 / bpb.27.480. PMID 15056851.
- ^ Альсет I, Осман Ф., Корвальд Х. и др. (2005). «Биохимическая характеристика и взаимодействия путей репарации ДНК при эксцизионной репарации оснований, опосредованной Mag1, у Schizosaccharomyces pombe». Нуклеиновые кислоты Res. 33 (3): 1123–31. Дои:10.1093 / нар / gki259. ЧВК 549418. PMID 15722486.
- ^ а б c Жемчуг LH (2000). «Структура и функция в суперсемействе урацил-ДНК-гликозилазы». Mutat Res. 460 (3–4): 165–81. Дои:10.1016 / S0921-8777 (00) 00025-2. PMID 10946227.
- ^ а б Mol CD, Arvai AS, Slupphaug G, Kavli B, Alseth I, Krokan HE, Tainer JA (март 1995 г.). «Кристаллическая структура и мутационный анализ урацил-ДНК-гликозилазы человека: структурные основы специфичности и катализа». Клетка. 80 (6): 869–78. Дои:10.1016/0092-8674(95)90290-2. PMID 7697717. S2CID 14851787.
- ^ Сандигурский М., Франклин В.А. (май 1999 г.). «Термостабильная урацил-ДНК-гликозилаза из Thermotoga maritima, член нового класса ферментов репарации ДНК». Curr. Биол. 9 (10): 531–4. Дои:10.1016 / S0960-9822 (99) 80237-1. PMID 10339434. S2CID 32822653.
- ^ Барретт Т.Е., Савва Р., Панайоту Дж., Барлоу Т., Браун Т., Йирикны Дж., Перл Л.Х. (январь 1998 г.). «Кристаллическая структура ДНК-гликозилазы, специфичной для несоответствия G: T / U: распознавание несоответствия посредством взаимодействий с комплементарными цепями». Клетка. 92 (1): 117–29. Дои:10.1016 / S0092-8674 (00) 80904-6. PMID 9489705. S2CID 9136303.
- ^ Бакли Б., Эренфельд Э. (октябрь 1987 г.). «Белковый комплекс связывания кэпа в неинфицированных и инфицированных полиовирусом клетках HeLa». J. Biol. Chem. 262 (28): 13599–606. PMID 2820976.
- ^ Мацубара М., Танака Т., Терато Х, Омаэ Э, Идзуми С., Катаянаги К., Иде Х (2004). «Мутационный анализ распознавания повреждений и каталитического механизма ДНК-гликозилазы человека SMUG1». Нуклеиновые кислоты Res. 32 (17): 5291–5302. Дои:10.1093 / нар / гх859. ЧВК 521670. PMID 15466595.
- ^ Ву П, Цю С., Сохаил А., Чжан Х, Бхагват А.С., Сяодун К. (2003). Ремонт несоответствия в метилированной ДНК. СТРУКТУРА И АКТИВНОСТЬ СПЕЦИФИЧНОГО ТИМИНГЛИКОЗИЛАЗНОГО ДОМЕНА МЕТИЛ-CpG-СВЯЗЫВАЮЩЕГО БЕЛКА MBD4. 5285-5291.
- ^ Вонг Э; Ян К; Kuraguchi M; Werling U; Авдиевич Э; Fan K; Fazzari M; Джин Би; Браун M.C; и другие. (1995). «Инактивация Mbd4 увеличивает мутации перехода C → T и способствует образованию опухолей желудочно-кишечного тракта». PNAS. 99 (23): 14937–14942. Дои:10.1073 / pnas.232579299. ЧВК 137523. PMID 12417741.
- ^ Мол CD, Arvai AS, Slupphaug G, Kavli B, Alseth I, Krokan HE, Tainer JA (1995). «Кристаллическая структура и мутационный анализ урацил-ДНК-гликозилазы человека». Клетка. 80 (6): 869–878. Дои:10.1016/0092-8674(95)90290-2. PMID 7697717. S2CID 14851787.
- ^ Slupphaug G, Mol CD, Kavli B, Arvai AS, Krokan HE, Tainer JA. (1996). Механизм переворота нуклеотидов в структуре урацила человека – ДНК-гликозилаза, связанная с ДНК. 384: 87-92.
- ^ Кавли Б., Оттерлей М., Слуппхауг Г., Крокан Х. Э. (апрель 2007 г.). «Урацил в ДНК - общий мутаген, но нормальный интермедиат в приобретенном иммунитете». Ремонт ДНК (Amst.). 6 (4): 505–16. Дои:10.1016 / j.dnarep.2006.10.014. PMID 17116429.
- ^ Hagen L; Пенья-Диас Дж; Кавли Б; Otterlei M; Slupphaug G; Крокан Х.Е. (август 2006 г.). «Геномный урацил и болезнь человека». Exp. Cell Res. 312 (14): 2666–72. Дои:10.1016 / j.yexcr.2006.06.015. PMID 16860315.
- ^ Слуппхауг Г., Маркуссен Ф.Х., Олсен Л.С., Осланд Р., Арсэтер Н., Бакке О., Крокан Х.Э., Хелланд, DE (июнь 1993 г.). «Ядерные и митохондриальные формы урацил-ДНК-гликозилазы человека кодируются одним и тем же геном». Нуклеиновые кислоты Res. 21 (11): 2579–84. Дои:10.1093 / nar / 21.11.2579. ЧВК 309584. PMID 8332455.
- ^ Olsen LC, Aasland R, Wittwer CU, Krokan HE, Helland DE (октябрь 1989 г.). «Молекулярное клонирование человеческой урацил-ДНК-гликозилазы, высококонсервативного фермента репарации ДНК». EMBO J. 8 (10): 3121–5. Дои:10.1002 / j.1460-2075.1989.tb08464.x. ЧВК 401392. PMID 2555154.
- ^ Аптон К., Стюарт Д. Т., Макфадден Г. (май 1993 г.). «Идентификация гена поксвируса, кодирующего урацил-ДНК-гликозилазу». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 90 (10): 4518–22. Bibcode:1993ПНАС ... 90.4518U. Дои:10.1073 / пнас.90.10.4518. ЧВК 46543. PMID 8389453.
- ^ Савва Р., Маколи-Хехт К., Браун Т., Жемчуг Л. (февраль 1995 г.). «Структурные основы специфической эксцизионной репарации оснований с помощью урацил-ДНК-гликозилазы». Природа. 373 (6514): 487–93. Bibcode:1995Натура.373..487С. Дои:10.1038 / 373487a0. PMID 7845459. S2CID 4315434.
- ^ Klungland A; Rosewell I; Hollenbach S; Ларсен Э; Дэйли Джи; Epe A; Seeberg E; Lindahl T; Barnes D. E .; и другие. (1999). «Накопление премутагенных повреждений ДНК у мышей, дефектных в удалении повреждений окислительного основания». PNAS. 96 (23): 13300–13305. Bibcode:1999 ПНАС ... 96 13 300 К. Дои:10.1073 / пнас.96.23.13300. ЧВК 23942. PMID 10557315.
- ^ Руссо М.Т., Де, Деган П., Парланти Е., Дольотти Е., Барнс Д.Э., Линдал Т., Янг Х., Миллер Дж. Х., Бигнами М .; и другие. (2004). «Накопление повреждения окислительным основанием 8-гидроксигуанина в ДНК мышей, склонных к опухолям, дефектных по ДНК-гликозилазам Myh и Ogg1». Рак Res. 64 (13): 4411–4414. Дои:10.1158 / 0008-5472.can-04-0355. PMID 15231648.CS1 maint: несколько имен: список авторов (связь)
- ^ Мо Э, Холл Д. Р., Лейрос И., Монсен В. Т., Тимминс Дж., МакСвини С. (2012). «Структурно-функциональные исследования необычной 3-метиладенин ДНК гликозилазы II (AlkA) из Deinococcus radiodurans». Acta Crystallogr D. 68 (6): 703–12. Дои:10.1107 / S090744491200947X. PMID 22683793.
- ^ Осорио, А; Milne, R. L .; Kuchenbaecker, K; Vaclová, T; Пита, G; Алонсо, Р. Петерлонго, П; Бланко, я; де ла Хойя, М; Дюран, М; Диес, О; Рамон-и-Кахаль, Т. Konstantopoulou, I; Мартинес-Бузас, К. Андрес Конехеро, Р. Суси, П; Макгаффог, L; Барроудейл, Д; Ли, А; Swe-Brca; Арвер, Б; Рантала, Дж; Ломан, N; Ehrencrona, H; Olopade, O.I .; Битти, М. С .; Домчек, С. М .; Натансон, К; Rebbeck, T. R .; и другие. (2014). «ДНК-гликозилазы, участвующие в эксцизионной репарации оснований, могут быть связаны с риском рака у носителей мутаций BRCA1 и BRCA2». PLOS Genetics. 10 (4): e1004256. Дои:10.1371 / journal.pgen.1004256. ЧВК 3974638. PMID 24698998.
- ^ Валавалкар, Нинад (2014). «Структура раствора и внутримолекулярный обмен белка 4 метилцитозинсвязывающего домена (MBD4) на ДНК предполагает механизм сканирования несовпадений mCpG / TpG». Исследования нуклеиновых кислот. 42 (17): 11218–11232. Дои:10.1093 / нар / gku782. ЧВК 4176167. PMID 25183517.
- ^ Bellacosa A, Drohat AC (август 2015 г.). «Роль эксцизионной репарации оснований в поддержании генетической и эпигенетической целостности сайтов CpG». Ремонт ДНК. 32: 33–42. Дои:10.1016 / j.dnarep.2015.04.011. ЧВК 4903958. PMID 26021671.
- ^ а б c Sjolund AB, Senejani AG, Sweasy JB (2013). «MBD4 и TDG: многогранные ДНК-гликозилазы с постоянно расширяющейся биологической ролью». Мутационные исследования. 743–744: 12–25. Дои:10.1016 / j.mrfmmm.2012.11.001. ЧВК 3661743. PMID 23195996.
- ^ Купер Д. Н., Юсуфиан Х. (февраль 1988 г.). «Динуклеотид CpG и генетическое заболевание человека». Генетика человека. 78 (2): 151–5. Дои:10.1007 / bf00278187. PMID 3338800. S2CID 41948691.
- ^ а б Ховард Дж. Х., Фролов А., Ценг К. В., Стюарт А., Мидзак А., Маджмундар А., Годвин А., Хеслин М., Беллакоса А., Арнолетти Дж. П. (январь 2009 г.). «Эпигенетическое подавление гена репарации ДНК MED1 / MBD4 при колоректальном раке и раке яичников». Биология и терапия рака. 8 (1): 94–100. Дои:10.4161 / cbt.8.1.7469. ЧВК 2683899. PMID 19127118.
- ^ Tricarico R, Cortellino S, Riccio A, Jagmohan-Changur S, Van der Klift H, Wijnen J, Turner D, Ventura A, Rovella V, Percesepe A, Lucci-Cordisco E, Radice P, Bertario L, Pedroni M, Ponz de Леон М., Манкузо П., Девараджан К., Цай К.К., Кляйн-Сзанто А.Дж., Нери Г., Мёллер П., Виль А., Генуарди М., Фодде Р., Беллакоса А. (октябрь 2015 г.). «Участие инактивации MBD4 в онкогенезе с дефицитом репарации несоответствий» (PDF). Oncotarget. 6 (40): 42892–904. Дои:10.18632 / oncotarget.5740. ЧВК 4767479. PMID 26503472.
- ^ Xiong XD, Luo XP, Liu X, Jing X, Zeng LQ, Lei M, Hong XS, Chen Y (2012). «Полиморфизм Glu346Lys MBD4 связан с риском рака шейки матки у населения Китая». Int. J. Gynecol. Рак. 22 (9): 1552–6. Дои:10.1097 / IGC.0b013e31826e22e4. PMID 23027038. S2CID 788490.
- ^ а б Hegde ML, Hegde PM, Bellot LJ, Mandal SM, Hazra TK, Li GM, Boldogh I, Tomkinson AE, Mitra S (2013). «Пререпликативная репарация окисленных оснований в геноме человека опосредуется ДНК-гликозилазой NEIL1 вместе с белками репликации». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 110 (33): E3090–9. Bibcode:2013PNAS..110E3090H. Дои:10.1073 / pnas.1304231110. ЧВК 3746843. PMID 23898192.
- ^ Немек А.А., Уоллес С.С., Суизи Дж.Б. (октябрь 2010 г.). «Варианты белков эксцизионной репарации оснований: факторы нестабильности генома». Семинары по биологии рака. 20 (5): 320–8. Дои:10.1016 / j.semcancer.2010.10.010. ЧВК 3254599. PMID 20955798.
- ^ Сузуки Т., Харашима Х, Камия Х (2010). «Влияние основных белков эксцизионной репарации на мутагенез с помощью 8-оксо-7,8-дигидрогуанина (8-гидроксигуанина) в паре с цитозином и аденином». Ремонт ДНК (Amst.). 9 (5): 542–50. Дои:10.1016 / j.dnarep.2010.02.004. HDL:2115/43021. PMID 20197241.
- ^ Синмура К., Тао Х., Гото М., Игараси Х., Танигучи Т, Маэкава М., Такезаки Т, Сугимура Х (2004). «Инактивирующие мутации гена эксцизионной репарации оснований человека NEIL1 при раке желудка». Канцерогенез. 25 (12): 2311–7. Дои:10.1093 / carcin / bgh267. PMID 15319300.
- ^ а б Чайсаингмонгкол Дж, Попанда О, Варта Р., Дайкхофф Дж., Герпель Е, Гейзельхарт Л., Клаус Р., Ласичка Ф, Кампос Б., Оукс С.С., Бермеджо Дж. Л., Херольд-Менде С., Пласс С., Шмезер П. (2012). «Эпигенетический скрининг генов репарации ДНК человека выявляет аберрантное метилирование промотора NEIL1 при плоскоклеточной карциноме головы и шеи». Онкоген. 31 (49): 5108–16. Дои:10.1038 / onc.2011.660. PMID 22286769.
- ^ До Х, Вонг NC, Мурон С., Джон Т., Соломон Б., Митчелл П.Л., Добрович А. (2014). «Критическая переоценка метилирования промотора гена репарации ДНК при немелкоклеточной карциноме легкого». Научные отчеты. 4: 4186. Bibcode:2014НатСР ... 4Э4186Д. Дои:10.1038 / srep04186. ЧВК 3935198. PMID 24569633.
- ^ Фаркас С.А., Выметалкова В., Водичкова Л., Водичка П., Нильссон Т.К. (апрель 2014 г.). «Изменения в метилировании ДНК в генах, часто мутирующих при спорадическом колоректальном раке, а также в генах репарации ДНК и сигнального пути Wnt / β-катенина». Эпигеномика. 6 (2): 179–91. Дои:10.2217 / epi.14.7. PMID 24811787.
внешняя ссылка
 СМИ, связанные с ДНК-гликозилаза в Wikimedia Commons
СМИ, связанные с ДНК-гликозилаза в Wikimedia Commons- ДНК + гликозилазы в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
