Гальваника - Electroplating
Было высказано предположение, что Гальваника из цинкового сплава и Электрогальванизация быть слился в эту статью. (Обсудить) Предлагается с августа 2020 года. |

Гальваника это общее название для процессов, которые создают металл покрытие на твердой основе через сокращение из катионы этого металла с помощью постоянный электрический ток. Покрываемая деталь действует как катод (отрицательный электрод ) из электролитическая ячейка; то электролит это решение из поваренная соль покрываемого металла; и анод (положительный электрод) обычно представляет собой блок из этого металла или какой-то инертный проводящий материал. Ток обеспечивается внешним источник питания.
Гальваника широко используется в промышленности и декоративное искусство для улучшения качества поверхности объектов, например устойчивости к истирание и коррозия, смазывающая способность, отражательная способность, электрическая проводимость, или внешний вид. Его также можно использовать для увеличения толщины деталей меньшего размера или изношенных деталей или для изготовления металлических пластин сложной формы. Этот процесс называется гальванопластика. Он также используется для очистки металлов, таких как медь.
Термин «гальваника» может также иногда использоваться для процессов, в которых для достижения окисление из анионы на твердую основу, как при образовании хлорид серебра на серебряной проволоке сделать серебряные / хлорсеребряные электроды.
Электрополировка, процесс, в котором для удаления катионов металлов с поверхности металлического объекта используется электрический ток, можно рассматривать как противоположность гальванизации.[1]
Обработать
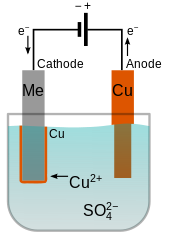
4. Медный анод используется для пополнения электролита катионами меди. Cu2+
поскольку они покрыты покрытием на катоде.
Электролит должен содержать положительные ионы (катионы) осаждаемого металла. Эти катионы восстанавливаются на катоде до металла в нулевом валентном состоянии. Например, электролит для меднение может быть решением сульфат меди (II), который диссоциирует на Cu2+ катионы и ТАК2−
4 анионы. На катоде Cu2+ превращается в металлическую медь за счет получения двух электронов.
Когда анод изготовлен из металла покрытия, там может происходить обратная реакция, превращающая его в растворенные катионы. Например, медь окисляется на аноде до Cu2+ потеряв два электрона. В этом случае скорость растворения анода будет равна скорости нанесения покрытия на катод, и, таким образом, ионы в ванне электролита будут постоянно пополняться анодом. Конечный результат - эффективный перенос металла от анодного источника к катоду.[2]
Вместо этого анод может быть изготовлен из материала, стойкого к электрохимическому окислению, такого как вести или углерод. Кислород, пероксид водорода, или вместо этого на аноде образуются другие побочные продукты. В этом случае ионы металла, подлежащего гальванике, необходимо периодически пополнять в ванне по мере вытягивания их из раствора.[3]
Покрытие чаще всего представляет собой одиночный металлический элемент, а не сплав. Однако некоторые сплавы можно электроосаждать, особенно латунь и припаять. Гальванические «сплавы» - это не настоящие сплавы, то есть твердые растворы, а скорее дискретные крошечные кристаллы покрываемых металлов. В случае плакированного припоя иногда считается необходимым иметь «настоящий сплав», и плакированный припой плавится, чтобы позволить олову и свинцу объединиться с образованием настоящего сплава. Настоящий сплав более устойчив к коррозии, чем сплав с покрытием.
Многие гальванические ванны включают цианиды из других металлов (например, цианистый калий ) помимо цианидов осаждаемого металла. Эти свободные цианиды способствуют коррозии анода, помогают поддерживать постоянный уровень ионов металлов и повышают проводимость. Кроме того, неметаллические химические вещества, такие как карбонаты и фосфаты может быть добавлен для увеличения проводимости.
Если гальваника на определенных участках подложки нежелательна, применяются ограничители, чтобы ванна не контактировала с подложкой. Типичные ограничители включают скотч, фольгу, лаки, и воск.[4]
Способность покрытия равномерно покрывать называется метательная сила; чем выше метательная сила, тем равномернее покрытие.[5]
удар
Первоначально специальное покрытие, называемое наносить удар или вспышка может использоваться для формирования очень тонкого (обычно менее 0,1 мкм) покрытия с высоким качеством и хорошей адгезией к субстрату. Это служит основой для последующих процессов нанесения покрытия. Для удара используется высокая плотность тока и ванна с низкой концентрацией ионов. Этот процесс медленный, поэтому после получения желаемой толщины покрытия используются более эффективные способы нанесения покрытия.
Также метод чеканки применяется в сочетании с нанесением покрытия на разные металлы. Если желательно нанести один тип покрытия на металл для улучшения коррозионной стойкости, но этот металл по своей природе имеет плохую адгезию к подложке, сначала можно нанести удар, совместимый с обоими. Одним из примеров такой ситуации является плохая адгезия электролитического никель на цинк сплавы, и в этом случае используется медный стержень, который хорошо прилегает к обоим.[3]
Электрохимическое осаждение
Электрохимическое осаждение обычно используется для выращивания металлов и проводящих оксидов металлов из-за следующих преимуществ: толщину и морфологию наноструктуры можно точно контролировать, регулируя электрохимические параметры; относительно однородные и компактные отложения могут быть синтезированы в структурах на основе темплатов; получаются более высокие скорости осаждения; а оборудование недорогое из-за отсутствия требований ни к высокому вакууму, ни к высокой температуре реакции.[6][7][8]
Импульсное гальваническое покрытие
Процесс импульсного гальванического покрытия или импульсного электроосаждения (PED) включает быстрое чередование электрический потенциал или текущий между двумя разными значениями, в результате чего получается серия импульсов одинаковой амплитуды, длительности и полярности, разделенных нулевым током. Изменяя амплитуду и ширину импульса, можно изменять состав и толщину осаждаемой пленки.[9]
Экспериментальные параметры импульсного гальванического покрытия обычно включают пиковый ток / потенциал, рабочий цикл, частоту и эффективный ток / потенциал. Пиковый ток / потенциал - это максимальное значение тока или потенциала гальваники. Рабочий цикл - это эффективная часть времени в течение определенного периода гальваники с приложенным током или потенциалом. Эффективный ток / потенциал рассчитывается путем умножения рабочего цикла на пиковое значение тока или потенциала. Импульсное гальваническое покрытие может помочь улучшить качество гальванической пленки и снять внутреннее напряжение, возникающее во время быстрого осаждения. Комбинация короткого рабочего цикла и высокой частоты может уменьшить поверхностные трещины. Однако для поддержания постоянного эффективного тока или потенциала может потребоваться высокопроизводительный источник питания, обеспечивающий высокий пиковый ток / потенциал и быстрое переключение. Другая распространенная проблема импульсного гальванического покрытия заключается в том, что анодный материал может покрыться металлическим покрытием и загрязниться во время обратного гальванического покрытия, особенно из-за высокой стоимости инертного электрода, такого как платина.
Другие факторы, которые могут повлиять на импульсное гальваническое покрытие, включают температуру, зазор между анодом и катодом и перемешивание. Иногда импульсное гальваническое покрытие может выполняться в нагретой гальванической ванне для увеличения скорости осаждения, поскольку скорость почти всех химических реакций возрастает экспоненциально с температурой в соответствии с законом Аррениуса. Зазор между анодом и катодом связан с распределением тока между анодом и катодом. Небольшое отношение площади зазора к площади образца может вызвать неравномерное распределение тока и повлиять на топологию поверхности образца с покрытием. Перемешивание может увеличить скорость переноса / диффузии ионов металла из объема раствора к поверхности электрода. Настройки перемешивания различаются для разных процессов гальваники металла.
Кисть для гальваники
Тесно связанным процессом является нанесение гальванических покрытий щеткой, при котором локальные участки или целые предметы покрываются щеткой, пропитанной гальваническим раствором. Кисть, обычно нержавеющая сталь тело обернуто абсорбентом ткань материал, который удерживает раствор для покрытия и предотвращает прямой контакт с покрываемым предметом, подключен к анод низкого напряжения постоянный ток источник питания, и элемент, который должен быть покрыт, подключен к катод. Оператор окунает щетку в раствор для нанесения покрытия, затем наносит его на предмет, постоянно перемещая щетку, чтобы равномерно распределить материал покрытия.
Щеточное гальваническое покрытие имеет несколько преимуществ по сравнению с покрытием резервуара, включая портативность, способность наносить покрытие на предметы, которые по какой-то причине не могут быть покрыты резервуаром (одним из применений было покрытие участков очень больших декоративных опорных колонн при реставрации здания), низкие требования к маскировке или ее отсутствие, и сравнительно низкие требования к объему раствора для нанесения покрытия. Недостатки по сравнению с металлизацией резервуара могут включать большее участие оператора (покрытие резервуара часто может выполняться с минимальным вниманием) и невозможность достичь такой большой толщины листа.
Твердый хром в щеточном гальваническом покрытии
Твердый хром - один из наиболее распространенных материалов покрытия, используемых для твердого покрытия и гальваники, благодаря его прочности, стойкости и гладкой поверхности. Однако хром очень опасен в своем шестивалентный штат. При вдыхании или употреблении переносится по воздуху Cr6+[JT2] был связан с раком легких и вызывает повреждение горла, рта и носа.
Это потому, что в шестивалентном состоянии хром имеет канцерогенный и тератогенный свойства, оказывающий мутагенное действие на клетки.
Ежегодно 558000 технических специалистов в США подвергаются воздействию шестивалентного хрома на рабочем месте, при этом те, кто работает в гальванической, сварочной и лакокрасочной промышленности, подвергаются наибольшему риску из-за повышенного воздействия высоких уровней Cr.6+ соединения.[10]
Из-за опасностей, связанных с шестивалентным хромом, поиск более безопасных и экологически чистых альтернатив был основным двигателем исследований щеточного гальванического покрытия в последнее десятилетие. Одна из разработанных альтернатив - композиты с металлической матрицей (MMC). MMC предлагает уникальные и превосходные характеристики для металлических покрытий, включая твердость, износостойкость и защиту от окисления при высоких температурах. Эта хромированная альтернатива MMC включает карбид кобальта и хрома, карбид никеля вольфрама и карбид никеля и хрома.[11]
Обшивка ствола
Этот метод гальваники является одним из наиболее часто используемых в промышленности для обработки большого количества мелких объектов. Объекты помещаются в бочкообразную непроводящую клетку, а затем погружаются в химическую ванну, содержащую взвешенные атомы металла, который должен быть нанесен на них. Затем ствол вращается, и электрические токи проходят через различные части ствола, замыкая цепи, когда они касаются друг друга. В результате получается очень однородный и эффективный процесс нанесения покрытия, хотя отделка конечных продуктов, вероятно, будет страдать от истирания во время процесса нанесения покрытия. Он не подходит для очень декоративных или точно спроектированных предметов.[12]
Чистота
Чистота важен для успешного гальванического покрытия, поскольку молекулярные слои масло может предотвратить прилипание покрытия. ASTM B322 - это стандартное руководство по очистке металлов перед нанесением гальванических покрытий. Очистка включает очистку растворителем, очистку горячим щелочным моющим средством, электроочистку, кислотную обработку и т. Д. Наиболее распространенным промышленным тестом на чистоту является испытание на разрыв воды, при котором поверхность тщательно ополаскивается и удерживается в вертикальном положении. Гидрофобный Загрязнения, такие как масла, заставляют воду рассыпаться и рассыпаться, что позволяет воде быстро стекать. Идеально чистые металлические поверхности гидрофильный и сохранит непрерывный слой воды, который не скатывается и не стекает. ASTM F22 описывает версию этого теста. Этот тест не обнаруживает гидрофильных загрязнителей, но гальваника может легко их вытеснить, поскольку растворы на водной основе. Поверхностно-активные вещества такие как мыло снижают чувствительность теста и должны быть тщательно смыты.
Эффекты
Гальваника изменяет химические, физические и механические свойства детали. Пример химического изменения: никель покрытие улучшает коррозионную стойкость. Примером физического изменения является изменение внешнего вида. Примером механического изменения является изменение предел прочности или поверхность твердость который является обязательным атрибутом в инструментальной промышленности.[13]Гальваника кислотным золотом нижележащих медных или никелированных цепей снижает контактное сопротивление, а также твердость поверхности. Покрытые медью участки из мягкой стали действуют как маска, если упрочнение таких участков нежелательно. Луженая сталь хромируется, чтобы предотвратить потускнение поверхности из-за окисления олова.
Гальваническое или химическое нанесение покрытия может использоваться как способ обработки металлической детали. радиоактивный, используя водный раствор, приготовленный из никеля -фосфор концентраты, содержащие радиоактивные гипофосфит 32п ионы.[14]
Альтернативы гальванике
Существует ряд альтернативных способов получения металлических покрытий на твердых подложках, которые не включают электролитическое восстановление:
- Гальваническое покрытие использует ванну, содержащую ионы металлов и химикаты, которые восстанавливают их до металла за счет окислительно-восстановительные реакции. Реакция должна быть автокаталитический, так что новый металл будет осаждаться поверх растущего покрытия, а не осаждаться в виде порошка через всю ванну сразу. Бесэлектронные процессы широко используются для нанесения никель-фосфорный или никель-бор сплавы на износостойкость и коррозионную стойкость, Серебряный для зеркало - изготовление, медь для печатные платы и многое другое. Основное преимущество этих процессов перед гальваникой состоит в том, что они могут создавать покрытия одинаковой толщины на поверхностях произвольной формы, даже внутри отверстий, и подложка не обязательно должна быть электрически проводящей. Еще одно важное преимущество заключается в том, что им не нужны источники питания или аноды особой формы. К недостаткам можно отнести более низкую скорость осаждения, потребление относительно дорогих химикатов и ограниченный выбор металлов для покрытия.
- Иммерсионное покрытие процессы используют реакции замещения в котором металл субстрата окисляется до растворимых ионов, в то время как ионы металла покрытия восстанавливаются и осаждаются на его месте. Этот процесс ограничен очень тонкими покрытиями, поскольку реакция прекращается после того, как субстрат полностью покрыт. Тем не менее, у него есть несколько важных приложений, таких как иммерсионное золото никель химическим способом (ENIG) процесс, используемый для получения позолоченных электрических контактов на печатных платах.
- Распыление использует сильный электронный луч для выброса микроскопических частиц металла на подложку в вакууме.
- Физическое осаждение из паровой фазы перенесите металл на субтрат, выпарив его.
- Химическое осаждение из паровой фазы использует газ, содержащий летучие соединения металла, которые осаждаются на подложке в результате химической реакции.
- Позолота это традиционный способ создания золотого слоя на металлах путем нанесения очень тонкого листа золота, удерживаемого клей
История

Вполне вероятно, что первое гальваническое покрытие было выполнено в Парфянская Империя эпоха. Вильгельм Кёниг был ассистентом в Национальный музей Ирака в 1930-х годах наблюдал ряд очень тонких серебряных предметов из древнего Ирака, покрытых очень тонкими слоями золота, и предположил, что они были гальваническими.[15][16][циркулярная ссылка ]. Он подтвердил свою идею, сославшись на возможный Парфянская батарея обнаружен в 1938 году недалеко от мегаполиса Ктесифон, столица Парфянский (150 г. до н.э. - 223 г. н.э.) и Сасанидский (224–650 гг. Н.э.) империи Персия. Было ли устройство на самом деле аккумулятором, и если да, то для чего оно использовалось, остается предметом споров среди исследователей.[17]
Современный электрохимия был изобретен итальянским химиком Луиджи Валентино Бругнателли в 1805 г. Бругнателли использовал своего коллегу Алессандро Вольта изобретение пятью годами ранее, гальваническая свая, чтобы облегчить первое электроосаждение. Изобретения Бругнателли были подавлены Французская Академия Наук и в течение следующих тридцати лет не использовался в промышленности. К 1839 году ученые в Британия и Россия независимо разработали процессы осаждения металла, аналогичные способам Бругнателли для гальваники меди на печатный станок тарелки.
Борис Якоби в России не только заново открыли гальванопластику, но и разработали электротипирование и гальванопластическая скульптура. Гальванопластика быстро вошла в моду в России, изобретателями стали такие люди. Петр Багратион, ученый Генрих Ленц писатель-фантаст Владимир Одоевский все вносят свой вклад в дальнейшее развитие технологии. Среди самых громких случаев использования гальваники в России середины XIX века были гигантские гальванопластические скульптуры Исаакиевский собор в Санкт-Петербург и позолоченный купол из Храм Христа Спасителя в Москва, самый высокий православный храм в мире.[18]

Вскоре после, Джон Райт из Бирмингем, Англия обнаружила, что цианистый калий был подходящим электролит для гальваники золота и серебра. Соратники Райта, Джордж Элкингтон и Генри Элкингтон получили первые патенты на гальванику в 1840 году. Эти двое затем основали гальваническую промышленность в Бирмингем откуда он распространился по миру. В Электрический генератор Woolrich 1844 г., сейчас в Thinktank, Музей науки Бирмингема, это самый ранний электрический генератор, используемый в промышленности.[19] Он использовался Elkingtons.[20][21][22]
В Norddeutsche Affinerie в Гамбург был первым современным гальваническим заводом, начавшим производство в 1876 году.[23]
Как наука о электрохимия росла, его связь с гальваникой стала понятна, и были разработаны другие виды недекоративного гальванического покрытия металлов. Промышленное гальваническое покрытие никель, латунь, банка, и цинк были разработаны к 1850-м годам. Гальванические ванны и оборудование, основанные на патентах Elkingtons, были увеличены для размещения покрытия многочисленных крупномасштабных объектов и для конкретных производственных и инженерных приложений.
Гальваническая промышленность получила большой импульс с появлением разработки электрические генераторы в конце 19 века. При более высоких токах металлические компоненты машин, оборудование и автомобильный детали, требующие защиты от коррозии и улучшенных свойств износа, а также лучшего внешнего вида, могут обрабатываться в больших объемах.
Две мировые войны и рост авиация промышленность дала толчок к дальнейшим разработкам и усовершенствованиям, включая такие процессы, как жесткие хромирование, бронза покрытие сплавами, покрытие сульфаматным никелем, а также многие другие процессы нанесения покрытия. Гальваническое оборудование эволюционировало от ручного управления деготь деревянные резервуары с футеровкой до автоматизированного оборудования, способного обрабатывать тысячи килограммов в час деталей.
Один из американских физиков Ричард Фейнман Первым проектом компании была разработка технологии нанесения гальванического покрытия на металл. пластик. Фейнман превратил оригинальную идею своего друга в успешное изобретение, позволив своему работодателю (и другу) сдержать коммерческие обещания, которые он дал, но не смог бы выполнить иначе.[24]

Корпусная ячейка

В Корпусная ячейка Тип испытательной ячейки, используемой для качественной проверки состояния гальванической ванны. Он позволяет оптимизировать диапазон плотности тока, оптимизировать концентрацию добавок, распознавать эффекты примесей и указывать способность к выбросу макроэлементов.[25] Ячейка Халла воспроизводит гальваническую ванну в лабораторных масштабах. Он заполнен образцом гальванического раствора, соответствующий анод подсоединен к выпрямитель. «Работа» заменяется панелью для испытания ячеек корпуса, на которую будет нанесено покрытие, чтобы показать «здоровье» ванны.
Ячейка Халла представляет собой контейнер трапециевидной формы, вмещающий 267 мл раствора. Такая форма позволяет размещать испытательную панель под углом к аноду. В результате осаждение наносится при различных плотностях тока, которые можно измерить с помощью линейки ячеек корпуса. Объем раствора позволяет количественно оптимизировать концентрацию добавки: добавление 1 грамма к 267 мл эквивалентно 0,5 унции / галлон в гальваническом резервуаре.[26]
Ячейка Харинга – Блюма
Ячейка Харинга – Блюма используется для определения макро-метательной способности гальванической ванны. Ячейка состоит из двух параллельных катодов с неподвижным анодом посередине. Катоды находятся на расстоянии от анода в соотношении 1: 5. Макро-метательная мощность рассчитывается исходя из толщины покрытия двух катодов, когда постоянный ток проходит за определенный период времени. Ячейка изготовлена из плексиглас или стекло.[27][28]
Смотрите также
использованная литература
- ^ https://www.electro-glo.com/faqs/
- ^ Дюфур 2006, п. IX-1.
- ^ а б Дюфур 2006, п. IX-2
- ^ Дюфур 2006, п. IX-3
- ^ "Профиль технологии предотвращения загрязнения Замены трехвалентного хрома для покрытия шестивалентным хромом" (PDF). Северо-восточная ассоциация должностных лиц по управлению отходами. 2003-10-18. Архивировано из оригинал (PDF) на 2011-07-20. Цитировать журнал требует
| журнал =(Помогите) - ^ США 4882014, Койл, Р. Т. и Дж. А. Свитцер, "Электрохимический синтез керамических пленок и порошков"
- ^ Гал-Ор, Л .; Silberman, I .; Хаим, Р. (1991). «Электролитический ZrO2 Покрытия: I. Электрохимические аспекты ». Журнал Электрохимического общества. 138 (7): 1939. Bibcode:1991JELS..138.1939G. Дои:10.1149/1.2085904.
- ^ Джу, Хёнкук; Ли, Джэ Кван; Ли, Чонмин; Ли, Джэён (2012). «Быстрый и селективный Cu2Рост наностержней O в шаблоны из анодного оксида алюминия путем электроосаждения ». Современная прикладная физика. 12 (1): 60–64. Bibcode:2012CAP .... 12 ... 60J. Дои:10.1016 / j.cap.2011.04.042.
- ^ kunji durai, M. S .; чаала, Мэти (2008). «Импульсное и обратное гальваническое покрытие - концепция, преимущества и применение». Electrochimica Acta. 53 (8): 3313–3322. Дои:10.1016 / j.electacta.2007.11.054.
- ^ Проктор, Дебора М (2016). «Оценка риска рака при вдыхании шестивалентного хрома на основе обновленных данных о смертности рабочих, производящих хромат в Пейнсвилле». Журнал экспозиции и эпидемиологии окружающей среды. 26 (2): 224–31. Дои:10.1038 / jes.2015.77. ЧВК 4756268. PMID 26669850.
- ^ Милошевич-Попович, Даниела (2018). «Достижения в композитах с металлической матрицей с металлическим покрытием». SIFCO ASC.
- ^ А.С. Тан (30 ноября 1992 г.). Олово и припой в полупроводниковой промышленности. Springer Science & Business Media. п. 122. ISBN 978-0-412-48240-3.
- ^ Тодд, Роберт Х .; Аллен, Делл К .; Альтинг, Лео (1994). "Покрытие поверхности". Справочное руководство по производственным процессам. Промышленная пресса. С. 454–458. ISBN 0-8311-3049-0. В архиве из оригинала от 09.10.2013.
- ^ США 6475644, Хампикян, Джанет и Нил Скотт, "Растворы для нанесения радиоактивных покрытий и основы"
- ^ Чицаз, М.Р. «Парфянская батарея» (PDF). www.sid.ir. Иранский университет науки и технологий, Школа архитектуры и урбанистики, Тегеран. Получено 2020-10-16.
- ^ «Гальванический элемент парфянского периода» (PDF). википедия.
- ^ Кейзер, Пол (1993). «Назначение парфянских гальванических элементов: электрическая батарея первого века, используемая для обезболивания». Журнал ближневосточных исследований. 52 (2): 81–98. Дои:10.1086/373610. JSTOR 545563. PMID 16468202. S2CID 12563132 - через JSTOR.
- ^ «История гальванотехнологии в России» (по-русски). Архивировано из оригинал 5 марта 2012 г.
- ^ Каталог музеев Бирмингема, инвентарный номер: 1889S00044
- ^ Томас, Джон Мейриг (1991). Майкл Фарадей и королевский институт: гений человека и места. Бристоль: Хильгер. п. 51. ISBN 0750301457.
- ^ Бошан, К. Г. (1997). Выставка электроэнергии. ИЭПП. п. 90. ISBN 9780852968956.
- ^ Хант, Л. Б. (март 1973 г.). «Ранняя история позолоты». Золотой бюллетень. 6 (1): 16–27. Дои:10.1007 / BF03215178.
- ^ Стелтер, М .; Бомбах, Х. (2004). «Оптимизация процесса электрорафинирования меди». Передовые инженерные материалы. 6 (7): 558. Дои:10.1002 / adem.200400403.
- ^ Фейнман, Ричард (1985). «Глава 6: Главный химик-исследователь корпорации Metaplast». Вы, конечно, шутите, мистер Фейнман!.
- ^ Обработка металлов: Путеводитель и справочник. 98 выпуск. 95. 1998. с. 588.
- ^ Кушнер, Артур С. (1 декабря 2006 г.). «Корпусная ячейка 101». Продукция Отделка. Архивировано из оригинал 13 марта 2010 г.
- ^ Бард, Аллан; Инзельт, Дьёрдь; Шольц, Фриц (2012). «Ячейка Харинга – Блюма». Электрохимический словарь. Springer. п. 444. Дои:10.1007/978-3-642-29551-5_8. ISBN 978-3-642-29551-5.
- ^ Вендт, Хартмут; Герхард, Крейзе (1999). Электрохимическая инженерия: наука и технологии в химической и других отраслях промышленности. Springer. п. 122. ISBN 3540643869.
Список используемой литературы
- Дюфур, Джим (2006). Введение в металлургию (5-е изд.). Кэмерон.[ISBN отсутствует ]


