Диэтилазодикарбоксилат - Diethyl azodicarboxylate
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Диэтилдиазендикарбоксилат | |
| Другие имена | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.016.202 |
| Номер ЕС |
|
PubChem CID | |
| |
| |
| Характеристики | |
| C6ЧАС10N2О4 | |
| Молярная масса | 174.156 г · моль−1 |
| Внешность | Жидкость от оранжевого до красного до оранжевого[2] |
| Плотность | 1,11 г / см3[3] |
| Температура плавления | 6 ° С (43 ° F, 279 К)[4] |
| Точка кипения | 104,5 ° С (220,1 ° F, 377,6 К) при 12 мм рт.[3] |
| 1,420 (20 ° С)[3] | |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материалов |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| H240, H302, H312, H315, H319, H332, H335 | |
| P210, P220, P234, P261, P264, P270, P271, P280, P301 + 312, P302 + 352, P304 + 312, P304 + 340, P305 + 351 + 338, P312, P321, P322, P330, P332 + 313, P337 + 313, P362, P363, P370 + 378, P370 + 380 + 375, P403 + 233, P403 + 235 | |
| точка возгорания | 85 ° С (185 ° F, 358 К)[5] |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Диэтилазодикарбоксилат, условно сокращенно DEAD, а иногда и DEADCAT,[6][7] является органическое соединение со структурной формулой CH3CH2О2CN = NCO2CH2CH3. Его молекулярная структура состоит из центрального азо функциональная группа, RN = NR, фланкированный двумя этиловыми сложный эфир группы. Эта оранжево-красная жидкость является ценным реагентом, но также весьма опасна и взрывается при нагревании. Поэтому коммерческая поставка чистого диэтилазодикарбоксилата в США запрещена и осуществляется либо в растворе, либо на полистирол частицы.
DEAD - это аза-диенофил и эффективный дегидрирующий агент, превращающий спирты к альдегиды, тиолы к дисульфиды и гидразогруппы к азо группы; это также хороший акцептор электронов. Хотя DEAD используется во многих химических реакциях, он наиболее известен как ключевой компонент Мицунобу реакция, обычная стратегия получения амина, азида, простого эфира, тиоэфира или сложного эфира из соответствующего спирта.[8] Он используется в синтезе различных натуральных продуктов и фармацевтических препаратов, таких как зидовудин, СПИД препарат, средство, медикамент; FdUMP, сильнодействующее противоопухолевое средство; и прокарбазин, химиотерапевтический препарат.
Характеристики
DEAD - это оранжево-красная жидкость, цвет которой становится желтым или бесцветным при разбавлении или химической реакции. Это изменение цвета обычно используется для визуального контроля синтеза. DEAD растворяется в большинстве обычных органических растворителей, таких как толуол, хлороформ, этиловый спирт,[9] тетрагидрофуран и дихлорметан[3][10] но имеет низкую растворимость в воде или четыреххлористый углерод; растворимость в воде выше для родственного азосоединения диметил азодикарбоксилат.[4]
DEAD является сильным акцептором электронов и легко окисляет раствор йодид натрия в ледниковом уксусная кислота. Также он активно реагирует с гидразин гидрат производство диэтилгидразодикарбоксилата и выделяющегося азота. Линейная комбинация атомных орбиталей, метод молекулярных орбиталей Расчеты (LCAO-MO) предполагают, что молекула DEAD необычна тем, что имеет высоко расположенную свободную связывающую орбиталь, и поэтому имеет тенденцию отводить атомы водорода от различных доноров водорода. Удаление водорода с помощью фотоэлемента DEAD было продемонстрировано для изопропиловый спирт, в результате чего пинакол и тетраэтилтетразантетракарбоксилат, и для ацетальдегид уступающий диацетил и диэтилгидразодикарбоксилат. Точно так же реакция DEAD с этанолом и циклогексанол абстрагирует производство водорода ацетальдегид и циклогексанон. Эти реакции также протекают без света, хотя и с гораздо меньшими выходами.[9]Таким образом, в целом DEAD - это азадиенофил и дегидрирующий агент, превращающий спирты к альдегиды, тиолы к дисульфиды и гидразогруппы к азо группы.[11] Он также подвергается перициклические реакции с алкены и диены через Ene и Дильс – Альдер механизмы.[12]
Подготовка
Хотя диэтилазодикарбоксилат имеется в продаже, его можно приготовить свежим в лаборатории, особенно если требуется, в чистой, неразбавленной форме. Двухэтапный синтез начинается с гидразин, сначала алкилирование с этилхлорформиат с последующей обработкой полученного диэтилгидразодикарбоксилата хлор (бурление через раствор), хлорноватистая кислота, концентрированный азотная кислота или же красная дымящаяся азотная кислота. Реакцию проводят на ледяной бане, и реагенты добавляют по каплям, чтобы температура не поднималась выше 20 ° C. Диэтилгидразодикарбоксилат - твердое вещество с температурой плавления 131–133 ° C, которое собирают в виде остатка; он значительно более устойчив к нагреванию, чем DEAD, и его обычно сушат при температуре около 80 ° C.[4][13]
Приложения
Мицунобу реакция
DEAD - это реагент в Мицунобу реакция где он образует аддукт с фосфинами (обычно трифенилфосфин ) и способствует синтезу сложных эфиров, простых эфиров, аминов и тиоэфиров из спиртов. Реакции обычно приводят к инверсия молекулярной симметрии.
DEAD был использован в оригинальной статье 1967 г. Ойо Мицунобу,[14] а его обзор использования диэтилазодикарбоксилата в 1981 году является самой цитируемой статьей по химии.[15][16] Реакция Мицунобу имеет несколько применений в синтезе натуральных продуктов и фармацевтических препаратов.
В приведенной выше реакции, которой помогает DEAD или ДИАДА (диизопропилазодикарбоксилат), тимидин 1 преобразуется в производную 2. Последний легко превращается в зидовудин. 4 (также известный как азидотимидин или AZT), важный противовирусный препарат, используемый, среди прочего, для лечения СПИД.[17][18][19] Другой пример фармацевтического применения реакции Мицунобу с помощью DEAD - это синтез бис [(пивалоилокси) метил [PIVz] производного 2’-дезокси-5-фторуридин 5’-монофосфата (FdUMP), который является мощным противоопухолевым агентом.[20]
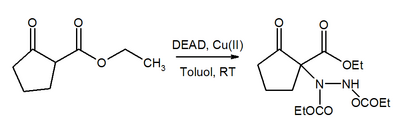
Реакция Майкла
Азо-группа в DEAD - это Майкл акцептор. В присутствии катализатора из меди (II) DEAD способствует превращению β-кетоэфиров в соответствующие производные гидразина.[21]
Замена бороновая кислота сложные эфиры действуют аналогично:[22]

Другие реакции
DEAD - эффективный компонент в Реакции Дильса-Альдера И в щелкните по химии, например, синтез бицикло [2.1.0] пентана, который происходит из Отто Дильс.[23] Он также использовался для создания аза-Бейлис-Хиллман аддукты с акрилатами.[24]
DEAD можно использовать для синтеза гетероциклические соединения. Таким образом, пиразолин деривативы конвертировать конденсация к α, β-ненасыщенным кетоны:[25]

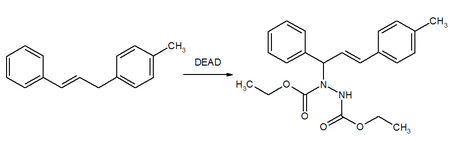
Другое применение - использование DEAD в качестве энофила в еновых реакциях:
Безопасность
DEAD токсичен, чувствителен к шоку и свету; он может сильно взорваться, когда его неразбавленная форма нагревается выше 100 ° C.[2][3][26] Доставка по воздуху чистого диэтилазодикарбоксилата запрещена в Соединенных Штатах и осуществляется в растворе, обычно около 40% МЕРТВОГО в толуоле.[27] Как вариант, DEAD транспортируется и хранится на 100–300 сетка полистирол частицы в концентрации около 1 ммоль /грамм.[3] Среднее значение, взвешенное по времени предельное пороговое значение для воздействия DEAD в течение типичной 40-часовой рабочей недели - 50 частей на миллион; то есть DEAD вдвое менее токсичен, чем, например, монооксид углерода.[28] Угрозы безопасности привели к быстрому сокращению использования DEAD и замене на ДИАДА и другие подобные соединения.
Рекомендации
- ^ Диэтилазо диформиат. Webbook.nist.gov (1972-07-28). Проверено 15 марта 2011.
- ^ а б Данные по безопасности (MSDS) диэтилазодикарбоксилата. Msds.chem.ox.ac.uk. Проверено 15 марта 2011.
- ^ а б c d е ж У. Л. Ф. Армарего; Кристина Ли Линь Чай (22 мая 2009 г.). Очистка лабораторных химикатов. Баттерворт-Хайнеманн. С. 124–. ISBN 978-1-85617-567-8. Получено 12 марта 2011.
- ^ а б c Кауэр, Дж. К. «Диэтилазодикарбоксилат». Органический синтез.; Коллективный объем, 4, п. 411
- ^ L19348 Диэтилазодикарбоксилат, 97% - Alfa Aesar - A Johnson Matthey Company. Alfa.com (1972-07-28). Проверено 15 марта 2011.
- ^ Кэролайн Купер (23 июля 2010 г.). Настольный справочник химика-органика. CRC Press. С. 109–. ISBN 978-1-4398-1164-1. Получено 12 марта 2011.
- ^ DEAD иногда используется для другого химического вещества, диэтилацетилендикарбоксилата. П. Н. Престон (1980). Бензимидазолы и родственные трициклические соединения. Джон Уайли и сыновья. С. 475–. ISBN 978-0-471-08189-0. Получено 12 марта 2011.
- ^ Барбара., Чако (2009). Стратегические применения названных реакций в органическом синтезе: предпосылки и подробные механизмы; 250 названных реакций. Эльзевир. ISBN 9780123694836. OCLC 634820219.
- ^ а б Йонеда, Фумио; Сузуки, Кунио; Нитта, Йошихиро (1967). «Новая реакция выделения водорода с диэтилазодикарбоксилатом». Журнал органической химии. 32 (3): 727–729. Дои:10.1021 / jo01278a049. ISSN 0022-3263.
- ^ Кельмара К. Келли (2009) Новые изотопные эффекты и механизмы органических реакций, Докторская диссертация, Техасский университет A&M, стр. 81 год
- ^ Фумио Йонеда; Кунио Сузуки; Ёсихиро Нитта (1966). «Новая реакция абстрагирования водорода с диэтилазодикарбоксилатом». Варенье. Chem. Soc. 88 (10): 2328. Дои:10.1021 / ja00962a051.
- ^ Эрик Дж. Стоунер, Эми К. Харт (2010). «Диэтилазодикарбоксилат». Энциклопедия реагентов для органического синтеза, 8 томов. Энциклопедия реагентов для органического синтеза. Дои:10.1002 / 047084289X.rd176.pub2. ISBN 978-0471936237.CS1 maint: использует параметр авторов (связь)
- ^ Рабджон, Н. (1948). «Диэтилазодикарбоксилат». Органический синтез. 28: 58. Дои:10.15227 / orgsyn.028.0058.
- ^ Mitsunobu, O .; Ямада, Ю. (1967). «Получение сложных эфиров карбоновой и фосфорной кислоты через соли четвертичного фосфония». Бык. Chem. Soc. JPN. 40 (10): 2380–2382. Дои:10.1246 / bcsj.40.2380.
- ^ Мицунобу, Ойо (1981). «Использование диэтилазодикарбоксилата и трифенилфосфина в синтезе и преобразовании натуральных продуктов». Синтез. 1981: 1–28. Дои:10.1055 / с-1981-29317.
- ^ По данным на март 2011 г., более 4300 цитирований Web of Science
- ^ Чернеки, Станислас и Валери, Жан-Марк «Процесс получения AZT (3'-азидо-3'-дезокситимидина) и родственных соединений» Патент США 5,124,442 выдан 23 июня 1992 г.
- ^ Чернецкий, Станислав; Валери, Жан-Марк (1991). «Эффективный синтез 3'-азидо-3'-дезокситимидина (AZT)». Синтез. 1991 (3): 239. Дои:10.1055 / с-1991-26434.
- ^ Dueholm, Kim L .; Aly, Youssef L .; Jørgensen, Per T .; Эль-Барбари, Ахмед А .; Педерсен, Эрик Б .; Нильсен, Клаус (1993). «Конвергентный синтез 2 ', 3'-дидезокси-3'-метилтио и 2', 3'-дидезокси-3'-меркаптонуклеозидов и их дисульфидных аналогов - потенциальные средства против ВИЧ». Monatshefte für Chemie - Ежемесячный химический журнал. 124: 37–53. Дои:10.1007 / BF00808508.
- ^ Фаркуар, Дэвид; Хан, Саид; Шриваства, Девендра Н .; Сондерс, Присцилла П. (1994). «Синтез и противоопухолевая оценка бис [(пивалоилокси) метил] 2'-дезокси-5-фторуридин 5'-монофосфата (FdUMP): стратегия введения нуклеотидов в клетки». Журнал медицинской химии. 37 (23): 3902–9. Дои:10.1021 / jm00049a009. PMID 7966151.
- ^ Comelles, C .; и другие. (2004). «Катализаторы на основе ионной и ковалентной меди (II) для добавок Майкла. Механизм». J. Org. Chem. 69 (20): 6834–42. Дои:10.1021 / jo049373z. PMID 15387609.
- ^ Такеши Уэмура; Наото Чатани (2005). «Добавление арилбороновой кислоты к азодикарбоксилатам, катализируемое солями меди». J. Org. Chem. 70 (21): 8631. Дои:10.1021 / jo051387x. PMID 16209627.
- ^ Гассман П.Г., Мэнсфилд К.Т. (1969). «БИЦИКЛО [2.1.0] ПЕНТАН». Органический синтез. 49: 1. Дои:10.15227 / orgsyn.049.0001. ISSN 0078-6209.
- ^ Ши, Мин; Чжао, Гуй-Лин (2004). «Реакции аза-Бейлиса-Хиллмана диизопропилазодикарбоксилата или диэтилазодикарбоксилата с акрилатами и акрилонитрилом». Тетраэдр. 60 (9): 2083–2089. Дои:10.1016 / j.tet.2003.12.059.
- ^ Виджей Наир; Смита К. Мэтью; Аккатту Т. Биджу; Эрингатоди Суреш (2007). "Новая реакция" Huisgen Zwitterion "с халконами и диенонами: эффективная стратегия синтеза пиразолина и производных пиразолопиридазина". Энгью. Chem. Int. Эд. 46 (12): 2070–2073. Дои:10.1002 / anie.200604025. PMID 17286329.
- ^ Дж. К. Барретт (1999). Производные аминокислот: практический подход. Издательство Оксфордского университета. С. 119–. ISBN 978-0-19-855853-8. Получено 12 марта 2011.
- ^ Диэтилазодикарбоксилат в химическом синтезе. Sigmaaldrich.com. Проверено 15 марта 2011.
- ^ Ливиус Котарка; Хайнер Эккерт (2004). Phosgenations - справочник. Wiley-VCH. п. 42. ISBN 978-3-527-29823-5. Получено 12 марта 2011.



