Гигантоклеточная карцинома легкого - Giant-cell carcinoma of the lung
Эта статья требует редактирования для соответствия с Википедией Руководство стиля. В частности, у него есть проблемы с неиспользованием MEDMOS. (Июнь 2018 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
| Гигантоклеточная карцинома легкого | |
|---|---|
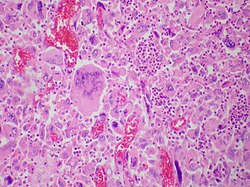 | |
| Легочная гигантоклеточная карцинома представляет собой редкую разновидность немелкоклеточной карциномы легкого, которая характеризуется наличием множества гигантских опухолевых клеток и притоком воспалительных клеток, которые в основном представляют собой полиморфноядерные лейкоциты, смешанные с макрофагами. Плотные овальные агрегаты полиморфноядерных лейкоцитов, видимые на этом изображении, вероятно, расположены в цитоплазме гигантских опухолевых клеток (эмпериополез), которые были разрезаны в плоскости, не включающей их ядра. | |
| Специальность | Онкология |
Гигантоклеточная карцинома легкого (GCCL) является редким гистологический форма крупноклеточный рак легкого, подтип недифференцированный рак легких, традиционно относящиеся к немелкоклеточные карциномы легких (НМРЛ).
Характерная черта этого смертоносного злокачественная опухоль отличительный свет микроскопический внешний вид его чрезвычайно большого клетки, которые причудливы и очень плеоморфный, и которые часто содержат более одного огромного деформированного плеоморфного ядро ("синцития "), которые являются результатом слияние клеток.
Хотя в литературе по раку легких принято относиться к гистологически смешанным опухолям, содержащим значительное количество злокачественных опухолей. гигантские клетки как «гигантоклеточная карцинома», технически диагноз «гигантоклеточная карцинома» должен строго ограничиваться новообразования содержащий Только злокачественные гигантские клетки (то есть «чистая» гигантоклеточная карцинома).[1]
Помимо большой разнородности рака легких (особенно у курильщиков табака), значительная вариабельность диагностический и отбор проб методы, используемые в медицинской практике, высокая относительная доля лиц с подозрением на GCCL, которые не прошли полную хирургический резекция, а также почти повсеместное отсутствие полных срезов и патологического исследования образцов резецированной опухоли не позволяет достичь высокого уровня количественной точности.
Классификация
В течение нескольких десятилетий первичный рак легких последовательно дихотомически классифицировался в целях лечения и исследований на: мелкоклеточные карциномы легких (SCLC) и немелкоклеточные карциномы легких (НМРЛ), основанный на чрезмерно упрощенном подходе, который сейчас явно устарел. Новая парадигма признает, что рак легких - это большая и чрезвычайно серьезная проблема. неоднородный семья злокачественных новообразования,[2] с более чем 50 различными гистологическими вариантами, включенными в 4-ю (2004 г.) ревизию Всемирная организация здоровья система типирования, наиболее широко используемая схема классификации рака легких («ВОЗ-2004»).[1] Эти варианты все чаще оцениваются как имеющие разные генетический, биологический, и клинический свойства, в том числе прогнозы и ответы на лечение схемы и, следовательно, эта правильная и последовательная гистологическая классификация рака легких необходимы для проверки и реализации оптимальных стратегий ведения.[3][4]
Около 1% случаев рака легких саркомы, опухоли половых клеток, и гемопоэтические опухоли, в то время как 99% случаев рака легких карцинома. Карциномы - это опухоли, состоящие из трансформированных аномальных клеток с ткань эпителия архитектура и / или молекулярный характеристики, и которые происходят от эмбриональный энтодерма.[5] В классификации ВОЗ-2004 признаны восемь основных таксонов карцином легких:[1]
- Мелкоклеточная карцинома
- Плоскоклеточная карцинома
- Аденокарцинома
- Крупноклеточная карцинома
- Аденосквамозная карцинома
- Саркоматоидная карцинома
- Карциноид
- Карцинома слюнных желез
Подклассификация GCCL среди этих основных таксонов претерпела значительные изменения за последние десятилетия. Согласно 2-й редакции (1981 г.) классификации ВОЗ, он считался подтипом крупноклеточная карцинома.[6] В 3-ей (1999 г.) редакции[7] он был помещен в таксон под названием «Карциномы с плеоморфными, саркоматоидными или саркоматозными элементами» вместе с плеоморфная карцинома, веретеноклеточная карцинома, карциносаркома, и легочная бластома, которые (возможно) являются родственными вариантами. В то время как 4-я редакция («ВОЗ-2004») сохранила ту же группу поражений, что и 3-я редакция, название основного таксона было сокращено до «саркоматоидные карциномы ".[1]
Текущие правила классификации рака легких в соответствии с ВОЗ-2004, хотя и полезны и усовершенствованы, в некоторой степени остаются довольно сложными, двусмысленными, произвольными и неполными.[1] Хотя смешанные опухоли, содержащие гигантские злокачественные клетки, довольно часто называются гигантоклеточными карциномами, точный классификация легочной опухоли как GCCL требует, чтобы вся опухоль состоит Только злокачественных гигантских клеток. Таким образом, полный забор всей опухоли - полученный с помощью хирургический резекция - абсолютно необходимо для окончательного диагноза GCCL.[1]
Цитология
Фон содержал множество лимфоцитов и нейтрофилов. Форма опухолевой клетки была веретенообразной или плеоморфной, а размеры опухолевых клеток варьировались более чем в 5 раз. Опухолевые клетки имели обильную, толстую и хорошо разграниченную цитоплазму. Расположение ядра центробежное, ядро овальной или неправильной формы. Часто наблюдались многоядерные гигантские клетки. Размер ядра был более чем в 5 раз больше, чем у нормальных лимфоцитов, и его размер также отличался более чем в 5 раз. Ядерная мембрана тонкая, ядерный хроматин крупнозернистый, а ядрышко единое и круглое.
В цитологических препаратах гигантские клетки обычно появляются в виде отдельных клеток или плоских рыхлых кластеров, а иногда и пучков.[8]
GCCL считаются членом наиболее распространенного типа рак легких, называется "немелкоклеточные карциномы ". Эта группа летальных новообразований составляет примерно 85% всех случаев рака легких.[1] Согласно определению «крупноклеточная карцинома по сравнению с мелкоклеточной карциномой», диаметр клеток GCCL должен быть значительно больше, чем в три раза, чем в состоянии покоя (т. е. без стимуляции) лимфоцит. Также по определению GCCL делает нет содержать любой количество этих небольших нейросекреторных гранул, содержащих нейроэндокринный клетки, характерные для мелкоклеточные карциномы - когда они это сделают, опухоль должна быть классифицирована как комбинированная мелкоклеточная карцинома.[1]
По сравнению с большинством других вариантов рака легких клетки, содержащие GCCL, имеют тенденцию быть намного больше (до 150 микрометров в диаметре или даже больше),[9] И клетки, и ядра сильно различаются по размеру и форме. Ядра карциномы гигантских клеток карциномы в среднем в 5 раз превышают размер ядер лимфоцитов.[8]
Клетки гигантоклеточной карциномы анапластический, и не показывают признаков созревания или дифференцировки клеток, не имея цитологический и тканевые архитектурные характеристики плоскоклеточная карцинома, аденокарцинома, нейроэндокринный карциномы или другие более дифференцированные типы клеток рака легких. Они, как правило, очень плеоморфны (т. Е. Изменчивы по характеристикам), но чаще всего имеют округлую и / или многоугольную форму с относительно низким соотношением ядер.цитоплазматический соотношение. Когда они связаны с веретеновыми клетками, что очень часто встречается в опухолях со смешанной гистологией, при цитологическом исследовании злокачественные гигантские клетки имеют тенденцию образовывать слабосвязные агрегатные структуры. Однако когда биопсия Образец состоит исключительно из гигантских злокачественных клеток, которые обычно бывают одиночными и дезагрегированными.[1]
Серия случаев показывает, что относительное количество гигантских клеток в данной опухоли, как правило, прямо пропорционально размеру опухоли и относительной степени некроза.[10]
Гигантские клетки при раке легких тесно связаны с наличием веретенов.[11]
В хроматин злокачественных гигантских клеток имеет тенденцию быть гиперхроматичными и крупно сгруппированными. Ядрышки обычно множественные и выступающие.[9]
Субклеточные характеристики, часто отмечаемые в злокачественных гигантских клетках при GCCL, включают обильные митохондрии, концентрические завитки тонофиламентных фибрилл и агрегаты из нескольких пар центриолей.[12]
Эмпериполез как «опухолевые клетки-опухолевые клетки», так и «лейкоциты-опухолевые клетки» (то есть активное проникновение последних) очень часто наблюдается в случаях GCCL.[12]
Архитектурные особенности ткани
В смешанных опухолях гигантские клетки с большей вероятностью будут обнаружены в большем количестве на краю опухоли.[11] Когда присутствует обширный некроз, гигантоклеточная опухоль может иметь только тонкий ободок из жизнеспособных клеток, остающийся по периметру образования.[нужна цитата ]
В одной ранней серии случаев было отмечено обильное образование рыхлых злокачественных гигантских клеток, заполняющих альвеолы жертв без разрушения, проникновения или нарушения нормальной базовой архитектуры, патологический поведение, которое имеет некоторое сходство с легочным вариантом бронхиолоальвеолярная карцинома.[13]
Обширный некроз опухоли и кровотечение чрезвычайно распространены при GCCL.[13]
Хотя проблема не была тщательно изучена контролируемым образом, было отмечено, что GCCL содержат значительно повышенные уровни VEGF.[14] Однако в одном исследовании, в котором опухоль гигантоклеточной карциномы, которая была полностью удалена, была разделена и исследована, не было отмечено качественных или количественных отклонений в васкуляризации ткани.[9]
Было отмечено, что GCCL инкапсулирован и разделяется через перегородки на «псевдолобулы» высокофиброзной стромой, которая, как предполагается, продуцируется соразмерно росту опухоли. Капсула обычно инфильтрирована гигантскими злокачественными клетками.[15]
Макроскопические особенности
Гигантоклеточные карциномы легких часто проявляют обширный некроз.[15] и миксоидная дегенерация.[11]
Была отмечена тенденция к уменьшению васкуляризации и плотности тканей (с меньшим усилением контраста на КТ) по направлению к центру этих поражений, особенно в больших опухолях, и даже в опухолях без значительного объема грубого некроза.[16]
В целом, срезанные поверхности этих злокачественных новообразований часто бывают серо-белыми или коричневыми и часто имеют миксоидные, некротические и / или геморрагические очаги.[16] Такие области часто показывают низкий уровень контрастности на CT сканирование.[нужна цитата ]
Как правило, наблюдаются низкая инкапсулярность и высокий уровень тканевого коллагена с сильным усилением контраста в этих областях.[16]
Было замечено, что GCCL развивается из / в эмфизематозный буллы.[17]
Окрашивание и иммуногистохимия
Случай метастазов в мозг из гигантоклеточной карциномы легкого (обе «чистые») дал положительный результат на цитокератины AE1 / AE3 и отрицательный на CK-7, CK-20, TTF-1 и GFAP.[18]
Клетки GCCL часто интенсивно окрашиваются реактивом Шиффа Периодной кислоты, что свидетельствует о наличии в клетке значительных количеств гликогена. цитоплазма.[15]
Дифференциальная диагностика
Под светом микроскопия, гигантские злокачественные плеоморфные клетки, составляющие GCCL, напоминают клетки, обнаруженные в хориокарцинома,[1] ангиосаркома,[19] и некоторые формы истинного саркома,[1] такие как злокачественная фиброзная гистиоцитома[1] и рабдомиосаркома.[9] В некоторых случаях они также могут иметь большое сходство с «активированным». гистиоциты видел в некоторых воспалительный условия.[9]
Редкая и потенциально трудная дилемма дифференциальной диагностики возникает, когда GCCL должны быть отделены от легочных или средостение хориокарциномы Это важное различие для меня, потому что, хотя есть известный стандарт лечения хориокарциномы, пока еще нет общепринятого специфического стандартного лечения GCCL. Тщательный анализ морфологии клеток является ключом к их разграничению - в то время как GCCL демонстрируют большие различия в распределении размеров и морфологии клеток в опухолях, хориокарциномы неизменно содержат только синцитиотрофобласты и цитотрофобласты.[20] GCCL и первичную хориокарциному легких также можно дифференцировать на основе ультраструктурных особенностей по электронная микроскопия, хотя EM еще не получил широкого распространения.[21]
Иногда метастаз GCCL в кости потенциально может быть ошибочно принят за первичный гигантоклеточная опухоль кости[22] - последний объект может вести себя как новообразование из доброкачественный, откровенно злокачественная,[23] или пограничный[24] в его клиническом поведении.[25]
Места метастазирования
GCCL особенно примечательны среди рака легких своей чрезвычайно необычной тенденцией метастазировать в тонкий кишечник, иногда вызывая препятствие, суровый кровотечение, и / или инвагинация. Эта клиническая характеристика GCCL наблюдалась в случаях, охватывающих более полувека.[26][27]
Внутри тонкой кишки тощая кишка, по-видимому, является предпочтительным местом для метастазирования GCCL.
GCCL также часто метастазирует в кости,[22] надпочечник, мозг,[18] легкие, печень, почки,
Метастазы в мозг из GCCL с большей вероятностью вызывают значительные кровоизлияния в мозг по сравнению с другими вариантами рака легких, вероятно, из-за значительного увеличения скорости пролиферации эндотелия и неоваскуляризации, роста опухолевой ткани, обширного некроза и агрессивного местного инфильтративного характера клеток GCCL.[18]
Патогенез
Несколько исследований, проведенных как на образцах гигантоклеточных опухолей, так и на клеточных линиях, выявили перестройку и усиление c-myc онкоген, иногда в сочетании с мутациями K-ras ген.[28][29]
Было показано, что сверхэкспрессия фактора роста эндотелия сосудов (VEGF) происходит в GCCL и, как полагают, связана с высоким метастатическим потенциалом этого варианта рака легких.[14]
Злокачественные гигантские клетки, идентичные тем, которые обнаруживаются в GCCL, обычно встречаются в случаях рака легких с выраженными большими или незначительными светлоклеточная карцинома pattern (обсуждение этого варианта см., например,[30]). Была выдвинута гипотеза, что они произошли от недифференцированного мультипотентный злокачественный стволовая клетка предшественник, который образуется в дистальном бронхиолы через пока неизвестный онкогенный путь или же онкогенный драйвер.[12]
Ультраструктурно злокачественные гигантские клетки часто содержат скопления микрофиламентов, расположенных завитушками около ядра клетки. Эти образования кажутся похожими по структуре на микрофиламенты и пучки, обнаруженные в клетке D1 желудочно-кишечного тракта и поджелудочной железы. эндокринный системы, и было высказано предположение, что эти клетки D1 могут быть раковыми стволовыми клетками по крайней мере для некоторых GCCL. Идентично выглядящие завитые структуры нитей также образовывались в некоторых клетках дыхательных путей животных после обработки канцерогенный нитрозамины.[31]
Ультраструктурные исследования показали, что гигантские злокачественные клетки в GCCL имеют энтодермальное происхождение.[32]
Замечательно быстрорастущие опухоли.[18]
Комбинированные / многофазные опухоли, содержащие гигантские клетки
Злокачественные гигантские клетки обычно обнаруживаются - и варьируются в относительной пропорции в большей или меньшей степени - как в первичных опухолях, так и в метастатазах многих различных вариантов карциномы легких. Ряд авторов отметили, что необычные злокачественные гигантские клетки чаще встречаются в первичных и вторичных опухолях, включая любые оставшиеся опухолевые «отложения», которые ранее лечились с помощью химиотерапия и / или радиация терапия в адъювант или же неоадъювантный протоколы.[32]
Характеристики изображения
GCCL часто представляет собой большую периферическую массу с сильной кавитацией.[33]
В рентгенографическом исследовании почти 2000 пациентов с раком легких, опубликованном 50 лет назад, 3,4% карцином легких оказались кавитационными массами.[34] большинство из которых были плоскоклеточная карцинома.
В ряде случаев сильной кавитации резецированный остаток опухоли состоит только из тонкого ободка из пролиферирующих клеток.[нужна цитата ]
Позитронно-эмиссионная томография
На позитронно-эмиссионная томография (ПЭТ) сканирование, было обнаружено, что GCCL имеет чрезвычайно высокие стандартизованные значения поглощения (SUV) для радиоактивной глюкозы, значения, которые статистически значимо выше, чем при других гистологических вариантах рака легких.[35]
Метаболические пути
ПЭТ-сканирование предполагает, что GCCL - это опухоли с особенно быстрым метаболизмом, и что метаболические пути GCCL могут быть необычно зависимыми или взаимосвязанными с ними. гликолиз.[35]
Паранеопластические синдромы
GCCL давно известны[36] для секреции бета субъединица хорионического гонадотропина человека (бета-HCG), часто в больших количествах, что может привести к очень высокому уровню эстроген и болезненно гинекомастия (увеличение груди) у мужчин как паранеопластические признаки.[37]
Гигантоклеточный рак легких хорошо известен своей паранеопластической продукцией и секрецией гранулопоэтического колониестимулирующего фактора (G-CSF).[29][38]
Сообщалось также, что GCCL продуцирует активатор плазминогена как паранеопластический феномен.[9]
Уход
Из-за его редкости не было рандомизированных клинических испытаний лечения GCCL, и вся доступная информация получена из небольших ретроспективных институциональных серий или многоцентровых метаданных.[39]
Прогноз
Гигантоклеточный рак легких долгое время считался исключительно агрессивным злокачественным новообразованием.[40][15][41] которые растут очень быстро[29] и имеют очень плохой прогноз.[42]
Многие небольшие исследования показали, что прогноз опухолей легких с гигантскими клетками хуже, чем у большинства других форм немелкоклеточного рака легких (НМРЛ).[11] в том числе плоскоклеточный рак,[42] и веретеноклеточная карцинома.[42]
Общая пятилетняя выживаемость при GCCL варьируется между исследованиями, но обычно считается очень низкой. Институт патологии вооруженных сил (США) сообщил о цифре 10%,[43] а в исследовании, посвященном более чем 150 000 случаев рака легких, была дана цифра 11,8%.[5] Однако в последнем отчете цифра 11,8% была основана на данных, которые включали веретеноклеточная карцинома, вариант, который, как обычно считается, имеет менее мрачный прогноз, чем GCCL.[11] Следовательно, вероятная выживаемость «чистого» GCCL, вероятно, ниже заявленной цифры.
В большом обзоре базы данных 1995 года, проведенном Трэвисом и его коллегами, гигантоклеточная карцинома имеет третий худший прогноз среди 18 гистологических форм рака легких. (Только мелкоклеточная карцинома и крупноклеточная карцинома имели более короткую среднюю выживаемость.)[5]
Большинство GCCL уже выросли и проникли локально и / или регионально, и / или уже дали отдаленные метастазы и на момент постановки диагноза являются неоперабельными.[15]
Эпидемиология
Верно заболеваемость, распространенность, и смертность GCCL обычно неизвестно из-за отсутствия точных рак данные на национальном уровне. Однако известно, что это очень редкий вариант опухоли во всех исследованных популяциях. В Американец исследование базы данных о более чем 60000 раковых опухолях легких, GCCL составлял от 0,3% до 0,4% первичных легочный злокачественные новообразования, при этом коэффициент заболеваемости с поправкой на возраст составляет около 3 новых случаев на миллион человек в год.[5] Приблизительно 220 000 случаев рака легких диагностированы в нас каждый год,[44] это соотношение предполагает, что ежегодно у американцев диагностируется примерно 660 и 880 новых случаев.[5][45]
Однако из более поздней серии из 4212 последовательных случаев рака легких только один (0,024%) поражение была определена как «чистая» гигантоклеточная карцинома после полного разделения всей доступной опухоли. ткань.[35] Хотя некоторые данные свидетельствуют о том, что несколько десятилетий назад GCCL мог быть значительно более распространенным, в одной серии исследований было идентифицировано 3,4% всех карцином легких как гигантоклеточные злокачественные новообразования.[46] возможно, что это число отражает
Большинство опубликованных серий случаев и отчетов о гигантских клетках рака легких показывают, что они диагностируются гораздо чаще у мужчин, чем у женщин.[16][42] с некоторыми исследованиями, показывающими чрезвычайно высокое соотношение мужчин и женщин (12: 1 или более). Однако в исследовании с участием более 150 000 жертв рака легких в США соотношение полов было чуть более 2: 1, при этом относительная доля гигантоклеточного рака у женщин на самом деле выше (0,4%), чем у мужчин (0,3%).[5]
Сообщалось, что гигантоклеточные карциномы диагностируются у значительно более молодого населения, чем все немелкоклеточные карциномы, рассматриваемые как группа.[16][40] Однако, как и почти все карциномы легких, GCC чрезвычайно редки у очень молодых людей: в США ВИДЯЩИЙ В период с 1983 по 1987 годы было зарегистрировано только 2 случая заболевания среди лиц моложе 30 лет.[5] Средний возраст постановки диагноза этих опухолей оценивается в 60 лет.[16]
Подавляющее большинство людей с GCCL - заядлые курильщики.[16]
Хотя определения "центральный " и "периферийный " может изменяться[16] между исследованиями GCCL неизменно диагностируется гораздо чаще в легкое периферия.[16] В обзоре литературы, составленном Kallenburg с соавторами, менее 30% GCCL возникают в воротах или других частях «центрального» легочного дерева.[40]
Также постулируется значительная предрасположенность к генезу GCCL в верхних долях жертв.[16]
История
Большинство источников приписывают Нэшу и Стауту публикацию первого подробного отчета в медицинской литературе о признании GCCL отдельной клинико-патологической организацией в 1958 году.[47] Однако есть некоторые свидетельства того, что эта опухоль фенотип был описан еще в 1951 г.[13] В отчете о 3 случаях гигантоклеточного рака легкого, опубликованном в 1961 году З.М. Наиб, автор цитирует два предыдущих исследования, связанных с GCCL, одно из которых было опубликовано в 1951 году M.M. Паттон и его сотрудники,[48] и один опубликованный в 1955 году Уолтоном и Прайсом.[49] В 1969 году доктор Александр Кеннеди в серии случаев из 3 GCCL Kennedy, опубликованных в 1969 году,[15] приписывают Хэдли и Буллоку первое использование термина «гигантоклеточная карцинома» 16 лет назад.[50]
GCCL был впервые подтвержден как эпителиальная опухоль (а не дедифференцированная плеоморфная опухоль). саркома ) в 1961 году.[51] В 1964–65 постулировались теории о том, что GCCL были дедиффентифицированными аденокарциномами.[52] а в некоторых случаях считалось происходящим от светлоклеточные аденокарциномы.[30]
Рекомендации
- ^ а б c d е ж грамм час я j k л Трэвис, Уильям Д; Брамбилла, Элизабет; Мюллер-Хермелинк, Х. Конрад; и др., ред. (2004). Патология и генетика опухолей легкого, плевры, тимуса и сердца (PDF). Классификация опухолей Всемирной организации здравоохранения. Лион: IARC Press. ISBN 92-832-2418-3. Архивировано из оригинал (PDF) 21 июля 2011 г.. Получено 27 марта 2010.
- ^ Roggli VL, Vollmer RT, Greenberg SD, McGavran MH, Spjut HJ, Yesner R (1985). «Гетерогенность рака легких: слепое и рандомизированное исследование 100 последовательных случаев». Хум Патол. 16 (6): 569–79. Дои:10.1016 / с0046-8177 (85) 80106-4. PMID 2987102.
- ^ Росси Дж., Маркиони А., Сартори Дж., Лонго Л., Пиччинини С., Кавацца А. (2007). «Гистотип в терапии и стадии немелкоклеточного рака легкого: новая роль старого и недооцененного фактора». Curr Resp Med Rev. 3: 69–77. Дои:10.2174/157339807779941820. S2CID 52904357.
- ^ Винсент, доктор медицины (2009). «Оптимизация лечения распространенного немелкоклеточного рака легкого: личное мнение». Курр Онкол. 16 (4): 9–21. Дои:10.3747 / co.v16i4.465. ЧВК 2722061. PMID 19672420.
- ^ а б c d е ж грамм Трэвис У.Д., Трэвис Л.Б., Девеса СС (1995). "Рак легких". Рак. 75 (1 приложение): 191–202. Дои:10.1002 / 1097-0142 (19950101) 75: 1+ <191 :: AID-CNCR2820751307> 3.0.CO; 2-Y. PMID 8000996.
- ^ Всемирная организация здравоохранения (1981). Гистологическое типирование опухолей легких (2-е изд.). Женева: Всемирная организация здравоохранения.
- ^ Брамбилла Э., Трэвис У.Д., Колби ТВ, Коррин Б., Шимосато Y (декабрь 2001 г.). «Новая классификация опухолей легких Всемирной организации здравоохранения». Евро. Респир. J. 18 (6): 1059–68. Дои:10.1183/09031936.01.00275301. PMID 11829087. S2CID 3108488.
- ^ а б Хиросима К., Досака-Акита Х, Усуда К. и др. (2011). «Цитологические характеристики плеоморфных и гигантоклеточных карцином легких». Акта Цитол. 55 (2): 173–9. Дои:10.1159/000320860. PMID 21325803. S2CID 39144324.
- ^ а б c d е ж Дэвидсон Дж. Ф., Макникол Г. П., Франк Г. Л., Андерсон Т. Дж., Дуглас А. С. (январь 1969 г.). «Опухоль, продуцирующая активатор плазминогена». Br Med J. 1 (5636): 88–91. Дои:10.1136 / bmj.1.5636.88. ЧВК 1982019. PMID 5761832.
- ^ Качич М., Оберман Б., Дворник Г. (декабрь 1989 г.). «Исследование применимости гистологической классификации бронхиальной карциномы согласно Всемирной организации здравоохранения». Тумори. 75 (6): 580–2. Дои:10.1177/030089168907500613. PMID 2482566. S2CID 11142517.
- ^ а б c d е Мацуи К., Китагава М. (май 1991 г.). «Веретеноклеточная карцинома легкого. Клинико-патологическое исследование трех случаев». Рак. 67 (9): 2361–7. Дои:10.1002 / 1097-0142 (19910501) 67: 9 <2361 :: help-cncr2820670925> 3.0.co; 2-3. PMID 1707339.
- ^ а б c Ван Н.С., Семайер Т.А., Ахмед М.Н., Кнаак Дж. (Январь 1976 г.). «Гигантоклеточный рак легкого. Исследование с помощью светового и электронного микроскопа». Гм. Патол. 7 (1): 3–16. Дои:10.1016 / с0046-8177 (76) 80003-2. PMID 172430.
- ^ а б c Наиб З.М. (1961). «Гигантоклеточная карцинома легкого: цитологическое исследование слущенных клеток в мокроте и смывах из бронхов». Сундук Диса. 40: 69–73. Дои:10.1378 / сундук.40.1.69. PMID 13727525. S2CID 19208368.
- ^ а б Цзян Д.Ф., Лу ИЛ, Цю Цзы и др. (2003). «Исследование дифференциальной экспрессии молекул, влияющих на метастатический потенциал между высокометастатической и слабометастатической гигантоклеточной карциномой легкого человека». Чжунхуа Чжун Лю За Чжи. 25: 131–4.
- ^ а б c d е ж Кеннеди А. (май 1969 г.). «Патология и выживаемость в операционных случаях гигантоклеточного рака легкого». J. Clin. Патол. 22 (3): 354–60. Дои:10.1136 / jcp.22.3.354. ЧВК 474089. PMID 5784984.
- ^ а б c d е ж грамм час я j Ким Т.Х., Ким С.Дж., Рю Й.Х. и др. (Август 2004 г.). «Плеоморфная карцинома легкого: сравнение характеристик КТ и патологических данных». Радиология. 232 (2): 554–9. Дои:10.1148 / радиол.2322031201. PMID 15215543.
- ^ Ширакуса Т., Шигемацу Н., Кога Т., Ямагата Ю. (1980). «Гигантоклеточная карцинома, возникающая в легочном пузыре». Scand J Thorac Cardiovasc Surg. 14 (3): 307–9. Дои:10.3109/14017438009101017. PMID 7221506.
- ^ а б c d Хагихара Н., Абэ Т., Вакамия Т., Сугита И., Ватанабе М., Табучи К. (2010). «Случай метастазирования в мозг при гигантоклеточной карциноме легких». Курумэ Мед Дж.. 57 (1–2): 39–41. Дои:10.2739 / kurumemedj.57.39. PMID 21727764.
- ^ Spivach A, Borea B, Bertoli G, Daris G (июль 1976 г.). «[Первичное новообразование легких редкой заболеваемости: гигантоклеточная карцинома]». Минерва Мед. (на итальянском). 67 (34): 2233–49. PMID 986035.
- ^ Трэвис В.Д. (ноябрь 2010 г.). «Саркоматоидные новообразования легкого и плевры». Arch. Патол. Лаборатория. Med. 134 (11): 1645–58. Дои:10.1043 / 2010-0086-RAR.1 (неактивно 09.11.2020). PMID 21043818.CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (связь)
- ^ Хаякава К., Такахаши М., Сасаки К., Кавой А., Окано Т. (январь 1977 г.). «Первичная хориокарцинома легкого: история болезни двух мужчин». Acta Pathol. JPN. 27 (1): 123–35. PMID 557868.
- ^ а б Виллебранд Х., Вернич В., Эльмохамед А (сентябрь 1970 г.). «[Легочные метастазы гигантоклеточной карциномы в кости - доброкачественные или злокачественные?]». Chirurg (на немецком). 41 (9): 419–23. PMID 5471024.
- ^ Хуан Л., Сюй Дж., Вуд DJ, Чжэн М. Х. (март 2000 г.). «Экспрессия гена лиганда остеопротегерина, остеопротегерина и активатора рецептора NF-kappaB в гигантоклеточной опухоли кости: возможное участие в индуцированном опухолевыми клетками образовании остеокластоподобных клеток». Являюсь. Дж. Патол. 156 (3): 761–7. Дои:10.1016 / с0002-9440 (10) 64942-5. ЧВК 1876848. PMID 10702390.
- ^ Вернер М (декабрь 2006 г.). «Гигантоклеточная опухоль кости: морфологические, биологические и гистогенетические аспекты». Int Orthop. 30 (6): 484–9. Дои:10.1007 / s00264-006-0215-7. ЧВК 3172738. PMID 17013643.
- ^ Пай С.Б., Лалита Р.М., Прасад К., Рао С.Г., Хариш К. (сентябрь 2005 г.). «Гигантоклеточная опухоль височной кости - история болезни». BMC Ухо, горло, нос. 5: 8. Дои:10.1186/1472-6815-5-8. ЧВК 1253509. PMID 16162299.
- ^ Томас C (1962). «[Гигантоклеточная карцинома легких]». Франкф З. Патол (на немецком). 72: 302–8. PMID 13981042.
- ^ Веллманн KF, Chafiian Y, Edelman E (февраль 1969). «Перфорация тонкой кишки из-за одиночных метастазов клинически невыявленной гигантоклеточной карциномы легких». Являюсь. J. Гастроэнтерол. 51 (2): 145–50. PMID 5776147.
- ^ Le Doussal JM, Gruaz-Guyon A, Martin M, Gautherot E, Delaage M, Barbet J (июнь 1990). «Нацеливание двухвалентного гаптена, меченного индием 111, на меланому человека, опосредованное конъюгатами биспецифических моноклональных антител: визуализация опухолей, размещенных у голых мышей». Рак Res. 50 (11): 3445–52. PMID 2334941.
- ^ а б c Тая Ю., Хосогай К., Хирохаши С. и др. (Декабрь 1984 г.). «Новая комбинация K-ras и амплификации myc, сопровождаемая точечной мутационной активацией K-ras при раке легких человека». EMBO J. 3 (12): 2943–6. Дои:10.1002 / j.1460-2075.1984.tb02236.x. ЧВК 557793. PMID 6098458.
- ^ а б Морган А.Д., Маккензи Д.Х. (январь 1964 г.). «Светлоклеточная карцинома легкого». J Pathol Bacteriol. 87: 25–7. Дои:10.1002 / path.1700870104. PMID 14106350.
- ^ Carstens PH, Broghamer WL (апрель 1978 г.). «Карциноид двенадцатиперстной кишки с цитоплазматическими завитками микрофиламентов». Дж. Патол. 124 (4): 235–8. Дои:10.1002 / path.1711240408. PMID 569192. S2CID 43844600.
- ^ а б Сидху Г.С. (июль 1979 г.). «Энтодермальное происхождение APUD-клеток пищеварительного и дыхательного тракта. Гистопатологические данные и обзор литературы». Являюсь. Дж. Патол. 96 (1): 5–20. ЧВК 2042351. PMID 37740.
- ^ Кулинер М.М., Абуав Дж., Рейх С.Б. (ноябрь 1958 г.). «Полостная карцинома легкого». Calif Med. 89 (5): 355–8. ЧВК 1512515. PMID 13585165.
- ^ Стрэнг С., Симпсон Дж. А. (март 1953 г.). «Карциноматозный абсцесс легкого». Грудная клетка. 8 (1): 11–26. Дои:10.1136 / thx.8.1.11. ЧВК 1019223. PMID 13038734.
- ^ а б c Park JS, Lee Y, Han J и др. (2011). «Клинико-патологические результаты лечебной резекции саркоматоидного рака легкого». Онкология. 81 (3–4): 206–13. Дои:10.1159/000333095. PMID 22076573. S2CID 25558721.
- ^ Дейли Дж. Э., Маркузе П. М. (август 1969 г.). «Гигантоклеточная карцинома легкого, секретирующая гонадотропин». Рак. 24 (2): 388–96. Дои:10.1002 / 1097-0142 (196908) 24: 2 <388 :: help-cncr2820240222> 3.0.co; 2-7. PMID 5796783.
- ^ Ятуру С., Харрара Э, Нопахаронсри С., Сингал Р., Гилл С. (2003). «Гинекомастия, связанная с гигантоклеточной карциномой легкого, секретирующей хорионический гонадотропин». Endocr Pract. 9 (3): 231–5. Дои:10.4158 / EP.9.3.233. PMID 12917067.
- ^ Камеда Т; Kodama T; Шимосато Y (1982). Shimosato Y; Меламед MR; Неттесхайм П. (ред.). Морфогенез рака легких. 2. Бока-Ратон, Флорида: CRC Press. С. 107–29.
- ^ Пэ Х.М., Мин Х.С., Ли Ш., Ким Д.В., Чунг Д.Х., Ли Дж.С., Ким Ю.В., Хео Д.С. (октябрь 2007 г.). «Паллиативная химиотерапия плеоморфной карциномы легких». Рак легких. 58 (1): 112–5. Дои:10.1016 / j.lungcan.2007.05.006. PMID 17574296.
- ^ а б c Калленберг Ф, Жак Дж (1979). «Гигантоклеточная карцинома легкого. Клиническая и патологическая оценка. Сравнение с другими крупноклеточными анапластическими бронхогенными карциномами». Scand J Thorac Cardiovasc Surg. 13 (3): 343–6. Дои:10.3109/14017437909100576. PMID 542838.
- ^ Раззук М.А., Уршель Х.С., Альберс Дж. Э., Мартин Дж. А., Полсон Д. Л. (июнь 1976 г.). «Легочный гигантоклеточный рак». Анна. Грудной. Surg. 21 (6): 540–5. Дои:10.1016 / с0003-4975 (10) 63926-4. PMID 1275605.
- ^ а б c d Чжао З.Л., Сун Н., Хуан Ц.Й., Лю Ю.П., Чжао HR (февраль 2007 г.). «[Клинико-патологические особенности плеоморфной (веретеноводной / гигантоклеточной) карциномы легких - отчет о 17 случаях]» [Клинико-патологические особенности плеоморфной (веретеноводной / гигантоклеточной) карциномы легких - отчет о 17 случаях]. AI Чжэн (на китайском языке). 26 (2): 183–8. PMID 17298750. (Китайский текст)
- ^ Колби ТВ, Косс М.Н., Трэвис В.Д. (1995). «Опухоли нижних дыхательных путей». В Rosai J, Sobin LH (ред.). Атлас опухолевой патологии. Вашингтон, округ Колумбия: Институт патологии вооруженных сил. С. 259–75.
- ^ "Информационный бюллетень: рак легкого и бронха". Национальный институт рака, программа SEER. Получено 24 февраля, 2012.
- ^ Мартин Л.В., Корреа А.М., Ордонез Н.Г. и др. (Сентябрь 2007 г.). «Саркоматоидный рак легкого: предиктор плохого прогноза». Анна. Грудной. Surg. 84 (3): 973–80. Дои:10.1016 / j.athoracsur.2007.03.099. PMID 17720411.
- ^ Hellstrom HR, Fisher ER (1963). «Гигантоклеточная карцинома легкого». Рак. 16 (8): 1080–8. Дои:10.1002 / 1097-0142 (196308) 16: 8 <1080 :: help-cncr2820160816> 3.0.co; 2-v. PMID 14050012.
- ^ Нэш А.Д., Стаут А.П. (1958). «Гигантоклеточный рак легкого; сообщение о 5 случаях». Рак. 11 (2): 369–76. Дои:10.1002 / 1097-0142 (195803/04) 11: 2 <369 :: help-cncr2820110222> 3.0.co; 2-8. PMID 13511359.
- ^ Паттон MM, Макдональд-младший, Moersch HJ (1951). «Бронхогенная крупноклеточная карцинома». J Thorac Cardiovasc Surg. 22 (1): 88–93. PMID 14851490.
- ^ Уолтер Дж. Б., Прайс Д. М. (июнь 1955 г.). «Гистология рака легких». Грудная клетка. 10 (2): 107–16. Дои:10.1136 / thx.10.2.107. ЧВК 1019475. PMID 14396845.
- ^ Хэдли Г.Г., Баллок В.К. (декабрь 1953 г.). «Отчеты о вскрытии легочной карциномы; обследование в больнице округа Лос-Анджелес за 1951 год». Calif Med. 79 (6): 431–3. ЧВК 1521859. PMID 13106728.
- ^ Оззелло Л., Стаут А. П. (1961). «Эпителиальное происхождение гигантоклеточного рака легкого подтверждено культурой ткани. Отчет о случае». Рак. 14 (5): 1052–6. Дои:10.1002 / 1097-0142 (196109/10) 14: 5 <1052 :: aid-cncr2820140521> 3.0.co; 2-д.. PMID 13731858.
- ^ Фридберг EC (февраль 1965 г.). «Гигантоклеточная карцинома легкого: дедифференцированная аденокарцинома». Рак. 18 (2): 259–64. Дои:10.1002 / 1097-0142 (196502) 18: 2 <259 :: aid-cncr2820180219> 3.0.co; 2-f. PMID 14254083.
внешняя ссылка
| Классификация |
|---|
- «Патология и генетика опухолей легкого, плевры, тимуса и сердца». Классификация опухолей Всемирной организации здравоохранения. (Страница загрузки).
- "Страница рака легких". Национальный институт рака.
