Ланостерол 14 альфа-деметилаза - Lanosterol 14 alpha-demethylase
| Цитохром P450, семейство 51, подсемейство A, полипептид 1 | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | CYP51A1 | ||||||
| Альт. символы | CYP51, P45014DM | ||||||
| Ген NCBI | 1595 | ||||||
| HGNC | 2649 | ||||||
| OMIM | 601637 | ||||||
| RefSeq | NM_000786 | ||||||
| UniProt | Q16850 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 1.14.14.154 | ||||||
| Locus | Chr. 7 q21.2-21.3 | ||||||
| |||||||

Ланостерол 14α-деметилаза (CYP51A1) это цитохром P450 фермент который участвует в преобразовании ланостерин с 4,4-диметилхолеста-8 (9), 14,24-триен-3β-олом.[4] В цитохром P450 изоферменты консервативная группа белки которые служат ключевыми игроками в метаболизм из органические вещества и биосинтез важных стероиды, липиды, и витамины в эукариоты.[5] Как член этого семейства, ланостерин 14α-деметилаза отвечает за важный этап биосинтеза стеролы. В частности, этот белок катализирует удаление C-14α-метильная группа от ланостерин.[5] Эта стадия деметилирования рассматривается как начальная контрольная точка в превращении ланостерин другим стеролы которые широко используются внутри клетки.[5]
Эволюция
Структурные и функциональные свойства цитохром P450 надсемейства подверглись обширной диверсификации в ходе эволюции.[6] Последние оценки показывают, что в настоящее время существует 10 классы и 267 семьи белков CYP.[7] Считается, что 14α-деметилаза или CYP51 разошлись на ранней стадии развития цитохрома. эволюционная история и с тех пор сохранил свою функцию; а именно, удаление 14α-метильной группы из стерола субстраты.[6]
Хотя образ действия CYP51 был хорошо консервированный, последовательность белка значительно варьируется между биологическими царствами.[8] Сравнение последовательностей CYP51 между царствами показывает сходство только 22-30% в аминокислотном составе.[9]
Структура
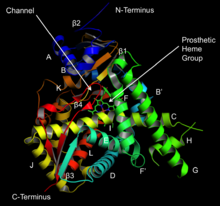
Хотя структура 14α-деметилазы может существенно различаться от одного организма к другому, выравнивание последовательностей анализ показывает, что в белке есть шесть областей, которые консервированный в эукариоты.[9] К ним относятся остатки в спирали B ', петле B' / C, спирали C, спирали I, петле K / β1-4 и β-цепи 1-4, которые отвечают за формирование поверхности полости для связывания субстрата.[6] Гомологическое моделирование показывает, что субстраты мигрируют с поверхности белка в захоронение фермента активный сайт через канал, который частично образован буквой A ' альфа-спираль и петля β4.[10][11] Наконец, активный сайт содержит гем протезная группа в котором железо связано с атомом серы на консервативном остатке цистеина.[9] Эта группа также связывает двухатомный кислород в шестом координационном сайте, который в конечном итоге встраивается в субстрат.[9]
Механизм

Катализируемый ферментами деметилирование из ланостерин как полагают, происходит в три этапа, каждая из которых требует одной молекулы двухатомного кислорода и одной молекулы НАДФН (или какой-то другой уменьшающий эквивалент ).[12] На первых двух этапах 14α-метильная группа претерпевает типичные цитохром монооксигенация, при которой один атом кислорода включается в субстрат, а другой восстанавливается до воды, что приводит к превращению стерола в карбоновый спирт, а затем в карбоксиальдегид.[9] Затем альдегид уходит как Муравьиная кислота и одновременно вводится двойная связь, давая деметилированный продукт.[9]
Смотрите также
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000001630 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Метабокард для 4,4-диметилхолеста-8,14,24-триенола (HMDB01023)». База данных метаболома человека. Февраль 2014 года.
- ^ а б c Лепешева Г.И., Уотерман М.Р. (март 2007 г.). «Стерол 14альфа-деметилаза цитохром P450 (CYP51), P450 во всех биологических царствах». Biochimica et Biophysica Acta (BBA) - Общие предметы. 1770 (3): 467–77. Дои:10.1016 / j.bbagen.2006.07.018. ЧВК 2324071. PMID 16963187.
- ^ а б c Бехер Р., Вирсель С.Г. (август 2012 г.). «Грибковая цитохром P450 стерол 14α-деметилаза (CYP51) и устойчивость к азолам у патогенов растений и человека». Прикладная микробиология и биотехнология. 95 (4): 825–40. Дои:10.1007 / s00253-012-4195-9. PMID 22684327. S2CID 17688962.
- ^ Ханнеманн Ф., Бишет А., Эвен К.М., Бернхардт Р. (март 2007 г.). «Системы цитохрома Р450 - биологические вариации цепей переноса электронов». Biochimica et Biophysica Acta (BBA) - Общие предметы. 1770 (3): 330–44. Дои:10.1016 / j.bbagen.2006.07.017. PMID 16978787.
- ^ Лепешева Г.И., Уотерман М.Р. (февраль 2004 г.). «CYP51 - всемогущий P450». Молекулярная и клеточная эндокринология. 215 (1–2): 165–70. Дои:10.1016 / j.mce.2003.11.016. PMID 15026190. S2CID 22489096.
- ^ а б c d е ж Лепешева Г.И., Уотерман М.Р. (январь 2011 г.). «Структурная основа сохранения семейства CYP51». Biochimica et Biophysica Acta (BBA) - Белки и протеомика. 1814 (1): 88–93. Дои:10.1016 / j.bbapap.2010.06.006. ЧВК 2962772. PMID 20547249.
- ^ Hargrove TY, Wawrzak Z, Liu J, Nes WD, Waterman MR, Lepesheva GI (июль 2011 г.). «Предпочтения субстрата и каталитические параметры, определяемые структурными характеристиками стерол-14альфа-деметилазы (CYP51) из Leishmania infantum». Журнал биологической химии. 286 (30): 26838–48. Дои:10.1074 / jbc.M111.237099. ЧВК 3143644. PMID 21632531.
- ^ Подуст Л.М., фон Крис Дж. П., Эддин А. Н., Ким Ю., Ермалицкая Л. В., Кюне Р. и др. (Ноябрь 2007 г.). «Низкомолекулярные каркасы для ингибиторов CYP51, идентифицированные с помощью высокопроизводительного скрининга и определенные с помощью рентгеновской кристаллографии». Противомикробные препараты и химиотерапия. 51 (11): 3915–23. Дои:10.1128 / AAC.00311-07. ЧВК 2151439. PMID 17846131.
- ^ Ванден Босше Х, Койманс Л (1998). «Цитохромы Р450 грибов». Микозы. 41 Дополнение 1: 32–8. Дои:10.1111 / j.1439-0507.1998.tb00581.x. PMID 9717384. S2CID 83821510.
дальнейшее чтение
- Бак С., Кан Р.А., Олсен К.Э., Халкиер Б.А. (февраль 1997 г.). «Клонирование и экспрессия в Escherichia coli обтузифолиол-14 альфа-деметилазы Sorghum bicolor (L.) Moench, цитохрома P450, ортолога стерол-14 альфа-деметилазы (CYP51) из грибов и млекопитающих». Журнал растений. 11 (2): 191–201. Дои:10.1046 / j.1365-313X.1997.11020191.x. PMID 9076987.
- Аояма Y, Ёсида Y (август 1991 г.). «Различные субстратные специфичности ланостерин 14a-деметилазы (P-45014DM) Saccharomyces cerevisiae и печени крысы для 24-метилен-24,25-дигидроланостерола и 24,25-дигидроланостерола». Сообщения о биохимических и биофизических исследованиях. 178 (3): 1064–71. Дои:10.1016 / 0006-291X (91) 91000-3. PMID 1872829.
- Аояма Y, Ёсида Y (март 1992 г.). «4-бета-метильная группа субстрата не влияет на активность ланостерин 14 альфа-деметилазы (P-450 (14) DM) дрожжей: разница между распознаванием субстрата дрожжами и растительными стерол 14 альфа-деметилазами». Сообщения о биохимических и биофизических исследованиях. 183 (3): 1266–72. Дои:10.1016 / S0006-291X (05) 80327-4. PMID 1567403.
- Александр К., Ахтар М., Кабан Р. Б., Макги Дж. Ф., Бартон Д. Х. (1972). «Удаление 32-го атома углерода как муравьиная кислота в биосинтезе холестерина». Журнал химического общества, химические коммуникации (7): 383. Дои:10.1039 / C39720000383.
внешние ссылки
- цитохром + P-450 + CYP51 в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)


