Полный синтез таксола Николау - Википедия - Nicolaou Taxol total synthesis

В Полный синтез таксола Николау, опубликовано К. К. Николау и его группа в 1994 г. полный синтез из Таксол.[1] Таксол является важным препарат, средство, медикамент в лечении рак но также дорого, потому что соединение добывается из ограниченного ресурса, а именно тихоокеанский тис.
Этот синтетический путь получения таксола - один из нескольких; другие группы представили свои собственные решения, особенно группа Холтон с линейный синтез начиная с борнеол, то Самуэль Данишефски группа, начиная с Кетон Виланда-Мишера и Wender группа из пинен.
Синтез Николау является примером конвергентный синтез потому что молекула собрана из трех предварительно собранных синтонов. Две основные части - это циклогексеновые кольца A и C, которые соединены двумя короткими мостиками, образуя 8-членное кольцо в середине (кольцо B). Третья предварительно собранная деталь - это амид хвост. RingD - это оксетан кольцо слилось с кольцом C. Два ключевых химических превращения: Реакция Шапиро и реакция связывания пинакола.[2] Общий синтез был опубликован в 1995 году в серии из четырех статей.[3][4][5][6]
Ретросинтез
Как показано на Ретросинтетической схеме I, Таксол был получен из диола 7.2 путем образования сложноэфирной связи в соответствии с методом Одзима-Холтона. Этот диол получают из карбоната 6.3 путем добавления фениллитий. В оксетан кольцо в соединении 6.3 получено SN2 реакция с участием мезилат производное от ацеталя 4.9. Кольцо B было замкнуто через Реакция Макмерри с участием диальдегида 4.8, который в конечном итоге был получен из альдегида 4.2 и гидразон 3.6 используя Реакция сочетания Шапиро.
 |
| Схема ретросинтеза 1 |
|---|
Схема ретросинтеза II показывает, что как альдегид, так и гидразон используется в Реакция сочетания Шапиро были синтезированы с использованием Реакции Дильса-Альдера.
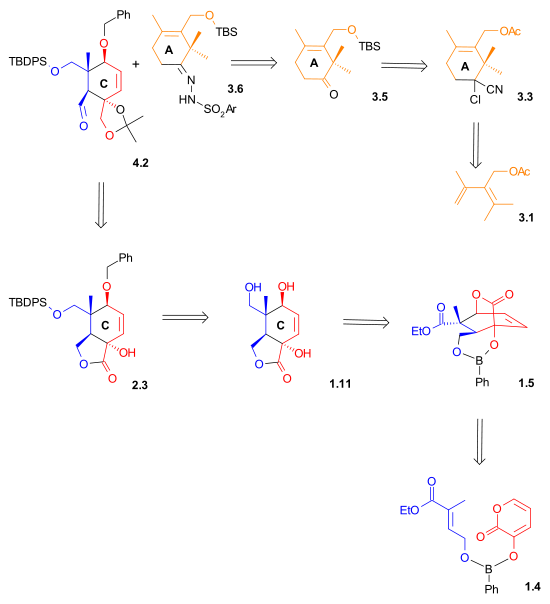 |
| Схема ретросинтеза 2 |
|---|
Синтез С-кольца
Как показано в Схема 1, кольцевой синтез кольца C начался с Реакция Дильса-Альдера между диеном 1.3 и диенофил 1.1 в присутствии фенилбороновой кислоты (1.2), который после добавления 2,2-диметил-1,3-пропандиола давал пятичленный лактон 1.8 с доходностью 62%. Бор служил молекулярный трос и выровняли диен и диенофил для этого эндо циклоприсоединение Дильса-Альдера. После защиты гидроксильных групп как терт-бутилдиметилсилиловые эфиры, восстановление эфира с литийалюминийгидрид и селективное снятие защиты с вторичной гидроксильной группы дало лактондиол 1.11. Необычный лактон гидратов 1.9 и 1.10 были выделены в качестве синтетических промежуточных продуктов в этом процессе.
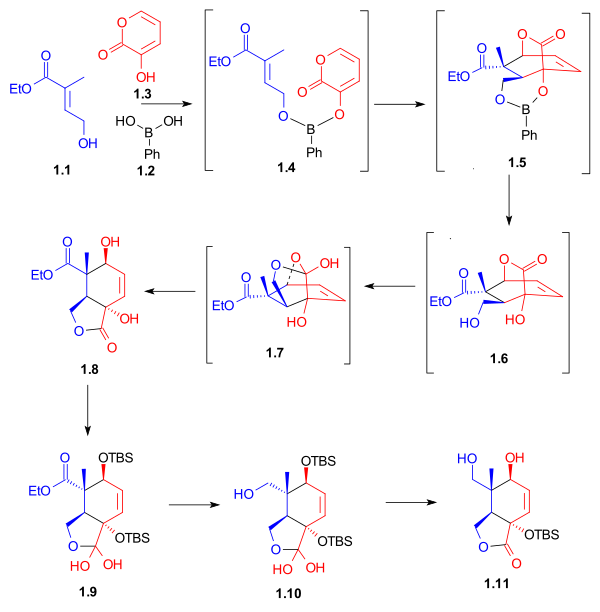 |
| Схема 1 |
|---|
Лактон диол 2.1после селективной защиты был восстановлен литийалюминийгидрид дать триол 2.4. Этот триол после преобразования в ацетонид, селективно окислялся до альдегид с помощью перрутенат тетрапропиламмония (TPAP) и N-метилморфолин N-оксид. Альдегид 2.6 послужила отправной точкой для построения кольца B (Схема 4, сложный 4.2).
 |
| Схема 2 |
|---|
Кольцевой синтез
Синтез кольца А (Схема 3) началось с Реакция Дильса-Альдера диена 3.1 с коммерчески доступным диенофилом 2-хлоракрилонитрил 3.2 дать циклогексен 3.3 с полным региоселективность. Гидролиз цианохлоргруппы и одновременное расщепление ацетатной группы привело к гидроксикетону 3.4. Гидроксильная группа была защищена как трет-бутилдиметилсилиловый эфир (3.5). В рамках подготовки к Реакция Шапиро, этот кетон был преобразован в гидразон 3.6.
 |
| Схема 3 |
|---|
Синтез кольца B

Соединение кольца A и кольца C дает 8-членное кольцо B. Одно подключение было выполнено через нуклеофильное присоединение из виниллитий соединение с альдегидом, а другое соединение через реакция связывания пинакола двух альдегидов (Схема 4).
А Реакция Шапиро соединения виниллития, полученного из гидразона 4.1 с альдегидом 4.2 устанавливает первое соединение, которое станет кольцом B. Контроль над стереохимия в 4.3 считается производным от относительного препятствия Si лицо в ориентации, показанной справа, из-за близости аксиальной метильной группы. Эпоксидирование с ванадил (ацетилацетат) преобразованный алкен 4.3 к эпоксид 4.4, который, по снижение с литийалюминийгидрид, дал диол 4.5. Затем этот диол был защищен как карбонатный эфир 4.6. Карбонатная группа также служила для создания жесткости в кольцевой структуре для неизбежного реакция связывания пинакола. Два силиловый эфир группы были удалены, а диол 4.7 затем окислили с получением диальдегида 4.8 с помощью N-метилморфолин N-окись в присутствии каталитического количества перрутенат тетрапропиламмония. На заключительном этапе формирования Кольца B, a пинаколь муфта используя условия, разработанные Макмерри (хлорид титана (III) и цинк /медь сплав ) дал диол 4.9.
 |
| Схема 4 |
|---|
Разрешение
На этом этапе синтеза таксола материал представлял собой рацемическая смесь. Для получения желаемого энантиомер, аллильный алкоголь 4.9 был ацилированный с (1S) - (-) - хлоридом камфана и диметиламинопиридин, давая два диастереомеры. Затем они были разделены с использованием стандартных колоночная хроматография. Затем желаемый энантиомер выделяли, когда один из разделенных дисатереомеров обрабатывали бикарбонат калия в метанол.
 |
| Энантиомерное разрешение 4.9. |
Синтез D-кольца
Желаемый энантиомер из разрешения, аллильный алкоголь 5.1 (Схема 5) был ацетилированный с уксусный ангидрид и 4- (диметиламино) пиридин в метиленхлориде с получением моноацетата 5.2. Примечательно, что эта реакция была исключительно для аллилового спирта, и соседняя гидроксильная группа не была ацетилированный. Алкоголь 5.2 был окисленный с перрутенат тетрапропиламмония и N-метилморфолин N-оксид давать кетон 5.3. Алкен 5.3 прошел гидроборирование в тетрагидрофуран. Окисление основным пероксид водорода и бикарбонат натрия дал алкоголь 5.4 с выходом 35%, с выходом региоизомера 15%. Ацетонид был удален, давая триол 5.5. Этот спирт был моноацетилирован, давая ацетат 5.6. В бензил группа была удалена и заменена триэтилсилильной группой. Диол 5.7 был выборочно активирован с помощью метансульфонилхлорид и 4- (диметиламино) пиридин с получением мезилат 5.8, с доходностью 78%.
 |
| Схема 5 |
|---|
В ацетил группа в 6.1 (Схема 6) был удален, чтобы получить первичный спирт 6.2. Кольцо таксола (D) было добавлено внутримолекулярный нуклеофильное замещение с участием этой гидроксильной группы, чтобы дать оксетан 6.3. После ацетилирования фениллитий был использован для открытия цикла карбонатного эфира с образованием спирта 6.5. Аллильное окисление хлорхромат пиридиния, ацетат натрия, и целит дал кетон 6.6, который впоследствии был сокращен с помощью борогидрид натрия дать вторичный спирт 6.7. Это было последнее соединение перед добавлением амид хвост.
 |
| Схема 6 |
|---|
Сложение хвоста
Как показано в Схема 7, Одзима лактам 7.1 реагировал с алкоголем 7.2 с бис (триметилсилил) амид натрия в качестве основы. Этот спирт представляет собой триэтилсилиловый эфир встречающегося в природе соединения баккатина III. Родственное соединение, 10-деацетилбаккатин III, содержится в Taxus baccata, также известный как тис европейский, в концентрации 1 грамм на килограмм листья. Удаление триэтилсилильной защитной группы дает таксол.
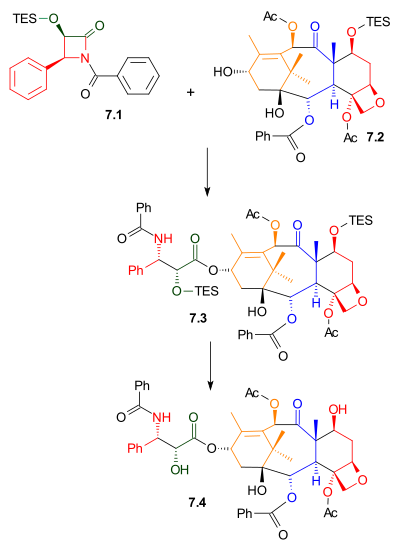 |
| Схема 7 |
|---|
Синтез прекурсора
Синтез диенофила Дильса-Альдера для кольца C
Этиловый сложный эфир из пропионовая кислота (1) был бромирован, а затем преобразован в Реагент Виттига с помощью трифенилфосфин. Альдегид 6 был получен от аллиловый спирт (4) по охране как трет-бутилдифенилсилиловый эфир (5) с последующим озонолиз. Реагент Виттига 3 и альдегид 6 отреагировал в Реакция Виттига дать ненасыщенный эфир 7, защита которого была снята, чтобы дать диенофилу 8 (Схема 1, соединение 1).

Синтез диена Дильса-Альдера для кольца А
Альдольная конденсация из ацетон и этилацетоацетат дал β-кетоэфир 3. А Реакция Гриньяра с участием бромистого метилмагния при условии алкоголь 4, который подвергался кислотному каталитическому устранение давать диен 5. Снижение и ацилирование дал диену 7 (Схема 3, соединение 1).

Защита групп
Ас (ацетил)
Защита: Уксусный ангидрид, пиридин, 4- (диметиламино) пиридин и дихлорметан
Снятие защиты: карбонат калия в метаноле и водном растворителе
Защита предотвратила мезилирование первичного кислорода в 5.8.
Ацетонид
Защита: 2,2-диметоксипропан и камфорсульфоновая кислота, и дихлорметан
Снятие защиты: Соляная кислота, метанол, вода и этиловый эфир
Защита вицинального диола 2.4 разрешил оставшуюся гидроксильную группу в спирте 2.5 избирательно окисляться с образованием альдегида 2.6. В ацетонид был удален намного позже при синтезе при подготовке к замыканию кольца D.
Bn (бензил)
Защита: Гидрид калия, йодид тетра-н-бутиламмония и бензилбромид.
Снятие защиты: водород, Pd (OH)2/ C
Вторичный спирт 2.2 был защищен как бензиловый эфир, так что восстановление лактона 2.3 могло произойти. Защита была снята намного позже при синтезе спирта. 5.7, который был заменен триэтилсилиловым эфиром.
Карбонатный эфир
Защита: Гидрид калия, фосген
Снятие защиты: Фениллитий открывает карбонатный эфир кольцо, чтобы дать алкоголь 6.5.
Защита добавляет жесткости кольцевой конструкции для реакция связывания пинакола образующий диол 4.9, а также предотвращает нежелательное окисление с образованием диальдегида 4.8.
Защита: Tert-бутилдифенилсилилхлорид, имидазол, и диметилформамид.
Снятие защиты: Фторид тетра-н-бутиламмония
Первичный спирт 2.1 была защищена при подготовке к снижению содержания лактона в 2.3. Защитную группу удалили, получив диол. 4.7 в рамках подготовки к реакция связывания пинакола.
TBS (трет-бутилдиметилсилил) [1]
Защита: трет-бутилдиметилсилилтрифлат, лутидин, 4- (диметиламино) пиридин и дихлорметан.
Снятие защиты: Камфорсульфоновая кислота, дихлорметан и метанол.
Вторичная гидроксильная группа в 1.8 был кратковременно защищен во время защиты третичной гидроксильной группы в том же соединении.
TBS (трет-бутилдиметилсилил) [2]
Защита: трет-бутилдиметилсилилтрифлат, лутидин, 4- (диметиламино) пиридин и дихлорметан.
Снятие защиты: Камфорсульфоновая кислота
Защита третичной гидроксильной группы в 1.8 было необходимо для обеспечения селективной защиты других гидроксильных групп на С-кольце.
TBS (трет-бутилдиметилсилил) [3]
Защита: Дихлорметан, имидазол и трет-бутилдиметилсилилхлорид.
Снятие защиты: Фторид тетра-н-бутиламмония
Защита гидроксильной группы в 3.4 позволил кетону претерпеть Реакция Шапиро с образованием соединения виллития 3.7.
ТЭС (триэтилсилил) [1]
Защита: триэтилсилилхлорид и пиридин.
Снятие защиты: гидролиз с использованием плавиковая кислота, пиридин и тетрагидрофуран.
Защита вторичной гидроксильной группы в 5.7 был необходим для окончательного добавления хвоста в спирт 7.2.
ТЭС (триэтилсилил) [2]
Защита: см. Одзима лактам.
Снятие защиты: гидролиз с использованием плавиковая кислота и пиридин
Защищенный вторичный спирт в Одзима лактам 7.1 во время реакции с алкоголем 7.2 в добавлении хвоста.
Смотрите также
- Общий синтез паклитаксела
- Полный синтез таксола Данишефского
- Общий синтез таксола Холтона
- Общий синтез таксола Kuwajima
- Полный синтез таксола Мукаяма
- Полный синтез таксола Вендера
внешняя ссылка
Рекомендации
- ^ Классика в полном синтезе: цели, стратегии, методы К. К. Николау, Э. Дж. Соренсен ISBN 3-527-29231-4
- ^ Николау, KC; Ян, Z; Лю, JJ; Ueno, H; Nantermet, PG; Гай, РК; Claiborne, CF; Renaud, J; и другие. (Февраль 1994). «Полный синтез таксола». Природа. 367 (6464): 630–4. Bibcode:1994Натура.367..630Н. Дои:10.1038 / 367630a0. PMID 7906395.
- ^ К. К. Николау; П. Г. Нантермет; Х. Уэно; Р. К. Гай; Э. А. Куладурос и Э. Дж. Соренсен (1995). «Полный синтез таксола. 1. Ретросинтез, деградация и восстановление». Варенье. Chem. Soc. 117 (2): 624–633. Дои:10.1021 / ja00107a006.
- ^ К. К. Николау; Ж.-Ж. Лю; З. Ян; Х. Уэно; Э. Дж. Соренсен; К. Ф. Клэйборн; Р. К. Гай; К.-К. Хван; М. Накада и П. Г. Нантермет (1995). «Полный синтез таксола. 2. Конструирование кольцевых промежуточных соединений A и C и начальные попытки создания кольцевой системы ABC». Варенье. Chem. Soc. 117 (2): 634–644. Дои:10.1021 / ja00107a007.
- ^ К. К. Николау; З. Ян; Ж.-Ж. Лю; П. Г. Нантермет; К. Ф. Клэйборн; Ж. Рено; Р. К. Гай и К. Шибаяма (1995). «Полный синтез таксола. 3. Формирование кольцевого скелета таксола ABC». Варенье. Chem. Soc. 117 (2): 645–652. Дои:10.1021 / ja00107a008.
- ^ К. К. Николау; Х. Уэно; Ж.-Ж. Лю; П. Г. Нантермет; З. Ян; Ж. Рено; К. Полваннан и Р. Чадха (1995). «Полный синтез таксола. 4. Заключительные стадии и завершение синтеза». Варенье. Chem. Soc. 117 (2): 653–659. Дои:10.1021 / ja00107a009.
