Ценобамат - Википедия - Cenobamate
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Xcopri |
| Другие имена | YKP3089 |
| AHFS /Drugs.com | xcopri |
| Маршруты администрация | Устно |
| Легальное положение | |
| Легальное положение | |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| PubChem SID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭМБЛ | |
| Химические и физические данные | |
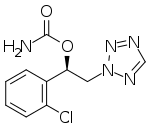
| Формула | C10ЧАС10ClN5О2 |
| Молярная масса | 267.67 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
Сенобамат, продается под торговой маркой Xcopri, это лекарство, используемое для лечения приступов с частичным началом у взрослых.[2][3]
Он был одобрен для медицинского применения в США в ноябре 2019 года.[2][3][4] и помещен в Список V в марте 2020 года.[5]
Фармакология
Фармакодинамика
Ценобамат - это напряженно-управляемый натриевый канал (VGSC) блокиратор.[6] Это селективный блокатор инактивированного состояния VGSC, предпочтительно ингибирующий постоянный ток натрия.[6] Было высказано предположение, что ценобамат дополнительно усиливает пресинаптический релиз из γ-аминомасляная кислота (ГАМК), тем самым увеличивая тормозящий ГАМКергический нейротрансмиссия.[6]
История
Безопасность и эффективность ценобамата для лечения приступов с частичным началом была установлена в двух рандомизированных двойных слепых плацебо-контролируемых исследованиях, в которых приняли участие 655 взрослых. В этих исследованиях у пациентов были приступы с частичным началом с вторичной генерализацией или без нее в среднем в течение примерно 24 лет, а средняя частота приступов составила 8,5 приступов за 28 дней в течение 8-недельного исходного периода. Во время испытаний дозы 100, 200 и 400 миллиграммов (мг) в день снижали процент приступов за 28 дней по сравнению с группой плацебо. Рекомендуемая поддерживающая доза после периода титрования (корректировки приема лекарств) составляет 200 мг в день; однако некоторым пациентам может потребоваться дополнительное титрование до 400 мг в день, максимальной рекомендованной дозы, в зависимости от их клинического ответа и переносимости.[2]
Соединенные штаты. Управление по контролю за продуктами и лекарствами (FDA) одобрило ценобамат в ноябре 2019 года и удовлетворило заявку на Xcopri в SK Life Science Inc.[2][3][4][7]
Рекомендации
- ^ «Списки контролируемых веществ: включение ценобамата в Список V». Федеральный регистр. 10 марта 2020.
- ^ а б c d «FDA одобряет новое лечение для взрослых с частичными приступами». НАС. Управление по контролю за продуктами и лекарствами (FDA) (Пресс-релиз). 21 ноября 2019. В архиве из оригинала 22 ноября 2019 г.. Получено 21 ноября 2019.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ а б c "Снимки испытаний лекарств: Xcopri". НАС. Управление по контролю за продуктами и лекарствами (FDA). 3 декабря 2019. В архиве с оригинала 19 декабря 2019 г.. Получено 18 декабря 2019.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ а б «Пакет одобрения лекарственных средств: Xcopri». НАС. Управление по контролю за продуктами и лекарствами (FDA). 10 декабря 2019. В архиве с оригинала 19 декабря 2019 г.. Получено 18 декабря 2019.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ «2020 - Размещение ценобамата в Списке V». Отдел контроля за утечками DEA. 10 марта 2020 г.. Получено 11 марта 2020.
- ^ а б c Younus I, Reddy DS (январь 2018 г.). «Возрождающийся бум новых лекарств от эпилепсии и заболеваний головного мозга». Обзор клинической фармакологии. 11 (1): 27–45. Дои:10.1080/17512433.2018.1386553. PMID 28956955.
- ^ «Статус утверждения сенобамата FDA». Drugs.com. 13 ноября 2019 г.. Получено 22 ноября 2019.
дальнейшее чтение
внешняя ссылка
- «Ценобамат». Портал информации о наркотиках. Национальная медицинская библиотека США (NLM).
| Этот противосудорожное средство -связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |
