Дегидрогеназа сетчатки - Википедия - Retinal dehydrogenase
| ретинальная дегидрогеназа | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 ретинальная дегидрогеназа ингибируется Yb | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 1.2.1.36 | ||||||||
| Количество CAS | 37250-99-0 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
В энзимология, а ретинальная дегидрогеназа, также известный как ретинальдегиддегидрогеназа, катализирует в химическая реакция преобразование сетчатка к ретиноевая кислота. Этот фермент принадлежит к семейству оксидоредуктазы, особенно класс, действующий на альдегидные или оксодонорные группы с НАД+ или же НАДФ+ как акцепторные группы, систематическое название сетчатка: НАД+ оксидоредуктаза. Этот фермент участвует в метаболизм ретинола. Общая схема реакции, катализируемой этим ферментом:
сетчатка + НАД+ + H2О ретиноевая кислота + НАДН + Н+
Структура
Дегидрогеназа сетчатки представляет собой тетрамер идентичных единиц, состоящий из димер димеров.[1] Ретинальная дегидрогеназа мономеры состоят из трех областей: нуклеотид переплет домен, домен тетрамеризации и каталитический домен. Димер можно представить в виде буквы «X», где димеры образуют верхнюю и нижнюю половины, пересекающиеся друг с другом. Интересно, что нуклеотид-связывающий домен дегидрогеназы ретиналя содержит 5 вместо обычных 6 β-тяжи в Россман фолд.[2] По-видимому, это сохраняется во многих альдегиддегидрогеназах. Домены тетрамеризации расположены экваториально вдоль «X», а области связывания нуклеотидов появляются на концах «X». Рядом с доменом тетрамеризации находится туннель глубиной 12 Å, который дает субстрату доступ к ключевым каталитическим областям.[1] Остатки возле C-терминал конец каталитического домена, как было обнаружено, придает специфичность другим альдегиддегидрогеназам. Общим для многих альдегиддегидрогеназ является каталитический цистеин, который, как было обнаружено, присутствует в RALDH2, специфической дегидрогеназе сетчатки, структура которой была решена.[1][3][4]

Специфика
Существует три основных класса альдегиддегидрогеназ: класс 1 (ALDH1) включает цитозольный белки класса 2 (ALDH2) включают митохондриальный белки, а класс 3 (ALDH3) включает опухоль -зависимые белки.[4] Ферменты ALDH1 демонстрируют высокую специфичность в отношении полностью транс-ретиналя и 9-цис-ретиналя в кинетических исследованиях альдегиддегидрогеназ овечьей печени, в то время как ферменты ALDH2 проявляют слабое сродство к сетчатке и вместо этого, по-видимому, в основном участвуют в окислении ацетальдегид.[5][6] Входной туннель к активному центру фермента, по-видимому, обеспечивает специфичность, наблюдаемую в ALDH1 для сетчатки в качестве субстрата. Размер туннеля является ключевым для придания этой специфичности: доступный для растворителя диаметр входного туннеля составляет 150 Å.3 в ALDH1, поэтому относительно большая сетчатка может быть приспособлена, в то время как доступный для растворителя диаметр в ALDH2 составляет всего 20 Å.3 который ограничивает доступ к сетчатке, но в значительной степени содержит ацетальдегид.[7]
Механизм
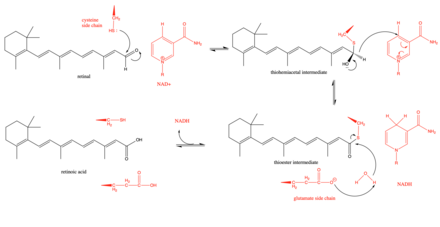
Предлагаемый механизм дегидрогеназы сетчатки начинается с ключевого остатка цистеина в активном центре, атакующего альдегидную группу в сетчатке с образованием тиогемиацетального промежуточного соединения.[3] Затем гидридный сдвиг фермент способствует образованию НАДН и тиоэфир средний. Этот гидридный сдвиг оказался стереоспецифический в подгруппе (класс 3) дегидрогеназ сетчатки.[8] Промежуточный тиоэфир затем атакует молекула воды, которая становится более нуклеофильной за счет глутамат остаток, который находится рядом с активным центром.[9] Были некоторые дебаты относительно того, действует ли остаток глутамата рядом с активным центром в качестве общего основания во время реакции или он более ограничен и просто депротонирует каталитический цистеин, чтобы сделать цистеин более нуклеофильным.[9] Кинетические исследования подтвердили этот механизм, показав, что реакция идет по упорядоченному последовательному пути с НАД.+ Сначала связывание, за которым следует связывание сетчатки, каталитическое расщепление ретиналя до ретиноевой кислоты, высвобождение ретиноевой кислоты и, наконец, высвобождение НАДН.[10]
Регулирование
Некоторые стратегии регуляции дегидрогеназ сетчатки только сейчас становятся более ясными после in vivo Регуляция оставалась загадкой в течение некоторого времени, хотя большая часть текущих исследований регуляции была сосредоточена на модуляции экспрессии генов, а не на прямой регуляции белков.[7] Дендритные клетки в кишечнике помогает модулировать иммунная толерантность за счет активности дегидрогеназы сетчатки; экспрессия в этих клетках может быть вызвана TNF рецептор, 4-1-BB.[11] Было также показано, что экспрессия определенной дегидрогеназы сетчатки, обнаруживаемой у людей, ретинальной короткоцепочечной дегидрогеназы / редуктазы (retSDR1), увеличивается за счет белков-супрессоров опухоли. p53 и p63, предполагая, что retSDR1 может обладать активностью по предотвращению опухолей.[12] Экспрессия генов ретинальной дегидрогеназы 1 и 2 типов усиливается за счет добавления холестерин или производные холестерина.[13] Дисульфирам препарат, используемый для искусственной регуляции активности альдегиддегидрогеназы у пациентов с алкоголизм путем ингибирования активности альдегиддегидрогеназ, хотя он не является специфическим для дегидрогеназы сетчатки.[14] Другой экзогенный Было также обнаружено, что молекулы ингибируют активность дегидрогеназы сетчатки, включая нитрофен, 4-бифенил карбоновая кислота, бисдиамин и SB-210661.[15]
Клиническое значение
Дегидрогеназа сетчатки играет ключевую роль в биосинтезе ретиноевой кислоты, которая, в свою очередь, действует в сигнальных путях клетки. Ретиноевая кислота отличается от других клеток сигнальные молекулы в том, что он распространяется в ядро и напрямую связывается с генными мишенями через рецепторы ретиноевой кислоты.[16] Этот сигнальный путь ретиноевой кислоты также является уникальным для хордовые, о чем свидетельствует присутствие дегидрогеназ сетчатки исключительно в хордовых.[17] Передача сигналов ретиноевой кислоты, по-видимому, контролирует такие процессы развития, как нейрогенез, кардиогенез, передняя конечность развитие бутонов, передняя кишка развитие, и глаз разработка. Передача сигналов ретиноевой кислоты также важна для поддержания здоровья взрослого человека. нейронный и эпителий тип ячейки.[18] Ретиноевая кислота образуется в организмах в результате окисления ретинола (Витамин А ) на сетчатку с алкогольдегидрогеназа. Затем дегидрогеназа сетчатки окисляет сетчатку до ретиноевой кислоты. Производство ретиноевой кислоты из витамина A необходимо строго контролировать, поскольку высокие уровни ретиноевой кислоты и витамина A могут привести к токсическим эффектам, в то время как дефицит витамина А приводит к собственным проблемам в развитии.[19][20] Это дает объяснение для многих стратегий регуляции транскрипции, обсужденных ранее. У людей мутации в гене, кодирующем определенную дегидрогеназу сетчатки (RDH12) также может привести к Врожденный амавроз Лебера, дистрофия сетчатки, ответственная за многие случаи врожденный слепота.[21]
Изоформы
Разные изоформы дегидрогеназы сетчатки существуют и играют ключевую роль в развитии, так как типы по-разному экспрессируются внутри развивающейся эмбрион. Фермент ретинальдегидрогеназа типа 2 (RALDH2) катализирует большую часть образования ретиноевой кислоты во время развития, но не все. RALDH2 имеет решающее значение для развития середина беременности и способствует развитию нервной системы, сердца, легких и передних конечностей; он также отвечает за выработку всей ретиноевой кислоты в определенные периоды середины беременности.[22] Позже в развитии ретинальная дегидрогеназа типа 1 (RALDH1) начинает активность в дорсальной ямке сетчатка и ретинальная дегидрогеназа типа 3 (RALDH3) становится активной в обонятельная ямка, вентральная сетчатка и мочеиспускательный канал. Raldh2 нокауты генов смертельны для мышей во время развития, поскольку мозг не может нормально развиваться.[23] Raldh3 нокаут гена у мышей фатален при рождении, так как носовые проходы не разработаны должным образом и вместо этого заблокированы.[24] Raldh1 нокауты не смертельны и, что интересно, показали, что они защищают от диеты. ожирение у мышей в ретиноид -независимо.[25]
Рекомендации
- ^ а б c Lamb AL, Newcomer ME (май 1999 г.). «Структура ретинальной дегидрогеназы II типа с разрешением 2,7 А: значение для специфичности сетчатки». Биохимия. 38 (19): 6003–11. Дои:10.1021 / bi9900471. PMID 10320326.
- ^ а б Лю ZJ, Sun YJ, Rose J, Chung YJ, Hsiao CD, Chang WR, Kuo I, Perozich J, Lindahl R, Hempel J, Wang BC (апрель 1997 г.). «Первая структура альдегиддегидрогеназы раскрывает новые взаимодействия между НАД и складкой Россманна». Структурная биология природы. 4 (4): 317–26. Дои:10.1038 / nsb0497-317. PMID 9095201.
- ^ а б c Абриола Д.П., Филдс Р., Штейн С., МакКерелл А.Д., Петрушко Р. (сентябрь 1987 г.). «Активный центр альдегиддегидрогеназы печени человека». Биохимия. 26 (18): 5679–84. Дои:10.1021 / bi00392a015. PMID 3676276.
- ^ а б Фаррес Дж., Ван Т.Т., Каннингем С.Дж., Вайнер Х. (февраль 1995 г.). «Исследование остатка цистеина в активном центре митохондриальной альдегиддегидрогеназы печени крысы с помощью сайт-направленного мутагенеза». Биохимия. 34 (8): 2592–8. Дои:10.1021 / bi00008a025. PMID 7873540.
- ^ Йошида А., Сюй LC, Даве В. (1992). «Активность окисления сетчатки и биологическая роль цитозольной альдегиддегидрогеназы человека». Фермент. 46 (4–5): 239–44. Дои:10.1159/000468794. PMID 1292933.
- ^ Китсон К.Е., Блайт Т.Дж. (1999). «Охота на ретиналь-специфическую альдегиддегидрогеназу в овечьей печени». Достижения экспериментальной медицины и биологии. 463: 213–21. Дои:10.1007/978-1-4615-4735-8_26. ISBN 978-1-4613-7146-5. PMID 10352688.
- ^ а б Мур С.А., Бейкер Х.М., Блайт Т.Дж., Китсон К.Е., Китсон TM, Бейкер EN (декабрь 1998 г.). "Цитозольная альдегиддегидрогеназа печени овцы: структура раскрывает основу ретинальной специфичности альдегиддегидрогеназ 1 класса". Структура. 6 (12): 1541–51. Дои:10.1016 / S0969-2126 (98) 00152-X. PMID 9862807.
- ^ Джонс К. Х., Линдал Р., Бейкер Д. К., Тимкович Р. (август 1987 г.). "Стереоспецифичность переноса гидрида альдегиддегидрогеназ печени крысы". Журнал биологической химии. 262 (23): 10911–3. PMID 3038902.
- ^ а б Ван Х, Вайнер Х (январь 1995 г.). «Вовлечение глутамата 268 в активный сайт митохондриальной (класс 2) печени человека альдегиддегидрогеназы, как было исследовано с помощью сайт-направленного мутагенеза». Биохимия. 34 (1): 237–43. Дои:10.1021 / bi00001a028. PMID 7819202.
- ^ Харт Дж. Дж., Дикинсон FM (июнь 1982 г.). «Кинетические свойства высокоочищенных препаратов цитоплазматической альдегиддегидрогеназы печени барана». Биохимический журнал. 203 (3): 617–27. Дои:10.1042 / bj2030617. ЧВК 1158276. PMID 7115304.
- ^ Ли С.В., Пак И., Ын С.Ю., Мадиредди С., Черутре Х., Крофт М. (сентябрь 2012 г.). «Передний край: 4-1BB контролирует регуляторную активность дендритных клеток, способствуя оптимальной экспрессии дегидрогеназы сетчатки». Журнал иммунологии. 189 (6): 2697–701. Дои:10.4049 / jimmunol.1201248. ЧВК 3436963. PMID 22896640.
- ^ Киршнер Р.Д., Ротер К., Мюллер Г.А., Энгеланд К. (июнь 2010 г.). «Ген ретинальной дегидрогеназы / редуктазы retSDR1 / DHRS3 активируется p53 и p63, но не мутантами, происходящими из опухолей или синдромов пороков развития EEC / ADULT». Клеточный цикл. 9 (11): 2177–88. Дои:10.4161 / cc.9.11.11844. PMID 20543567.
- ^ Huq MD, Tsai NP, Gupta P, Wei LN (июль 2006 г.). «Регулирование дегидрогеназ сетчатки и синтеза ретиноевой кислоты метаболитами холестерина». Журнал EMBO. 25 (13): 3203–13. Дои:10.1038 / sj.emboj.7601181. ЧВК 1500992. PMID 16763553.
- ^ Липски Дж. Дж., Берти Дж. Дж., Аквилина Дж. В., Мэйс, округ Колумбия (октябрь 1997 г.). «Влияние метаболита дисульфирама на метаболизм ретинальдегида». Ланцет. 350 (9085): 1176. Дои:10.1016 / S0140-6736 (05) 63821-4. PMID 9343525.
- ^ Мей Дж., Бабюк Р.П., Клагстон Р., Чжан В., Грир Дж. Дж. (Февраль 2003 г.). «Ретинальная дегидрогеназа-2 ингибируется соединениями, которые вызывают врожденные диафрагмальные грыжи у грызунов». Американский журнал патологии. 162 (2): 673–9. Дои:10.1016 / S0002-9440 (10) 63861-8. ЧВК 1851155. PMID 12547725.
- ^ Чавла А., Репа Дж. Дж., Эванс Р. М., Мангельсдорф Д. Д. (ноябрь 2001 г.). «Ядерные рецепторы и физиология липидов: открытие X-файлов». Наука. 294 (5548): 1866–70. Bibcode:2001Sci ... 294.1866C. Дои:10.1126 / science.294.5548.1866. PMID 11729302.
- ^ Марлетаз Ф, Голландия Л.З., Лауде В., Шуберт М (2006). «Передача сигналов ретиноевой кислоты и эволюция хордовых». Международный журнал биологических наук. 2 (2): 38–47. Дои:10.7150 / ijbs.2.38. ЧВК 1458431. PMID 16733532.
- ^ Маден М (октябрь 2007 г.). «Ретиноевая кислота в развитии, регенерации и поддержании нервной системы». Обзоры природы. Неврология. 8 (10): 755–65. Дои:10.1038 / номер 2212. PMID 17882253.
- ^ Guillonneau M, Jacq-Aigrain E (сентябрь 1997 г.). «[Тератогенные эффекты витамина А и его производных]». Archives de Pédiatrie. 4 (9): 867–74. Дои:10.1016 / S0929-693X (97) 88158-4. PMID 9345570.
- ^ Дикман Э.Д., Таллер С., Смит С.М. (август 1997 г.). «Регулируемое во времени истощение ретиноевой кислоты вызывает специфические дефекты нервного гребня, глазной и нервной системы». Разработка. 124 (16): 3111–21. PMID 9272952.
- ^ Perrault I, Hanein S, Gerber S, Barbet F, Ducroq D, Dollfus H, Hamel C, Dufier JL, Munnich A, Kaplan J, Rozet JM (октябрь 2004 г.). «Мутации ретинальной дегидрогеназы 12 (RDH12) при врожденном амаврозе Лебера». Американский журнал генетики человека. 75 (4): 639–46. Дои:10.1086/424889. ЧВК 1182050. PMID 15322982.
- ^ Молоткова Н., Молотков А., Сырбу И.О., Дестер Г. (февраль 2005 г.). «Потребность в мезодермальной ретиноевой кислоте, вырабатываемой Raldh2 для задней нервной трансформации». Механизмы развития. 122 (2): 145–55. Дои:10.1016 / j.mod.2004.10.008. ЧВК 2826194. PMID 15652703.
- ^ Мик Ф.А., Хазельбек Р.Дж., Куэнка А.Э., Дестер Дж. (Май 2002 г.). «Новая активность по выработке ретиноевой кислоты в нервной трубке и сердце, идентифицированная условным спасением мышей с нулевым мутантом Raldh2». Разработка. 129 (9): 2271–82. ЧВК 2833017. PMID 11959834.
- ^ Молотков А., Молоткова Н., Дестер Г. (май 2006 г.). «Ретиноевая кислота направляет морфогенетические движения глаз через паракринную передачу сигналов, но не нужна для формирования дорсовентрального паттерна сетчатки». Разработка. 133 (10): 1901–10. Дои:10.1242 / dev.02328. ЧВК 2833011. PMID 16611695.
- ^ Ян Д., Кройс CR, Хуанг П, Ван Дж, Мин Дж, Ю HS, Дэн Й, Наполи, Джей Лион (2 ноября 2017 г.). «Raldh1 способствует ожирению в подростковом возрасте независимо от сигналов сетчатки». PLOS ONE. 12 (11): e0187669. Bibcode:2017PLoSO..1287669Y. Дои:10.1371 / journal.pone.0187669. ЧВК 5667840. PMID 29095919.

