Альдегиддегидрогеназа - Aldehyde dehydrogenase
| Альдегиддегидрогеназа (НАД +) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
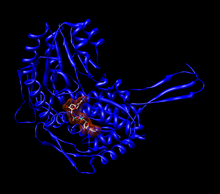 Мономер альдегиддегидрогеназы 2 человека (ALDH2 ) с модель, заполняющая пространство из НАД + на активном сайте.[1] | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 1.2.1.3 | ||||||||
| Количество CAS | 9028-86-8 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Альдегиддегидрогеназы (EC 1.2.1.3 ) являются группой ферменты который катализировать то окисление из альдегиды.[2] Они превращают альдегиды (R – C (= O)-ЧАС) к карбоновые кислоты (R – C (= O)-ОЙ). Кислород поступает из молекулы воды. На сегодняшний день в геноме человека идентифицировано девятнадцать генов ALDH. Эти гены участвуют в широком спектре биологических процессов, включая детоксикацию экзогенно и эндогенно генерируемых альдегидов.
Функция
Альдегиддегидрогеназа - это полиморфный фермент[3] ответственный за окисление из альдегиды к карбоновые кислоты, которые покидают печень и метаболизируются мышцами и сердцем тела.[3] У млекопитающих существует три различных класса этих ферментов: класс 1 (низкий Kм, цитозольный), класс 2 (низкий Kм, митохондриальный) и класс 3 (высокий Kм, например, в опухолях, желудке и роговице). Во всех трех классах существуют конститутивные и индуцибельные формы. ALDH1 и ALDH2 являются наиболее важными ферментами для окисления альдегидов, и оба являются тетрамерными ферментами, состоящими из 54кДа субъединицы. Эти ферменты обнаружены во многих тканях тела, но их самая высокая концентрация в печени.[3]
Активный сайт
Активный центр фермента альдегиддегидрогеназы в значительной степени сохраняется во всех классах ферментов, и, хотя количество аминокислот, присутствующих в субъединице, может меняться, общая функция сайта меняется мало. Активный центр связывается с одной молекулой альдегида и одной из них. НАД+ или же НАДФ+ который действует как кофактор. Цистеин и глутамат будут взаимодействовать с альдегидным субстратом. Многие другие остатки будут взаимодействовать с NAD (P)+ чтобы удерживать его на месте. Магний может быть использован для улучшения функции фермента, хотя количество, которое он помогает ферменту, может варьироваться в зависимости от класса альдегидов.
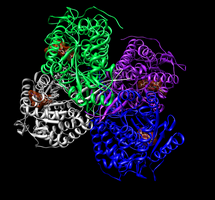
Тетрамер альдегиддегидрогеназы 2 с моделью заполнения пространства НАД+ на каждом активном сайте.[1]

Активный центр митохондриальной альдегиддегидрогеназы 2 человека. Cys302 и Glu268 взаимодействуют с альдегидным субстратом. НАД+ удерживается на месте множеством остатков (показанных в виде проволок или палочек).[1]
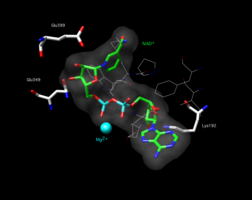
Активный центр мутантной альдегиддегидрогеназы 2 K487E с моделью NAD, заполняющей пространство+ на активном сайте. Аминокислота Glu349 выделена.[1]
Механизм
Общая реакция, катализируемая альдегиддегидрогеназами, следующая:
В этом НАД (П)+-зависимая реакция, альдегид переходит в активный сайт через канал, отходящий от поверхности фермента. Активный сайт содержит Россманн фолд, а взаимодействия между кофактором и складкой учитывают действие активного сайта.[4]
 |
А сера из цистеина в активном центре делает нуклеофильная атака на карбонил углерод альдегида. Водород запускается как гидрид и атакует НАД (П)+ сделать НАД (P) H. Затем активный центр фермента претерпевает изоморфное изменение, в результате чего NAD (P) H перемещается, создавая пространство для доступа молекулы воды к субстрату. Вода насыщается глутаматом в активном центре, и вода производит нуклеофильную атаку на карбонильный углерод, отталкивая серу как уходящая группа.
Патология (дефицит альдегиддегидрогеназы)

ALDH2 играет решающую роль в поддержании низкого уровня ацетальдегида в крови во время окисления алкоголя.[6] На этом пути (от этанола до ацетальдегида до ацетата) промежуточные структуры могут быть токсичными, и проблемы со здоровьем возникают, когда эти промежуточные соединения не могут быть очищены.[3] Когда в крови наблюдается высокий уровень ацетальдегида, возникают покраснение лица, головокружение, учащенное сердцебиение, тошнота и общие симптомы «похмелья». Эти симптомы указывают на заболевание, известное как реакция промывки спиртом, также известный как «азиатский прилив» или «восточный приливной синдром».[7]
Существует мутантная форма альдегиддегидрогеназы, называемая ALDH2 * 2, в которой a лизин остаток заменяет глутамат в активном сайте в позиции 487 ALDH2.[8] Гомозиготный люди с мутантным аллелем практически не имеют активности ALDH2, а те гетерозиготный для мутации снижена активность. Таким образом, мутация частично доминантная.[3] Неэффективный гомозиготный аллель работает со скоростью около 8% нормального аллеля, так как показывает более высокий Kм для НАД+ и имеет более высокую максимальную скорость, чем аллель дикого типа.[3] Эта мутация распространена в Японии, где 41% неалкогольной контрольной группы имели дефицит ALDH2, где только 2–5% алкогольной группы имели дефицит ALDH2. На Тайване цифры аналогичны: 30% контрольной группы демонстрируют дефицит, а 6% алкоголиков демонстрируют его.[3] Дефицит проявляется в медленном удалении ацетальдегида, при этом низкая толерантность к алкоголю, возможно, приводит к более низкой частоте алкоголизма.[3][7]
Эти симптомы такие же, как и у людей, которые пьют во время лечения препаратом. дисульфирам, поэтому дисульфирам используется для лечения алкоголизма. У пациентов наблюдается более высокий уровень ацетальдегида в крови, и они серьезно заболевают даже при употреблении небольшого количества алкоголя.[3] Несколько препаратов (например, метронидазол ) вызывают аналогичную реакцию, известную как «дисульфирамоподобная реакция».
Ёкояма и другие. обнаружили, что снижение активности фермента альдегиддегидрогеназы-2, вызванное мутировавшим аллелем ALDH2, способствует более высокой вероятности пищеводный и рак ротоглотки. Метаболизируемый ацетальдегид в крови, который в шесть раз выше, чем у людей без мутации, оказался канцероген у лабораторных животных. ALDH2 * 2 связан с повышенным риском рака ротоглотки, пищевода, желудка, толстой кишки и легких. Однако они не обнаружили связи между повышенным уровнем ALDH2 * 2 в крови и повышенным риском рака печени.[9]
Демир и другие. обнаружили, что ALDH1 является потенциально важным, плохим прогностическим фактором при раке груди, связанным с высокой гистологической степенью, отрицательностью рецепторов эстрогена / прогестерона и положительностью HER2.[10]
В некоторых исследованиях случай-контроль утверждалось, что носительство аллеля ALDH2 * 2 связано с риском позднего начала Болезнь Альцгеймера независимо от аполипопротеин E ген (вероятность НАГРУЗКИ у носителей аллеля ALDH2 * 2 почти вдвое выше, чем у не носителей).[11] Более того, ген ALDH, экспрессия и активность белка существенно снижаются в черная субстанция из болезнь Паркинсона пациенты.[12] Эти отчеты согласуются с выводами, касающимися токсичных альдегиды, полученные в результате окисления липидов при этих заболеваниях и в нейродегенерация в целом.[13]
Фитцморис и другие. исследовали ингибирование альдегиддегидрогеназы как патогенный механизм болезни Паркинсона. «Эта модель ALDH для этиологии БП может помочь объяснить избирательную уязвимость дофаминергических нейронов при БП и предоставить потенциальный механизм, посредством которого токсические вещества окружающей среды вносят вклад в патогенез БП». [14]
Нокаутирующая мышь модели дополнительно подтверждают участие семейства ALDH в нейродегенерации. Мыши с нулевым уровнем ALDH1a1 и ALDH2 демонстрируют возрастную недостаточность двигательной активности и значительное повышение уровня биогенных альдегидов, как болезнь Паркинсона.[15]
У мышей ALDH2 - / - наблюдаются возрастные нарушения памяти при выполнении различных задач, а также эндотелиальная дисфункция, атрофия мозга и другие патологии, связанные с болезнью Альцгеймера, включая заметное увеличение продуктов перекисного окисления липидов. амилоид-бета, п-тау и активирован каспасы. Эти поведенческие и биохимические нарушения, подобные болезни Альцгеймера, были эффективно уменьшены, когда мышей ALDH2 - / - лечили усиленными изотопами дейтерированными полиненасыщенные жирные кислоты (Д-ПНЖК).[16]
Гены
- ALDH1A1, ALDH1A2, ALDH1A3, ALDH1B1, ALDH1L1, ALDH1L2
- ALDH2
- ALDH3A1, ALDH3A2, ALDH3B1, ALDH3B2
- ALDH4A1, ALDH5A1, ALDH6A1, ALDH7A1, ALDH8A1, ALDH9A1, ALDH16A1, ALDH18A1
Смотрите также
Рекомендации
- ^ а б c d PDB: 1o02; Перес-Миллер С.Дж., Херли Т.Д. (июнь 2003 г.). «Изомеризация кофермента является неотъемлемой частью катализа в альдегиддегидрогеназе». Биохимия. 42 (23): 7100–9. Дои:10.1021 / bi034182w. PMID 12795606.
- ^ Маркити С.А., Брокер С., Стагос Д., Василиу В. (июнь 2008 г.). «Ферменты, окисляющие альдегид, не относящиеся к P450: суперсемейство альдегиддегидрогеназ». Мнение эксперта по метаболизму лекарств и токсикологии. 4 (6): 697–720. Дои:10.1517/17425255.4.6.697. ЧВК 2658643. PMID 18611112.
- ^ а б c d е ж грамм час я Крабб Д.В., Мацумото М., Чанг Д., Ю М. (февраль 2004 г.). «Обзор роли алкогольдегидрогеназы и альдегиддегидрогеназы и их вариантов в генезе алкогольной патологии». Труды Общества питания. 63 (1): 49–63. Дои:10.1079 / PNS2003327. PMID 15099407.
- ^ Лю ZJ, Sun YJ, Rose J, Chung YJ, Hsiao CD, Chang WR, Kuo I, Perozich J, Lindahl R, Hempel J, Wang BC (апрель 1997 г.). «Первая структура альдегиддегидрогеназы раскрывает новые взаимодействия между НАД и складкой Россманна». Структурная биология природы. 4 (4): 317–26. Дои:10.1038 / nsb0497-317. PMID 9095201. S2CID 21436007.
- ^ Рисунок 11-4 в: Жезл Цветок; Хамфри П. Рэнг; Морин М. Дейл; Риттер, Джеймс М. (2007). Фармакология Рэнга и Дейла. Эдинбург: Черчилль Ливингстон. ISBN 978-0-443-06911-6.
- ^ Edenberg, Howard J .; Макклинтик, Жанетт Н. (2018). «Алкогольдегидрогеназы, альдегиддегидрогеназы и расстройства, связанные с употреблением алкоголя: критический обзор». Алкоголизм, Клинические и экспериментальные исследования. 42 (12): 2281–2297. Дои:10.1111 / acer.13904. ISSN 1530-0277. ЧВК 6286250. PMID 30320893.
- ^ а б Томассон Х. Р., Эденберг Х. Дж., Крабб Д. В., Май XL, Джером Р. Э., Ли Т.К., Ван С.П., Лин Ю.Т., Лу РБ, Инь С.Дж. (апрель 1991 г.). «Генотипы алкоголя и альдегиддегидрогеназы и алкоголизм у китайских мужчин». Американский журнал генетики человека. 48 (4): 677–81. ЧВК 1682953. PMID 2014795.
- ^ Стейнмец К.Г., Се П., Вайнер Х., Херли Т.Д. (май 1997 г.). «Структура митохондриальной альдегиддегидрогеназы: генетический компонент отвращения к этанолу». Структура. 5 (5): 701–11. Дои:10.1016 / S0969-2126 (97) 00224-4. PMID 9195888.
- ^ Ёкояма А., Мурамацу Т., Омори Т., Ёкояма Т., Окуяма К., Такахаши Н., Хасэгава И., Хигучи С., Маруяма К., Ширакура К., Исии Н. (август 1998 г.). «Связанные с алкоголем раковые заболевания и альдегиддегидрогеназа-2 у японских алкоголиков». Канцерогенез. 19 (8): 1383–7. Дои:10.1093 / carcin / 19.8.1383. PMID 9744533.
- ^ Демир, Хейл; Дулгар, Озгечан; Гулле, Бугра Тайгун; Turna, Hande; Ильван, Сеннур (07.11.2018). «Прогностическое значение альдегиддегидрогеназы 1 (ALDH1) при инвазивном раке молочной железы». Боснийский журнал фундаментальных медицинских наук. 18 (4): 313–319. Дои:10.17305 / bjbms.2018.3094. ISSN 1840-4812.
- ^ Камино К., Нагасака К., Имагава М., Ямамото Х., Йонеда Х., Уэки А., Китамура С., Намеката К., Мики Т., Охта С. (июнь 2000 г.). «Дефицит митохондриальной альдегиддегидрогеназы увеличивает риск болезни Альцгеймера с поздним началом у населения Японии». Сообщения о биохимических и биофизических исследованиях. 273 (1): 192–6. Дои:10.1006 / bbrc.2000.2923. PMID 10873585.
- ^ Грюнблатт Э, Ридерер П (февраль 2016 г.). «Альдегиддегидрогеназа (ALDH) при болезни Альцгеймера и Паркинсона». Журнал нейронной передачи. 123 (2): 83–90. Дои:10.1007 / s00702-014-1320-1. PMID 25298080. S2CID 24270982.
- ^ Wood PL (сентябрь 2006 г.). «Нейродегенерация и альдегидная нагрузка: от концепции до терапии». Журнал психиатрии и неврологии. 31 (5): 296–7. ЧВК 1557683. PMID 16951732.
- ^ Fitzmaurice AG, Rhodes SL, Lulla A, Murphy NP, Lam HA, O'Donnell KC, Barnhill L, Casida JE, Cockburn M, Sagasti A, Stahl MC, Maidment NT, Ritz B, Bronstein JM (январь 2013 г.). «Ингибирование альдегиддегидрогеназы как патогенный механизм болезни Паркинсона». Труды Национальной академии наук Соединенных Штатов Америки. 110 (2): 636–41. Bibcode:2013ПНАС..110..636Ф. Дои:10.1073 / pnas.1220399110. ЧВК 3545765. PMID 23267077.
- ^ Вей М.С., Фернандес Э., Мартинес П.А., Салливан П., Гольдштейн Д.С., Стронг Р. (2012). «Нейродегенерация и двигательная дисфункция у мышей, лишенных цитозольной и митохондриальной альдегиддегидрогеназы: последствия для болезни Паркинсона». PLOS ONE. 7 (2): e31522. Bibcode:2012PLoSO ... 731522W. Дои:10.1371 / journal.pone.0031522. ЧВК 3284575. PMID 22384032.
- ^ Эльхаррам А, Чегледы Н.М., Голод М., Милн Г.Л., Поллок Э., Беннетт Б.М., Щепинов М.С. (декабрь 2017 г.). «Полиненасыщенные жирные кислоты, усиленные дейтерием, улучшают познавательные способности на мышиной модели спорадической болезни Альцгеймера». Журнал FEBS. 284 (23): 4083–4095. Дои:10.1111 / фев.14291. ЧВК 5716852. PMID 29024570.
внешняя ссылка
- Альдегид + дегидрогеназа в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)



