Глицеральдегид-3-фосфатдегидрогеназа - Glyceraldehyde 3-phosphate dehydrogenase
| Глицеральдегид-3-фосфатдегидрогеназа, NAD-связывающий домен | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 детерминанты термостабильности фермента, наблюдаемые в молекулярной структуре d-глицеральдегид-3-фосфатдегидрогеназы thermus aquaticus при разрешении 2,5 ангстрем | |||||||||
| Идентификаторы | |||||||||
| Символ | Gp_dh_N | ||||||||
| Pfam | PF00044 | ||||||||
| Pfam клан | CL0063 | ||||||||
| ИнтерПро | IPR020828 | ||||||||
| PROSITE | PDOC00069 | ||||||||
| SCOP2 | 1gd1 / Объем / СУПФАМ | ||||||||
| |||||||||
| Глицеральдегид-3-фосфатдегидрогеназа, C-концевой домен | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 кристаллическая структура глицеральдегид-3-фосфатдегидрогеназы из pyrococcus horikoshii ot3 | |||||||||
| Идентификаторы | |||||||||
| Символ | Gp_dh_C | ||||||||
| Pfam | PF02800 | ||||||||
| Pfam клан | CL0139 | ||||||||
| ИнтерПро | IPR020829 | ||||||||
| PROSITE | PDOC00069 | ||||||||
| SCOP2 | 1gd1 / Объем / СУПФАМ | ||||||||
| |||||||||
Глицеральдегид-3-фосфатдегидрогеназа (сокращенно GAPDH) (EC 1.2.1.12 ) является фермент около 37 кДа, что катализирует шестую стадию гликолиз и таким образом служит для разрушения глюкоза для энергии и молекул углерода. В дополнение к этой давно установленной метаболической функции, GAPDH недавно был вовлечен в несколько неметаболических процессов, включая транскрипция активация, инициирование апоптоз,[4] От ER к перемещению пузырьков Гольджи, и быстрый аксонал, или аксоплазматический транспорт.[5] В сперме специфические для яичка изофермент GAPDHS выражается.
Структура
В нормальных клеточных условиях цитоплазматический GAPDH существует прежде всего как тетрамер. Эта форма состоит из четырех идентичных 37-кДа субъединицы, содержащие один каталитический тиол сгруппируйте каждый и критически важный для каталитической функции фермента.[6][7] Ядерный GAPDH увеличился изоэлектрическая точка (pI) pH 8,3–8,7.[7] Следует отметить, что цистеин остаток C152 в ферменте активный сайт требуется для индукции апоптоза окислительный стресс.[7] В частности, посттрансляционные модификации цитоплазматического GAPDH вносят свой вклад в его функции вне гликолиза.[6]
GAPDH кодируется одним геном, который продуцирует один транскрипт мРНК с 8 вариантами сплайсинга, хотя изоформа существует как отдельный ген, который экспрессируется только в сперматозоиды.[7]
Реакция
| глицеральдегид-3-фосфат | глицеральдегид фосфатдегидрогеназа | D-глицерат 1,3-бисфосфат | |
 | 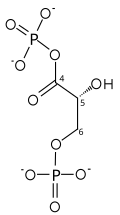 | ||
| НАД+ + Pя | НАДН + ЧАС+ | ||
 | |||
| НАД+ + Pя | НАДН + ЧАС+ | ||
Сложный C00118 в КЕГГ База данных Pathway. Фермент 1.2.1.12 в КЕГГ База данных Pathway. Реакция R01063 в КЕГГ База данных Pathway. Сложный C00236 в КЕГГ База данных Pathway.
Двухэтапное преобразование G3P
Первая реакция - это окисление глицеральдегид-3-фосфат (G3P) в позиции-1 (на диаграмме он показан как 4-й углерод от гликолиза), в котором альдегид превращается в карбоновая кислота (ΔG ° '= - 50 кДж / моль (-12 ккал / моль)) и НАД + одновременно эндергонически восстанавливается до НАДН.
Энергия, выделяемая этим очень экзергонический реакция окисления приводит в движение эндергонический вторая реакция (ΔG ° '= + 50 кДж / моль (+ 12 ккал / моль)), в которой молекула неорганического фосфат переносится в промежуточное соединение GAP с образованием продукта с высоким потенциалом переноса фосфорила: 1,3-бисфосфоглицерат (1,3-БПГ).
Это пример фосфорилирование сопряжена с окислением, и в целом реакция носит несколько эндергонический характер (ΔG ° '= + 6,3 кДж / моль (+1,5)). Энергетическая связь здесь стала возможной благодаря GAPDH.
Механизм
GAPDH использует ковалентный катализ и общий щелочной катализ для уменьшения очень большой энергии активации второй стадии (фосфорилирования) этой реакции.
1: Окисление
Первый цистеин остаток в активном центре GAPDH атакует карбонильную группу GAP, создавая гемитиоацеталь промежуточный (ковалентный катализ).
Гемитиоацеталь депротонируется гистидин остаток в активном центре фермента (общий щелочной катализ). Депротонирование способствует реформированию карбонильной группы в последующем промежуточном тиоэфире и выбросу гидрид-ион.
Затем соседняя, прочно связанная молекула НАД+ принимает гидрид-ион, формируя НАДН в то время как гемитиоацеталь окисляется до тиоэфир.
Этот вид тиоэфира намного более энергетичен (менее стабилен), чем карбоновая кислота частицы, которые возникли бы, если бы GAP был окислен в отсутствие GAPDH (разновидность карбоновой кислоты имеет настолько низкую энергию, что энергетический барьер для второй стадии реакции (фосфорилирование) будет слишком высоким, и, следовательно, реакция будет слишком медленной и неблагоприятные для живого организма).
2: фосфорилирование
НАДН покидает активный центр и замещается другой молекулой НАД.+, положительный заряд которого стабилизирует отрицательно заряженный карбонильный кислород в переходном состоянии следующей и последней ступени. Наконец, молекула неорганический фосфат атакует тиоэфир и образует тетраэдрический промежуточный продукт, который затем разрушается с высвобождением 1,3-бисфосфоглицерата, и тиол группа остатка цистеина фермента.
Регулирование
Этот белок может использовать морфеин модель аллостерическая регуляция.[8]
Функция
Метаболический
Как следует из названия, глицеральдегид-3-фосфатдегидрогеназа (GAPDH) катализирует превращение глицеральдегид-3-фосфат к D-глицерат 1,3-бисфосфат. Это 6-й шаг в гликолитическом распаде глюкозы, важном пути снабжения энергией и молекулами углерода, который происходит в цитозоль эукариотических клеток. Преобразование происходит в два связанных этапа. Первый благоприятен и допускает второй неблагоприятный шаг.
Транскрипция и апоптоз
GAPDH может сам активировать транскрипция. В ОСА-С комплекс транскрипционных коактиваторов содержит GAPDH и лактатдегидрогеназа, два белка, которые ранее считались вовлеченными только в метаболизм. GAPDH перемещается между цитозоль и ядро и, таким образом, может связывать метаболическое состояние с транскрипцией гена.[9]
В 2005 году Hara et al. показали, что GAPDH инициирует апоптоз. Это не третья функция, но ее можно рассматривать как активность, опосредованную связыванием GAPDH с ДНК аналогично активации транскрипции, о которой говорилось выше. Исследование показало, что GAPDH S-нитрозилированный NO в ответ на клеточный стресс, который заставляет его связываться с белком SIAH1, а убиквитинлигаза. Комплекс перемещается в ядро, где Siah1 нацелен на ядерные белки для деградация, таким образом инициируя контролируемое отключение ячейки.[10] В последующем исследовании группа продемонстрировала, что депренил, который клинически использовался для лечения болезнь Паркинсона, сильно снижает апоптотическое действие GAPDH, предотвращая его S-нитрозилирование, и поэтому может использоваться в качестве лекарственного средства.[11]
Метаболический переключатель
GAPDH действует как обратимый метаболический переключатель при окислительном стрессе.[12] Когда клетки подвергаются воздействию окислители, они нуждаются в чрезмерном количестве кофактора антиоксиданта НАДФН. В цитозоле НАДФН восстанавливается из НАДФ + несколькими ферментами, три из которых катализируют первые шаги Пентозофосфатный путь. Обработка оксидантами вызывает инактивацию GAPDH. Эта инактивация временно перенаправляет метаболический поток с гликолиза на пентозофосфатный путь, позволяя клетке вырабатывать больше НАДФН.[13] В стрессовых условиях НАДФН необходим некоторым антиоксидантным системам, включая глутаредоксин и тиоредоксин а также имеет важное значение для переработки глутатион.
От скорой помощи до транспорта Гольджи
GAPDH также, похоже, участвует в транспорт везикул от эндоплазматический ретикулум (ER) в аппарат Гольджи который является частью маршрута доставки секретируемых белков. Выяснилось, что GAPDH вербуют Rab2 к пузырно-трубчатые скопления ER, где это помогает формировать Пузырьки COP 1. GAPDH активируется через тирозин фосфорилирование к Src.[14]
Дополнительные функции
GAPDH, как и многие другие ферменты, выполняет несколько функций. В дополнение к катализации 6-й ступени гликолиз, недавние данные указывают на участие GAPDH в других клеточных процессах. Было описано, что GAPDH демонстрирует многофункциональность более высокого порядка в контексте поддержания гомеостаза клеточного железа,[15] конкретно как шаперонный белок для лабильного гема внутри клеток.[16] Это стало сюрпризом для исследователей, но с эволюционной точки зрения имеет смысл повторно использовать и адаптировать существующие белки вместо того, чтобы создавать новый белок с нуля.
Использовать в качестве контроля загрузки
Поскольку ген GAPDH часто стабильно и конститутивно экспрессируется на высоких уровнях в большинстве тканей и клеток, он считается ген домашнего хозяйства. По этой причине GAPDH обычно используется биологическими исследователями в качестве контроль загрузки за вестерн-блот и как контроль для КПЦР. Однако исследователи сообщили о различном регулировании GAPDH при определенных условиях.[17] Например, фактор транскрипции МЗФ-1 было показано, что он регулирует ген GAPDH.[18] Гипоксия также сильно активирует GAPDH.[19] Следовательно, использование GAPDH для контроля загрузки следует тщательно продумать.
Сотовая связь
Все стадии гликолиза проходят в цитозоль и то же самое происходит с реакцией, катализируемой GAPDH. В красные кровяные тельца, GAPDH и несколько других гликолитических ферментов собираются в комплексы внутри клеточная мембрана. По-видимому, этот процесс регулируется фосфорилированием и оксигенацией.[20] Ожидается, что близкое расположение нескольких гликолитических ферментов значительно увеличит общую скорость распада глюкозы. Недавние исследования также показали, что GAPDH экспрессируется зависимым от железа способом на внешней стороне клеточной мембраны, где он играет роль в поддержании гомеостаза клеточного железа.[21][22]
Клиническое значение
Рак
GAPDH сверхэкспрессируется при множественных раковых заболеваниях человека, таких как кожный меланома, и его экспрессия положительно коррелирует с прогрессированием опухоли.[23][24] Его гликолитические и антиапоптотические функции способствуют пролиферации и защите опухолевых клеток, способствуя туморогенез. В частности, GAPDH защищает от теломер сокращение, вызванное химиотерапевтический препараты, стимулирующие сфинголипид керамид. Между тем, условия вроде окислительный стресс нарушают функцию GAPDH, что приводит к старению и смерти клеток.[7] Более того, истощение GAPDH смогло вызвать старение в опухолевых клетках, таким образом представляя новую терапевтическую стратегию для контроля роста опухоли.[25]
Нейродегенерация
GAPDH причастен к нескольким нейродегенеративным заболеваниям и расстройствам, в основном через взаимодействия с другими белками, специфичными для этого заболевания или расстройства. Эти взаимодействия могут влиять не только на энергетический метаболизм, но и на другие функции GAPDH.[6] Например, взаимодействие GAPDH с бета-амилоид белок-предшественник (betaAPP) может влиять на его функцию в отношении цитоскелет или мембранный транспорт, при взаимодействии с Хантингтин может вмешиваться в его функцию в отношении апоптоза, ядерных тРНК транспорт, Репликация ДНК, и Ремонт ДНК. Кроме того, сообщалось о ядерной транслокации GAPDH в болезнь Паркинсона (PD) и несколько антиапоптотических препаратов для PD, таких как разагилин, функционируют, предотвращая ядерную транслокацию GAPDH. Предполагается, что гипометаболизм может быть одним из факторов развития БП, но точные механизмы, лежащие в основе участия GAPDH в нейродегенеративном заболевании, еще предстоит выяснить.[26] В SNP rs3741916 в 5' UTR из GAPDH ген может быть связан с поздним началом Болезнь Альцгеймера.[27]
Взаимодействия
Партнеры по связыванию белков
GAPDH участвует в ряде биологических функций через белок-белковые взаимодействия с:
- тубулин для облегчения связывания микротрубочек;[6]
- актин для облегчения полимеризации актина;[6]
- VDAC1 побудить митохондриальный мембранная проницаемость (ММП) и апоптоз;[6]
- Инозитол-1,4,5-трифосфатный рецептор для регулирования внутриклеточного Ca2 + сигнализация;[6]
- Октябрь-1 сформировать коактиватор сложный OCA-S, который требуется для гистон H2B синтез во время Фаза S из клеточный цикл;[7]
- p22 помочь микротрубочка организация;[7]
- Rab2 для облегчения эндоплазматический ретикулум (ER) -гольджи транспорт;[7]
- Трансферрин на поверхности различных клеток и во внеклеточной жидкости;[7][22][28]
- Лактатдегидрогеназа;[7]
- Лактоферрин;[29]
- Апуриновая / апиримидиновая эндонуклеаза (APE1 ), таким образом превращая окисленный APE1 в его восстановленную форму, чтобы перезапустить его эндонуклеаза Мероприятия;[7]
- Протеин промиелоцитарного лейкоза (PML) в РНК -зависимая мода;[7]
- Реб изолировать GTPase в условиях низкого уровня глюкозы;[7]
- Siah1 образует комплекс, который перемещается в ядро, где он убиквитинаты и разрушает ядерные белки в условиях нитрозативного стресса;[7]
- GAPDH, конкурент белка Siah, увеличивает жизнь (GOSPEL), чтобы блокировать взаимодействие GAPDH с Siah1 и, таким образом, гибель клеток в ответ на окислительный стресс;[7]
- p300 /CREB-связывающий белок (CBP), который ацетилаты GAPDH и, в свою очередь, усиливает ацетилирование дополнительных апоптотических мишеней;[7]
- Са2 + / кальмодулин-зависимая протеинкиназа, специфичная для скелетных мышц;[7]
- Акт;[7]
- Бета-амилоид белок-предшественник (бетаАПП);[26]
- Хантингтин.[26]
- GAPDH может самоассоциироваться в гомотипные олигомеры / агрегаты
Партнеры по связыванию нуклеиновых кислот
GAPDH связывается с одноцепочечной РНК [30] и были идентифицированы ДНК и ряд партнеров по связыванию нуклеиновых кислот:[7]
Ингибиторы
Интерактивная карта проезда
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи.[§ 1]
- ^ Интерактивную карту путей можно редактировать на WikiPathways: «ГликолизГлюконеогенез_WP534».
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000111640 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Tarze A., Deniaud A, Le Bras M, Maillier E, Molle D, Larochette N, Zamzami N, Jan G, Kroemer G, Brenner C. (апрель 2007 г.). «GAPDH, новый регулятор проапоптотической проницаемости митохондриальной мембраны». Онкоген. 26 (18): 2606–20. Дои:10.1038 / sj.onc.1210074. PMID 17072346.
- ^ Zala D, Hinckelmann MV, Yu H, Lyra da Cunha MM, Liot G, Cordelières FP, Marco S, Saudou F (январь 2013 г.). «Везикулярный гликолиз обеспечивает бортовую энергию для быстрого аксонального транспорта». Клетка. 152 (3): 479–91. Дои:10.1016 / j.cell.2012.12.029. PMID 23374344.
- ^ а б c d е ж грамм Тристан С., Шахани Н., Седлак Т.В., Сава А. (февраль 2011 г.). «Разнообразные функции GAPDH: виды из разных субклеточных компартментов». Сотовая связь. 23 (2): 317–23. Дои:10.1016 / j.cellsig.2010.08.003. ЧВК 3084531. PMID 20727968.
- ^ а б c d е ж грамм час я j k л м п о п q р s Николс К., Ли Х., Лю Дж. П. (август 2012 г.). «GAPDH: обычный фермент с необычными функциями». Клиническая и экспериментальная фармакология и физиология. 39 (8): 674–9. Дои:10.1111 / j.1440-1681.2011.05599.x. PMID 21895736. S2CID 23499684.
- ^ Селвуд Т., Джаффе Е.К. (март 2012 г.). «Динамические диссоциирующие гомоолигомеры и контроль функции белка». Архивы биохимии и биофизики. 519 (2): 131–43. Дои:10.1016 / j.abb.2011.11.020. ЧВК 3298769. PMID 22182754.
- ^ Чжэн Л., Редер Р., Ло Ю. (июль 2003 г.). «Активация S-фазы промотора гистона H2B с помощью OCA-S, коактиваторного комплекса, который содержит GAPDH в качестве ключевого компонента». Клетка. 114 (2): 255–66. Дои:10.1016 / S0092-8674 (03) 00552-X. PMID 12887926. S2CID 5543647.
- ^ Hara MR, Agrawal N, Kim SF, Cascio MB, Fujimuro M, Ozeki Y, Takahashi M, Cheah JH, Tankou SK, Hester LD, Ferris CD, Hayward SD, Snyder SH, Sawa A (июль 2005 г.). «S-нитрозилированный GAPDH инициирует апоптотическую гибель клеток путем ядерной транслокации после связывания Siah1». Природа клеточной биологии. 7 (7): 665–74. Дои:10,1038 / ncb1268. PMID 15951807. S2CID 1922911.
- ^ Hara MR, Thomas B, Cascio MB, Bae BI, Hester LD, Dawson VL, Dawson TM, Sawa A, Snyder SH (март 2006 г.). «Нейропротекция фармакологической блокадой каскада смерти GAPDH». Труды Национальной академии наук Соединенных Штатов Америки. 103 (10): 3887–9. Дои:10.1073 / pnas.0511321103. ЧВК 1450161. PMID 16505364.
- ^ Агарвал А.Р., Чжао Л., Санчети Х., Сундар И.К., Рахман И., Каденас Е. (ноябрь 2012 г.). «Кратковременное воздействие сигаретного дыма вызывает обратимые изменения в энергетическом обмене и окислительно-восстановительном статусе клеток, независимо от воспалительных реакций в легких мыши». Американский журнал физиологии. Клеточная и молекулярная физиология легких. 303 (10): L889–98. Дои:10.1152 / ajplung.00219.2012. PMID 23064950.
- ^ Ральсер М., Вамелинк М.М., Ковальд А., Гериш Б., Херен Г., Струйс Е.А., Клипп Э., Якобс С., Брайтенбах М., Лехрах Н., Кробич С. (2007). «Динамическое изменение маршрута потока углеводов является ключом к противодействию окислительному стрессу». Журнал биологии. 6 (4): 10. Дои:10.1186 / jbiol61. ЧВК 2373902. PMID 18154684.
- ^ Тисдейл EJ, Artalejo CR (июнь 2007 г.). «Мутант GAPDH, дефектный по Src-зависимому фосфорилированию тирозина, препятствует Rab2-опосредованным событиям». Трафик. 8 (6): 733–41. Дои:10.1111 / j.1600-0854.2007.00569.x. ЧВК 3775588. PMID 17488287.
- ^ Борадия В.М., Радже М., Радже К.И. (декабрь 2014 г.). «Белок подрабатывает метаболизмом железа: глицеральдегид-3-фосфатдегидрогеназа (GAPDH)». Сделки биохимического общества. 42 (6): 1796–801. Дои:10.1042 / BST20140220. PMID 25399609.
- ^ Суини Э.А., Сингх А.Б., Чакраварти Р., Мартинес-Гусман О., Сайни А., Хак М.М. и др. (Июль 2018). «Глицеральдегид-3-фосфатдегидрогеназа - шаперон, выделяющий лабильный гем в клетках». Журнал биологической химии. 293 (37): 14557–14568. Дои:10.1074 / jbc.RA118.004169. ЧВК 6139559. PMID 30012884.
- ^ Барбер Р.Д., Хармер Д.В., Коулман Р.А., Кларк Б.Дж. (май 2005 г.). «GAPDH как ген домашнего хозяйства: анализ экспрессии мРНК GAPDH на панели из 72 тканей человека». Физиологическая геномика. 21 (3): 389–95. CiteSeerX 10.1.1.459.7039. Дои:10.1152 / физиолгеномика.00025.2005. PMID 15769908.
- ^ Piszczatowski RT, Rafferty BJ, Rozado A, Tobak S, Lents NH (август 2014 г.). «Ген глицеральдегид-3-фосфатдегидрогеназы (GAPDH) регулируется миелоидным цинковым пальцем 1 (MZF-1) и индуцируется кальцитриолом». Сообщения о биохимических и биофизических исследованиях. 451 (1): 137–41. Дои:10.1016 / j.bbrc.2014.07.082. PMID 25065746.
- ^ Ян, Инчжун; Fan, Wenhong; Чжу, Линлинг; Чжао, Тонг; Ма, Лан; Ву, Ян; Ге, Рили; Вентилятор, Мин (2008). «Влияние гипоксии на экспрессию мРНК генов домашнего хозяйства в ткани мозга крысы и первичных культивируемых нервных клетках». Границы медицины в Китае. 2 (3): 239–243. Дои:10.1007 / s11684-008-0045-7. S2CID 85327763.
- ^ Campanella ME, Chu H, Low PS (февраль 2005 г.). «Сборка и регуляция комплекса гликолитических ферментов на мембране эритроцитов человека». Труды Национальной академии наук Соединенных Штатов Америки. 102 (7): 2402–7. Дои:10.1073 / pnas.0409741102. ЧВК 549020. PMID 15701694.
- ^ Сировер М.А. (декабрь 2014 г.). «Структурный анализ функционального разнообразия глицеральдегид-3-фосфатдегидрогеназы». Международный журнал биохимии и клеточной биологии. 57: 20–6. Дои:10.1016 / j.biocel.2014.09.026. ЧВК 4268148. PMID 25286305.
- ^ а б Кумар С., Шеоканд Н., Мхадешвар М.А., Радже С.И., Радже М. (январь 2012 г.). «Характеристика глицеральдегид-3-фосфатдегидрогеназы как нового рецептора трансферрина». Международный журнал биохимии и клеточной биологии. 44 (1): 189–99. Дои:10.1016 / j.biocel.2011.10.016. PMID 22062951.
- ^ Рамос Д., Пеллин-Карселен А., Агусти Дж., Мургуи А., Жорда Е., Пеллин А., Монтеагудо С. (январь 2015 г.). «Нарушение регуляции экспрессии глицеральдегид-3-фосфатдегидрогеназы во время опухолевой прогрессии меланомы кожи человека». Противораковые исследования. 35 (1): 439–44. PMID 25550585.
- ^ Ван Д., Мутхарт Д.Р., Лоуи Д.Р., Цянь X (2013). «Экспрессия генов связанного с глицеральдегид-3-фосфатдегидрогеназой клеточного цикла (GACC) коррелирует со стадией рака и плохой выживаемостью у пациентов с солидными опухолями». PLOS ONE. 8 (4): e61262. Дои:10.1371 / journal.pone.0061262. ЧВК 3631177. PMID 23620736.
- ^ Пхадке М, Крынецкая Н, Мишра А, Крынецкий Э (июль 2011). «Фенотип ускоренного клеточного старения GAPDH-истощенных клеток карциномы легких человека». Сообщения о биохимических и биофизических исследованиях. 411 (2): 409–15. Дои:10.1016 / j.bbrc.2011.06.165. ЧВК 3154080. PMID 21749859.
- ^ а б c Маццола Дж. Л., Сировер М. А. (октябрь 2002 г.). «Изменение внутриклеточной структуры и функции глицеральдегид-3-фосфатдегидрогеназы: общий фенотип нейродегенеративных нарушений?». Нейротоксикология. 23 (4–5): 603–9. Дои:10.1016 / s0161-813x (02) 00062-1. PMID 12428732.
- ^ Аллен М., Кокс С., Белбин О., Ма Л., Бишельо Г. Д., Уилкокс С. Л., Хауэлл С. К., Хантер Т. А., Калли О., Уолкер Л. П., Карраскильо М. М., Диксон Д. В., Петерсен Р. К., Графф-Рэдфорд Н. Р., Юнкин С. Г., Эртекин-Танер N (январь 2012 г.). «Ассоциация и гетерогенность в локусе GAPDH при болезни Альцгеймера». Нейробиология старения. 33 (1): 203.e25–33. Дои:10.1016 / j.neurobiolaging.2010.08.002. ЧВК 3017231. PMID 20864222.
- ^ Радже К.И., Кумар С., Харле А., Нанда Д.С., Радже М. (февраль 2007 г.). «Глицеральдегид-3-фосфатдегидрогеназа поверхности клеток макрофагов представляет собой новый рецептор трансферрина». Журнал биологической химии. 282 (5): 3252–61. Дои:10.1074 / jbc.M608328200. PMID 17121833.
- ^ Секретируемая многофункциональная глицеральдегид-3-фосфатдегидрогеназа секвестрирует лактоферрин и железо в клетки неканоническим путем. Анооп С. Чаухан, Пуджа Рават, Химаншу Малхотра, Навдип Шеоканд, Манодж Кумар, Анил Патидар, Сурбхи Чаудакхар, Прийянка. Радже и Манодж Радже, научные отчеты 5, 18465; DOI: 10.1038 / srep18465 (2015)
- ^ Уайт М.Р., Хан М.М., Дередж Д., Росс С.Р., Квинтин Р., Цуккони Б.Е., Высоцкий В.Х., Винтроде П.Л., Уилсон Г.М., Гарсин Е.Д. (январь 2015 г.). «Мутация интерфейса димера в глицеральдегид-3-фосфатдегидрогеназе регулирует его связывание с AU-богатой РНК». Журнал биологической химии. 290 (3): 1770–85. Дои:10.1074 / jbc.M114.618165. ЧВК 4340419. PMID 25451934.
дальнейшее чтение
- Воет Д., Воет Дж. Г. (2010). Биохимия. Нью-Йорк: Вили. ISBN 978-0-470-57095-1.
- Страйер Л., Берг Дж. М., Тимочко Дж. Л. (2002). Биохимия, пятое издание и лекционная тетрадь. Сан-Франциско: В. Х. Фриман. ISBN 978-0-7167-9804-0.
- Схема механизма реакции ГАФД из Lodish MCB на книжной полке NCBI
- аналогичная диаграмма из Альбертса Клетка на книжной полке NCBI
внешняя ссылка
- PDBe-KB предоставляет обзор всей структурной информации, доступной в PDB для глицеральдегид-3-фосфатдегидрогеназы человека
АТФ ADP АТФ ADP + + 2 ×  2 ×  2 × 3-фосфоглицерат 2 ×  2 × 2-фосфоглицерат 2 ×  2 × Фосфоенолпируват 2 ×  ADP АТФ 2 × Пируват 2 × |












