Йодирование гидразона - Hydrazone iodination
Йодирование гидразона является органическая реакция в котором гидразон превращается в винилйодид по реакции йод и ненуклеофильное основание, такое как DBU.[1][2] Впервые опубликовано Дерек Бартон в 1962 году реакцию иногда называют Реакция Бартона (хотя есть много разных реакций Бартона) или, более описательно, как Бартон-винил-йодная процедура.
Реакция имеет более ранние корни с открытием 1911 года Виландом и Розеу, что реакция гидразонов с одним йодом (без основания) приводит к азин димер (структура 2 в схема 1).
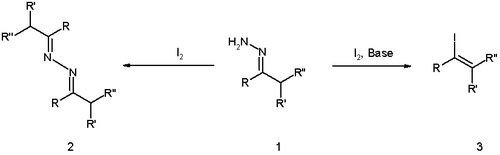
В оригинальной публикации Бартона[3] реакция была оптимизирована с помощью сильного гуанидин основание, обратное добавление гидразона к раствору йода и исключение воды.

Когда йод как электрофил заменяется на ароматный селенилбромиды, получаются соответствующие винилселениды:[4]

Механизм реакции
В механизм реакции предложенная в оригинальной публикации Бартона, изложена следующим образом:

Гидразон окисленный йодом в диазо средний. На следующем этапе йод вступает в реакцию как электрофил; вытеснение азота затем генерирует иодокарбоний ион. Когда место реакции не затруднено стерически, второй йодид может рекомбинировать с образованием близнец ди-йодид; в противном случае реакция элиминации приводит к винилиодиду. Когда присутствует вода, продукт реакции может вернуться в кетон.
Эта реакция связана с Реакция Шапиро.
Объем
Примером такой процедуры является реакция 2,2,6-триметилциклогексанон в гидразон реакцией с гидразин и триэтиламин в этиловый спирт в рефлюкс с последующей реакцией гидразона с йод в присутствии 2-трет-бутил-1,1,3,3-тетраметилгуанидин (дешевле DBU) в диэтиловый эфир в комнатная температура.[5] Другой пример можно найти в Полный синтез таксола Данишефского.
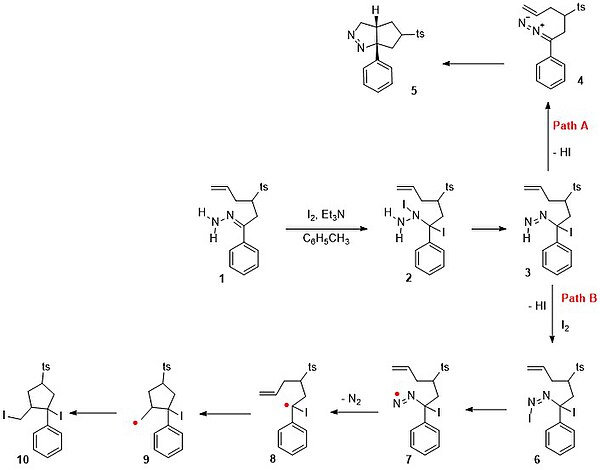
В одном исследовании[6] это попытка поймать любой реактивный промежуточный продукт этой реакции с внутренним алкен. Когда гидразон 1 в схема 5 реагирует с йодом и триэтиламин в толуол, ожидаемым продуктом реакции не является ди-йодид 10 через путь B в свободный радикал механизм. Последовательность реакций, начиная с 1: реакция присоединения галогена к ди-йодидному промежуточному соединению 2 с последующим реакция элиминации с потерей Йодистый водород к 3. На пути B другой эквивалент йода реагирует на двойную азо-связь с последующей потерей HI и образованием 6. Связь азота с йодом слабая и гомолиз дает азот свободный радикал 7. Потеря азота приводит к образованию радикалов 8. Положение радикала передается алкену в 9 который позже рекомбинирует с йодидом, чтобы 10. Обратите внимание, что в отсутствие алкена 8 примет иодидный радикал, и близнец ди-йодид затем теряет HI с образованием винилиодида. Фактический процесс - это путь A с устранение привет диазо сложный 4 за которым следует диазоалкан 1,3-диполярное циклоприсоединение к пиразолину 5 с доходностью 85%.
Рекомендации
- ^ Новая реакция гидразонов Бартон, Д. Х. Р. , Р. Э. О'Брайен и С. Стернхелл Журнал химического общества,1962, 470 - 476 Дои:10.1039 / JR9620000470 Абстрактный
- ^ Исследования окисления гидразонов йодом и фенилселененилбромидом в присутствии сильных органических оснований; улучшенная методика синтеза винилиодидов и фенилвинилселенидов Бартон, Д. Х. Р.; Bashiardes, G .; Фурри, Ж.-Л. Тетраэдр 1988, 44, 147 Абстрактный
- ^ Улучшенный препарат винилиодидов Дерек Х. Р. Бартон, Джордж Башиард и Жан-Луи Фурри Письма о тетраэдре Том 24, Выпуск 15, 1983, Страницы 1605-1608 Абстрактный
- ^ Новый синтез фенилвинилселенидов Дерек Х. Р. Бартон, Джордж Башиард и Жан-Луи Фурри Письма о тетраэдре Том 25, Выпуск 12, 1984, Страницы 1287-1290 Абстрактный
- ^ Получение и реакции 2-трет-бутил-1,1,3,3-тетраметилгуанидина: 2,2,6-триметилциклогексен-1-иодид Дерек Х. Р. Бартон, Ми Чен, Джозеф Ч. Ясбереньи и Деннис К. Тейлор Органический синтез, Сб. Vol. 9, стр.147 (1998); Vol. 74, стр.101 (1997) Статья В архиве 2005-11-17 на Wayback Machine
- ^ Наблюдения за реакцией гидразонов с йодом: перехват диазопродуктов Беатрис Куиклет-Отец и Самир З. Зард Химические коммуникации, 2006, 1831 - 1832 Абстрактный
