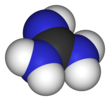
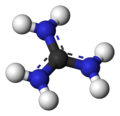
Гуанидин - Guanidine
| |||
| |||
| Имена | |||
|---|---|---|---|
| Имена ИЮПАК Гуанидин[1] Иминометандиамин | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 506044 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.003.656 | ||
| Номер ЕС |
| ||
| 100679 | |||
| MeSH | Гуанидин | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| CЧАС5N3 | |||
| Молярная масса | 59.072 г · моль−1 | ||
| Температура плавления | 50 ° С (122 ° F, 323 К) | ||
| бревно п | −1.251 | ||
| Кислотность (пKа) | 13.6 | ||
| Конъюгированная кислота | Гуанидиний | ||
| Термохимия | |||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | −57 - −55 кДж моль−1 | ||
Станд. Энтальпия горение (ΔcЧАС⦵298) | −1.0511 - −1.0531 МДж моль−1 | ||
| Фармакология | |||
| Фармакокинетика: | |||
| 7–8 часов | |||
| Опасности | |||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза ) | 475 мг / кг (перорально, крыса)[2] | ||
| Родственные соединения | |||
Родственные соединения | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Гуанидин представляет собой соединение формулы HNC (NH2)2. Это бесцветное твердое вещество, растворяющееся в полярных растворителях. Это сильная база который используется в производстве пластмассы и взрывчатка. Он находится в моча как нормальный продукт белка метаболизм. Гуанидин часть также появляется в более крупных органических молекулах, в том числе в боковой цепи аргинин.
Структура
Гуанидин можно рассматривать как азотистый аналог угольная кислота. То есть группа C = O в угольной кислоте заменяется группой C = NH, и каждая группа OH заменяется NH
2 группа.[3] Изобутилен можно рассматривать как углеродный аналог во многом таким же образом. Подробный кристаллографический анализ гуанидина был выяснен через 148 лет после его первого синтеза, несмотря на простоту молекулы.[4] В 2013 году положения атомов водорода и параметры их смещения были точно определены с помощью монокристаллической нейтронографии.[5]
Производство
Гуанидин можно получить из природных источников, сначала он был выделен Адольф Стрекер через деградацию гуанин.[6] Впервые он был синтезирован в 1861 году путем окислительного разложения ароматического природного продукта. гуанин, изолированный от перуанского гуано.[7]
Лабораторный метод получения гуанидина представляет собой щадящее (180-190 ° C) термическое разложение сухого тиоцианат аммония в безводных условиях:
Коммерческий путь включает двухэтапный процесс, начинающийся с реакции дициандиамид с аммоний соли. Через посредство бигуанидин, это аммонолиз стадия дает соли катиона гуанидиния (см. ниже). На втором этапе соль обрабатывают основанием, например метоксид натрия.[6]
Химия
Катион гуанидиния
С пKб 0,4 гуанидин является сильным основанием. Большинство производных гуанидина фактически представляют собой соли, содержащие конъюгированную кислоту.
В конъюгированная кислота называется гуанидиний катион, (C (NH
2)+
3). Этот плоский симметричный ион состоит из трех амино- группы, каждая из которых связана с центральным атомом углерода ковалентной связью порядок 4/3. Это очень стабильный +1 катион в водном растворе благодаря эффективному резонансная стабилизация заряда и эффективного сольватация молекулами воды. В результате его пKа составляет 13,6[8] это означает, что гуанидин является очень сильным основанием в воде; в нейтральной воде он существует почти исключительно в виде гуанидиния.
канонические формы
Тест на гуанидин
Гуанидин может быть выборочно обнаружен с помощью 1,2-нафтохинон-4-сульфоновой кислоты натрия (Реактив Фолина ) и подкисленной мочевины.[9]
Использует
Промышленность
Основная часть коммерческого интереса - это нитрат [C (NH
2)3]НЕТ
3. Он используется в качестве топлива, например в подушки безопасности.
Биохимия
Гуанидин существует в протонированном виде, как гуанидин, в растворе при физиологическом pH.
Гуанидиния хлорид (также известный как гидрохлорид гуанидина) имеет хаотропный свойства и используется для денатурирования белков. Хлорид гуанидиния, как известно, денатурирует белки с линейной зависимостью между концентрацией и свободная энергия разворачивания. В водных растворах, содержащих 6M гуанидиния хлорид, почти все белки потерять все вторичная структура и стать случайно свернутый пептидные цепи. Тиоцианат гуанидиния также используется для его денатурирующего действия на различные биологические образцы.
Гуанидиния хлорид[10] используется как адъювант в лечении ботулизм, введен в 1968 г.,[11] но теперь его роль считается спорным[12] - потому что у некоторых пациентов после приема этого препарата не было улучшения.
Другой
Гидроксид гуанидиния является активным ингредиентом некоторых не щелочных средства для расслабления волос.
Производные гуанидина
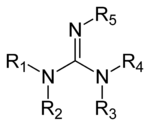
Гуанидины группа органические соединения разделяя общий функциональная группа с общей структурой (Р
1р
2N) (R
3р
4N) C = N − R
5. Центральная связь в этой группе - связь я добываю, а группа структурно связана с амидинами и мочевинами. Примеры гуанидинов: аргинин, триазабициклодецен, сакситоксин, и креатин.
Галегин представляет собой изоамиленгуанидин.[13]
Смотрите также
- Категория: Гуанидины
- Тест Сакагути
- Y-ароматичность
- Амидин
Рекомендации
- ^ «Гуанидин - Резюме соединения». PubChem Compound. США: Национальный центр биотехнологической информации. 16 сентября 2004 г. Опознание.. Получено 29 февраля 2012.
- ^ «Гуанидин гидрохлорид». ChemIDplus. Национальная медицинская библиотека.
- ^ Goebel, M .; Клапоэтке, Т. М. (2007). «Первая структурная характеристика гуанидина». Chem. Сообщество. 43 (30): 3180–2. Дои:10.1039 / B705100J. PMID 17653381.
- ^ Yamada, T .; Лю, X .; Englert, U .; Yamane, H .; Дронсковски, Р. (2009). «Наконец-то достигнута твердотельная структура свободного основания гуанидина». Chem. Евро. J. 15 (23): 5651–5. Дои:10.1002 / chem.200900508. PMID 19388036.
- ^ Савински, П. К .; Meven, M .; Englert, U .; Дронсковски, Р. (2013). "Монокристаллическое нейтронографическое исследование гуанидина, CN3ЧАС5". Cryst. Рост Des. 13 (4): 1730–5. Дои:10.1021 / cg400054k.
- ^ а б Гютнер, Томас; Мерченк, Бернд; Шульц, Бернд. «Гуанидин и производные». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a12_545.pub2.
- ^ Стрекер, А. (1861). "Untersuchungen über die chemischen Beziehungen zwischen Guanin, Xanthin, Theobromin, Caffeïn und Kreatinin" [Исследования химических взаимоотношений между гуанином, ксантином, теобромином, кофеином и креатинином]. Liebigs Ann. Chem. 118 (2): 151–177. Дои:10.1002 / jlac.18611180203.
- ^ Перрин, Д. Д. (1972). Константы диссоциации органических оснований в водном растворе. (Дополнение под ред.). Лондон: Баттервортс..
- ^ Салливан, М. X. (1935-10-01). «Колориметрический тест на гуанидин». Труды Общества экспериментальной биологии и медицины. 33 (1): 106–108. Дои:10.3181 / 00379727-33-8270C. ISSN 0037-9727. S2CID 88290359.
- ^ Каплан, Дж. Э .; Дэвис, Л. Э .; Нараян, В .; Koster, J .; Каценштейн, Д. (1979). «Ботулизм типа А и лечение гуанидином». Анналы неврологии. 6 (1): 69–71. Дои:10.1002 / ana.410060117. PMID 389150. S2CID 42901888.
- ^ Пуджиари, Марчелло; Черингтон, Майкл (1978). «Ботулизм и гуанидин: десять лет спустя». Варенье. Med. Assoc. 240 (21): 2276–7. Дои:10.1001 / jama.1978.03290210058027. PMID 702753.
- ^ Брук, Ицхак (2001). Детские анаэробные инфекции: диагностика и лечение (3-е изд.). Тейлор и Фрэнсис. п. 529. ISBN 0824741862.
- ^ Виттерс, Л. А. (2001). «Цветение французской сирени». Журнал клинических исследований. 108 (8): 1105–7. Дои:10.1172 / JCI14178. ЧВК 209536. PMID 11602616.