Основные белки мочи - Major urinary proteins

Основные белки мочи (Mups), также известный как α2у-глобулины, площадь подсемейство белков, содержащихся в изобилии в моча и другие выделения многих животных. Mups предоставляют небольшой диапазон идентифицирующей информации о животном-доноре при обнаружении вомероназальный орган животного-получателя. Они принадлежат к большему семья белков, известных как липокалины. Mups кодируются кластер генов, расположенных рядом друг с другом на одном участке ДНК, количество которых сильно различается у разных видов: от как минимум 21 функционального гена у мышей до ни одного у человека. Белки Mup образуют характерный перчатка форма, охватывающая лиганд - карман для переплета, в который помещаются небольшие органические химикаты.
Белки в моче были впервые обнаружены у грызунов в 1932 году во время исследований Томас Аддис в дело протеинурия. Они сильные люди аллергены и в значительной степени ответственны за ряд аллергия на животных, в том числе кошкам, лошадям и грызунам. Их эндогенный функция внутри животного неизвестна, но может включать регулирование расхода энергии. Однако, как секретируемые белки, они играют множество ролей в химической коммуникации между животными, функционируя как феромон переносчики и стабилизаторы у грызунов и свиней. Мупы также могут действовать как белковые феромоны. Было продемонстрировано, что они продвигают агрессия у самцов мышей, и один специфический белок Mup, обнаруженный в моче самцов мышей, сексуально привлекателен для самок мышей. Mups также может функционировать как сигналы между разными видами: мыши проявляют инстинктивную реакцию страха при обнаружении Mups, полученных от хищников, таких как кошки и крысы.
Открытие

Люди с хорошим здоровьем выделяют мочу, в значительной степени не содержащую белка. Поэтому с 1827 года медики и ученые интересовались протеинурия, избыток белка в моче человека, как индикатор заболевание почек.[примечания 1][2] Чтобы лучше понять этиология протеинурии, некоторые ученые попытались изучить это явление в лабораторные животные.[3] Между 1932 и 1933 гг. Ряд ученых, в том числе Томас Аддис, независимо сообщили об удивительном открытии, что у некоторых здоровых грызунов есть белок в моче.[4][5][6] Однако только в 1960-х годах были впервые подробно описаны основные белки мочи мышей и крыс.[7][8] Было обнаружено, что белки в основном производятся в печень мужчин и секретируется через почки в мочу в большом количестве (миллиграммы в сутки).[7][8][9]
С момента своего названия было обнаружено, что белки по-разному экспрессируются в других железы которые выделяют продукты непосредственно во внешнюю среду. К ним относятся слезный, околоушный, подчелюстной, сублингвальный, препуциальный и молочная железа железы.[10][11][12] У некоторых видов, таких как кошки и свиньи, слизистые оболочки вообще не экспрессируются в моче и в основном обнаруживаются в слюне.[13][14] Иногда термин мочевые пузыри (uMups) используется для того, чтобы отличить слизистые оболочки, выраженные в моче, от таковых в других тканях.[15]
Mup гены
Между 1979 и 1981 годами было подсчитано, что Mups кодируются генная семья от 15 до 35 генов и псевдогены у мышей и примерно 20 генами у крысы.[16][17][18] В 2008 году более точное количество генов Mup у ряда видов было определено путем анализа Последовательность ДНК всего геномы.[1][19]
Грызунов

Мышь эталонный геном имеет как минимум 21 отдельный ген Mup (с открытые рамки для чтения ) и еще 21 псевдоген Mup (с рамки чтения нарушен бессмысленная мутация или неполный дупликация гена ). Все они сгруппированы вместе, выстроены бок о бок по 1.92 мегабазы ДНК на хромосоме 4. 21 функциональный ген был разделен на два подкласса в зависимости от положения и сходства последовательностей: 6 периферических Шапки класса А и 15 центральных Шапки класса B.[1][20] Центральный кластер генов Mup класса B сформирован за счет ряда последовательные дупликации от одного из Mups класса А. Поскольку все гены класса B почти идентичны друг другу, исследователи пришли к выводу, что эти дупликации произошли совсем недавно в эволюции мышей. Действительно, повторяющаяся структура этих центральных генов Mup означает, что они, вероятно, будут нестабильными и могут варьироваться в количестве среди диких мышей.[20] Mups класса A больше отличаются друг от друга и, следовательно, вероятно, будут более стабильными, старыми генами, но какие функциональные различия, если таковые имеются, неизвестны.[1] Сходство между генами затрудняет изучение региона с помощью современная технология секвенирования ДНК. Следовательно, кластер генов Mup - одна из немногих частей мышиных последовательность всего генома с оставшимися пробелами, и другие гены могут остаться неоткрытыми.[1][20]
Моча крысы также содержит гомологичный белки мочи; хотя изначально им было дано другое название, α2ты-глобулины,[8][9] с тех пор они стали известны как крысиные шкуры.[21][22] У крыс есть 9 различных генов Mup и еще 13 псевдогенов, сгруппированных вместе в 1,1 мегабаз ДНК на хромосоме 5. Как и у мышей, кластер образован множественными дупликациями. Однако это произошло независимо от дупликаций у мышей, а это означает, что оба вида грызунов расширили свои семейства генов Mup. отдельно, но параллельно.[1][23]
Негрызуны
Большинство других изученных млекопитающих, включая свинью, корову, кошку, собаку, детеныша, макаку, шимпанзе и орангутанга, имеют единственный ген Mup. Некоторые, однако, имеют расширенное число: лошади имеют три гена Mup и лемуры серые мыши есть как минимум два. Насекомые, рыбы, земноводные, птицы и сумчатые похоже, нарушил синтения в хромосомном положении кластера генов Mup, предполагая, что семейство генов может быть специфическим для плацентарных млекопитающих.[1] Люди - единственные плацентарные млекопитающие не обнаружено никаких активных генов Mup; вместо этого у них есть единственный псевдоген Mup, содержащий мутацию, которая вызывает ошибочное совпадение, делая его дисфункциональным.[1]
Функция
Транспортные белки
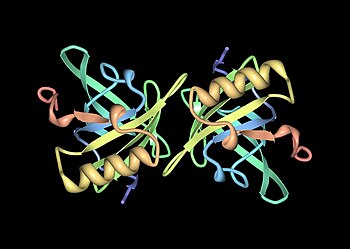
Мупы - члены большой семьи малообеспеченныхмолекулярный вес (~19 кДа ) белки, известные как липокалины.[25] У них есть характерная структура из восьми бета-листы организовано в антипараллельный бета-ствол открытый с одной стороны, с альфа спирали на обоих концах.[25] Следовательно, они образуют характерную форму перчаток, охватывающую чашеобразный карман который связывает небольшие органические химические вещества с высоким сродством.[1][26] Некоторые из этих лигандов связываются с Mups мыши, включая 2-втор-бутил-4,5-дигидротиазол (сокращенно SBT или DHT), 6-гидрокси-6-метил-3-гептанон (HMH) и 2,3-дигидро-экзобревикомин (DHB).[27][28][29] Все это химические вещества, специфичные для мочи, которые, как было показано, действуют как феромоны - молекулярные сигналы, выделяемые одним человеком, которые запускают врожденный поведенческий ответ у другого представителя того же вида.[27][30] Мышиные муфты также действуют как стабилизаторы феромонов, обеспечивая механизм медленного высвобождения, который увеличивает эффективность летучих феромонов у мужчин. следы запаха мочи.[31] Учитывая разнообразие Mups у грызунов, первоначально считалось, что разные Mups могут иметь связывающие карманы разной формы и, следовательно, связывать разные феромоны. Однако подробные исследования показали, что большинство переменные сайты расположены на поверхности белков и, по-видимому, мало влияют на связывание лиганда.[32]
Rat Mups связывает различные мелкие химические вещества. Самый распространенный лиганд - 1-хлордекан, с 2-метил-N-фенил-2-пропенамид, гексадекан и 2,6,11-триметилдекан оказался менее заметным.[33] Rat Mups также связывают лимонен -1,2-эпоксид, приводящий к заболеванию почек хозяина, гиалиновый -капелька нефропатия, что прогрессирует до рака. У других видов это заболевание не развивается, потому что их слизистые не связывают это конкретное химическое вещество.[34] Соответственно, когда трансгенные мыши были сконструированы для экспрессии Mup крыс, у них развилась болезнь почек.[35]Муп, найденный у свиней, назван липокалин слюны (SAL), экспрессируется в слюнных железах мужчин, где они прочно связываются андростенон и андростенол, оба феромона, которые заставляют самок свиней принимать брачная позиция.[1][14]
Изотермическая калориметрия титрования исследования, проведенные с Mups и связанными лигандами (пиразины,[36][37] спирты,[38][39] тиазолины,[40][28] 6-гидрокси-6-метил-3-гептанон,[41] и N-фенилнафтиламин,[42][43]) обнаружил необычный связывающий феномен. В активный сайт было обнаружено, что гидратация ниже оптимальной, что приводит к связыванию лиганда за счет энтальпийный рассеивающие силы. Это противоречит большинству других белков, которые проявляют энтропия -приводимые связывающие силы от реорганизации молекулы воды. Этот необычный процесс получил название неклассический гидрофобный эффект.[43]
Феромоны

Исследования были направлены на определение точной функции Mups в связи с феромонами. Было показано, что белки Mup способствуют половое созревание и ускорить цикл течки у самок мышей, вызывая Vandenbergh и Эффекты Уиттена.[38][44] Однако в обоих случаях слизистые оболочки должны были быть представлены женщине, растворенной в мужской моче, что указывает на то, что белок требует определенного контекста мочи для функционирования. В 2007 году слизи, обычно обнаруживаемые в моче самцов мышей, производили в трансгенные бактерии, и поэтому созданы без химических веществ, которые они обычно связывают. Было показано, что этих Mups достаточно для продвижения агрессивный поведение у мужчин даже при отсутствии мочи.[19] Кроме того, было обнаружено, что слизистые оболочки, созданные из бактерий, активируют обонятельные сенсорные нейроны в вомероназальном органе (VNO), подсистеме носа, которая, как известно, обнаруживает феромоны через определенные Рецепторы чувств, мышей и крыс.[19][45] Вместе это продемонстрировало, что белки Mup могут действовать как феромоны, независимо от своих лигандов.[46]

В соответствии с ролью в агрессии самцов, взрослые самцы мышей выделяют в мочу значительно больше Mups, чем самки, молодые особи или самцы. кастрированный самцы мышей. Точный механизм, управляющий этим разница между полами сложный, но как минимум три гормона -тестостерон, гормон роста и тироксин - известно, что они положительно влияют на выработку Mups у мышей.[47] Дикий домовая мышь моча содержит различные комбинации от четырех до семи различных белков Mup на мышь.[48] Немного инбредные линии лабораторных мышей, Такие как BALB / c и C57BL / 6, также имеют разные белки, выраженные в моче.[20] Однако, в отличие от диких мышей, разные особи из одного и того же штамма экспрессируют один и тот же белковый паттерн, артефакт многих поколений. инбридинг.[49][50] Один необычный Mup менее изменчив, чем другие: он постоянно продуцируется большой долей диких мышей-самцов и почти никогда не обнаруживается в моче самок. Когда этот Mup был создан в бактериях и использован в поведенческих тестах, было обнаружено, что он привлекает самок мышей. Другие Mup были протестированы, но не обладали такими же привлекательными качествами, что позволяет предположить, что Mup действует как половой феромон.[51] Ученые назвали это Mup дарцин (Mup20, Q5FW60) в качестве юмористической ссылки на Фицуильям Дарси, то романтический герой из Гордость и предубеждение.[52][53] Взятые вместе, сложные образцы производимых Mups могут предоставить различную информацию о животном-доноре, например Пол, плодородие, социальное превосходство, возраст, генетическое разнообразие или же родство.[19][54][55] Дикие мыши (в отличие от лабораторных мышей, которые генетически идентичны и, следовательно, также имеют идентичные образцы Mups в моче) имеют индивидуальные образцы экспрессии Mup в моче, которые действуют как "штрих-код «для однозначной идентификации владельца ароматической марки.[54]
У домашней мыши основной кластер генов MUP обеспечивает высокополиморфный ароматический сигнал генетической идентичности. Дикие мыши, свободно размножающиеся в полуестественных вольерах, показали избегание инбридинга. Это избегание было результатом сильного дефицита успешных спариваний между мышами, имеющими оба гаплотипа MUP (полное совпадение).[56] В другом исследовании с использованием белоногих мышей было обнаружено, что когда мышей, происходящих из диких популяций, были инбредными, выживаемость снижалась, когда таких мышей повторно вводили в естественную среду обитания.[57] Эти данные свидетельствуют о том, что инбридинг снижает приспособленность и что распознавание запаховых сигналов развилось у мышей как средство предотвращения инбридинговая депрессия.
Кайромоны
Помимо того, что они служат социальными сигналами между представителями одного вида, Mups могут действовать как кайромоны - химические сигналы, передающие информацию между видами.[58][59][60] Мыши инстинктивно боятся запаха своей естественной хищники, в том числе кошек и крыс. Это происходит даже у лабораторных мышей, которые были изолированы от хищников на протяжении сотен поколений.[61] Когда химические сигналы, ответственные за страх ответ был очищен от слюны кошки и мочи крысы, были идентифицированы два сигнала гомологичных белков: Fel d 4 (Felis domesticus аллерген 4; Q5VFH6), продукт кота Mup ген и Крыса n 1 (Раттус норвегикус аллерген 1; P02761), продукт крысы Mup13 ген.[59] Мыши боятся этих мук, даже если они созданы бактериями, но животные-мутанты, которые не могут обнаружить мук, не проявляют страха перед крысами, что демонстрирует их важность в инициировании пугающего поведения.[58][62] Неизвестно, как именно Mups разных видов инициируют разное поведение, но было показано, что Mups мышей и Mups-хищников активируют уникальные паттерны сенсорных нейронов в носу мышей-реципиентов. Это означает, что мышь воспринимает их по-разному, через различные нейронные цепи.[58][59] В рецепторы феромона ответственные за обнаружение Mup также неизвестны, хотя они считаются членами Рецептор V2R учебный класс.[19][59]
Аллергены
Наряду с другими членами семейства белков липокалина, основные белки мочи могут быть сильными аллергенами для людей.[64] Причина этого не известна; тем не мение, молекулярная мимикрия между Mups и структурно подобными липокалинами человека было предложено в качестве возможного объяснения.[65] Белковый продукт мыши Mup6 и Mup2 гены (ранее ошибочно принимавшиеся за Mup17 из-за сходства между MUP мыши), известный как Mus m 1, Ag1 или MA1,[66] составляет большую часть аллергенных свойств мочи мышей.[1][67] Белок чрезвычайно устойчив в окружающей среде; исследования показали, что 95% домов в центральной части города и 82% домов всех типов в Соединенных Штатах имеют обнаруживаемые уровни по крайней мере в одной комнате.[68][69] Точно так же Крыса № 1 является известным аллергеном человека.[64] Исследование, проведенное в США, обнаружило его присутствие в 33% домов в центральной части города, и 21% жителей были чувствительны к аллергену.[70] Воздействие и сенсибилизация к белкам Mup грызунов считается фактором риска для детства астма и является основной причиной аллергия на лабораторных животных (LAA) - профессиональное заболевание лабораторное животное техники и ученые.[71][72][73][74] Одно исследование показало, что две трети лабораторных работников, у которых развились астматические реакции на животных, имели антитела Крысе №1.[75]
Mup гены других млекопитающих также кодируют аллергенные белки, например, Fel d 4 в основном продуцируется в поднижнечелюстная слюнная железа и размещается на перхоть как кошка ухаживает за собой. Исследование показало, что 63% кошка аллергия у людей есть антитела против белка. У большинства было выше титры антител против Fel d 4, чем против Fel d 1, еще один известный кошачий аллерген.[13] Так же, Equ c 1 (Equus caballus аллерген 1; Q95182) является белковым продуктом лошади Mup ген, который находится в печени, подъязычных и подчелюстных слюнных железах.[1][76] Он отвечает за около 80% реакции антител у пациентов, которые хронически подвергаются воздействию аллергенов лошади.[76]
Метаболизм
В то время как обнаружение слизи, выделяемой другими животными, хорошо изучено, ее функциональная роль в организме продуцента менее ясна. Однако в 2009 году было показано, что Mups связан с регулированием расхода энергии у мышей. Ученые обнаружили, что мыши с генетическим ожирением и диабетом производят в тридцать раз меньше Mup. РНК чем их тощие братья и сестры.[77] Когда они доставляли белок Mup непосредственно в кровоток этих мышей, они наблюдали увеличение расхода энергии, физической активности и температуры тела и соответствующее снижение непереносимость глюкозы и резистентность к инсулину. Они предполагают, что благотворное влияние Mups на энергетический метаболизм происходит за счет увеличения митохондриальный функция скелетных мышц.[77] Другое исследование показало, что у мышей с ожирением, вызванным диетой, было меньше шишек. В этом случае присутствие Mups в кровотоке мышей ограничивало выработку глюкозы за счет прямого ингибирования экспрессия генов в печени.[78]
Смотрите также
- Цис-вакценилацетат, феромон агрессии насекомых
- Главный комплекс гистосовместимости, пептиды также участвуют в индивидуальном распознавании у мышей
- Белки, производимые и секретируемые печенью
Примечания
- ^ В том году Ричард Брайт первое заболевание почек, позднее получившее название Болезнь Брайта, с белковый моча.
Рекомендации
- ^ а б c d е ж грамм час я j k л Логан Д.В., Мартон Т.Ф., Стоуэрс Л. (сентябрь 2008 г.). «Видовая специфичность основных белков мочи в результате параллельной эволюции». PLOS ONE. 3 (9): e3280. Bibcode:2008PLoSO ... 3,3280 л. Дои:10.1371 / journal.pone.0003280. ЧВК 2533699. PMID 18815613.
- ^ Comper WD, Hilliard LM, Nikolic-Paterson DJ, Russo LM (декабрь 2008 г.). «Болезнезависимые механизмы альбуминурии». Американский журнал физиологии. Почечная физиология. 295 (6): F1589-600. Дои:10.1152 / ajprenal.00142.2008. PMID 18579704.
- ^ Лемли К.В., Полинг Л. (1994). "Томас Аддис: 1881–1949". Биографические воспоминания Национальной академии наук. 63: 1–46.
- ^ Аддис Т (1932). «Протеинурия и цилиндрурия». Труды Калифорнийской академии наук. 2: 38–52.
- ^ Bell ME (сентябрь 1933 г.). «Альбуминурия у нормальных крыс-самцов». Журнал физиологии. 79 (2): 191–3. Дои:10.1113 / jphysiol.1933.sp003040. ЧВК 1394952. PMID 16994453.
- ^ Парфентьев И.А., Перльцвейг В.А. (1933). «Состав мочи белых мышей». Журнал биологической химии. 100 (2): 551–55.
- ^ а б Finlayson JS, Asofsky R, Potter M, Runner CC (август 1965 г.). «Основные белковые комплексы мочи нормальных мышей: происхождение». Наука. 149 (3687): 981–2. Bibcode:1965 г., наука ... 149..981F. Дои:10.1126 / science.149.3687.981. PMID 5827345. S2CID 23007588.
- ^ а б c Рой А.К., Нойгауз О.В. (март 1966 г.). «Идентификация белков мочи крыс зонным и иммуноэлектрофорезом». Труды Общества экспериментальной биологии и медицины. 121 (3): 894–9. Дои:10.3181/00379727-121-30917. PMID 4160706. S2CID 41096617.
- ^ а б Рой А.К., Нойгауз О.В. (сентябрь 1966 г.). «Доказательство печеночного синтеза зависимого от пола белка у крысы». Biochimica et Biophysica Acta. 127 (1): 82–7. Дои:10.1016/0304-4165(66)90478-8. PMID 4165835.
- ^ Held WA, Gallagher JF (апрель 1985 г.). «Экспрессия мРНК альфа 2u-глобулина крысы в препуциальной железе». Биохимическая генетика. 23 (3–4): 281–90. Дои:10.1007 / BF00504325. PMID 2409959. S2CID 25646065.
- ^ Губиц Р.М., Линч К.Р., Кулькарни А.Б., Долан К.П., Гресик Е.В., Холландер П., Фейгельсон П. (октябрь 1984 г.). «Дифференциальная регуляция экспрессии гена альфа 2u глобулина в печени, слезной и слюнной железах». Журнал биологической химии. 259 (20): 12803–9. PMID 6208189.
- ^ Шахан К., Денаро М., Гилмартин М., Ши И., Дерман Э. (май 1987 г.). «Экспрессия шести основных генов белка в моче мыши в молочных, околоушных, подъязычных, подчелюстных и слезных железах и в печени». Молекулярная и клеточная биология. 7 (5): 1947–54. Дои:10.1128 / MCB.7.5.1947. ЧВК 365300. PMID 3600653.
- ^ а б Смит В., Батлер А.Дж., Хейзелл Л.А., Чепмен М.Д., Помес А., Никелс Д.Г., Томас В.Р. (ноябрь 2004 г.). «Fel d 4, кошачий аллерген липокалина». Клиническая и экспериментальная аллергия. 34 (11): 1732–8. Дои:10.1111 / j.1365-2222.2004.02090.x. PMID 15544598. S2CID 20266013.
- ^ а б Лоебель Д., Скалони А., Паолини С., Фини С., Феррара Л., Брер Х., Пелоси П. (сентябрь 2000 г.). «Клонирование, посттрансляционные модификации, гетерологичная экспрессия и связывание лиганда липокалина слюны хряка». Биохимический журнал. 350 Pt 2 (Pt 2): 369–79. Дои:10.1042/0264-6021:3500369. ЧВК 1221263. PMID 10947950.
- ^ Бейнон Р. Дж., Херст Дж. Л. (февраль 2003 г.). «Множественные роли основных белков мочи в домашней мыши Mus domesticus». Сделки биохимического общества. 31 (Пт 1): 142–6. Дои:10.1042 / BST0310142. PMID 12546672.
- ^ Курц Д.Т. (1981). «Крысиный альфа-2u-глобулин кодируется мультигенным семейством». Журнал молекулярной и прикладной генетики. 1 (1): 29–38. PMID 6180115.
- ^ Хасти Н.Д., Хелд Вашингтон, Тул Дж.Дж. (июнь 1979 г.). «Множественные гены, кодирующие основные регулируемые андрогеном белки мочи мышей». Клетка. 17 (2): 449–57. Дои:10.1016/0092-8674(79)90171-5. PMID 88267. S2CID 20636057.
- ^ Епископ Дж. О., Кларк А. Дж., Клиссолд П. М., Хейни С., Франк У. (1982). «Две основные группы генов основных белков мочи мышей, обе в основном расположены на хромосоме 4». Журнал EMBO. 1 (5): 615–20. Дои:10.1002 / j.1460-2075.1982.tb01217.x. ЧВК 553096. PMID 6329695.
- ^ а б c d е Чамеро П., Мартон Т.Ф., Логан Д.В., Фланаган К., Круз Дж. Р., Сагателиан А. и др. (Декабрь 2007 г.). «Идентификация белковых феромонов, способствующих агрессивному поведению». Природа. 450 (7171): 899–902. Bibcode:2007Натура.450..899C. Дои:10.1038 / природа05997. PMID 18064011. S2CID 4398766.
- ^ а б c d е Мадж Дж. М., Армстронг С. Д., Макларен К., Бейнон Р. Дж., Херст Дж. Л., Николсон С. и др. (2008). «Динамическая нестабильность семейства генов основных белков мочи, выявленная путем геномных и фенотипических сравнений мышей линий C57 и 129». Геномная биология. 9 (5): R91. Дои:10.1186 / gb-2008-9-5-r91. ЧВК 2441477. PMID 18507838.
- ^ Херст Дж, Бейнон Р.Дж., Робертс С.К., Вятт Т.Д. (2007). Липокалины в моче у Rodenta: есть ли общая модель?. Химические сигналы у позвоночных 11. Springer New York. ISBN 978-0-387-73944-1.
- ^ Cavaggioni A, Mucignat-Caretta C (октябрь 2000 г.). «Основные белки мочи, альфа (2U) -глобулины и афродизин». Biochimica et Biophysica Acta (BBA) - Структура белка и молекулярная энзимология. 1482 (1–2): 218–28. Дои:10.1016 / S0167-4838 (00) 00149-7. PMID 11058763.
- ^ Макфадьен Д.А., Эддисон В., Локк Дж. (Май 1999 г.). «Геномная организация крысиного кластера генов альфа 2u-глобулина». Геном млекопитающих. 10 (5): 463–70. Дои:10.1007 / s003359901024. PMID 10337619. S2CID 1121039.
- ^ Böcskei Z, Groom CR, Flower DR, Wright CE, Phillips SE, Cavaggioni A и др. (Ноябрь 1992 г.). «Связывание феромона с двумя белками мочи грызунов, выявленное с помощью рентгеновской кристаллографии». Природа. 360 (6400): 186–8. Bibcode:1992Натура.360..186Б. Дои:10.1038 / 360186a0. PMID 1279439. S2CID 4362015.
- ^ а б Цветок DR (август 1996 г.). «Семейство белков липокалина: структура и функции». Биохимический журнал. 318 (Pt 1) (1): 1–14. Дои:10.1042 / bj3180001. ЧВК 1217580. PMID 8761444.
- ^ Ганфорнина, доктор медицины, Гутьеррес Г., Бастиани М., Санчес Д. (январь 2000 г.). «Филогенетический анализ семейства белков липокалина». Молекулярная биология и эволюция. 17 (1): 114–26. Дои:10.1093 / oxfordjournals.molbev.a026224. PMID 10666711.
- ^ а б Хальперн М., Мартинес-Маркос А. (июнь 2003 г.). «Структура и функции вомероназальной системы: обновленная информация» (PDF). Прогресс в нейробиологии. 70 (3): 245–318. Дои:10.1016 / S0301-0082 (03) 00103-5. PMID 12951145. S2CID 31122845.
- ^ а б Тимм Д.Е., Бейкер Л.Дж., Мюллер Х., Зидек Л., Новотный М.В. (май 2001 г.). «Структурная основа связывания феромона с основным белком мочи мыши (MUP-I)». Белковая наука. 10 (5): 997–1004. Дои:10.1110 / л.с. 52201. ЧВК 2374202. PMID 11316880.
- ^ Армстронг С.Д., Робертсон Д.Х., Читем С.А., Херст Дж.Л., Бейнон Р.Дж. (октябрь 2005 г.). «Структурные и функциональные различия в изоформах основных белков мочи мышей: специфический для мужчин белок, который предпочтительно связывает мужской феромон». Биохимический журнал. 391 (Pt 2): 343–50. Дои:10.1042 / BJ20050404. ЧВК 1276933. PMID 15934926.
- ^ Стоуэрс Л., Мартон Т.Ф. (июнь 2005 г.). «Что такое феромон? Пересмотр феромонов млекопитающих». Нейрон. 46 (5): 699–702. Дои:10.1016 / j.neuron.2005.04.032. PMID 15924856. S2CID 9354126.
- ^ Херст Дж. Л., Робертсон Д. Х., Толладей Ю., Бейнон Р. Дж. (Май 1998 г.). «Белки в метках запаха мочи самцов домашних мышей увеличивают продолжительность обонятельных сигналов». Поведение животных. 55 (5): 1289–97. Дои:10.1006 / anbe.1997.0650. PMID 9632512. S2CID 9879771.
- ^ Дарвиш Мари А., Веггерби С., Робертсон Д.Х., Гаскелл С.Дж., Хаббард С.Дж., Мартинсен Л. и др. (Февраль 2001 г.). «Влияние полиморфизма на связывание лиганда основными белками мочи мышей». Белковая наука. 10 (2): 411–7. Дои:10.1110 / пс 31701. ЧВК 2373947. PMID 11266626.
- ^ Раджкумар Р., Илаяраджа Р., Муцигнат С., Каваггиони А., Арчунан Г. (август 2009 г.). «Идентификация альфа2u-глобулина и связанных летучих веществ у индийской обыкновенной домашней крысы (Rattus rattus)». Индийский журнал биохимии и биофизики. 46 (4): 319–24. PMID 19788064.
- ^ Lehman-McKeeman LD, Caudill D (февраль 1992 г.). «Биохимическая основа устойчивости мышей к нефропатии гиалиновых капель: отсутствие значимости суперсемейства белков альфа 2u-глобулина в этом специфическом для самцов крыс синдроме». Токсикология и прикладная фармакология. 112 (2): 214–21. Дои:10.1016 / 0041-008X (92) 90190-4. PMID 1371614.
- ^ Lehman-McKeeman LD, Caudill D (ноябрь 1994 г.). «d-лимонен индуцировал нефропатию капель гиалина у трансгенных мышей с альфа 2u-глобулином». Фундаментальная и прикладная токсикология. 23 (4): 562–8. Дои:10.1006 / faat.1994.1141. PMID 7532604.
- ^ Bingham RJ, Findlay JB, Hsieh SY, Kalverda AP, Kjellberg A, Perazzolo C, et al. (Февраль 2004 г.). «Термодинамика связывания 2-метокси-3-изопропилпиразина и 2-метокси-3-изобутилпиразина с основным белком мочи». Журнал Американского химического общества. 126 (6): 1675–81. Дои:10.1021 / ja038461i. PMID 14871097.
- ^ Barratt E, Bingham RJ, Warner DJ, Laughton CA, Phillips SE, Homans SW (август 2005 г.). «Ван-дер-ваальсовы взаимодействия доминируют над ассоциацией лиганд-белок в сайте связывания белка, закрытом от воды растворителя». Журнал Американского химического общества. 127 (33): 11827–34. Дои:10.1021 / ja0527525. PMID 16104761.
- ^ а б Mucignat-Caretta C, Caretta A, Cavaggioni A (июль 1995 г.). «Ускорение наступления полового созревания самок мышей за счет белков мочи самцов». Журнал физиологии. 486 (Pt 2) (Pt 2): 517–22. Дои:10.1113 / jphysiol.1995.sp020830. ЧВК 1156539. PMID 7473215.
- ^ Малхэм Р., Джонстон С., Бингем Р. Дж., Баррат Э., Филлипс С.Е., Лоутон, Калифорния, Хоманс, SW (декабрь 2005 г.). «Сильные дисперсионные взаимодействия растворенного вещества в комплексе белок-лиганд». Журнал Американского химического общества. 127 (48): 17061–7. Дои:10.1021 / ja055454g. PMID 16316253.
- ^ Шарроу С.Д., Новотный М.В., Стоун М.Дж. (май 2003 г.). «Термодинамический анализ связывания между основным белком мочи мышей-I и феромоном 2-втор-бутил-4,5-дигидротиазолом». Биохимия. 42 (20): 6302–9. Дои:10.1021 / bi026423q. PMID 12755635.
- ^ Шарроу С.Д., Эдмондс К.А., Гудман М.А., Новотный М.В., Стоун М.Дж. (январь 2005 г.). «Термодинамические последствия разрушения сети водородных связей, опосредованной водой, в комплексе белок: феромон». Белковая наука. 14 (1): 249–56. Дои:10.1110 / пс 04912605. ЧВК 2253314. PMID 15608125.
- ^ Pertinhez TA, Ferrari E, Casali E, Patel JA, Spisni A., Smith LJ (декабрь 2009 г.). «Полость связывания основного белка мочи мыши оптимизирована для различных способов связывания лиганда». Сообщения о биохимических и биофизических исследованиях. 390 (4): 1266–71. Дои:10.1016 / j.bbrc.2009.10.133. PMID 19878650.
- ^ а б Homans SW (июль 2007 г.). «Вода, вода везде - кроме там, где это важно?». Открытие наркотиков сегодня. 12 (13–14): 534–9. Дои:10.1016 / j.drudis.2007.05.004. PMID 17631247.
- ^ Marchlewska-koj A, Caretta A, Mucignat-Caretta C, Olejniczak, P (2000). «Стимуляция течки у самок мышей белками мочи самцов». Журнал химической экологии. 26 (10): 2355–65. Дои:10.1023 / А: 1005578911652. S2CID 9181177.
- ^ Кригер Дж., Шмитт А., Лёбель Д., Гудерманн Т., Шульц Г., Брер Х., Бекхофф I (февраль 1999 г.). «Селективная активация подтипов белка G в вомероназальном органе при стимуляции соединениями, полученными из мочи». Журнал биологической химии. 274 (8): 4655–62. Дои:10.1074 / jbc.274.8.4655. PMID 9988702.
- ^ «Белок агрессии, обнаруженный у мышей». Новости BBC. 5 декабря 2007 г.. Получено 26 сентября 2009.
- ^ Кнопф JL, Галлахер JF, Held WA (декабрь 1983 г.). «Дифференциальная, мультигормональная регуляция семейства основных генов мочевого белка мыши в печени». Молекулярная и клеточная биология. 3 (12): 2232–40. Дои:10.1128 / MCB.3.12.2232. ЧВК 370094. PMID 6656765.
- ^ Робертсон Д.Х., Херст Дж. Л., Болгар М. С., Гаскелл С. Дж., Бейнон Р. Дж. (1997). «Молекулярная гетерогенность белков мочи в популяциях диких домашних мышей». Быстрые коммуникации в масс-спектрометрии. 11 (7): 786–90. Bibcode:1997RCMS ... 11..786R. Дои:10.1002 / (SICI) 1097-0231 (19970422) 11: 7 <786 :: AID-RCM876> 3.0.CO; 2-8. PMID 9161047.
- ^ Робертсон Д.Х., Кокс К.А., Гаскелл С.Дж., Эвершед Р.П., Бейнон Р.Дж. (май 1996 г.). «Молекулярная гетерогенность основных белков мочи домашней мыши Mus musculus». Биохимический журнал. 316 (Pt 1) (Pt 1): 265–72. Дои:10.1042 / bj3160265. ЧВК 1217333. PMID 8645216.
- ^ Читем С.А., Смит А.Л., Армстронг С.Д., Бейнон Р.Дж., Херст Дж.Л. (февраль 2009 г.). «Ограниченное изменение основных белков мочи лабораторных мышей». Физиология и поведение. 96 (2): 253–61. Дои:10.1016 / j.physbeh.2008.10.005. PMID 18973768. S2CID 20637696.
- ^ Бреннан П.А. (июнь 2010 г.). «По запаху сексуального влечения». BMC Биология. 8 (1): 71. Дои:10.1186/1741-7007-8-71. ЧВК 2880966. PMID 20504292.
- ^ Робертс С.А., Симпсон Д.М., Армстронг С.Д., Дэвидсон А.Дж., Робертсон Д.Х., Маклин Л. и др. (Июнь 2010 г.). «Дарцин: мужской феромон, который стимулирует женскую память и сексуальное влечение к запаху отдельного мужчины». BMC Биология. 8 (1): 75. Дои:10.1186/1741-7007-8-75. ЧВК 2890510. PMID 20525243.
- ^ Московиц С (3 июня 2010 г.). «Биологи узнают, почему мыши сходят с ума от мочи». FoxNews.com. FOX News Network. Получено 9 июн 2010.
- ^ а б Hurst JL, Payne CE, Nevison CM, Marie AD, Humphries RE, Robertson DH и др. (Декабрь 2001 г.). «Индивидуальное распознавание у мышей, опосредованное основными белками мочи». Природа. 414 (6864): 631–4. Bibcode:2001Натура.414..631H. Дои:10.1038 / 414631a. PMID 11740558. S2CID 464644.
- ^ Том, доктор медицины, Стокли П., Жюри Ф, Оллиер В.Е., Бейнон Р.Дж., Херст Д.Л. (апрель 2008 г.). «Прямая оценка генетической гетерозиготности по запаху у мышей». Текущая биология. 18 (8): 619–23. Дои:10.1016 / j.cub.2008.03.056. PMID 18424142. S2CID 268741.
- ^ Шерборн А.Л., Том, доктор медицины, Патерсон С., Жюри Ф., Оллиер В.Е., Стокли П. и др. (Декабрь 2007 г.). «Генетическая основа предотвращения инбридинга у домашних мышей». Текущая биология. 17 (23): 2061–6. Дои:10.1016 / j.cub.2007.10.041. ЧВК 2148465. PMID 17997307.
- ^ Хименес Дж. А., Хьюз К. А., Алакс Дж., Грэм Л., Лейси Р. К. (октябрь 1994 г.). «Экспериментальное исследование инбредной депрессии в естественной среде обитания». Наука. 266 (5183): 271–3. Bibcode:1994Sci ... 266..271J. Дои:10.1126 / science.7939661. PMID 7939661.
- ^ а б c Папес Ф., Логан Д.В., Стоуэрс Л. (май 2010 г.). «Вомероназальный орган опосредует межвидовое защитное поведение посредством обнаружения гомологов белковых феромонов». Клетка. 141 (4): 692–703. Дои:10.1016 / j.cell.2010.03.037. ЧВК 2873972. PMID 20478258.
- ^ а б c d Родригес I (май 2010 г.). «Химический МУПпетер». Клетка. 141 (4): 568–70. Дои:10.1016 / j.cell.2010.04.032. PMID 20478249. S2CID 13992615.
- ^ «Почему мыши боятся запаха кошек». Новости BBC. 17 мая 2010 года. Получено 18 мая 2010.
- ^ Эренберг Р. (5 июня 2010 г.). "Сражайся или беги, это в мочу". Новости науки.
- ^ Bhanoo S (17 мая 2010 г.). «Когда мышь чувствует запах крысы». Нью-Йорк Таймс.
- ^ Ласкомб М.Б., Грегуар С., Понсе П., Таварес Г.А., Розински-Чупин И., Рабильон Дж. И др. (Июль 2000 г.). «Кристаллическая структура аллергена Equ c 1. Димерный липокалин с ограниченными IgE-реактивными эпитопами». Журнал биологической химии. 275 (28): 21572–7. Дои:10.1074 / jbc.M002854200. PMID 10787420.
- ^ а б Локки Р., Ледфорд Д.К. (2008). «Аллергены млекопитающих». Аллергены и иммунотерапия аллергенов. Том 21 Клинической аллергии и иммунологии. Informa Health Care. С. 201–218. ISBN 978-1-4200-6197-0.
- ^ Виртанен Т., Цайлер Т., Мянтъярви Р. (декабрь 1999 г.). «Важными аллергенами животных являются белки липокалина: почему они аллергенны?». Международный архив аллергии и иммунологии. 120 (4): 247–58. Дои:10.1159/000024277. PMID 10640908. S2CID 1171463.
- ^ "Mus m 1 Allergen Details". www.allergen.org.
- ^ Лоруссо Дж. Р., Моффат С., Оман Дж. Л. (ноябрь 1986 г.). «Иммунологические и биохимические свойства основного аллергена мочи мыши (Mus m 1)». Журнал аллергии и клинической иммунологии. 78 (5, п. 1): 928–37. Дои:10.1016/0091-6749(86)90242-3. PMID 3097107.
- ^ Кон Р. Д., Арбес С. Дж., Инь М., Джарамилло Р., Зельдин, округ Колумбия (июнь 2004 г.). «Национальная распространенность и риск воздействия мышиного аллергена в домохозяйствах США». Журнал аллергии и клинической иммунологии. 113 (6): 1167–71. Дои:10.1016 / j.jaci.2003.12.592. PMID 15208600.
- ^ Phipatanakul W, Eggleston PA, Wright EC, Wood RA (декабрь 2000 г.). «Мышиный аллерген. I. Распространенность мышиного аллергена в городских домах. Национальное совместное исследование городской астмы». Журнал аллергии и клинической иммунологии. 106 (6): 1070–4. Дои:10.1067 / mai.2000.110796. PMID 11112888.
- ^ Перри Т., Мацуи Е., Мерриман Б., Дуонг Т., Эгглстон П. (август 2003 г.). «Распространенность крысиного аллергена в городских домах и его связь с сенсибилизацией и заболеваемостью астмой». Журнал аллергии и клинической иммунологии. 112 (2): 346–52. Дои:10.1067 / mai.2003.1640. PMID 12897741.
- ^ Вуд РА (2001). «Аллергены лабораторных животных». Журнал ILAR. 42 (1): 12–6. Дои:10.1093 / ilar.42.1.12. PMID 11123185.
- ^ Гаффин Дж. М., Пипатанакул В. (апрель 2009 г.). «Роль комнатных аллергенов в развитии астмы». Текущее мнение в области аллергии и клинической иммунологии. 9 (2): 128–35. Дои:10.1097 / ACI.0b013e32832678b0. ЧВК 2674017. PMID 19326507.
- ^ Pongracic JA, Visness CM, Gruchalla RS, Evans R, Mitchell HE (июль 2008 г.). «Влияние мышиного аллергена и вмешательства окружающей среды грызунов на астму у городских детей». Анналы аллергии, астмы и иммунологии. 101 (1): 35–41. Дои:10.1016 / S1081-1206 (10) 60832-0. PMID 18681082.
- ^ Гордон С., Прис Р. (сентябрь 2003 г.). «Профилактика аллергии на лабораторных животных». Медицина труда. 53 (6): 371–7. Дои:10.1093 / occmed / kqg117. PMID 14514903.
- ^ Платтс-Миллс Т.А., Лонгботтом Дж., Эдвардс Дж., Кокрофт А., Уилкинс С. (март 1987 г.). «Профессиональная астма и ринит, связанные с лабораторными крысами: сывороточные антитела IgG и IgE к аллергену мочи крысы». Журнал аллергии и клинической иммунологии. 79 (3): 505–15. Дои:10.1016/0091-6749(87)90369-1. PMID 3819230.
- ^ а б Грегуар С., Розински-Чупин И., Рабильон Дж., Альзари П.М., Дэвид Б., Дандеу Дж. П. (декабрь 1996 г.). «Клонирование кДНК и секвенирование выявили, что главный аллерген лошади Equ c1 является гликопротеином суперсемейства липокалинов». Журнал биологической химии. 271 (51): 32951–9. Дои:10.1074 / jbc.271.51.32951. PMID 8955138.
- ^ а б Хуэй X, Чжу В., Ван И, Лам К.С., Чжан Дж., Ву Д. и др. (Май 2009 г.). «Основной белок-1 в моче увеличивает расход энергии и улучшает непереносимость глюкозы за счет усиления митохондриальной функции в скелетных мышцах мышей с диабетом». Журнал биологической химии. 284 (21): 14050–7. Дои:10.1074 / jbc.M109.001107. ЧВК 2682853. PMID 19336396.
- ^ Чжоу Ю., Цзян Л., Жуй Л. (апрель 2009 г.). «Идентификация MUP1 как регулятора метаболизма глюкозы и липидов у мышей». Журнал биологической химии. 284 (17): 11152–9. Дои:10.1074 / jbc.M900754200. ЧВК 2670120. PMID 19258313.
внешняя ссылка
- Запах грызуна, The Why Files - наука, стоящая за новостями
- Сигналы страха от хищников на YouTube, видео, описывающее исследование, которое определило, что Mups были kairomones

