Протамин - Википедия - Protamine
| Протамин 1 | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | PRM1 | ||||||
| Ген NCBI | 5619 | ||||||
| HGNC | 9447 | ||||||
| OMIM | 182880 | ||||||
| RefSeq | NM_002761 | ||||||
| UniProt | P04553 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 16 p13.13 | ||||||
| |||||||
| Протамин 2 | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | PRM2 | ||||||
| Ген NCBI | 5620 | ||||||
| HGNC | 9448 | ||||||
| OMIM | 182890 | ||||||
| RefSeq | NM_002762 | ||||||
| UniProt | P04554 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 16 p13.13 | ||||||
| |||||||
Протамины маленькие, аргинин -богатые, ядерный белки что заменить гистоны поздно в гаплоидный фаза сперматогенез и считаются необходимыми для сперма конденсация головы и ДНК стабилизация. Они могут позволить более плотную упаковку ДНК в сперматозоид чем гистоны, но они должны быть декомпрессированы, прежде чем генетические данные можно будет использовать для синтеза белка. Однако у людей и, возможно, других приматов 10-15% генома сперматозоидов упаковано гистонами, которые, как считается, связывают гены, которые необходимы для раннего эмбрионального развития.[1]
Протамин и протаминоподобные (PL) белки входят в состав сперматозоидов. специфические основные ядерные белки (SNBP). Белки PL по структуре занимают промежуточное положение между протамином и Гистон H1, C-конец которого является предшественником протамина позвоночных.[2]
Сперматогенез
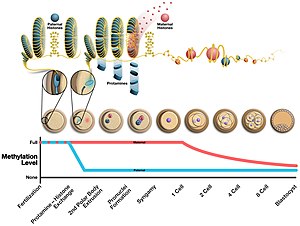
Во время образования сперматозоидов протамин связывается с фосфатным остовом ДНК, используя богатый аргинином домен в качестве якоря. Затем ДНК сворачивается в тороид, O-образная структура, хотя механизм неизвестен. Сперматозоид может содержать до 50 000 тороидальных структур в своем ядре, причем каждый тороид содержит около 50 килобаз.[3] Перед формированием тороида гистоны удаляются из ДНК переходными ядерными белками, так что протамин может его конденсировать. Эффектом этого изменения являются: 1) увеличение гидродинамики сперматозоидов для лучшего прохождения через жидкости за счет уменьшения размера головки 2) уменьшение возникновения повреждений ДНК 3) удаление эпигенетических маркеров, возникающих при модификациях гистонов.[4]
Структура головки сперматозоида также связана с уровнем протамина. Было обнаружено, что отношение протамина 2 к протамину 1 и переходным ядерным белкам изменяет форму головки сперматозоида у различных видов мышей, изменяя экспрессию протамина 2 посредством мутаций в его промоторной области. Было обнаружено, что уменьшение соотношения увеличивает конкурентоспособность спермы в Mus разновидность. Однако требуется дальнейшее тестирование, чтобы определить, как это соотношение влияет на форму головы и влияет ли моногамия на этот выбор. Исследования показывают, что у людей мужчины с несбалансированным Prm1 / Prm2 являются субфертильными или бесплодными.[5] Протамин 2 кодируется как более длинный белок, который требует расщепления на N-конце, прежде чем он станет функциональным. Протамин человека и шимпанзе претерпел быструю эволюцию.[6]
Медицинское использование
При смешивании с инсулин, протамины замедляют начало и увеличивают продолжительность действия инсулина (см. Инсулин НПХ ).[7]
Протамин используется в кардиохирургии, сосудистой хирургии и в процедурах интервенционной радиологии, чтобы нейтрализовать анти-свертывающий эффект гепарин. Побочные эффекты включают повышение давления в легочной артерии и снижение периферического кровяного давления, потребление кислорода миокардом, сердечный выброс и частоту сердечных сокращений.[8]
Сульфат протамина это противоядие от гепарин передозировка, но может возникнуть сильная аллергия.[9] Версия протамина с укороченной цепью также действует как мощный антагонист гепарина, но с заметно уменьшенным антигенность. Первоначально он был произведен как смесь, сделанная термолизин переваривание протамина,[10] но фактическая эффективная часть пептида VSRRRRRRGGRRRR с тех пор был изолирован.[11] Также был получен аналог этого пептида.[12]
В генной терапии сульфат протамина способность конденсировать плазмидную ДНК вместе с одобрением США Управление по контролю за продуктами и лекарствами (FDA) сделали его привлекательным кандидатом для увеличения скорости трансдукции как вирусных[13] и невирусные (например, с использованием катионных липосом)[14] опосредованные механизмы доставки.
Протамин можно использовать как лекарство от ожирения. Было показано, что протамин сдерживает увеличение массы тела и липопротеин низкой плотности у крыс с высоким содержанием жиров. Этот эффект происходит за счет ингибирования липаза активность, фермент, ответственный за триацилглицерин пищеварение и всасывание, что приводит к снижению всасывания пищевых жиров. Когда крыс лечили протамином, повреждений печени не обнаружено. Однако эмульгирование длинноцепочечных жирных кислот для переваривания и всасывания в тонком кишечнике у людей менее постоянное, чем у крыс, что будет варьировать эффективность протамина как лекарственного средства. Кроме того, человеческие пептидазы могут разлагать протамин с разной скоростью, поэтому необходимы дальнейшие тесты для определения способности протамина предотвращать ожирение у людей.[15]
Распространение видов и изоформы
Мыши, люди[1] и у некоторых рыб есть два или более разных протамина, тогда как сперма быка и кабана,[16] имеют одну форму протамина из-за мутации в гене PRM2. У крыс, несмотря на наличие гена PRM2, экспрессия этого белка чрезвычайно мала из-за ограниченной транскрипции из-за неэффективного промотора в дополнение к измененному процессингу транскрипта мРНК.[17]
Человек
2 человеческих протамина обозначены PRM1 и PRM2.
Рыбы
Примеры протаминов из рыбы:
- сальмин из лосось
- clupeine из сельдь сперма (Clupea)
- иридин из радужная форель
- тонкий девять из тунец (Thunnus)
- стеллин из звездного осетра (Acipenser stellatus )
- сциллиорхинин из морская собака (Scylliorhinus)
Структура
| Протамин P1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | Протамин_P1 | ||||||||
| Pfam | PF00260 | ||||||||
| ИнтерПро | IPR000221 | ||||||||
| PROSITE | PDOC00047 | ||||||||
| |||||||||
| Протамин P2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | Протамин_P2 | ||||||||
| Pfam | PF00841 | ||||||||
| ИнтерПро | IPR000492 | ||||||||
| |||||||||
Первичная структура протамина P1, протамина, используемого для упаковки ДНК в сперматозоиды, у плацентарных млекопитающих обычно состоит из 49 или 50 аминокислот. Эта последовательность разделена на три отдельных домена: богатый аргинином домен для связывания ДНК, фланкированный более короткими пептидными последовательностями, содержащими в основном остатки цистеина. Богатый аргинином домен состоит из 3-11 остатков аргинина и является консервативным между последовательностями протамина 1 рыб и протамина 1 млекопитающих при примерно 60-80% идентичности последовательностей.[1]После трансляции структура протамина P1 немедленно фосфорилируется по всем трем из вышеупомянутых доменов. Другой раунд фосфорилирования происходит, когда сперма попадает в яйцеклетку, но функция этого фосфорилирования неясна. Когда протамин P1 связывается с ДНК, образуется цистеин с аминоконца одного протамина P1. дисульфидные связи с цистеином на карбокси-конце другого протамина P1. Дисульфидные связи функционируют для предотвращения диссоциации протамина P1 от ДНК до тех пор, пока связи не уменьшатся, когда сперма входит в яйцеклетку.[1]
Вторичная и третичная структура протамина достоверно неизвестна, но было опубликовано несколько предложений.[18][19][20]
Смотрите также
Рекомендации
- ^ а б c d Балхорн Р. (2007). «Семейство протаминов ядерных белков сперматозоидов». Геномная биология. 8 (9): 227. Дои:10.1186 / gb-2007-8-9-227. ЧВК 2375014. PMID 17903313.
- ^ Эйрин-Лопес Дж. М., Аусио Дж. (Октябрь 2009 г.). «Происхождение и эволюция хромосомных белков спермы». BioEssays. 31 (10): 1062–70. Дои:10.1002 / bies.200900050. PMID 19708021. S2CID 17131119.
- ^ Брюэр Л. Р., Корцетт М., Балхорн Р. (октябрь 1999 г.). «Конденсация и деконденсация одной и той же молекулы ДНК, вызванная протамином». Наука. 286 (5437): 120–3. Дои:10.1126 / science.286.5437.120. PMID 10506559.
- ^ Woop M (январь 2015 г.). «Оптимизация движения связанных частиц для измерения уплотнения ДНК протамином». Биофизический журнал. 108 (2): 393a. Bibcode:2015BpJ ... 108..393Вт. Дои:10.1016 / j.bpj.2014.11.2156.
- ^ Люке Л., Кэмпбелл П., Вареа Санчес М., Нахман М.В., Ролдан Э.Р. (май 2014 г.). «Половой отбор на экспрессию протамина и переходного ядерного белка у мышей». Ход работы. Биологические науки. 281 (1783): 20133359. Дои:10.1098 / rspb.2013.3359. ЧВК 3996607. PMID 24671975.
- ^ Wyckoff GJ, Wang W, Wu CI (январь 2000 г.). «Быстрая эволюция мужских репродуктивных генов при происхождении человека». Природа. 403 (6767): 304–9. Bibcode:2000Натурал 403..304Вт. Дои:10.1038/35002070. PMID 10659848. S2CID 3136139.
- ^ Оуэнс Д.Р. (июнь 2011 г.). «Препараты инсулина пролонгированного действия». Диабетические технологии и терапия. 13 Дополнение 1: S5-14. Дои:10.1089 / диаметр 2011.0068. PMID 21668337.
- ^ Карр Дж. А., Сильверман Н. (октябрь 1999 г.). «Взаимодействие гепарина с протамином. Обзор». Журнал сердечно-сосудистой хирургии. 40 (5): 659–66. PMID 10596998.
- ^ Weiler JM, Freiman P, Sharath MD, Metzger WJ, Smith JM, Richerson HB, Ballas ZK, Halverson PC, Shulan DJ, Matsuo S (февраль 1985 г.). «Серьезные побочные реакции на сульфат протамина: нужны ли альтернативы?». Журнал аллергии и клинической иммунологии. 75 (2): 297–303. Дои:10.1016/0091-6749(85)90061-2. PMID 2857186.
- ^ Бьюн И, Чанг LC, Ли Л.М., Хан И.С., Сингх В.К., Ян В.К. (2000). «Протамин с низким молекулярным весом: мощный, но нетоксичный антагонист гепарина / протамина с низким молекулярным весом». Журнал ASAIO. 46 (4): 435–9. Дои:10.1097/00002480-200007000-00013. PMID 10926141. S2CID 13106365.
- ^ Хэ Х, Йе Дж, Лю Э, Лян Цюй, Лю Цюй, Ян В.К. (ноябрь 2014 г.). «Протамин с низкой молекулярной массой (LMWP): нетоксичный заменитель протамина и эффективный проникающий в клетки пептид». Журнал контролируемого выпуска. 193: 63–73. Дои:10.1016 / j.jconrel.2014.05.056. PMID 24943246.
- ^ Chang LC, Lee HF, Yang Z, Yang VC (1 сентября 2001 г.). «Протамин с низким молекулярным весом (LMWP) как нетоксичный гепарин / антидот низкомолекулярного гепарина (I): получение и характеристика». AAPS PharmSci. 3 (3): 7–14. Дои:10.1208 / пс030317. ЧВК 2751012. PMID 11741268.
- ^ Корнетта К., Андерсон В.Ф. (февраль 1989 г.). «Сульфат протамина как эффективная альтернатива полибрену в передаче генов, опосредованной ретровирусами: последствия для генной терапии человека». Журнал вирусологических методов. 23 (2): 187–94. Дои:10.1016/0166-0934(89)90132-8. PMID 2786000.
- ^ Сорги Флорида, Бхаттачарья С., Хуанг Л. (сентябрь 1997 г.). «Сульфат протамина усиливает опосредованный липидами перенос генов». Генная терапия. 4 (9): 961–8. Дои:10.1038 / sj.gt.3300484. PMID 9349433. S2CID 22101764.
- ^ Дуарте-Васкес М.А., Гарсиа-Падилья С., Ольвера-Очоа Л., Гонсалес-Ромеро К.Э., Акоста-Иньигес Дж., Де ла Крус-Кордеро Р., Росадо Ю.Л. (июнь 2009 г.). «Влияние протамина на ожирение, вызванное диетой с высоким содержанием жиров у крыс». Международный журнал ожирения. 33 (6): 687–92. Дои:10.1038 / ijo.2009.78. PMID 19434066.
- ^ Майер В.М., Нуссбаум Г., Доменджуд Л., Клемм Ю., Энгель В. (март 1990 г.). «Недостаток протамина 2 (P2) в сперматозоидах кабана и быка связан с мутациями в гене P2». Исследования нуклеиновых кислот. 18 (5): 1249–54. Дои:10.1093 / nar / 18.5.1249. ЧВК 330441. PMID 2320417.
- ^ Буник Д., Балхорн Р., Станкер Л. Х., Хехт Н. Б. (май 1990 г.). «Экспрессия гена протамина 2 крысы подавлена на уровне транскрипции и трансляции». Экспериментальные исследования клеток. 188 (1): 147–52. Дои:10.1016 / 0014-4827 (90) 90290-кв. PMID 2328773.
- ^ Мартинс Р.П., Ostermeier GC, Krawetz SA (декабрь 2004 г.). «Взаимодействие ядерной матрицы в протаминовом домене человека: рабочая модель потенцирования». Журнал биологической химии. 279 (50): 51862–8. Дои:10.1074 / jbc.M409415200. PMID 15452126.
- ^ Vilfan ID, Conwell CC, Hud NV (май 2004 г.). «Формирование нативного хроматина сперматозоидов млекопитающих с помощью свернутого протамина быка». Журнал биологической химии. 279 (19): 20088–95. Дои:10.1074 / jbc.M312777200. PMID 14990583.
- ^ Biegeleisen K (август 2006 г.). «Вероятная структура комплекса протамин-ДНК». Журнал теоретической биологии. 241 (3): 533–40. Дои:10.1016 / j.jtbi.2005.12.015. PMID 16442565.
внешняя ссылка
- Протамины в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- V03AB14 (ВОЗ)
