Редактирование генов CRISPR - CRISPR gene editing
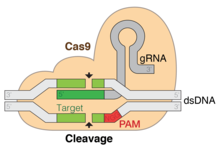
Редактирование генов CRISPR это генная инженерия техника в молекулярная биология по которому геномы живых организмов могут быть изменены. Он основан на упрощенной версии бактериального CRISPR -Cas9 система противовирусной защиты. Поставив Cas9 нуклеаза в комплексе с синтетическим направляющая РНК (гРНК) в клетку, геном клетки может быть разрезан в желаемом месте, что позволяет удалить существующие гены и / или добавить новые. in vivo (в живых организмах).[1]
Этот метод считается очень важным в биотехнологии и медицине, поскольку он позволяет редактировать геномы. in vivo с чрезвычайно высокой точностью, дешево и легко. Его можно использовать при создании новых лекарств, сельскохозяйственных продуктов и генетически модифицированные организмы, или как средство борьбы с патогенами и вредителями. Также есть возможности для лечения наследственных генетические заболевания а также болезни, возникающие из соматические мутации например, рак. Однако его использование в генетическая модификация зародышевой линии человека является весьма спорным. Развитие методики заработало Дженнифер Дудна и Эммануэль Шарпантье то Нобелевская премия по химии в 2020 году.[2] Третья группа исследователей, разделяющих Премия Кавли за то же открытие[3] (во главе с Виргиниюс Шикшнис ) не был удостоен Нобелевской премии.[4][5]
Синопсис
Действуя как генетические ножницы, нуклеаза Cas9 открывает обе цепи целевой последовательности ДНК ввести модификацию одним из двух способов. Подключаемые мутации, облегченные с помощью гомологически направленный ремонт (HDR) - это традиционный путь целевых подходов к редактированию генома.[6] Это позволяет ввести целевые Повреждение и восстановление ДНК. HDR использует аналогичные последовательности ДНК для репарации разрыва путем включения экзогенной ДНК, которая функционирует как репарационная матрица.[6] Этот метод основан на периодическом и изолированном возникновении повреждения ДНК в целевом участке для начала восстановления. Нокаут-мутации, вызванные CRISPR-Cas9, приводят к репарации двухцепочечного разрыва посредством негомологичное соединение концов (NHEJ). NHEJ часто может приводить к случайным делециям или вставкам в сайте репарации, что может нарушить или изменить функциональность гена. Таким образом, геномная инженерия с помощью CRISPR-Cas9 дает исследователям возможность генерировать целевое случайное разрушение генов. Из-за этого точность редактирования генома вызывает большую озабоченность. Редактирование генома приводит к необратимым изменениям генома.
В то время как редактирование генома в эукариотических клетках стало возможным с использованием различных методов с 1980-х годов, используемые методы оказались неэффективными и непрактичными для реализации в больших масштабах. С открытием CRISPR и, в частности, молекулы нуклеазы Cas9 эффективное и высокоселективное редактирование стало реальностью. Cas9, полученный из видов бактерий Streptococcus pyogenes облегчил целевую модификацию генома в эукариотических клетках, предоставив надежный метод создания целевого разрыва в определенном месте, обозначенном направляющими цепями crRNA и tracrRNA.[7] Легкость, с которой исследователи могут вставить Cas9 и матричную РНК, чтобы тишина или вызвать точечные мутации на конкретных места оказался бесценным для быстрых и эффективных отображение геномных моделей и биологических процессов, связанных с различными генами у различных эукариот. Были разработаны новые варианты нуклеазы Cas9, которые значительно снижают нецелевую активность.[8]
Методы редактирования генома CRISPR-Cas9 имеют множество потенциальных применений, в том числе в медицине и сельском хозяйстве. Использование комплекса CRISPR-Cas9-gRNA для редактирования генома[9] был AAAS выбор для Прорыв года в 2015 году.[10] Много биоэтический высказывались опасения по поводу перспективы использования CRISPR для зародышевый редактирование, особенно в человеческих эмбрионах.[11]
История
Предшественники
В начале 2000-х исследователи разработали нуклеазы цинковых пальцев (ZFN), синтетические белки, чьи ДНК-связывающие домены позволяют им создавать двухцепочечные разрывы в ДНК в определенных точках. В 2010 году синтетические нуклеазы назвали эффекторные нуклеазы, подобные активаторам транскрипции (TALEN) предоставили более простой способ нацелить двухцепочечный разрыв в определенное место на цепи ДНК. И нуклеазы цинковых пальцев, и TALEN требуют разработки и создания индивидуального белка для каждой целевой последовательности ДНК, что является гораздо более сложным и трудоемким процессом, чем создание направляющих РНК. CRISPR гораздо проще разработать, потому что для этого процесса требуется синтез только короткой последовательности РНК, процедура, которая уже широко используется для многих других методов молекулярной биологии (например, для создания олигонуклеотид грунтовки ).[12]
В то время как такие методы, как РНК-интерференция (РНКи) не полностью подавляют функцию гена, CRISPR, ZFNs, и ТАЛЕНЫ обеспечить полный необратимый нокаут гена.[13] CRISPR также может нацеливаться на несколько сайтов ДНК одновременно, просто вводя разные гРНК. Кроме того, стоимость использования CRISPR относительно невысока.[13][14][15]
Открытие
В 2012 Дженнифер Дудна и Эммануэль Шарпантье опубликовали свой вывод о том, что CRISPR-Cas9 могут быть запрограммированы с помощью РНК для редактирования геномной ДНК, что в настоящее время считается одним из самых значительных открытий в мире. история биологии.[16]
Патенты и коммерциализация
По состоянию на ноябрь 2013 г.[Обновить], SAGE Labs (часть Horizon Discovery группа) имел эксклюзивные права от одной из этих компаний по производству и продаже генно-инженерных крыс и неисключительных прав на модели мышей и кроликов.[17] К 2015 г.[Обновить], Thermo Fisher Scientific получила лицензию на интеллектуальную собственность от ToolGen для разработки наборов реагентов CRISPR.[18]
По состоянию на декабрь 2014 г.[Обновить], патентные права к CRISPR были оспорены. Несколько компаний были созданы для разработки родственных лекарств и исследовательских инструментов.[19] По мере того, как компании наращивали финансирование, возникли сомнения в том, можно ли быстро монетизировать CRISPR.[20] В феврале 2017 года Патентное ведомство США вынесло решение патентное вмешательство дело, возбужденное Калифорнийским университетом в отношении патентов, выданных Broad Institute и обнаружили, что патенты Броуда с формулами, охватывающими применение CRISPR-Cas9 в эукариотических клетках, отличаются от изобретений, заявленных Калифорнийским университетом.[21][22][23]Вскоре после этого Калифорнийский университет подал апелляцию на это решение.[24][25]
Недавние события
В марте 2017 года Европейское патентное ведомство (ЕПВ) объявило о своем намерении разрешить широкие заявки на редактирование всех видов ячеек Институту Макса Планка в Берлине, Калифорнийскому университету и Венскому университету.[26][27] а в августе 2017 года ЕПВ объявило о своем намерении разрешить претензии CRISPR в патентной заявке, поданной MilliporeSigma.[26] По состоянию на август 2017 г.[Обновить] Ситуация с патентами в Европе была сложной: MilliporeSigma, ToolGen, Вильнюсский университет и Гарвард вместе с Калифорнийским университетом и Бродом боролись за свои претензии.[28]
В июле 2018 г. ECJ постановил, что редактирование генов для растений была подкатегорией ГМО продукты и поэтому отныне метод CRISPR будет регулироваться в Европейский Союз своими правилами и положениями для ГМО.[29]
В феврале 2020 года исследование в США безопасно показало редактирование гена CRISPR на трех онкологических больных.[30]
В октябре 2020 года исследователи Эммануэль Шарпантье и Дженнифер Дудна были удостоены Нобелевской премии по химии за свои работы в этой области. [31]
Геномная инженерия

Редактирование генома CRISPR-Cas9 осуществляется с помощью Тип II Система CRISPR. При использовании для редактирования генома эта система включает Cas9, crRNA и tracrRNA вместе с необязательным участком матрицы репарации ДНК, которая используется в любом негомологичное соединение концов (NHEJ) или гомологически направленный ремонт (HDR).

Основные компоненты
| Составная часть | Функция |
|---|---|
| crRNA | Содержит направляющую РНК, которая определяет правильный сегмент ДНК хозяина вместе с областью, которая связывается с tracrRNA (обычно в петля для шпильки форма), образуя активный комплекс. |
| tracrRNA | Связывается с crRNA и образует активный комплекс. |
| sgRNA | Однонаправляющие РНК представляют собой комбинированную РНК, состоящую из tracrRNA и хотя бы один crRNA. |
| Cas9 | Фермент, активная форма которого способна модифицировать ДНК. Существует множество вариантов с различными функциями (например, разрыв одной цепи, разрыв двух цепей, связывание ДНК) из-за функции распознавания сайта ДНК каждого фермента. |
| Ремонтный шаблон | Молекула ДНК, используемая в качестве матрицы в процессе репарации ДНК клетки-хозяина, позволяет вставлять определенную последовательность ДНК в сегмент хозяина, разрушенный Cas9. |
CRISPR-Cas9 часто нанимает плазмида к трансфицировать клетки-мишени.[32] Основные компоненты этой плазмиды показаны на изображении и перечислены в таблице. CrRNA уникально разработана для каждого приложения, так как это последовательность, которую Cas9 использует для идентификации и прямого связывания с конкретными последовательностями в ДНК клетки-хозяина. CrRNA должна связываться только там, где требуется редактирование. Матрица репарации также уникальна для каждого применения, поскольку она должна до некоторой степени дополнять последовательности ДНК по обе стороны от разреза, а также содержать любую последовательность, желаемую для вставки в геном хозяина.
Множественные crRNA и tracrRNA могут быть упакованы вместе, чтобы сформировать единую направляющую РНК (sgRNA).[33] Эта sgRNA может быть включена вместе с геном, кодирующим белок Cas9, и превращена в плазмиду для трансфекции в клетки. Доступно множество онлайн-инструментов для помощи в разработке эффективных последовательностей sgRNA.[34][35]

Структура
CRISPR-Cas9 предлагает высокую точность и относительно простую конструкцию. Его специфичность зависит от двух факторов: целевой последовательности и прилегающий мотив протоспейсера (PAM) последовательность. Целевая последовательность составляет 20 оснований в длину как часть каждого локуса CRISPR в массиве crRNA.[32] Типичный массив crRNA имеет несколько уникальных целевых последовательностей. Белки Cas9 выбирают правильное место в геноме хозяина, используя последовательность для связывания с парами оснований на ДНК хозяина. Последовательность не является частью белка Cas9 и, как результат, настраивается и может быть независимо синтезированный.[36][37]
Последовательность PAM в геноме хозяина распознается Cas9. Cas9 нельзя легко изменить для распознавания другой последовательности PAM. Однако это, в конечном счете, не является слишком ограничивающим, поскольку обычно это очень короткая и неспецифическая последовательность, которая часто встречается во многих местах по всему геному (например, последовательность PAM SpCas9 - это 5'-NGG-3 ', а в геноме человека встречается примерно через каждые От 8 до 12 пар оснований).[32]
После того, как эти последовательности были собраны в плазмиду и трансфицированы в клетки, белок Cas9 с помощью crRNA находит правильную последовательность в ДНК клетки-хозяина и - в зависимости от варианта Cas9 - создает одно- или двухцепочечный разрыв на соответствующее место в ДНК.[38]
Правильно расположенные одноцепочечные разрывы в ДНК хозяина могут запускать гомологически направленный ремонт, который менее подвержен ошибкам, чем негомологичное соединение концов это обычно следует за двухцепочечным разрывом. Предоставление матрицы репарации ДНК позволяет вставить определенную последовательность ДНК в точное место в геноме. Матрица репарации должна простираться от 40 до 90 пар оснований за пределы индуцированного Cas9 разрыва ДНК.[32] Цель состоит в том, чтобы естественный процесс HDR клетки использовал предоставленную репарационную матрицу и тем самым включил новую последовательность в геном. После включения эта новая последовательность становится частью генетического материала клетки и переходит в ее дочерние клетки.
Доставка
Доставка Cas9, sgRNA и связанных комплексов в клетки может происходить через вирусные и невирусные системы. Электропорация ДНК, РНК или рибонуклеокомплексов - это распространенный метод, хотя он может оказывать вредное воздействие на клетки-мишени.[39] Методы химической трансфекции с использованием липиды также использовались для введения в клетки sgRNA в комплексе с Cas9.[40] Типы клеток, которые труднее трансфицировать (например, стволовые клетки, нейроны и гемопоэтические клетки), требуют более эффективных систем доставки, например, основанных на лентивирус (LV), аденовирус (AdV) и аденоассоциированный вирус (AAV).[41][42][43]
Контролируемое редактирование генома
Несколько вариантов CRISPR-Cas9 позволяют активацию гена или редактирование генома с помощью внешнего триггера, такого как свет или небольшие молекулы.[44][45][46] К ним относятся фотоактивируемые системы CRISPR, разработанные путем слияния светочувствительных белков-партнеров с активаторным доменом и dCas9 для активации гена,[47][48] или путем слияния аналогичных светочувствительных доменов с двумя конструкциями расщепленного Cas9,[49][50] или путем включения неестественных аминокислот в клетку Cas9,[51] или путем модификации направляющих РНК фоторасщепляемыми дополнениями для редактирования генома.[52]
Методы управления редактированием генома с помощью малых молекул включают аллостерический Cas9, без детектируемого фонового редактирования, который активирует связывание и расщепление при добавлении 4-гидрокситамоксифен (4-HT),[44] 4-HT отзывчивый интеин -связанный Cas9,[53] или Cas9, который реагирует на 4-HT при слиянии с четырьмя доменами ERT2.[54] Индуцибельный сплит-Cas9 позволяет димеризация фрагментов Cas9[55] и рапамицин -индуцируемая система сплит-Cas9, разработанная путем слияния двух конструкций сплит-Cas9 с FRB и FKBP фрагменты.[56] Другие исследования смогли вызвать транскрипцию Cas9 с помощью небольшой молекулы, доксициклин.[57][58] Небольшие молекулы также можно использовать для улучшения гомологически направленного ремонта,[59] часто путем ингибирования негомологичного пути соединения концов.[60] Эти системы позволяют условно контролировать активность CRISPR для повышения точности, эффективности и пространственно-временного контроля.
CRISPR-скрининг
Сгруппированные регулярно расположенные короткие палиндромные повторы (CRISPR) / Cas9 system - это технология редактирования генов, которая может вызывать двухцепочечные разрывы (DSB), одноцепочечные разрывы или любое место, где направляющие рибонуклеиновые кислоты (РНК) могут связываться с последовательностью смежного мотива протоспейсера (PAM).[61] Путем простого изменения последовательности гРНК Cas9-эндонуклеаза может доставляться к интересующему гену и индуцировать DSB.[62] Эффективность Cas9-эндонуклеазы и легкость, с которой гены могут быть нацелены, привели к разработке библиотек CRISPR-нокаута (KO) как для клеток мыши, так и для клеток человека, которые могут охватывать либо конкретные представляющие интерес наборы генов, либо весь геном.[63][64] Скрининг CRISPR помогает ученым создавать систематические и высокопроизводительные генетические нарушения в живых модельных организмах. Это генетическое нарушение необходимо для полного понимания функции генов и эпигенетической регуляции.[65] Преимущество объединенных библиотек CRISPR заключается в том, что одновременно можно нацеливать больше генов.
Нокаут-библиотеки создаются таким образом, чтобы обеспечить равное представление и производительность для всех экспрессируемых гРНК и нести антибиотик или флуоресцентный маркер селекции, который можно использовать для восстановления трансдуцированных клеток.[61] Есть два плазмида системы в библиотеках CRISPR / Cas9. Во-первых, все в одной плазмиде, где sgRNA и Cas9 одновременно продуцируются в трансфицированной клетке. Во-вторых, это двухвекторная система: плазмиды sgRNA и Cas9 доставляются отдельно.[66] Важно доставить тысячи уникальных векторов, содержащих sgRNAs, в один сосуд клеток с помощью вирусной трансдукции на низких уровнях. множественность заражения (MOI, обычно 0,1-0,6), это предотвращает вероятность того, что отдельный клон клетки получит более одного типа sgRNA, иначе это может привести к неправильному назначению генотип к фенотип.[63]
После того, как объединенная библиотека подготовлена, необходимо выполнить глубокое секвенирование (NGS, секвенирование следующего поколения) плазмидной ДНК, амплифицированной с помощью ПЦР, чтобы выявить изобилие sgRNA. Представляющие интерес клетки могут быть последовательно инфицированы библиотекой, а затем отобраны в соответствии с фенотипом. Есть 2 типа отбора: отрицательный и положительный. Путем отрицательного отбора эффективно обнаруживаются мертвые или медленно растущие клетки. Он может идентифицировать гены, необходимые для выживания, которые в дальнейшем могут служить кандидатами для молекулярно-направленных лекарств. С другой стороны, положительный отбор дает набор популяций с преимуществом роста, приобретенных путем случайного мутагенеза.[61] После отбора геномная ДНК собирается и секвенируется с помощью NGS. Обнаруживается истощение или обогащение sgRNA и сравнивается с исходной библиотекой sgRNA, аннотированной целевым геном, которому соответствует sgRNA. Затем статистический анализ идентифицирует гены, которые, вероятно, имеют отношение к интересующему фенотипу.[63]
| Библиотека | МНЕ БЫ | Виды | ПИ | Гены нацелены | гРНК на ген | Всего гРНК |
|---|---|---|---|---|---|---|
| Библиотека нокаутов Bassik Mouse CRISPR | 1000000121 — 1000000130 | Мышь | Бассик | Варьируется (всего ∼23000) | ∼10 | Варьируется |
| Библиотека нокаутов CRISPR, ген супрессора опухолей мыши | 113584 Магистраль EFS 113585 Магистраль ГТД | Мышь | Чен | 56 | ∼4 | 286 |
| Полногеномная библиотека мышей Бри | 73632 (1 плазмида) 73633 (2 плазмиды) | Мышь | Денч и Рут | 19,674 | 4 | 78,637 |
| Библиотека нокаутов Bassik Human CRISPR | 101926 — 101934 | Человек | Бассик | Варьируется (всего ∼20 500) | ∼10 | Варьируется |
| Полногеномная библиотека человека Брунелло | 73179 (1 плазмида) 73178 (2 плазмиды) | Человек | Денч и Рут | 19,114 | 4 | 76,441 |
| Нокаутная библиотека для всего генома человека на основе мини-человеческого AsCpf1 | 130630 | Человек | Draetta | 16,977 | 3-4 | 17032 массива |
Помимо нокаута, существуют также библиотеки нокдауна (CRISPRi) и активации (CRISPRa), которые используют способность протеолитически деактивированных слитых белков Cas9 (dCas9) связывать целевую ДНК, что означает, что интересующий ген не разрезан, а чрезмерно выражен или подавлен. Это сделало систему CRISPR / Cas9 еще более интересной для редактирования генов. Неактивный белок dCas9 модулирует экспрессию гена, направляя dCas9-репрессоры или активаторы к промоторам или сайтам старта транскрипции генов-мишеней. Для репрессирующих генов Cas9 может быть слит с эффекторным доменом KRAB, который образует комплекс с gRNA, тогда как CRISPRa использует dCas9, слитый с различными доменами активации транскрипции, которые далее направляются gRNA на промоторные области для усиления экспрессии.[68][69][70]
Приложения
Модели заболеваний
Геномная модификация Cas9 позволила быстро и эффективно получить трансгенный модели в области генетики. Cas9 можно легко ввести в клетки-мишени вместе с sgRNA посредством плазмидной трансфекции, чтобы смоделировать распространение заболеваний, реакцию клетки и защиту от инфекции.[71] Возможность внедрения Cas9 in vivo позволяет создавать более точные модели функций генов и эффектов мутаций, избегая при этом нецелевых мутаций, обычно наблюдаемых с помощью более старых методов генной инженерии.
Революция CRISPR и Cas9 в геномном моделировании распространяется не только на млекопитающих. Традиционные геномные модели, такие как Drosophila melanogaster, один из первых модельных организмов, получил дальнейшее улучшение разрешения с помощью Cas9.[71] Cas9 использует клеточно-специфические промоторы, позволяющие контролировать использование Cas9. Cas9 - это точный метод лечения заболеваний, поскольку фермент Cas9 воздействует только на определенные типы клеток. Клетки, подвергающиеся терапии Cas9, также могут быть удалены и повторно введены для обеспечения усиленного эффекта терапии.[72]
CRISPR-Cas9 можно использовать для редактирования ДНК организмов in vivo и устранить отдельные гены или даже целые хромосомы от организма на любом этапе его развития. Хромосомы, которые были успешно удалены in vivo с использованием методов CRISPR включают в себя Y-хромосому и X-хромосому взрослых лабораторных мышей и хромосомы 14 и 21 человека в линиях эмбриональных стволовых клеток и анеуплоидный мышей соответственно. Этот метод может быть полезен для лечения генетических заболеваний, вызванных аномальным количеством хромосом, таких как Синдром Дауна и интерсекс расстройства.[73]
Успешно in vivo редактирование генома с использованием CRISPR-Cas9 было продемонстрировано на многих модельных организмах, включая кишечная палочка,[74] Saccharomyces cerevisiae,[75] грибковые микроорганизмы албиканс,[76] Caenorhabditis elegans,[77] Арабидопсис виды,[78] Данио Рерио,[79] и Mus musculus.[80][81] Были достигнуты успехи в изучении основ биологии, в создании моделей болезней,[77] и в экспериментальном лечении моделей болезней.[82]
Были высказаны опасения, что нецелевые эффекты (редактирование генов помимо предполагаемых) может исказить результаты эксперимента по редактированию генов CRISPR (т.е. наблюдаемое фенотипическое изменение может быть связано не с изменением целевого гена, а с каким-либо другим геном). В CRISPR были внесены изменения, чтобы свести к минимуму возможность нецелевого воздействия. Ортогональные эксперименты CRISPR часто рекомендуются для подтверждения результатов экспериментов по редактированию генов.[83][84]
CRISPR упрощает создание генетически модифицированные организмы для исследований, которые имитируют болезнь или показывают, что происходит, когда ген сбил или мутировал. CRISPR можно использовать в зародышевый уровень для создания организмов, в которых целевой ген изменен повсюду (то есть во всех клетках / тканях / органах многоклеточного организма), или его можно использовать в клетках, не являющихся зародышевыми, для создания локальных изменений, которые влияют только на определенные популяции клеток в организме .[85][86][87]
CRISPR можно использовать для создания клеточных моделей болезней человека.[88] Например, применительно к человеку плюрипотентные стволовые клетки, CRISPR использовался для введения целевых мутаций в гены, относящиеся к поликистоз почек (ДОК) и очаговый сегментарный гломерулосклероз (ФСГС).[89] Эти модифицированные CRISPR плюрипотентные стволовые клетки впоследствии были выращены в почках человека. органоиды которые демонстрировали специфические для болезни фенотипы. Почки органоиды из стволовых клеток с мутациями PKD образовались большие полупрозрачные структуры кисты из почечных канальцев. Кисты были способны достигать макроскопических размеров - до одного сантиметра в диаметре.[90] Органоиды почек с мутациями в гене, связанном с FSGS, развили дефекты соединения между подоциты, фильтрующие клетки, пораженные этим заболеванием. Это было связано с неспособностью подоцитов образовывать микроворсинки между соседними клетками.[91] Важно отметить, что эти фенотипы заболевания отсутствовали в контрольных органоидах с идентичным генетическим фоном, но не имели модификаций CRISPR.[89]
Аналогичный подход был использован для моделирования синдром удлиненного интервала QT в кардиомиоциты происходит из плюрипотентных стволовых клеток.[92] Эти созданные с помощью CRISPR клеточные модели с изогенным контролем обеспечивают новый способ изучения болезней человека и тестирования лекарств.
Биомедицина
Технология CRISPR-Cas была предложена для лечения множества заболеваний человека, особенно тех, которые имеют генетическую причину.[93] Его способность изменять определенные последовательности ДНК делает его инструментом с потенциалом исправления мутаций, вызывающих заболевание. Ранние исследования на животных моделях показывают, что методы лечения, основанные на технологии CRISPR, имеют потенциал для лечения широкого спектра заболеваний,[94] включая рак,[95] бета-талассемия,[96] серповидноклеточная анемия,[97] гемофилия,[98] кистозный фиброз,[99] Мышечная дистрофия Дюшенна,[100] Болезнь Хантингтона,[101][102] и болезни сердца.[103] CRISPR также может найти применение в тканевой инженерии и регенеративной медицине, например, для создания кровеносных сосудов человека, в которых отсутствует экспрессия MHC класс II белки, которые часто вызывают отторжение трансплантата.[104]
CRISPR в лечении инфекции
«РНК-управляемые нуклеазы» на основе CRISPR-Cas могут быть использованы для нацеливания факторы вирулентности, гены, кодирующие устойчивость к антибиотикам и другие представляющие интерес с медицинской точки зрения последовательности. Таким образом, эта технология представляет собой новую форму противомикробной терапии и стратегию, позволяющую манипулировать популяциями бактерий.[105][106] Недавние исследования предполагают корреляцию между вмешательством в локус CRISPR-Cas и приобретением устойчивости к антибиотикам.[107] Эта система обеспечивает защиту бактерий от проникновения чужеродных ДНК, таких как транспозоны, бактериофаги, и плазмиды. Было показано, что эта система оказывает сильное избирательное давление для приобретения устойчивости к антибиотикам и фактора вирулентности у бактериальных патогенов.[107]
Терапия на основе Редактирование гена CRISPR – Cas3 Технология, поставляемая сконструированными бактериофагами, может быть использована для уничтожения целевой ДНК патогенов.[108] Cas3 более разрушительный, чем более известный Cas9.[109][110]
Исследования показывают, что CRISPR - это эффективный способ ограничить репликацию нескольких герпесвирусы. Он смог уничтожить вирусную ДНК в случае Вирус Эпштейна-Барра (EBV). Антигерпесвирусные CRISPR имеют многообещающие применения, такие как удаление вызывающих рак EBV из опухолевых клеток, помощь в избавлении от донорских органов для с ослабленным иммунитетом пациенты с вирусными захватчиками или профилактика простой герпес вспышки и рецидивирующие инфекции глаз путем блокирования HSV-1 реактивация. По состоянию на август 2016 г.[Обновить], они ожидали тестирования.[111]
CRISPR может возродить концепцию пересадка органы животных в людей. Ретровирусы присутствующие в геномах животных могут нанести вред реципиентам трансплантата. В 2015 году команда удалила 62 копии определенной последовательности ретровирусной ДНК из генома свиньи в эпителиальной клетке почки.[112] Исследователи недавно продемонстрировали способность рожать живых образцов свиней после удаления этих ретровирусов из их генома с помощью CRISPR впервые.[113]
CRISPR и рак
Первое клиническое испытание с использованием CRISPR началось в 2016 году. Оно включало удаление иммунных клеток у людей с раком легких, использование CRISPR для удаления гена, экспрессирующего PD-1, а затем введение измененных клеток обратно тому же человеку. 20 других судебных процессов находятся в стадии или почти готовы, в основном в Китае, по состоянию на 2017 год.[Обновить].[95]
В 2016 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило клиническое испытание, в котором CRISPR будет использоваться для изменения Т-клеток, выделенных у людей с различными видами рака, а затем для введения этих сконструированных Т-клеток обратно тем же людям.[114]
Нокдаун / активация

Использование "мертвых" версий Cas9 (dCas9 ) устраняет способность CRISPR разрезать ДНК, сохраняя при этом его способность нацеливаться на желаемые последовательности. Несколько групп добавляли к dCas9s различные регуляторные факторы, позволяя им включать или выключать практически любой ген или регулировать уровень его активности.[112] Подобно РНКи, CRISPR-интерференция (CRISPRi) отключает гены обратимым образом путем нацеливания, но не разрезания сайта. Целевой сайт метилирован, эпигенетически изменение гена. Эта модификация подавляет транскрипцию.Эти точно размещенные модификации могут затем использоваться для регулирования воздействия на экспрессию генов и динамику ДНК после ингибирования определенных последовательностей генома в ДНК. В течение последних нескольких лет были тщательно изучены эпигенетические метки в различных клетках человека, и было обнаружено, что определенные закономерности внутри меток коррелируют со всем, от роста опухоли до активности мозга.[9] Напротив, активация, опосредованная CRISPR (CRISPRa), способствует транскрипции гена.[115] Cas9 - эффективный способ нацеливания и подавления специфических генов на уровне ДНК.[116] У бактерий присутствие одного Cas9 достаточно, чтобы блокировать транскрипцию. Для приложений для млекопитающих добавляется часть белка. Его направляющая РНК нацелена на регуляторные последовательности ДНК, называемые промоутеры которые непосредственно предшествуют целевому гену.[117]
Cas9 использовался для перевозки синтетических факторы транскрипции которые активировали определенные гены человека. Сильный эффект достигается за счет нацеливания нескольких конструкций CRISPR на несколько разные участки промотора гена.[117]
Редактирование РНК
В 2016 году исследователи продемонстрировали, что CRISPR от обычной бактерии во рту может использоваться для редактирования РНК. Исследователи провели поиск в базах данных, содержащих сотни миллионов генетических последовательностей, в поисках тех, которые напоминают гены CRISPR. Они считали фузобактерии Leptotrichia shahii. У него была группа генов, которые напоминали гены CRISPR, но с важными отличиями. Когда исследователи снабдили этими генами другие бактерии, которые они назвали C2c2, они обнаружили, что эти организмы получили новую защиту.[118] Позднее C2c2 был переименован в Cas13a, чтобы соответствовать стандартной номенклатуре генов Cas.[119]
Многие вирусы кодируют свою генетическую информацию в РНК, а не в ДНК, которую они используют для создания новых вирусов. ВИЧ и полиовирус такие вирусы. Бактерии с Cas13 образуют молекулы, которые могут расщеплять РНК, уничтожая вирус. Настройка этих генов открывала любую молекулу РНК для редактирования.[118]
Системы CRISPR-Cas также могут использоваться для редактирования микро-РНК и длинная некодирующая РНК гены у растений.[120]
Генный драйв
Генные двигатели могут стать мощным инструментом для восстановления баланса экосистем за счет уничтожения инвазивных видов. Высказывались опасения относительно эффективности, непредвиденных последствий для целевых и нецелевых видов, особенно в связи с возможностью случайного выброса из лабораторий в дикую природу. Ученые предложили несколько мер предосторожности для обеспечения сдерживания экспериментальных генов, включая молекулярные, репродуктивные и экологические.[121] Многие рекомендуют развивать иммунизацию и инверсию в тандеме с генами, чтобы при необходимости перезаписать их эффекты.[122] По-прежнему существует консенсус в отношении того, что необходимо более тщательно изучить долгосрочные последствия, особенно в отношении потенциального экологического нарушения, которое невозможно исправить с помощью реверсивных движений.[123] Как таковой, ДНК-вычисления потребуется.
В пробирке генетическое истощение
Необогащенные библиотеки секвенирования часто содержат большое количество нежелательных последовательностей. Cas9 может специально истощать нежелательные последовательности с помощью двухцепочечного разрыва с эффективностью до 99% и без значительного нецелевые эффекты как видно с рестрикционные ферменты. Обработка Cas9 может истощить обильную рРНК, увеличивая при этом чувствительность к патогенам в библиотеках РНК-seq.[124]
Основное редактирование
Основное редактирование[125] (или базовое редактирование) - это усовершенствование CRISPR для точной вставки или удаления участков ДНК. Редактирование CRISPR не всегда безупречно, и разрезы могут оказаться не в том месте. Обе проблемы являются проблемой для использования технологий в медицине.[126] Первичное редактирование не разрезает двухцепочечную ДНК, а вместо этого использует нацеленный аппарат CRISPR для перемещения дополнительного фермента к желаемой последовательности, где он преобразует один нуклеотид в другой.[127] Новое руководство, называемое pegRNA, содержит матрицу РНК для новой последовательности ДНК, которая должна быть добавлена в геном в целевом месте. Для этого требуется второй белок, присоединенный к Cas9: фермент обратной транскриптазы, который может создавать новую цепь ДНК из матрицы РНК и вставлять ее в разорванный сайт.[128] Каждое из этих трех независимых событий сопряжения дает возможность предотвратить последовательности, не соответствующие цели, что значительно увеличивает гибкость нацеливания и точность редактирования.[127] Редактирование Prime было разработано исследователями из Широкий институт Массачусетского технологического института и Гарварда в Массачусетсе.[129] Требуется дополнительная работа по оптимизации методов.[129][128]
Общество и культура
Модификация зародышевой линии человека
По состоянию на март 2015 года несколько групп объявили о продолжающихся исследованиях с намерением заложить основы для применения CRISPR к человеческим эмбрионам для инженерия зародышевой линии человека, включая лаборатории в США, Китае и Великобритании, а также американскую биотехнологическую компанию OvaScience.[130] Ученые, в том числе один из первооткрывателей CRISPR, призвали ввести во всем мире мораторий на применение CRISPR к зародышевой линии человека, особенно в клинических целях. Они заявили, что «ученым следует избегать даже попыток в слабых юрисдикциях модифицировать геном зародышевой линии для клинического применения на людях» до тех пор, пока все последствия «не будут обсуждены научными и правительственными организациями».[131][132] Эти ученые поддерживают дальнейшие низкоуровневые исследования CRISPR и не считают CRISPR достаточно развитым для любого клинического использования при внесении наследственных изменений в людей.[133]
В апреле 2015 года китайские ученые сообщили о результатах попытки изменить ДНК нежизнеспособных человеческие эмбрионы использование CRISPR для исправления мутации, вызывающей бета-талассемия, смертельное наследственное заболевание.[134][135] Исследование ранее было отклонено обоими Природа и Наука отчасти из-за этических соображений.[136] В результате экспериментов удалось изменить только некоторые из предполагаемых генов и нецелевые эффекты на другие гены. Исследователи заявили, что CRISPR не готов к клиническому применению в репродуктивная медицина.[136] Сообщалось, что в апреле 2016 года китайские ученые предприняли вторую безуспешную попытку изменить ДНК нежизнеспособных человеческих эмбрионов с помощью CRISPR - на этот раз для изменения CCR5 ген, обеспечивающий устойчивость эмбриона к ВИЧ инфекция.[137]
В декабре 2015 года в Вашингтоне прошел Международный саммит по редактированию генов человека под руководством Дэвид Балтимор. Члены национальных академий наук США, Великобритании и Китая обсудили этику модификации зародышевой линии. Они согласились поддерживать фундаментальные и клинические исследования в соответствии с определенными правовыми и этическими принципами. Особое различие проводилось между соматические клетки, где эффекты редактирования ограничены одним человеком и клетками зародышевой линии, где изменения генома могут быть унаследованы потомками. Унаследованные модификации могут иметь непредвиденные и далеко идущие последствия для эволюции человека, генетически (например, взаимодействие гена и окружающей среды) и культурно (например, социальный дарвинизм ). Изменение гаметоциты и эмбрионы, вызывающие наследственные изменения у людей, были определены как безответственные. Группа согласилась инициировать международный форум для решения таких проблем и согласования правил в разных странах.[138]
В феврале 2017 г. Национальные академии наук, инженерии и медицины США (НАСЕМ Комитет по редактированию генов человека опубликовал отчет, в котором рассматриваются этические, правовые и научные аспекты технологии геномной инженерии. В заключении отчета говорилось, что наследственное редактирование генома сейчас недопустимо, но может быть оправдано при определенных заболеваниях; однако они не оправдывали использование CRISPR для улучшения.[139]
В ноябре 2018 г. Цзянькуй Хэ объявил, что отредактировал два человеческих эмбриона, пытаясь отключить ген для CCR5, который кодирует рецептор, ВИЧ используется для входа в клетки. Он сказал, что девочки-близнецы, Лулу и Нана, родился несколькими неделями ранее. Он сказал, что у девочек все еще есть функциональные копии CCR5 вместе с отключенным CCR5 (мозаика ) и все еще были уязвимы к ВИЧ. Работа была широко осуждена как неэтичная, опасная и преждевременная.[140] Международная группа ученых призвала к глобальному мораторию на генетическое редактирование человеческих эмбрионов.[141]
Политические барьеры для генной инженерии
Правила политики для системы CRISPR-Cas9 различаются по всему миру. В феврале 2016 года регуляторы разрешили британским ученым генетически модифицировать человеческие эмбрионы с помощью CRISPR-Cas9 и связанных методов. Однако исследователям было запрещено имплантировать эмбрионы, и эмбрионы должны были быть уничтожены через семь дней.[142]
В США существует продуманная межведомственная система регулирования для оценки новых генетически модифицированных продуктов питания и сельскохозяйственных культур. Например, Закон о защите сельскохозяйственных рисков 2000 г. дает Министерство сельского хозяйства США полномочия по надзору за обнаружением, контролем, искоренением, подавлением, предотвращением или замедлением распространения вредителей растений или вредных сорняков для защиты сельского хозяйства, окружающей среды и экономики США. Закон регулирует любые генетически модифицированный организм который использует геном заранее определенного «вредителя растений» или любого растения, ранее не классифицированного.[143] В 2015 году Иньонг Ян успешно деактивировал 16 специфических генов в белый шампиньон чтобы они не подрумянились. Поскольку он не добавил никаких чужеродных видов (трансгенный ) ДНК его организма, гриб не мог регулироваться Министерством сельского хозяйства США в соответствии с разделом 340.2.[144] Белый шампиньон Янга был первым организмом, генетически модифицированным с помощью белковой системы CRISPR-Cas9, который прошел регулирование в США.[145]
В 2016 году Министерство сельского хозяйства США спонсировало комитет для рассмотрения будущей нормативной политики в отношении будущих методов генетической модификации. С помощью США Национальные академии наук, инженерии и медицины, группы с особыми интересами встретились 15 апреля, чтобы обдумать возможные достижения в генной инженерии в течение следующих пяти лет и любые новые правила, которые могут потребоваться в результате.[146] В 2017 г. Управление по контролю за продуктами и лекарствами предложили правило, которое классифицирует генно-инженерные модификации животных как «лекарства для животных», подвергая их строгому регулированию, если они будут выставлены на продажу, и ограничивая возможности частных лиц и малых предприятий делать их прибыльными.[147][148]
В Китае, где социальные условия резко отличаются от условий на Западе, генетические заболевания вызывают серьезную стигму.[149] Это оставляет Китаю меньше политических барьеров для использования этой технологии.[150][151]
Признание
В 2012 и 2013 годах CRISPR занял второе место в рейтинге Научный журнал с Прорыв года награда. В 2015 году он стал обладателем этой награды.[112] CRISPR был назван одним из Обзор технологий MIT's 10 прорывных технологий в 2014 и 2016 годах.[152][153] В 2016 г. Дженнифер Дудна и Эммануэль Шарпантье вместе с Рудольфом Баррангу, Филипп Хорват, и Фэн Чжан получил награду Gairdner International. В 2017 году Дудна и Шарпантье были награждены Премией Японии в Токио, Япония, за революционное изобретение CRISPR-Cas9. В 2016 году Шарпантье, Дудна и Чжан выиграли Приз Тан в биофармацевтической науке.[154] В 2020 году Шарпантье и Дудна были награждены Нобелевская премия по химии «За разработку метода редактирования генома».[155]
Смотрите также
использованная литература
- ^ Хендель А., Бак Р.О., Кларк Д.Т., Кеннеди А.Б., Райан Д.Е., Рой С., Стейнфельд И., Лунстад Б.Д., Кайзер Р.Дж., Вилкенс А.Б., Баккетта Р., Цаленко А., Деллингер Д., Брюн Л., Портеус М.Х. (сентябрь 2015 г.). «Химически модифицированные направляющие РНК улучшают редактирование генома CRISPR-Cas в первичных клетках человека». Природа Биотехнологии. 33 (9): 985–9. Дои:10.1038 / nbt.3290. ЧВК 4729442. PMID 26121415.
- ^ Коэн, Джон (7 октября 2020 г.). «CRISPR, революционные генетические« ножницы », удостоенные Нобелевской премии по химии». Наука. Дои:10.1126 / science.abf0540.
- ^ CohenJun. 4, Джон; 2018; Вечер, 12:45 (04.06.2018). «С престижной наградой в центре внимания становится малоизвестный исследователь CRISPR». Наука | AAAS. Получено 2020-05-02.CS1 maint: числовые имена: список авторов (ссылка на сайт)
- ^ Литовские ученые не получили Нобелевской премии, несмотря на открытие той же технологии. LRT.LT
- ^ Шикшнис, Виргиниюс (16.06.2018). "Imam genų žirkles, iškerpam klaidą, ligos nelieka". Laisvės TV / Freedom TV (на литовском языке). 12:22 мин. LaisvėsTV. <...> Tai mes tą savo straipsnį išsiuntėm į redakciją pirmieji, bet laimės ten daug nebuvo. Viena edakcija pasakė, kad mes net Recenzentam nesiųsim. Nusiuntėm į kitą redakciją - tai jis (straipsnis) pragulėjo kažkur ant redaktoriaus stalo labai ilgai. Na ir taip galų gale išsiuntėm į trečią žurnalą ir trečias žurnalas po kelių mėnesių jį išspausdino. Bet, aišku, Berklio university mokslininkams sekėsi geriau - jie išsiuntė straipsnį į žurnalą Science - jį priėmė ir išspausdino per 2 savaites. Nors iš tikro jie tą straispnį išsiuntė pora mėnesių vėliau nei mes. Получено 2018-06-30.
<...> Ну, это мы первыми прислали статью, но нам не повезло. В одной редакции нам сказали, что статью рецензентам не будут отправлять. Мы отправили статью в другой журнал - и статья хранилась слишком долго, может быть, на каком-то столе редактора. В конце концов, мы отправили его в третий журнал, и через несколько месяцев он был опубликован. Между тем ученым из Университета Беркли повезло больше - они прислали статью позже, чем мы, и она была принята и опубликована через две недели. Но на самом деле они прислали статью на несколько месяцев позже нас.
- ^ а б Бак Р.О., Гомес-Оспина Н., Портеус М.Х. (2018). «Генное редактирование в центре внимания». Тенденции в генетике. 34 (8): 600–611. Дои:10.1016 / j.tig.2018.05.004. PMID 29908711.
- ^ Чжан Дж. Х., Пандей М., Калер Дж. Ф., Лошаков А., Харрис Б., Дагур П. К., Мо Ю. Ю., Саймондс В. Ф. (ноябрь 2014 г.). «Повышение специфичности и эффективности CRISPR / CAS9 и гРНК с помощью репортера целевой ДНК». Журнал биотехнологии. 189: 1–8. Дои:10.1016 / j.jbiotec.2014.08.033. ЧВК 4252756. PMID 25193712.
- ^ Вакульскас К.А., Девер Д.П., Реттиг Г.Р., Тюрк Р., Якоби А.М., Коллингвуд М.А., Бод Н.М., Макнил М.С., Ян С., Камарена Дж., Ли С.М., Парк С.Х., Вибкинг В., Бак Р.О., Гомес-Оспина Н., Павел-Дину M, Sun W, Bao G, Porteus MH, Behlke MA (август 2018 г.). «Высококачественный мутант Cas9, доставляемый в виде рибонуклеопротеинового комплекса, позволяет эффективно редактировать гены в гемопоэтических стволовых и клетках-предшественниках». Природа Медицина. 24 (8): 1216–1224. Дои:10.1038 / s41591-018-0137-0. ЧВК 6107069. PMID 30082871.
- ^ а б c Ледфорд Х (март 2016 г.). «CRISPR: редактирование генов - это только начало». Природа. 531 (7593): 156–9. Bibcode:2016Натура.531..156Л. Дои:10.1038 / 531156a. PMID 26961639.
- ^ Трэвис Дж (17 декабря 2015 г.). «Прорыв года: CRISPR - лучший вариант». Научный журнал. Американская ассоциация развития науки.
- ^ Ледфорд Х (июнь 2015 г.). "CRISPR, разрушитель". Природа. 522 (7554): 20–4. Bibcode:2015Натура.522 ... 20л. Дои:10.1038 / 522020a. PMID 26040877.
- ^ Янг С. (11 февраля 2014 г.). "CRISPR и другие инструменты редактирования генома расширяют возможности медицинских исследований и генной терапии". Обзор технологий MIT. Получено 2014-04-13.
- ^ а б Хайденрайх М., Чжан Ф. (январь 2016 г.). «Применение систем CRISPR-Cas в неврологии». Обзоры природы. Неврология. 17 (1): 36–44. Дои:10.1038 / номер 2015.2. ЧВК 4899966. PMID 26656253.
- ^ Баррангу Р., Дудна Дж. А. (сентябрь 2016 г.). «Применение технологий CRISPR в исследованиях и за его пределами». Природа Биотехнологии. 34 (9): 933–941. Дои:10.1038 / nbt.3659. PMID 27606440. S2CID 21543486.
- ^ Cox DB, Platt RJ, Zhang F (февраль 2015 г.). «Терапевтическое редактирование генома: перспективы и проблемы». Природа Медицина. 21 (2): 121–31. Дои:10,1038 / нм.3793. ЧВК 4492683. PMID 25654603.
- ^ Поллак, Эндрю (11 мая 2015 г.). "Дженнифер Дудна, пионер, которая помогла упростить редактирование генома". Газета "Нью-Йорк Таймс. Получено 8 октября, 2020.
- ^ "Безумие CRISPR". GEN. 2013-11-08.
- ^ Персонал (1 апреля 2015 г.). «Новости: Товары и услуги». Новости генной инженерии и биотехнологии (Бумага). 35 (7): 8. Дои:10.1089 / gen.35.21.05.
- ^ «Кому принадлежит крупнейшее биотехнологическое открытие века? Идет ожесточенная борьба за патенты на CRISPR, новую революционную форму редактирования ДНК». Массачусетский технологический институт Обзор технологий. Получено 25 февраля 2015.
- ^ Фай С. «Генетический черновик: Editas и CRISPR». Бизнес-журнал Атлас. Получено 19 января 2016.
- ^ Поллак А (15 февраля 2017 г.). "Ученые Гарварда и Массачусетского технологического института выиграли патентную битву за редактирование генов". Нью-Йорк Таймс.
- ^ Акст Ж (15 февраля 2017 г.). "Броуд выигрывает дело о патентном вмешательстве CRISPR". Журнал Ученый.
- ^ Нунан К.Е. (16 февраля 2017 г.). «PTAB решает вмешательство CRISPR в пользу Института Броуда - их доводы». Патентные документы.
- ^ Potenza A (13 апреля 2017 г.). «Калифорнийский университет в Беркли оспаривает решение о том, что патенты CRISPR принадлежат Broad Institute. 3 комментария Судебная тяжба, вероятно, будет продолжаться в течение месяцев или даже лет». Грани. Получено 22 сентября 2017.
- ^ Buhr S (26 июля 2017 г.). «Битва за патенты CRISPR возобновляется, поскольку Калифорнийский университет в Беркли подает апелляцию». TechCrunch. Получено 22 сентября 2017.
- ^ а б Филиппидис А. (7 августа 2017 г.). «MilliporeSigma получит европейский патент на технологию CRISPR». Новости генной инженерии и биотехнологии. Получено 22 сентября 2017.
- ^ Акст Ж (24 марта 2017 г.). «Калифорнийский университет в Беркли получает патент CRISPR в Европе». Ученый. Получено 22 сентября 2017.
- ^ Коэн Дж. (4 августа 2017 г.). «Битва за патенты CRISPR в Европе принимает« дикий »поворот с удивительным игроком». Наука. Дои:10.1126 / science.aan7211.
- ^ «Главный суд ЕС: правила ГМО касаются техники редактирования генов растений». Retuers. 25 июля 2018.
- ^ AFP. «Исследование в США показывает, что геномы трех больных раком были безопасно изменены с помощью CRISPR». ScienceAlert. Получено 2020-02-09.
- ^ СП Чамари. «Эти ученые заслужили Нобелевскую премию, но не открыли Crispr». Forbes. Получено 2020-07-10.
- ^ а б c d е Ран Ф.А., Сюй П.Д., Райт Дж., Агарвала В., Скотт Д.А., Чжан Ф. (ноябрь 2013 г.). «Геномная инженерия с использованием системы CRISPR-Cas9». Протоколы природы. 8 (11): 2281–308. Дои:10.1038 / nprot.2013.143. HDL:1721.1/102943. ЧВК 3969860. PMID 24157548.
- ^ Ли Дж (2013). Обнаружение генов, ответственных за заболевания почек (Кандидат наук.). Университет Торонто. Получено 26 декабря 2016.
- ^ Мор С.Е., Ху Й., Эвен-Кампен Б., Хаусден Б.Е., Вишваната Р., Перримон Н. (сентябрь 2016 г.). «Руководство CRISPR по разработке РНК для исследовательских приложений». Журнал FEBS. 283 (17): 3232–8. Дои:10.1111 / фев.13777. ЧВК 5014588. PMID 27276584.
- ^ Бразелтон В.А., Зарекор С., Райт Д.А., Ван Й., Лю Дж., Чен К., Ян Б., Лоуренс-Дилл С.Дж. (2015). «Краткое руководство по инструментам разработки CRISPR sgRNA». ГМ-культуры и продукты питания. 6 (4): 266–76. Дои:10.1080/21645698.2015.1137690. ЧВК 5033207. PMID 26745836.
- ^ Хорват П., Баррангу Р. (январь 2010 г.). «CRISPR / Cas, иммунная система бактерий и архей». Наука. 327 (5962): 167–70. Bibcode:2010Sci ... 327..167H. Дои:10.1126 / science.1179555. PMID 20056882. S2CID 17960960.
- ^ Бялк П., Ривера-Торрес Н., Страус Б., Кмиец Э.Б. (08.06.2015). «Регулирование активности редактирования генов, управляемой одноцепочечными олигонуклеотидами и системами CRISPR / Cas9». PLOS ONE. 10 (6): e0129308. Bibcode:2015PLoSO..1029308B. Дои:10.1371 / journal.pone.0129308. ЧВК 4459703. PMID 26053390.
- ^ Сандер JD, Joung JK (апрель 2014 г.). «Системы CRISPR-Cas для редактирования, регулирования и нацеливания на геномы». Природа Биотехнологии. 32 (4): 347–55. Дои:10.1038 / nbt.2842. ЧВК 4022601. PMID 24584096.
- ^ Lino CA, Harper JC, Carney JP, Timlin JA (ноябрь 2018 г.). «Доставка CRISPR: обзор проблем и подходов». Доставка наркотиков. 25 (1): 1234–1257. Дои:10.1080/10717544.2018.1474964. ЧВК 6058482. PMID 29801422.
- ^ Ли Л., Ху С., Чен Х (июль 2018 г.). «Невирусные системы доставки для редактирования генома на основе CRISPR / Cas9: проблемы и возможности». Биоматериалы. 171: 207–218. Дои:10.1016 / j.biomaterials.2018.04.031. ЧВК 5944364. PMID 29704747.
- ^ Бак Р.О., Портеус М.Х. (июль 2017 г.). «CRISPR-опосредованная интеграция больших генных кассет с использованием донорных векторов AAV». Отчеты по ячейкам. 20 (3): 750–756. Дои:10.1016 / j.celrep.2017.06.064. ЧВК 5568673. PMID 28723575.
- ^ Шмидт Ф., Гримм Д. (февраль 2015 г.). «Геномная инженерия CRISPR и доставка вирусных генов: случай взаимного притяжения». Биотехнологический журнал. 10 (2): 258–72. Дои:10.1002 / biot.201400529. PMID 25663455. S2CID 37653318.
- ^ Ваксмонский Н. (24 сентября 2015 г.). "CRISPR 101: Системы экспрессии млекопитающих и способы доставки". Получено 11 июн 2018.
- ^ а б Оукс Б.Л., Надлер, округ Колумбия, Фламхольц А., Феллманн С., Шталь Б.Т., Дудна Д.А., Сэвидж Д.Ф. (июнь 2016 г.). «Профилирование инженерных горячих точек позволяет идентифицировать аллостерический переключатель CRISPR-Cas9». Природа Биотехнологии. 34 (6): 646–51. Дои:10.1038 / nbt.3528. ЧВК 4900928. PMID 27136077.
- ^ Нуньес Дж. К., Харрингтон Л. Б., Дудна Дж. А. (март 2016 г.). «Химическая и биофизическая модуляция Cas9 для настраиваемой инженерии генома». ACS Химическая биология. 11 (3): 681–8. Дои:10.1021 / acschembio.5b01019. PMID 26857072.
- ^ Чжоу В., Дейтерс А. (апрель 2016 г.). «Условное управление функцией CRISPR / Cas9». Angewandte Chemie. 55 (18): 5394–9. Дои:10.1002 / anie.201511441. PMID 26996256.
- ^ Польштейн Л. Р., Герсбах Калифорния (март 2015 г.). «Индуцируемая светом система CRISPR-Cas9 для контроля активации эндогенных генов». Природа Химическая Биология. 11 (3): 198–200. Дои:10.1038 / nchembio.1753. ЧВК 4412021. PMID 25664691.
- ^ Нихонгаки Ю., Ямамото С., Кавано Ф, Сузуки Х, Сато М. (февраль 2015 г.). «Фотоактивируемая система транскрипции на основе CRISPR-Cas9». Химия и биология. 22 (2): 169–74. Дои:10.1016 / j.chembiol.2014.12.011. PMID 25619936.
- ^ Райт А.В., Штернберг С.Х., Тейлор Д.В., Шталь Б.Т., Бардалес Дж.А., Корнфельд Дж. Э., Дудна Дж. А. (март 2015 г.). «Рациональный дизайн ферментного комплекса расщепления Cas9». Труды Национальной академии наук Соединенных Штатов Америки. 112 (10): 2984–9. Bibcode:2015PNAS..112.2984W. Дои:10.1073 / pnas.1501698112. ЧВК 4364227. PMID 25713377.
- ^ Нихонгаки Ю., Кавано Ф, Накадзима Т., Сато М. (июль 2015 г.). «Фотоактивируемый CRISPR-Cas9 для оптогенетического редактирования генома». Природа Биотехнологии. 33 (7): 755–60. Дои:10.1038 / nbt.3245. PMID 26076431. S2CID 205281536.
- ^ Хемфилл Дж., Борхардт Е.К., Браун К., Асокан А., Дейтерс А. (май 2015 г.). «Оптический контроль редактирования генов CRISPR / Cas9». Журнал Американского химического общества. 137 (17): 5642–5. Дои:10.1021 / ja512664v. ЧВК 4919123. PMID 25905628.
- ^ Джейн П.К., Раманан В., Шеперс А.Г., Далви Н.С., Панда А., Флеминг Х.Э., Бхатия С.Н. (сентябрь 2016 г.). «Разработка светоактивированного CRISPR с использованием направляющих РНК с фоторасщепляемыми протекторами». Angewandte Chemie. 55 (40): 12440–4. Дои:10.1002 / anie.201606123. ЧВК 5864249. PMID 27554600.
- ^ Дэвис К. М., Паттанаяк В., Томпсон Д. Б., Зурис Дж. А., Лю Д. Р. (май 2015 г.). «Белок Cas9, запускаемый малыми молекулами, с улучшенной специфичностью редактирования генома». Природа Химическая Биология. 11 (5): 316–8. Дои:10.1038 / nchembio.1793. ЧВК 4402137. PMID 25848930.
- ^ Лю К.И., Рамли М.Н., Ву К.В., Ван И, Чжао Т., Чжан Икс, Иим Г.Р., Чонг Б.А., Гаухер А., Чуа М.З., Юнг Дж., Ли Дж.Х., Тан М.Х. (ноябрь 2016 г.). «Химически индуцируемая система CRISPR-Cas9 для быстрого контроля редактирования генома». Природа Химическая Биология. 12 (11): 980–987. Дои:10.1038 / nchembio.2179. PMID 27618190. S2CID 33891039.
- ^ Truong DJ, Kühner K, Kühn R, Werfel S, Engelhardt S, Wurst W., Ortiz O (июль 2015 г.). «Разработка интерактивной сплит-системы Cas9 для генной терапии». Исследования нуклеиновых кислот. 43 (13): 6450–8. Дои:10.1093 / nar / gkv601. ЧВК 4513872. PMID 26082496.
- ^ Zetsche B, Volz SE, Zhang F (февраль 2015 г.). «Архитектура split-Cas9 для индуцибельного редактирования генома и модуляции транскрипции». Природа Биотехнологии. 33 (2): 139–42. Дои:10.1038 / nbt.3149. ЧВК 4503468. PMID 25643054.
- ^ Гонсалес Ф., Чжу З., Ши З. Д., Лелли К., Верма Н., Ли К. В., Хуанфу Д. (август 2014 г.). «Платформа iCRISPR для быстрого, мультиплексируемого и индуцибельного редактирования генома в плюрипотентных стволовых клетках человека». Стволовая клетка клетки. 15 (2): 215–26. Дои:10.1016 / j.stem.2014.05.018. ЧВК 4127112. PMID 24931489.
- ^ Доу Л.Е., Фишер Дж., О'Рурк К.П., Мули А., Кастенхубер Е.Р., Лившиц Г., Чахарганех Д.Ф., Соци Н.Д., Лоу С.В. (апрель 2015 г.). «Индуцируемое редактирование генома in vivo с помощью CRISPR-Cas9». Природа Биотехнологии. 33 (4): 390–4. Дои:10.1038 / nbt.3155. ЧВК 4390466. PMID 25690852.
- ^ Ю Ц, Лю И, Ма Т, Лю К., Сюй С., Чжан И, Лю Х, Ла Русса М., Се М., Дин С., Ци Л.С. (февраль 2015 г.). «Малые молекулы улучшают редактирование генома CRISPR в плюрипотентных стволовых клетках». Стволовая клетка клетки. 16 (2): 142–7. Дои:10.1016 / j.stem.2015.01.003. ЧВК 4461869. PMID 25658371.
- ^ Маруяма Т., Дуган С.К., Труттманн М.С., Билате А.М., Инграм-младший, Плоег Х.Л. (май 2015 г.). «Повышение эффективности точного редактирования генома с помощью CRISPR-Cas9 за счет ингибирования негомологичного соединения концов». Природа Биотехнологии. 33 (5): 538–42. Дои:10.1038 / nbt.3190. ЧВК 4618510. PMID 25798939.
- ^ а б c Курата М., Ямамото К., Мориарити Б.С., Китагава М., Ларгаэспада Д.А. (февраль 2018 г.). «Скрининг библиотеки CRISPR / Cas9 для открытия лекарственной мишени». Журнал генетики человека. 63 (2): 179–186. Дои:10.1038 / с10038-017-0376-9. PMID 29158600. S2CID 3308058.
- ^ Хираннирамол К., Чен И, Лю В., Ван Х (январь 2020 г.). «Обобщенный дизайн sgRNA для повышения эффективности редактирования CRISPR / Cas9». Биоинформатика. 36 (9): 2684–2689. Дои:10.1093 / биоинформатика / btaa041. ЧВК 7203743. PMID 31971562.
- ^ а б c Агротис А., Кеттелер Р. (24 сентября 2015 г.). «Новая эра в функциональной геномике с использованием CRISPR / Cas9 при скрининге библиотек». Границы генетики. 6: 300. Дои:10.3389 / fgene.2015.00300. ЧВК 4585242. PMID 26442115.
- ^ Ю. Дж. С., Юса К. (июль 2019 г.). «Полногеномный скрининг CRISPR-Cas9 в клетках млекопитающих». Методы. 164–165: 29–35. Дои:10.1016 / j.ymeth.2019.04.015. PMID 31034882.
- ^ Joung J, Konermann S, Gootenberg JS, Abudayyeh OO, Platt RJ, Brigham MD, et al. (Апрель 2017 г.). «Геномный нокаут CRISPR-Cas9 и скрининг транскрипционной активации». Протоколы природы. 12 (4): 828–863. Дои:10.1038 / nprot.2017.016. ЧВК 5526071. PMID 28333914.
- ^ Joung J, Konermann S, Gootenberg JS, Abudayyeh OO, Platt RJ, Brigham MD, et al. (Апрель 2017 г.). «Геномный нокаут CRISPR-Cas9 и скрининг транскрипционной активации». Протоколы природы. 12 (4): 828–863. Дои:10.1038 / nprot.2017.016. ЧВК 5526071. PMID 28333914.
- ^ "Addgene: объединенные библиотеки". www.addgene.org. Получено 2020-01-31.
- ^ Макдейд-младший, Ваксмонский NC, Swanson LE, Fan M (июль 2016 г.). «Практические рекомендации по использованию объединенных лентивирусных библиотек CRISPR». Текущие протоколы в молекулярной биологии. 115 (1): 31.5.1–31.5.13. Дои:10.1002 / cpmb.8. PMID 27366891. S2CID 5055878.
- ^ Cheng AW, Wang H, Yang H, Shi L, Katz Y, Theunissen TW и др. (Октябрь 2013). «Мультиплексная активация эндогенных генов с помощью CRISPR-on, системы активаторов транскрипции, управляемой РНК». Клеточные исследования. 23 (10): 1163–71. Дои:10.1038 / cr.2013.122. ЧВК 3790238. PMID 23979020.
- ^ Гилберт Л.А., Хорлбек М.А., Адамсон Б., Вильялта Дж. Э., Чен Ю., Уайтхед Е. Х. и др. (Октябрь 2014 г.). "Контроль репрессии и активации генов, опосредованный CRISPR в масштабе генома". Ячейка. 159 (3): 647–61. Дои:10.1016 / j.cell.2014.09.029. ЧВК 4253859. PMID 25307932.
- ^ а б Dow LE (октябрь 2015 г.). «Моделирование болезни in vivo с помощью CRISPR / Cas9». Тенденции в молекулярной медицине. 21 (10): 609–621. Дои:10.1016 / j.molmed.2015.07.006. ЧВК 4592741. PMID 26432018.
- ^ Дудна Дж, Мали П. (2016). CRISPR-Cas: лабораторное руководство. Колд-Спринг-Харбор, Нью-Йорк. ISBN 9781621821304. OCLC 922914104.
- ^ Цзо Э, Хо Х, Яо Х, Ху Х, Сунь Y, Инь Дж и др. (2017). «CRISPR / Cas9-опосредованное целевое устранение хромосом». Геномная биология. 18 (1): 224. Дои:10.1186 / s13059-017-1354-4. ЧВК 5701507. PMID 29178945. Сложить резюме – Genome Web.
- ^ Джавед М.Р., Садаф М., Ахмед Т., Джамиль А., Наваз М., Аббас Н., Иджаз А. (август 2018 г.). «Система CRISPR-Cas: история и перспективы как инструмент редактирования генома у микроорганизмов». обзор. Современная микробиология. 75 (12): 1675–1683. Дои:10.1007 / s00284-018-1547-4. PMID 30078067. S2CID 51920661.
- ^ Гирш Р.М., Finnigan GC (декабрь 2017 г.). «Дрожжи - все еще чудовище: разнообразные применения технологии редактирования CRISPR / Cas в S. cerevisiae». Йельский журнал биологии и медицины. 90 (4): 643–651. ЧВК 5733842. PMID 29259528.
- ^ Рашманова Х, Венингер А, Глидер А, Ковар К., Фогл Т (2018). «Внедрение технологий CRISPR-Cas в традиционных и нетрадиционных дрожжах: текущее состояние и перспективы на будущее». обзор. Достижения биотехнологии. 36 (3): 641–665. Дои:10.1016 / j.biotechadv.2018.01.006. PMID 29331410.
- ^ а б Ма Д., Лю Ф (декабрь 2015 г.). «Редактирование генома и его применение в модельных организмах». обзор. Геномика, протеомика и биоинформатика. 13 (6): 336–44. Дои:10.1016 / j.gpb.2015.12.001. ЧВК 4747648. PMID 26762955.
- ^ Хуршид Х, Ян С.А., Шинвари З.К., Джамал М., Шах Ш. (2018). «Эра редактирования генома растений, опосредованного CRISPR / Cas9». обзор. Актуальные проблемы молекулярной биологии. 26: 47–54. Дои:10.21775 / cimb.026.047. PMID 28879855.
- ^ Симоне Б.В., Мартинес-Гальвес Дж., WareJoncas Z, Эккер СК (август 2018 г.). «Рыбалка за понимание: разблокировка набора инструментов редактора генов рыбок данио». обзор. Методы. 150: 3–10. Дои:10.1016 / j.ymeth.2018.07.012. ЧВК 6590056. PMID 30076892.
- ^ Сингх П., Шименти Дж. К., Болкун-Филас Э. (январь 2015 г.). «Практическое руководство по приложениям CRISPR для мыши-генетика». обзор. Генетика. 199 (1): 1–15. Дои:10.1534 / genetics.114.169771. ЧВК 4286675. PMID 25271304.
- ^ Soni D, Wang DM, Regmi SC, Mittal M, Vogel SM, Schlüter D, Tiruppathi C (май 2018 г.). «Деубиквитиназная функция A20 поддерживает и восстанавливает эндотелиальный барьер после повреждения сосудов легких». Открытие смерти клетки. 4 (60): 60. Дои:10.1038 / s41420-018-0056-3. ЧВК 5955943. PMID 29796309.
- ^ Гао X, Тао Y, Ламас V, Хуанг М., Йе WH, Пан Б. и др. (2018). «Лечение аутосомно-доминантной потери слуха путем доставки in vivo агентов для редактирования генома». Природа. 553 (7687): 217–221. Bibcode:2018Натура.553..217G. Дои:10.1038 / природа25164. ЧВК 5784267. PMID 29258297.
- ^ Кадам США, Шелак Р.М., Чавхан Р.Л., Супрасанна П. (октябрь 2018 г.). «Обеспокоенность относительно« нецелевой »активности эндонуклеаз, редактирующих геном». обзор. Физиология и биохимия растений. 131: 22–30. Дои:10.1016 / j.plaphy.2018.03.027. PMID 29653762.
- ^ Kimberland ML, Hou W., Alfonso-Pecchio A, Wilson S, Rao Y, Zhang S, Lu Q (август 2018 г.). «Стратегии управления нецелевыми эффектами CRISPR / Cas9 и биологическими вариациями в экспериментах по редактированию генома млекопитающих». обзор. Журнал биотехнологии. 284: 91–101. Дои:10.1016 / j.jbiotec.2018.08.007. PMID 30142414.
- ^ ван Эрп ПБ, Блумер Дж., Уилкинсон Р., Виденхефт Б. (июнь 2015 г.). «История и влияние на рынок CRISPR РНК-управляемых нуклеаз». Текущее мнение в вирусологии. 12: 85–90. Дои:10.1016 / j.coviro.2015.03.011. ЧВК 4470805. PMID 25914022.
- ^ Maggio I, Gonçalves MA (май 2015 г.). «Редактирование генома на перекрестке доставки, специфичности и точности». Тенденции в биотехнологии. 33 (5): 280–91. Дои:10.1016 / j.tibtech.2015.02.011. PMID 25819765.
- ^ Рат Д., Амлингер Л., Рат А., Лундгрен М. (октябрь 2015 г.). «Иммунная система CRISPR-Cas: биология, механизмы и приложения». Биохимия. 117: 119–28. Дои:10.1016 / j.biochi.2015.03.025. PMID 25868999.
- ^ «Что такое CRISPR? Как это работает? Это генное редактирование?» LiveScience.Tech ». LiveScience.Tech. 2018-04-30. Получено 2020-02-06.
- ^ а б Фридман Б.С., Брукс С.Р., Лам А.К., Фу Х., Моризейн Р., Агравал В. и др. (Октябрь 2015 г.). «Моделирование заболевания почек с помощью CRISPR-мутантных почечных органоидов, полученных из плюрипотентных сфероидов эпибласта человека». Nature Communications. 6: 8715. Bibcode:2015 НатКо ... 6.8715F. Дои:10.1038 / ncomms9715. ЧВК 4620584. PMID 26493500.
- ^ Cruz NM, Song X, Czerniecki SM, Gulieva RE, Churchill AJ, Kim YK, et al. (Ноябрь 2017 г.). «Органоидный цистогенез показывает критическую роль микросреды в поликистозной болезни почек человека». Материалы Природы. 16 (11): 1112–1119. Bibcode:2017НатМа..16.1112C. Дои:10.1038 / nmat4994. ЧВК 5936694. PMID 28967916.
- ^ Ким Ю.К., Рафаэли И., Брукс К.Р., Цзин П., Гулиева Р.Э., Хьюз М.Р. и др. (Декабрь 2017 г.). "Генно-отредактированные органоиды почек человека раскрывают механизмы заболевания в развитии подоцитов". Стволовые клетки. 35 (12): 2366–2378. Дои:10.1002 / шток.2707. ЧВК 5742857. PMID 28905451.
- ^ Беллин М., Казини С., Дэвис Р.П., Д'Аниелло С., Хаас Дж., Уорд-ван Оостваард Д., Тертулен Л.Г., Юнг С.Б., Эллиот Д.А., Веллинг А., Лаугвиц К.Л., Моретти А., Mummery CL (декабрь 2013 г.). «Изогенные пары плюрипотентных стволовых клеток человека раскрывают роль мутации KCNH2 в синдроме длинного QT». Журнал EMBO. 32 (24): 3161–75. Дои:10.1038 / emboj.2013.240. ЧВК 3981141. PMID 24213244.
- ^ Цай Л., Фишер А.Л., Хуанг Х., Се З. (декабрь 2016 г.). «Редактирование генома с помощью CRISPR и болезни человека». Гены и болезни. 3 (4): 244–251. Дои:10.1016 / j.gendis.2016.07.003. ЧВК 6150104. PMID 30258895.
- ^ «Семь болезней, которые может вылечить технология CRISPR». Labiotech.eu. 2018-06-25. Получено 2018-08-22.
- ^ а б «CRISPR / Cas9 и рак». Новости иммуноонкологии. 2018-04-27. Получено 2019-02-18.
- ^ Се Ф, Е Л., Чанг Дж. К., Бейер А. И., Ван Дж., Мюнч МО, Кан Ю. В. (сентябрь 2014 г.). «Полная генная коррекция мутаций β-талассемии в ИПСК, специфичных для пациента, с использованием CRISPR / Cas9 и piggyBac». Геномные исследования. 24 (9): 1526–33. Дои:10.1101 / гр.173427.114. ЧВК 4158758. PMID 25096406.
- ^ Девер Д.П., Бак Р.О., Райниш А., Камарена Дж., Вашингтон Дж., Николас К.Э., Павел-Дину М., Саксена Н., Вилкенс А.Б., Мантри С., Учида Н., Хендель А., Нарла А., Маджети Р., Вайнберг К.И., Портеус М.Х. ( 2016-11-17). "Нацеливание на ген β-глобина CRISPR / Cas9 в гемопоэтических стволовых клетках человека". Природа. 539 (7629): 384–389. Bibcode:2016Натура.539..384D. Дои:10.1038 / природа20134. ЧВК 5898607. PMID 27820943.
- ^ Разработана одноклеточная терапия гемофилии "CRISPR" | GEN ". GEN. 2018-05-02. Получено 2018-08-22.
- ^ Маранги М, Пистритто Дж (2018-04-20). «Инновационные терапевтические стратегии при кистозном фиброзе: переход к технике CRISPR». Границы фармакологии. 9: 396. Дои:10.3389 / fphar.2018.00396. ЧВК 5920621. PMID 29731717.
- ^ Bengtsson NE, Hall JK, Odom GL, Phelps MP, Andrus CR, Hawkins RD, Hauschka SD, Chamberlain JR, Chamberlain JS (февраль 2017 г.). «Мышечно-специфическое редактирование гена дистрофина CRISPR / Cas9 улучшает патофизиологию мышечной дистрофии Дюшенна на мышиной модели». Nature Communications. 8: 14454. Bibcode:2017НатКо ... 814454B. Дои:10.1038 / ncomms14454. ЧВК 5316861. PMID 28195574.
- ^ Эйзенштейн М (май 2018 г.). «CRISPR борется с болезнью Хантингтона». Природа. 557 (7707): S42 – S43. Bibcode:2018Натура.557S..42E. Дои:10.1038 / d41586-018-05177-у. PMID 29844549.
- ^ Dabrowska M, Juzwa W, Krzyzosiak WJ, Olejniczak M (2018). «Точное иссечение CAG тракта из гена Хантингтина с помощью Cas9 Nickases». Границы неврологии. 12: 75. Дои:10.3389 / fnins.2018.00075. ЧВК 5834764. PMID 29535594.
- ^ Король А (март 2018 г.). "Редакция CRISPR для болезней сердца". Природа. 555 (7695): S23 – S25. Bibcode:2018Натура.555 ..... K. Дои:10.1038 / d41586-018-02482-4. PMID 29517035.
- ^ Абрахими П., Чанг В.Г., Клюгер М.С., Цян Й., Теллидес Дж., Зальцман В.М., Побер Дж.С. (июль 2015 г.). «Эффективное разрушение генов в культивируемых первичных эндотелиальных клетках человека с помощью CRISPR / Cas9». Циркуляционные исследования. 117 (2): 121–8. Дои:10.1161 / CIRCRESAHA.117.306290. ЧВК 4490936. PMID 25940550.
- ^ Gomaa AA, Klumpe HE, Luo ML, Selle K, Barrangou R, Beisel CL (январь 2014 г.). «Программируемое удаление штаммов бактерий с использованием систем CRISPR-Cas для генома». мБио. 5 (1): e00928–13. Дои:10,1128 / mBio.00928-13. ЧВК 3903277. PMID 24473129.
- ^ Citorik RJ, Mimee M, Lu TK (ноябрь 2014 г.). «Последовательноспецифические противомикробные препараты с использованием эффективно доставляемых нуклеаз, управляемых РНК». Природа Биотехнологии. 32 (11): 1141–5. Дои:10.1038 / nbt.3011. HDL:1721.1/100834. ЧВК 4237163. PMID 25240928.
- ^ а б Голизаде П., Агазаде М., Асгарзаде М., Кафил Х.С. (октябрь 2017 г.). «Подавление адаптивной иммунной системы CRISPR / Cas при бактериальных инфекциях». Европейский журнал клинической микробиологии и инфекционных заболеваний. 36 (11): 2043–2051. Дои:10.1007 / s10096-017-3036-2. PMID 28601970. S2CID 22716314.
- ^ Гибни, Элизабет (2 января 2018 г.). «Чего ждать в 2018 году: науку в новом году». Природа. 553 (7686): 12–13. Bibcode:2018Натура 553 ... 12G. Дои:10.1038 / d41586-018-00009-5. PMID 29300040.
- ^ Тейлор, Фил (3 января 2019 г.). "J&J приобретает долю в противомикробных препаратах Pac-Man на основе CRISPR компании Locus". Жестокая биотехнология. Получено 27 февраля 2019.
- ^ Рирдон, Сара (2017). «Модифицированные вирусы несут смерть устойчивым к антибиотикам бактериям». Природа. 546 (7660): 586–587. Bibcode:2017Натура.546..586R. Дои:10.1038 / природа.2017.22173. PMID 28661508.
- ^ ван Димен Ф.Р., Круз Е.М., Хойкаас М.Дж., Брюггелинг К.Э., Шюрх А.С., ван Хэм П.М., Имхоф С.М., Найхус М., Вирц Э.Д., Леббинк Р.Дж. (2016). «CRISPR / Cas9-опосредованное редактирование генома герпесвирусов ограничивает продуктивные и скрытые инфекции». Патогены PLOS. 12 (6): e1005701. Дои:10.1371 / journal.ppat.1005701. ЧВК 4928872. PMID 27362483. Сложить резюме – Канал PLOS Media на YouTube.
- ^ а б c Science News Staff (17 декабря 2015 г.). «А научный прорыв года - это…». news.sciencemag.org. Получено 2015-12-21.
- ^ Муллин Э. «Использование CRISPR на свиньях может сделать их органы более безопасными для трансплантации человеку». Обзор технологий MIT. Получено 2017-09-09.
- ^ Рирдон С (2016). «Первое клиническое испытание CRISPR получило зеленый свет от комиссии США». Природа. Дои:10.1038 / природа.2016.20137. S2CID 89466280.
- ^ Домингес А.А., Лим В.А., Ци Л.С. (январь 2016 г.). «Помимо редактирования: перепрофилирование CRISPR-Cas9 для точной регуляции генома и исследования». Обзоры природы Молекулярная клеточная биология. 17 (1): 5–15. Дои:10.1038 / nrm.2015.2. ЧВК 4922510. PMID 26670017.
- ^ Шалем О, Санджана Н.Э., Хартениан Э., Ши Х, Скотт Д.А., Миккельсен Т.С., Хекл Д., Эберт Б.Л., Рут Д.Е., Дюнч Дж. Г., Чжан Ф. (январь 2014 г.). «Скрининг нокаута CRISPR-Cas9 в масштабе генома в клетках человека». Наука. 343 (6166): 84–7. Bibcode:2014Наука ... 343 ... 84S. Дои:10.1126 / science.1247005. ЧВК 4089965. PMID 24336571.
- ^ а б Pennisi E (август 2013 г.). «Увлечение CRISPR». Новости в фокусе. Наука. 341 (6148): 833–6. Bibcode:2013Наука ... 341..833П. Дои:10.1126 / science.341.6148.833. PMID 23970676.
- ^ а б Zimmer C (03.06.2016). «Ученые нашли форму редактирования генов Crispr с новыми возможностями». Нью-Йорк Таймс. ISSN 0362-4331. Получено 2016-06-10.
- ^ Пикар-Оливер А., Герсбах, Калифорния (август 2019 г.). «Новое поколение технологий и приложений CRISPR-Cas». Обзоры природы. Молекулярная клеточная биология. 20 (8): 490–507. Дои:10.1038 / с41580-019-0131-5. ЧВК 7079207. PMID 31147612.
- ^ Basak J, Nithin C (2015). «Нацеливание на некодирующие РНК в растениях с помощью технологии CRISPR-Cas - задача, которую стоит принять». Границы растениеводства. 6: 1001. Дои:10.3389 / fpls.2015.01001. ЧВК 4652605. PMID 26635829.
- ^ Акбари О.С., Беллен Х.Дж., Бир Э., Буллок С.Л., Берт А., Черч Г.М. и др. (Август 2015 г.). «БИОБЕЗОПАСНОСТЬ. Обеспечение безопасности экспериментов с генным драйвом в лаборатории». Наука. 349 (6251): 927–9. Bibcode:2015Научный ... 349..927А. Дои:10.1126 / science.aac7932. ЧВК 4692367. PMID 26229113.
- ^ Каплан А.Л., родитель Б., Шен М., Планкетт С. (ноябрь 2015 г.). «Не терять время - этические проблемы, создаваемые CRISPR: CRISPR / Cas, являясь эффективной, простой и дешевой технологией для редактирования генома любого организма, поднимает множество этических и нормативных вопросов, помимо использования для управления клетками зародышевой линии человека. ". Отчеты EMBO. 16 (11): 1421–6. Дои:10.15252 / набр.201541337. ЧВК 4641494. PMID 26450575.
- ^ Oye KA, Esvelt K, Appleton E, Catteruccia F, Church G, Kuiken T. и др. (Август 2014 г.). «Биотехнология. Регулирование генного влечения». Наука. 345 (6197): 626–8. Bibcode:2014Наука ... 345..626O. Дои:10.1126 / science.1254287. PMID 25035410.
- ^ Гу В., Кроуфорд Э.Д., О'Донован Б.Д., Уилсон М.Р., Чоу Э.Д., Реталлак Х., ДеРизи Д.Л. (март 2016 г.). «Истощение избыточных последовательностей путем гибридизации (DASH): использование Cas9 для удаления нежелательных видов с высокой численностью в библиотеках секвенирования и приложениях для молекулярного подсчета». Геномная биология. 17: 41. Дои:10.1186 / s13059-016-0904-5. ЧВК 4778327. PMID 26944702.
- ^ Анзалоне А.В., Рэндольф П.Б., Дэвис Дж. Р., Соуза А. А., Коблан Л. В., Леви Дж. М., Чен П. Дж., Уилсон С., Ньюби Г. А., Рагурам А., Лю Д. Р. (2019). «Редактирование генома с поиском и заменой без двухцепочечных разрывов или донорской ДНК». Природа. 576 (7785): 149–157. Bibcode:2019Натура 576..149A. Дои:10.1038 / s41586-019-1711-4. ЧВК 6907074. PMID 31634902.
- ^ Новый инструмент редактирования генов может сделать CRISPR более точным. Лила Тулин, Смитсоновский журнал. 21 октября 2019.
- ^ а б Новый «главный» редактор генома может превзойти CRISPR. Джон Коэн, Наука. 21 октября 2019.
- ^ а б Новый метод «первичного редактирования» позволяет делать только одноцепочечные разрезы ДНК. Эмма Ясински, Ученый. 21 октября 2019.
- ^ а б Основное редактирование: инструмент ДНК может исправить 89% генетических дефектов. Джеймс Галлахер, Новости BBC. 21 октября 2019.
- ^ Regalado A (5 марта 2015 г.). "Создание идеального ребенка". Обзор технологий MIT.
- ^ Балтимор Д., Берг П., Ботчан М., Кэрролл Д., Чаро Р. А., Черч Г., Корн Дж. Э., Дейли Г. К., Дудна Дж. А., Феннер М., Грили ХТ, Джинек М., Мартин Г. С., Пенхет Е., Пак Дж., Штернберг С. Г., Вайсман Д. , Ямамото KR (апрель 2015 г.). «Биотехнология. Разумный путь вперед для геномной инженерии и модификации генов зародышевой линии». Наука. 348 (6230): 36–8. Bibcode:2015Научный ... 348 ... 36B. Дои:10.1126 / science.aab1028. ЧВК 4394183. PMID 25791083.
- ^ Lanphier E, Urnov F, Haecker SE, Werner M, Smolenski J (март 2015). «Не редактируйте зародышевую линию человека». Природа. 519 (7544): 410–1. Bibcode:2015Натура.519..410л. Дои:10.1038 / 519410a. PMID 25810189.
- ^ Уэйд Н. (19 марта 2015 г.). «Ученые добиваются запрета на метод редактирования генома человека». Нью-Йорк Таймс. Получено 20 марта 2015.
Биологи, пишущие в журнале Science, поддерживают продолжение лабораторных исследований с этой техникой, и мало кто из ученых считает, что она готова для клинического использования.
- ^ Liang P, Xu Y, Zhang X, Ding C, Huang R, Zhang Z, Lv J, Xie X, Chen Y, Li Y, Sun Y, Bai Y, Songyang Z, Ma W, Zhou C, Huang J (май 2015 г.) ). "CRISPR / Cas9-опосредованное редактирование генов в трипроядерных зиготах человека". Белки и клетки. 6 (5): 363–72. Дои:10.1007 / s13238-015-0153-5. ЧВК 4417674. PMID 25894090.
- ^ Колата Г. (23 апреля 2015 г.). «Китайские ученые редактируют гены эмбрионов человека, вызывая опасения». Нью-Йорк Таймс. Получено 24 апреля 2015.
- ^ а б Сираноски Д., Рирдон С. (2015). «Китайские ученые генетически модифицируют человеческие эмбрионы». Природа. Дои:10.1038 / природа.2015.17378. S2CID 87604469.
- ^ Regalado A (8 мая 2016 г.). «Китайские исследователи экспериментируют с созданием ВИЧ-устойчивых эмбрионов». Обзор технологий MIT. Получено 2016-06-10.
- ^ «Международный саммит по редактированию генов». Национальные академии наук, инженерии и медицины. 3 декабря 2015 г.. Получено 3 декабря 2015.
- ^ Броковски, Кэролайн (апрель 2018 г.). «Сокращают ли это заявления CRISPR по этике зародышевой линии?». CRISPR Journal. 1 (2): 115–125. Дои:10.1089 / crispr.2017.0024. ЧВК 6694771. PMID 31021208.
- ^ Бегли С. (28 ноября 2018 г.). «На фоне шумихи китайский ученый защищает создание генно-отредактированных младенцев». СТАТ.
- ^ редактор, Ian Sample Science (13 марта 2019 г.). «Ученые призывают к глобальному мораторию на редактирование генов эмбрионов». Theguardian.com. Получено 14 марта 2019.CS1 maint: дополнительный текст: список авторов (ссылка на сайт)
- ^ Каллавей Э (февраль 2016 г.). «Британские ученые получили лицензию на редактирование генов в человеческих эмбрионах». Природа. 530 (7588): 18. Bibcode:2016 Натур 530 ... 18C. Дои:10.1038 / природа.2016.19270. PMID 26842037.
- ^ МакХьюген А., Смит С. (январь 2008 г.). «Система регулирования США для генетически модифицированных [генетически модифицированных организмов (ГМО), рДНК или трансгенных] сортов сельскохозяйственных культур». Журнал биотехнологии растений. 6 (1): 2–12. Дои:10.1111 / j.1467-7652.2007.00300.x. PMID 17956539. S2CID 3210837.
- ^ USDA. «Re: Запрос на подтверждение» (PDF).
- ^ Вальс Э (2016). "Грибы CRISPR, отредактированные генами, не подлежат регулированию в США". Природа. 532 (7599): 293. Bibcode:2016 Натур.532..293Вт. Дои:10.1038 / природа.2016.19754. PMID 27111611.
- ^ Ледфорд Х (апрель 2016 г.). «Генное редактирование резко возросло, поскольку США пересматривают правила». Природа. 532 (7598): 158–9. Bibcode:2016Натура.532..158Л. Дои:10.1038 / 532158a. PMID 27075074.
- ^ «FDA принимает жесткие меры против мошенников-генетиков», Кристен В. Браун. Gizmodo. 1 февраля 2017 г. Дата обращения 5 фев 2017 г.
- ^ "Руководство для промышленности № 187 / Регулирование намеренно измененной геномной ДНК у животных" (PDF). 2020-02-11.
- ^ Сираноски Д. (2017). «Принятие Китаем выбора эмбрионов вызывает острые вопросы». Природа. 548 (7667): 272–274. Bibcode:2017Натура.548..272C. Дои:10.1038 / 548272a. PMID 28816265.
- ^ Пэн И (2016). «Мораль и этика, регулирующие патенты CRISPR-Cas9 в Китае». Природа Биотехнологии. 34 (6): 616–8. Дои:10.1038 / nbt.3590. PMID 27281418. S2CID 38509820.
- ^ Рана П., Маркус А.Д., Фан В (21.01.2018). "Китай, которому не мешают правила, идет впереди в испытаниях по редактированию генов". Wall Street Journal. ISSN 0099-9660. Получено 2018-01-23.
- ^ Талбот Д. (2016). «Точное редактирование генов в растениях / 10 прорывных технологий 2016». Обзор MIT Technology. Массачусетский Институт Технологий. Получено 18 марта 2016.
- ^ Ларсон С., Шаффер А. (2014). «Редактирование генома / 10 прорывных технологий 2014». Массачусетский Институт Технологий. Получено 18 марта 2016.
- ^ 良 艮 創意, 很好 設計, 李維宗 設計. «Лауреаты Танской премии». www.tang-prize.org. Получено 2018-08-05.
- ^ «Пресс-релиз: Нобелевская премия по химии 2020 года». Нобелевский фонд. Получено 7 октября 2020.
