Coniine - Coniine
 (S) -Coniine | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК (2S) -2-пропилпиперидин | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ |
|
| ЧЭМБЛ |
|
| ChemSpider |
|
| ECHA InfoCard | 100.006.621 |
| Номер ЕС |
|
| КЕГГ |
|
PubChem CID | |
| UNII |
|
| |
| |
| |
| Характеристики | |
| C8ЧАС17N | |
| Молярная масса | 127.231 г · моль−1 |
| Температура плавления | -2 ° С (28 ° F, 271 К) |
| Точка кипения | От 166 до 167 ° C (от 331 до 333 ° F, от 439 до 440 K) |
| 1.4505 | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Coniine ядовитый химическое соединение, алкалоид присутствует и изолируется от яд болиголов (Conium maculatum ), где его присутствие было источником значительного экономического, медицинского и историко-культурного интереса; кониин также производится желтый кувшин (Саррацения желтая ), и петрушка дурацкая (Aethusa cynapium ). Его проглатывание и длительное воздействие токсичны для людей и всех классов домашнего скота; его механизм отравления включает нарушение работы центральной нервной системы со смертью, вызванной респираторный паралич. В биосинтез of coniine содержит в качестве предпоследнего шага не-ферментативный циклизация 5-оксооктиламин к γ-coniceine, a База Шиффа отличается от кониина только двойной связью углерод-азот в звенеть. Этот путь приводит к естественному кониину, который представляет собой смесь - рацемат - состоящий из двух энантиомеров, стереоизомеры (S) - (+) - кониин и (р) - (-) - коническая, в зависимости от направления цепи, ответвляющейся от кольца. Оба энантиомера токсичны, при этом (р) -энантиомер является более биологически активным и токсичным из двух в целом. Coniine занимает место в органическая химия история как первый из важного класса алкалоиды быть синтезированным Альберт Ладенбург в 1886 году, и он был синтезирован в лаборатории несколькими уникальными способами вплоть до наших дней.
Отравление болиголовом было периодической проблемой для людей, регулярной ветеринарной проблемой и имело значительные случаи в истории человечества и культуры. Примечательно, что в 399 г. до н.э. Сократ, когда он был приговорен к смертной казни, решил умереть, выпив смесь кониина яд болиголов.
Естественное происхождение

Ядовитый болиголов (Conium maculatum) содержит очень токсичный количества кониина. Его присутствие на сельскохозяйственных угодьях является проблемой для животноводов, потому что животные будут есть его, если они не будут хорошо накормлены или болиголов смешан с пастбищной травой.[1] Кониин присутствует в Conium maculatum как смесь R - (-) - и S - (+) -энантиомеры.[2]

Кониин также встречается в Саррацения желтая, желтый кувшин.[3][неосновной источник необходим ][нужен лучший источник ] Желтый кувшин - это плотоядное растение Встречается исключительно на юго-востоке США. Растение использует смесь сахара и кониина, чтобы одновременно привлекать и отравлять насекомых, которые затем попадают в пищеварительный тракт.[4] Кониин также встречается в Aethusa cynapium, широко известная как петрушка дурака.[5]
История природных изолятов
История кониина по понятным причинам связана с ядовитым растением болиголов, поскольку этот натуральный продукт нельзя было синтезировать до 1880-х годов.[6] Самое известное отравление болиголовом произошло в 399 г. до н.э., когда философ Сократ, как полагают, употребил жидкость, наполненную болиголовом, для исполнения своего смертного приговора, поскольку он был осужден за нечестие по отношению к богам и растление молодости.[7][8][9] Сок болиголова часто использовался для казни преступников в древняя Греция.[10]
Болиголов на протяжении всей истории имел ограниченное медицинское применение. Греки использовали его не только как смертную казнь, но и как спазмолитик и лечение артрит.[нужна цитата ] Книги 10 века свидетельствуют о медицинском использовании англосаксов.[11] в Средний возраст считалось, что болиголов можно использовать для лечения бешенства;[нужна цитата ] в более поздние европейские времена он стал ассоциироваться с летучие мази в колдовстве.[нужна цитата ] Коренные американцы использовали экстракт болиголова как стрела яд.[12]
Хотя желтый кувшин и петрушка также содержат кониин, нет сообщений о традиционном использовании этих растений.[нужна цитата ]
Фармакология и токсикология
(р) - (-) энантиомер кониина является более биологически активным, по крайней мере, в одной системе (клетки TE-671, экспрессирующие никотиновые нейромышечные рецепторы плода человека), а в биотесте на мышах тот же энантиомер и рацемическая смесь примерно в два раза больше токсичен, чем (S) - (+) энантиомер (см. ниже).[2]
Кониин в виде рацемата или чистого энантиомера начинается со связывания и стимуляции никотиновый рецептор на постсинаптической мембране нервномышечное соединение. Последующая деполяризация приводит к никотиновой токсичности; поскольку кониин остается связанным с рецептором, нерв остается деполяризованным, инактивируя его.[13] Это систематически приводит к вялый паралич, действие, подобное действию кураре.[нужна цитата ] Симптомы паралича обычно проявляются в течение получаса, хотя смерть может занять несколько часов.[нужна цитата ] Центральная нервная система не затрагивается: человек остается в сознании и осознает, пока паралич дыхания не приведет к остановке дыхания.[нужна цитата ] Вялый мышечный паралич - это восходящий паралич, в первую очередь поражаются нижние конечности.[нужна цитата ] У человека может быть гипоксический судороги незадолго до смерти, замаскированные мышечным параличом, так что человек может просто слегка вздрогнуть.[нужна цитата ] Причиной смерти является нехватка кислорода для мозга и сердца в результате паралича дыхания, так что отравленный человек может выздороветь, если будет поддерживаться искусственная вентиляция легких до тех пор, пока токсин не будет удален из системы жертвы.
LD50 значения (в мыши, в / в введенные) для р- (-) и S- (+) энантиомеры и рацемат составляют приблизительно 7, 12 и 8 миллиграммов на килограмм соответственно.[2]
Химические свойства
(+/–) - Кониин была первой изолированные по Giesecke,[14] но формулу предложил Блит[15] и определенно установлено Hoffmann.[16][17]
D-(S) -Кониин с тех пор был определен как бесцветная щелочная жидкость с резким запахом и жгучим вкусом; имеет D0° 0,8626 и D19° 0,8438, показатель преломления п23°D 1.4505, и является правовращающим, [α]19°D + 15,7 °. (См. Комментарии о удельное вращение ниже, в разделе «Энантиомеры».) L-(р) -Конийн имеет [α]21°D 15 ° и в остальном напоминает свой D-изомер, но соли имеют несколько разные температуры плавления; платинихлорид имеет т.пл. 160 ° C (Леффлер и Фридрих сообщают о 175 ° C), аурихлорид т.пл. 59 ° С.[18][19]
Растворимость
Кониин мало растворим (1 из 90) в холодной воде, в меньшей - в горячей, так что прозрачный холодный раствор становится мутный при нагревании. С другой стороны, основа растворяет около 25% воды при комнатной температуре. Он смешивается с алкоголь во всех пропорциях, легко растворяется в эфир и большинство органических растворителей. Кониин растворяется в сероуглерод, образуя сложный тиокарбамат.[20][21]
Кристаллизация
Кониин затвердевает в мягкую кристаллическую массу при -2 ° C. Это медленно окисляет в воздухе. Соли хорошо кристаллизуются и растворимы в воде или спирте. Гидрохлорид B • HCl кристаллизуется из воды в виде ромбов, т. Пл. 220 ° С, [α]20°D + 10,1 °; гидробромид в иглах, т.пл. 211 ° C, а D-кислый виннокислый, B • C4ЧАС6О6• 2 часа2O в ромбических кристаллах, т.пл. 54 ° С. Платинихлорид, (B • HCl)2• PtCl4•ЧАС2О, выделяется из концентрированного раствора в виде масла, которое затвердевает до массы оранжево-желтых кристаллов, т.пл. 175 ° С (сухой). Аурихлорид, B • HAuCl4кристаллизуется при стоянии, т.пл. 77 ° С. В пикрат образует мелкие желтые иголки, т.пл. 75 ° C, от горячей воды. 2,4-динитробензоил- и 3,5-динитробензоил-производные имеют mps. 139,0–139,5 ° C и 108–9 ° C соответственно.[22] Осадок, образованный раствором иодида кадмия, является кристаллическим, т.пл. 118 ° C, в то время как никотин с этим реагентом аморфен.
Изменения цвета
Coniine не окрашивает серный или же азотная кислота. Нитропруссид натрия дает темно-красный цвет, который исчезает при нагревании, но снова появляется при охлаждении и изменяется на синий или фиолетовый под действием альдегиды.[23]
Удельное вращение
В стереохимический состав «кониина» имеет большое значение, поскольку два его энантиомера не обладают идентичными биологическими свойствами,[2] и многие из старших фармакологический исследования этого соединения проводились с использованием встречающихся в природе изомерный смесь.[нужна цитата ] S- (+) - Кониин имеет особое вращение, [α]D, + 8,4 ° (c = 4,0, в CHCl3).[24] Эти авторы отмечают, что ценность Ладенбурга,[25] + 15 °, для «чистого», т.е. неразбавленного образца. Столь же высокое значение + 16 ° для [α]D of "coniine" дается без явного указания источника в Индекс Merck.[26] Значение + 7,7 ° (c = 4,0, CHCl3) для синтетического S - (+) - кониина и -7,9 ° (c = 0,5, CHCl3) для синтетического R - (-) - кониина приводится другими химиками.[27] Гидрохлоридные соли (S) - (+) и (р) - (-) энантиомеры кониина имеют значения [α]D + 4,6 ° и -5,2 ° соответственно (с = 0,5, в метаноле).[2]
Синтез
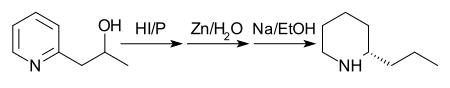
Первоначальный синтез (показанный на схеме ниже) Coniine был выполнен Ладенбургом в 1886 году.[28] Ладенбург нагревает йодистую соль N-метилпиридина до 250 ° C, получая 2-метилпиридин. Затем он исполнил Конденсация Кневенагеля с ацетальдегид в безводном хлорид цинка с получением 2-пропенилпиридина. Фактически, Ладенбург использовал паральдегид, циклический тример ацетальдегида, который легко образует ацетальдегид при нагревании. Наконец, 2-пропенилпиридин был уменьшенный с металлическим натрий в этиловый спирт предоставлять рацемический (±) кониин. Фракционная кристаллизация рацемического кониина с (+) -Винная кислота уступил энантиочистка кониин.

Схема, предложенная Ладенбургом, давала низкие урожаи, поэтому поиск альтернативных маршрутов был открыт. Несколько лучший выход наблюдается, если 2-метилпиридин и ацетальдегид нагревают в герметичной пробирке с соляная кислота на 10 часов. Образуется смесь 2-пропенилпиридина и 2-хлорпропилпиридина, которую затем восстанавливают натрием в этаноле с получением гонка-coniine. Примечание: хотя на схеме ниже показан один энантиомер кониина, в конечной реакции образуется рацемическая смесь, которую затем разделяют.
В 1907 году был предложен другой маршрут с более высокой урожайностью. Сначала 2- (2'-гидроксипропил) пиридин восстанавливают фосфор и дымящийся йодистоводородная кислота при 125 ° С. Во-вторых, продукт обрабатывается цинк пыль и вода. Наконец, продукт второй стадии обрабатывают натрием в этаноле.[29] Примечание: хотя на схеме ниже показан один энантиомер кониина, в конечной реакции образуется рацемическая смесь, которую затем разделяют.
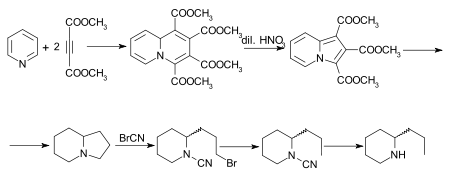
Был осуществлен ряд других синтезов кониина,[30] из которых особый интерес представляет работа Дильса и Альдера.[31] Первоначальный аддукт пиридин и диметилацетилендикарбоксилат представляет собой тетраметилхинолизин-1,2,3,4-тетракарбоксилат, который при окислении разбавленным азотная кислота превращается в триметилиндолизин-трикарбоксилат. Это при гидролизе и декарбоксилировании дает индолизин, октагидропроизводное которого, также известное как октагидропирроколин[32] конвертируется цианоген бромид методом последовательно на бромцианоамид, цианоамид и рац.-coniine. Синтез алкалоида, начиная с индолизин (пирроколин) описан Очиаи и Цуда.[33]
Подготовка L-(р) -кониин восстановлением β-коницеина (L-пропенилпиперидин) Лёффлера и Фридриха[19] предоставляет средства для преобразования конгидрин к L-(р) -кониин.[34] Гесс и Эйхель сообщили:[35] неправильно,[36] который пеллетерин был альдегид (β-2-пиперидилпропальдегид), соответствующий кониину, и давал рац-Coniine, когда это гидразон был нагрет этоксид натрия в этиловый спирт при 156–170 ° C. По мнению этих авторов, D-(S) -кониин становится почти оптически неактивным при нагревании с гидроксид бария и спирт при 180–230 ° C. Leithe[37] показал путем наблюдения оптического вращения (+) -пипеколиновая кислота (пиперидин-2-карбоновая кислота) и некоторые из ее производных в различных условиях,[38] что он должен принадлежать D-серии аминокислоты.
В настоящее время кониин и многие другие алкалоиды могут быть синтезированы стереоселективно.[27] Например, катализируемая Pd реакция переноса 1,3-хиральности может стереоспецифически преобразовать единственный энантиомер аллилового спирта в циклическую структуру (в данном случае пиперидин).[39] Таким образом, исходя из (S) -спирта, получают (S) -энантиомер кониина, и наоборот. Примечательно, что разделение рацемического спирта на разные энантиомеры осуществляется с помощью Candida antarctica липаза.
Биосинтез
Биосинтез кониина все еще изучается, большая часть пути выяснена. Первоначально предполагалось использовать 4 ацетильные группы в качестве кормовых соединений для поликетидсинтазы, которая образует кониин,[40] на самом деле он является производным двух малонил и бутирил-КоА, которые обычным образом образуются из ацетил-КоА.[41]
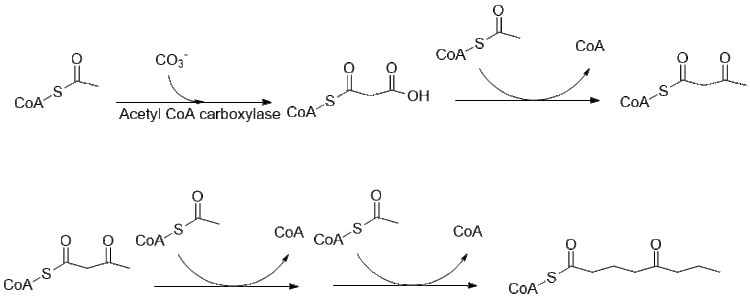
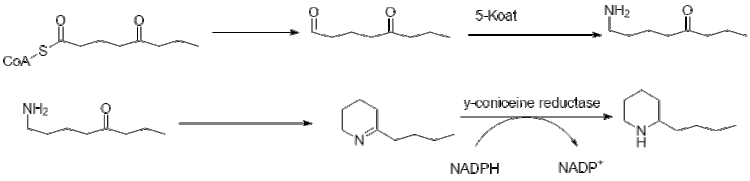
Дальнейшее удлинение бутирил-КоА с использованием 2 малонил-КоА приводит к образованию 5-кетооктаналя. Затем кетооктаналь подвергается трансаминированию с использованием аланин: 5-кетооктаналь аминотрансферазы.[42] Затем амин самопроизвольно циклизуется и дегидратируется с образованием предшественника кониина γ-коницеина. Затем его уменьшают с помощью НАДФН-зависимой γ-коницеинредуктазы с образованием кониина.
В популярной культуре
Кониин - орудие убийства в Агата Кристи детективный роман Пять поросят.
Стереоизомеры R и S 2-пропилпиперидина представляют собой нейротоксин, присутствующий в форме жизни, подобной слизню, в Простор. В шоу показано, что токсин вызывает почти мгновенную смерть при контакте с кожей.
Рекомендации
- ^ Питерс, Эми; Буска, Кэсси. "Ядовитая тсуга". Служба расширения Осу. Получено 3 мая 2015.
- ^ а б c d е Стивен Т. Ли; Бенедикт Т. Грин; Кевин Д. Уэлч; Джеймс А. Пфистер; Кип Э. Пантер (2008). «Стереоселективные потенции и относительная токсичность энантиомеров кониина». Химические исследования в токсикологии. 21 (10): 2061–2064. Дои:10.1021 / tx800229w. PMID 18763813.
- ^ Н. В. Моды; Р. Хенсон; П. А. Хедин; У. Кокпол; Д. Х. Майлз (1976). «Изоляция насекомых, парализующих агент кониин, от Саррацения желтая". Experientia. 32 (7): 829–830. Дои:10.1007 / BF02003710. S2CID 38319708.
- ^ Маки, Робин. "Желтый кувшин или трубы". Министерство сельского хозяйства США. Лесная служба Министерства сельского хозяйства США. Получено 3 мая 2015.
- ^ Клэпхэм, Тутин и Варбург. Флора Британских островов (2-е изд.). п. 524.CS1 maint: несколько имен: список авторов (связь)
- ^ Чисхолм, Хью, изд. (1911). . Британская энциклопедия. 6 (11-е изд.). Издательство Кембриджского университета. п. 942.
- ^ Джеймс Уоррен (2001). «Сократовское самоубийство». Журнал эллинских исследований. 121: 91–106. Дои:10.2307/631830. JSTOR 631830. PMID 19681231.
- ^ Р. Г. Фрей (1978). «Совершил ли Сократ самоубийство?». Философия. 53 (203): 106–108. Дои:10.1017 / S0031819100016375. S2CID 170399183.
- ^ Джексон, Генри (1911). . В Чисхолме, Хью (ред.). Британская энциклопедия. 25 (11-е изд.). Издательство Кембриджского университета. С. 331–338.
СОКРАТ, сын скульптора Софрониска и акушерки Фаэнареты, родился в Афинах не ранее 471 года и не позднее мая или июня 469 г. до н. Э. ... В 399 году, через четыре года после реставрации и амнистии, ему было предъявлено обвинение в нарушении общественной морали. ... Обвинение звучало так: «Сократ виновен, во-первых, в отрицании признанных государством богов и введении новых божеств, а, во-вторых, в развращении молодых». ... В обычных обстоятельствах осужденный преступник выпил чашу болиголова на следующий день после суда; но в случае Сократа правило, согласно которому во время отсутствия священного корабля, ежегодно отправляемого на Делос, никого нельзя предавать смерти, вызвало исключительную
| дата доступа =требует| url =(помощь) - ^ "Самоубийство Сократа". EyeWitness к истории. Получено 3 мая 2015.
- ^ Грив М. (1971). Современный травяной (2-е изд.). Минеола, Нью-Йорк: Dover Publications. п. 392. ISBN 978-0-486-22798-6. Получено 3 мая 2015.
- ^ Мозер, Л; Крисп, Д. "Ядовитая тсуга" (PDF). Сан-Франциско Пикс Управление сорняками. Получено 3 мая 2015.
- ^ Голдранк, Льюис; Нельсон, Льюис. Токсикологические чрезвычайные ситуации (11-е изд.). Нью-Йорк: Макгроу-Хилл. С. Глава 118: Растения.
- ^ Giseke, Aug. Lud. (1827) "Ueber das wirksame Princip des Schierlings, Conium maculatum" (Об активном компоненте болиголова, Conium maculatum), Archiv der Pharmazie, 20 (2): 97–111. На стр. 99, Гисеке считает, что это имя принадлежит швейцарскому аптекарю Пешье. Coniin (кониин). Видеть сноска на стр. 87 из: Peschier (1821) "Neue analytische Untersuchungen über den unter verschiedenen Himmelsstrichen gebauten Mohn; ferner über einige inländische Narcotica, und Entdeckung neuer Pflanzensäuren und Entdeckung neuer Pflanzensäuren und Alkälien in denselmore различные аналитические исследования в области климатических исследований" , и открытие новых растительных кислот и щелочей в том же), Neues Journal der Pharmacie für Aerzte, Apotheker und Chemiker, 5 (1): 76–101. С п. 87: "Eine Abbildung der krystallisirten Säure s. Рис. 1 das coniumsaure Natron ist Рис. 2 abgebildet." (Изображение кристаллической кислоты см. На рис. 1; натриевая соль кониевой кислоты изображена на рис. 2.)
- ^ Блит, Дж. (1849) «О составе кониина и продуктов его разложения». Ежеквартальный журнал Лондонского химического общества, 1 : 345–363. Блит обнаружил, что эмпирическая формула кониина имеет вид (стр. 351): C17ЧАС17N. Ошибка в количестве углерода частично связана с тем, что он предположил, что атомная масса углерода равна 6, а не 12 - распространенная ошибка в то время.
- ^ Хоффманн, А. В. (1881) "Einwirkung der Wärme auf die Ammoniumbasen: 2. Coniin" (Воздействие тепла на основания аммония: 2. Кониин), Berichte der deutschen chemischen Gesellschaft, 14 : 705–713.
- ^ Пантер К. Э. и Киллер Р. Ф., гл. 5: Пиперидиновые алкалоиды ядовитого болиголова (Conium maculatum) в: Cheeke, Peter R., ed., Токсиканты растительного происхождения: алкалоиды, т. 1 (Бока-Ратон, Флорида: CRC Press, Inc., 1989), п. 116.
- ^ Аренс, Бер., 1902, 35, 1330
- ^ а б Леффлер и Фридрих, Бер., 1909, 42, 107.
- ^ Мельцер, Arch. Pharm., 1898, 236, 701
- ^ ср. Диллинг, Pharm. Дж., 1909, [iv], 29, 34, 70, 102.
- ^ Шпет, Куффнер и Энсфелльнер, Бер., 1933, 66, 596.
- ^ Габутти, Chem. Soc. Abstr., 1906, [II], 711.
- ^ Крейг Дж. Саймерман; А. Р. Пиндер (1971). «Улучшено разрешение метода coniine». Журнал органической химии. 36 (23): 3648–3649. Дои:10.1021 / jo00822a051.
- ^ А. Ладенбург (1888). Энн Юстуса Либиха. Chem. 247 1-98.
- ^ Индекс Merck, 15-е изд. (2013), стр. 446, Монография 2489, О'Нил: Королевское химическое общество. http://www.rsc.org/Merck-Index/monograph/mono1500002489
- ^ а б Д. Эндерс и Дж. Тибес (1993) Энн Либиха. Chem. 173-177.
- ^ Ладенбург, А. (1886-01-01). "Versuche zur Synthese des Coniin". Berichte der Deutschen Chemischen Gesellschaft. 19 (1): 439–441. Дои:10.1002 / cber.188601901108. ISSN 0365-9496.
- ^ Ладенбург, А. (1907-06-01). "Noch ein Wort über das Isoconlin. 14. Mitteilung über den asymmetryschen Stickstoff". Berichte der Deutschen Chemischen Gesellschaft. 40 (3): 3734–3736. Дои:10.1002 / cber.190704003170. ISSN 0365-9496.
- ^ Денич, Мария; Благоевич, Полина; Радулович, Нико (2013). «Синтетические подходы к кониину и другим 2-алкилпиперидинам». Facta Universitatis - серия: физика, химия и технологии. 11 (1): 1–26. Дои:10.2298 / FUPCT1301001D.
- ^ Дильс и Ольха, Annalen, 1932, 498, 16.
- ^ Г. Р. Клемо; Г. Р. Рэймидж (1932). «Октагидропирроколин». Журнал химического общества: 2969–2973. Дои:10.1039 / JR9320002969.
- ^ Бер., 1934, 67, 1011.
- ^ Талапатра, Сунил Кумар; Талапатра, Бани (2015), Талапатра, Сунил Кумар; Талапатра, Бани (ред.), «Кониин, конгидрин и псевдоконгидрин (С-скелет, полученный из C8-жирной кислоты и азота в результате трансаминирования)», Химия растительных натуральных продуктов: стереохимия, строение, синтез, биология и медицина, Springer, стр. 733–748, Дои:10.1007/978-3-642-45410-3_17, ISBN 978-3-642-45410-3
- ^ Бер., 1917, 50, 1192, 1386.
- ^ Пеллетерин теперь известен как 1- (2-пиперидинил) -2-пропанон;[согласно кому? ] видеть: Индекс Merck, 15-е изд. (2013), стр. 1314, г.[оригинальное исследование? ] Монография 7181, О'Нил: Королевское химическое общество. Доступно в Интернете по адресу: http://www.rsc.org/Merck-Index/monograph/mono1500007181
- ^ Бер., 1932, 65, 927.
- ^ Джордж Уильям Клаф (1918). «Взаимосвязь между оптическими вращательными способностями и относительными конфигурациями оптически активных соединений. Влияние некоторых неорганических галоидов на оптические вращательные способности α-гидроксикислот, α-аминокислот и их производных». Журнал химического общества, Сделки. 113: 526–554. Дои:10.1039 / CT9181300526.
- ^ Hande, Sudhir M .; Кавай, Нобуюки; Уениши, Дзюнъити (02.01.2009). «Эффективный синтез 2- и 2,6-замещенных пиперидинов с использованием реакции переноса 1,3-хиральности, катализируемой PdII». Журнал органической химии. 74 (1): 244–253. Дои:10.1021 / jo801926g. ISSN 0022-3263. PMID 19012434.
- ^ Leete E (1964) Биосинтез алкалоидов болиголова. Включение ацетата-1-C14 в кониин и конгидрин. J Am Chem Soc 86, 2509–2513
- ^ Ханну Хотти, Тууликки Сеппанен-Лааксо, Микко Арвас, Теему Х. Тири и Хайко Ришер, Поликетидсинтазы из ядовитого болиголова (Conium maculatum L.) FEBS Journal 282, 2015 4141–4156
- ^ Робертс М.Ф. Фитохимия 17 1978, 107-112
дальнейшее чтение
- Грин, Бенедикт Т .; Ли, Стивен Т .; Пантер, Кип Э .; Браун, Дэвид Р. (2012). "Алкалоиды пиперидина: тератогены человека и пищевых животных" (PDF). Пищевая и химическая токсикология. 50 (6): 2049–2055. Дои:10.1016 / j.fct.2012.03.049. PMID 22449544. Получено 23 января, 2017.