Бета-лактамаза - Википедия - Beta-lactamase
| Бета-лактамаза | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 Структура Streptomyces albus бета-лактамаза | |||||||||||
| Идентификаторы | |||||||||||
| Символ | β-лактамазный домен | ||||||||||
| Pfam | PF00144 | ||||||||||
| Pfam клан | CL0013 | ||||||||||
| ИнтерПро | IPR001466 | ||||||||||
| PROSITE | PS00146 | ||||||||||
| SCOP2 | 56601 / Объем / СУПФАМ | ||||||||||
| |||||||||||
| β-лактамаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
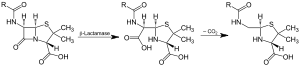 Действие β-лактамазы и декарбоксилирование промежуточного | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 3.5.2.6 | ||||||||
| Количество CAS | 9073-60-3 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||


Бета-лактамазы находятся ферменты (ЕС 3.5.2.6 ) продуцируются бактериями, которые обеспечивают мульти- сопротивление к β-лактамные антибиотики Такие как пенициллины, цефалоспорины, цефамицины, и карбапенемы (эртапенем ), хотя карбапенемы относительно устойчивы к бета-лактамазе. Бета-лактамаза обеспечивает устойчивость к антибиотикам, нарушая антибиотики ' структура. Все эти антибиотики имеют общий элемент в их молекулярной структуре: четырехатомное кольцо, известное как β-лактам. Через гидролиз, фермент лактамаза разрывает β-лактамное кольцо, деактивируя антибактериальные свойства молекулы.
Бета-лактамные антибиотики обычно используются для лечения широкого спектра Грамположительный и Грамотрицательный бактерии.
Бета-лактамазы, продуцируемые грамотрицательными организмами, обычно секретируются, особенно когда в окружающей среде присутствуют антибиотики.[1]
Структура
Структура Streptomyces β-лактамаза определяется как 1BSG.
Пенициллиназа
Пенициллиназа - это особый тип β-лактамазы, проявляющий специфичность к пенициллины, опять же гидролиз то β-лактам звенеть. Молекулярные массы различных пенициллиназ имеют тенденцию к кластеризации около 50 килодальтон.
Пенициллиназа была первой идентифицированной β-лактамазой. Впервые он был выделен Абрахамом и Чейном в 1940 г. из грамотрицательных бактерий. Кишечная палочка еще до того, как пенициллин стал применяться в клинической практике,[2] но продукция пенициллиназы быстро распространилась на бактерии, которые раньше ее не производили или продуцировали очень редко. Бета-лактамы, устойчивые к пенициллиназе, такие как метициллин были разработаны, но сейчас широко распространены сопротивление даже этим.
Устойчивость к грамотрицательным бактериям
Среди грамотрицательных бактерий серьезную озабоченность вызывает появление устойчивости к цефалоспоринам расширенного спектра. Первоначально он появился у ограниченного числа видов бактерий (E. cloacae, C. freundii, S. marcescens, и P. aeruginosa ), которые могут мутировать с гиперпродукцией β-лактамазы хромосомного класса C. Несколько лет спустя резистентность появилась у видов бактерий, не продуцирующих ферменты AmpC (K. pneumoniae, Сальмонелла виды, P. mirabilis ) из-за продукции БЛРС TEM- или SHV-типа (бета-лактамаз расширенного спектра). Обычно такая устойчивость включает оксиимино- (например, цефтизоксим, цефотаксим, цефтриаксон, и цефтазидим, а также оксимино-монобактам азтреонам ), но не 7-альфа-метоксицефалоспорины (цефамицины; другими словами, цефокситин и цефотетан ); был заблокирован ингибиторами, такими как клавуланат, сульбактам или же тазобактам и не вовлекал карбапенемы и темоциллин. Хромосомно-опосредованные β-лактамазы AmpC представляют собой новую угрозу, поскольку они придают устойчивость к 7-альфа-метоксицефалоспоринам (цефамицины ) Такие как цефокситин или же цефотетан но не подвержены действию коммерчески доступных ингибиторов β-лактамаз и могут в штаммах с потерей поринов внешней мембраны обеспечивать устойчивость к карбапенемам.[3]
Бета-лактамаза расширенного спектра действия (БЛРС)
Члены этого семейства обычно экспрессируют β-лактамазы (например, ТЕМ-3, ТЕМ-4 и SHV-1), которые придают устойчивость к цефалоспоринам расширенного спектра (расширенного спектра). В середине 1980-х годов эта новая группа ферментов, β-лактамазы расширенного спектра (БЛРС), была обнаружена (впервые обнаружена в 1979 году).[4] Распространенность бактерий, продуцирующих БЛРС, в больницах неотложной помощи постепенно увеличивается.[5] БЛРС представляют собой бета-лактамазы, которые гидролизуют цефалоспорины расширенного спектра с оксиимино-боковой цепью. Эти цефалоспорины включают: цефотаксим, цефтриаксон, и цефтазидим, а также оксиимино-монобактам азтреонам. Таким образом, ESBL дают множественное сопротивление к этим антибиотикам и родственным оксиимино-бета-лактамам. В типичных обстоятельствах они происходят от генов TEM-1, TEM-2 или SHV-1 путем мутаций, которые изменяют конфигурацию аминокислот вокруг активного сайта этих β-лактамаз. Более широкий набор β-лактамных антибиотиков подвержен гидролизу этими ферментами. Недавно было описано возрастающее количество ESBL, не принадлежащих к линии TEM или SHV.[6] ESBL часто кодируются плазмидой. Плазмиды, ответственные за продукцию ESBL, часто несут гены, кодирующие устойчивость к другим классам лекарств (например, аминогликозидам). Следовательно, варианты антибиотиков при лечении организмов, продуцирующих БЛРС, крайне ограничены. Карбапенемы являются препаратом выбора для серьезных инфекций из-за организмов, продуцирующих БЛРС, но устойчивых к карбапенемам (в первую очередь эртапенем резистентных) изолятов недавно появились. Организмы, продуцирующие БЛРС, могут оказаться восприимчивыми к некоторым препаратам расширенного спектра действия. цефалоспорины. Однако лечение такими антибиотиками было связано с высокой частотой неудач.[нужна цитата ]
Типы
Бета-лактамазы ТЕМ (класс А)
ТЕМ-1 - наиболее часто встречающаяся бета-лактамаза в Грамотрицательный бактерии. До 90% устойчивости к ампициллину в Кишечная палочка за счет производства ТЭМ-1.[7] Также отвечает за резистентность к ампициллину и пенициллину, которая наблюдается у H. influenzae и N. gonorrhoeae во все большем количестве. Хотя бета-лактамазы ТЕМ-типа чаще всего обнаруживаются в Кишечная палочка и K. pneumoniae, они также все чаще обнаруживаются у других видов грамотрицательных бактерий. Аминокислотные замены, ответственные за бета-лактамаза расширенного спектра (БЛРС) фенотип кластера вокруг активного центра фермента и изменяет его конфигурацию, открывая доступ к субстратам оксиимино-бета-лактама. Открытие активного центра для бета-лактамных субстратов также обычно увеличивает чувствительность фермента к ингибиторам β-лактамазы, таким как клавулановая кислота. Единичные аминокислотные замены в положениях 104, 164, 238 и 240 вызывают фенотип БЛРС, но БЛРС с самым широким спектром обычно имеют более одной аминокислотной замены. На основании различных комбинаций изменений в настоящее время описано 140 ферментов ТЕМ-типа. ТЕМ-10, ТЕМ-12 и ТЕМ-26 являются одними из самых распространенных в США.[8][9][10] Термин ТЕА происходит от имени афинского пациента (Темониера), от которого изолят был извлечен в 1963 году.[11]
Бета-лактамазы SHV (класс A)
SHV-1 делит 68 процентов своих аминокислот с ТЕМ-1 и имеет аналогичную общую структуру. Бета-лактамаза SHV-1 чаще всего встречается в K. pneumoniae и отвечает за до 20% опосредованной плазмидой устойчивости к ампициллину у этого вида. ESBL этого семейства также имеют аминокислотные изменения вокруг активного сайта, чаще всего в положениях 238, 238 и 240. Известно более 60 разновидностей SHV. ШВ-5 и ШВ-12 - одни из самых распространенных.[8]
CTX-M бета-лактамазы (класс A)
Эти ферменты были названы из-за их большей активности против цефотаксим чем другие субстраты оксиимино-бета-лактама (например, цефтазидим, цефтриаксон, или же цефепим ). Они не возникают в результате мутации, а представляют собой примеры приобретения плазмид генов бета-лактамаз, обычно обнаруживаемых на хромосоме Клюйвера виды, группа редко патогенных комменсальных организмов. Эти ферменты не очень тесно связаны с бета-лактамазами TEM или SHV в том смысле, что они показывают только приблизительно 40% идентичности с этими двумя обычно изолированными бета-лактамазами. В настоящее время известно более 80 ферментов CTX-M. Несмотря на свое название, некоторые из них более активны на цефтазидим чем цефотаксим. В основном они были обнаружены в штаммах Salmonella enterica серовар Тифимуриум и Кишечная палочка, но также были описаны у других видов Энтеробактерии и являются преобладающим типом БЛРС в некоторых частях Южной Америки. (Они также встречаются в Восточной Европе) CTX-M-14, CTX-M-3 и CTX-M-2 являются наиболее распространенными. CTX-M-15 в настоящее время (2006 г.) самый распространенный тип в Кишечная палочка Великобритании и широко распространен в обществе.[12] Пример бета-лактамазы CTX-M-15 вместе с ISEcp1, недавно было обнаружено, что они транспонировались на хромосому Клебсиелла пневмонии АТСС BAA-2146.[13]
Бета-лактамазы OXA (класс D)
Бета-лактамазы OXA долгое время считались менее распространенной, но также опосредованной плазмидами разновидностью бета-лактамаз, способной гидролизовать оксациллин и родственные антистафилококковые пенициллины. Эти бета-лактамазы отличаются от ферментов ТЕМ и SHV тем, что они принадлежат к молекулярному классу D и функциональной группе 2d. Бета-лактамазы типа OXA придают устойчивость к ампициллин и цефалотин и характеризуются высокой гидролитической активностью в отношении оксациллин и клоксациллин и то, что они плохо тормозятся клавулановая кислота. Аминокислотные замены в ферментах OXA также могут давать фенотип ESBL. Хотя большинство ESBL были обнаружены в Кишечная палочка, K. pneumoniae, и другие Энтеробактерии, БЛРС типа OXA были обнаружены в основном в P. aeruginosa. БЛРС типа OXA были обнаружены в основном в Синегнойная палочка изоляты из Турции и Франции. Семейство бета-лактамаз OXA было первоначально создано как фенотипическая, а не генотипическая группа для нескольких бета-лактамаз, которые имели специфический профиль гидролиза. Следовательно, среди некоторых членов этого семейства наблюдается лишь 20% гомологии последовательностей. Однако недавние дополнения к этому семейству показывают некоторую степень гомологии с одним или несколькими существующими членами семейства бета-лактамаз OXA. Некоторые придают устойчивость преимущественно к цефтазидиму, но OXA-17 дает большую устойчивость к цефотаксиму и цефепиму, чем к цефтазидиму.
Другие
Другие опосредованные плазмидой ESBL, такие как PER, VEB, GES и бета-лактамазы IBC, были описаны, но встречаются редко и обнаруживаются в основном в P. aeruginosa и на ограниченном количестве географических сайтов. PER-1 в изолятах в Турции, Франции и Италии; ВЭБ-1 и ВЭБ-2 у штаммов из Юго-Восточной Азии; и GES-1, GES-2 и IBC-2 в изолятах из Южной Африки, Франции и Греции. PER-1 также распространен среди видов acinetobacter с множественной устойчивостью в Корее и Турции. Некоторые из этих ферментов также обнаружены у Enterobacteriaceae, тогда как другие необычные ESBL (такие как BES-1, IBC-1, SFO-1 и TLA-1) были обнаружены только у Enterobacteriaceae.
Уход
В то время как организмы, продуцирующие БЛРС, ранее были связаны с больницами и учреждениями, в настоящее время эти организмы все чаще встречаются в обществе. CTX-M-15-положительный Кишечная палочка являются причиной приобретенных сообществом мочевые инфекции в Соединенном Королевстве,[12] и имеют тенденцию быть устойчивыми ко всем пероральным β-лактамным антибиотикам, а также к хинолоны и сульфаниламиды. Варианты лечения могут включать: нитрофурантоин, фосфомицин, мециллинам и хлорамфеникол. В отчаянии, раз в день эртапенем или же гентамицин также могут использоваться инъекции.
Устойчивые к ингибиторам β-лактамазы
Хотя резистентные к ингибиторам β-лактамазы не являются БЛРС, их часто обсуждают с БЛРС, поскольку они также являются производными ферментов классического типа ТЕМ или SHV. Эти ферменты сначала получили обозначение IRT для резистентной к ингибитору ТЕМ β-лактамазы; однако впоследствии все они были переименованы в числовые обозначения ТЕА. Существует по крайней мере 19 различных устойчивых к ингибиторам β-лактамаз ТЕА. Устойчивые к ингибиторам β-лактамазы ТЕМ обнаружены в основном в клинических изолятах Кишечная палочка, но и некоторые штаммы K. pneumoniae, Клебсиелла окситока, P. mirabilis, и Citrobacter freundii. Хотя устойчивые к ингибитору варианты ТЕА устойчивы к ингибированию клавулановая кислота и сульбактам, тем самым демонстрируя клиническую резистентность к комбинациям бета-лактам-ингибитор лактамазы амоксициллин -клавуланат (коамоксиклав ), тикарциллин -клавуланат (co-ticarclav ), и ампициллин / сульбактам, они обычно остаются восприимчивыми к ингибированию тазобактам и впоследствии комбинация пиперациллин / тазобактам,[нужна цитата ] хотя сопротивление было описано. Это уже не в первую очередь европейская эпидемиология, она часто встречается в северных частях Америки и должна быть проверена на наличие сложных ИМП.[9]
Β-лактамазы AmpC-типа (класс C)
Β-лактамазы типа AmpC обычно выделяют из грамотрицательных бактерий, устойчивых к цефалоспоринам широкого спектра действия. Β-лактамазы AmpC (также называемые классом C или группой 1) обычно кодируются на хромосомах многих грамотрицательных бактерий, включая Citrobacter, Серратия и Энтеробактер виды, где его выражение обычно индуцируемый; это также может произойти на кишечная палочка но обычно не индуцируется, хотя может быть гиперэкспрессирован. Β-лактамазы типа AmpC также могут переноситься на плазмидах.[3] Β-лактамазы AmpC, в отличие от ESBL, гидролизуют цефалоспорины широкого и расширенного спектра (цефамицины, а также до оксиимино-β-лактамов), но не ингибируются ингибиторами β-лактамаз, такими как клавулановая кислота. Бета-лактамазные организмы AmpC-типа часто клинически сгруппированы по аббревиатуре «SPACE»: Серратия, Псевдомонады или же Протей, Acinetobacter, Citrobacter, и Энтеробактер.
Карбапенемазы
Карбапенемы известны своей стабильностью к β-лактамазам AmpC и β-лактамазам расширенного спектра действия. Карбапенемазы представляют собой разнообразную группу β-лактамаз, которые активны не только против оксиимино-цефалоспоринов и цефамицинов, но также и против карбапенемов. Азтреонам устойчив к металло-β-лактамазам, но многие продуценты IMP и VIM устойчивы из-за других механизмов. Ранее считалось, что карбапенемазы происходят только из классов A, B и D, но была описана карбапенемаза класса C.
Карбапенемазы типа IMP (металло-β-лактамазы) (класс B)
Плазмид-опосредованные карбапенемазы IMP-типа (IMP означает активный на имипенеме), 19 разновидностей которых в настоящее время известны, были установлены в Японии в 1990-х годах как у кишечных грамотрицательных организмов, так и у Псевдомонады и Acinetobacter разновидность. Ферменты ИМФ медленно распространились в другие страны Дальнего Востока, были зарегистрированы в Европе в 1997 году и были обнаружены в Канаде и Бразилии.
VIM (Веронская интегрон-кодируемая металло-β-лактамаза) (класс B)
Второе растущее семейство карбапенемаз, семейство VIM, было зарегистрировано в Италии в 1999 году и теперь включает 10 членов, которые имеют широкое географическое распространение в Европе, Южной Америке и на Дальнем Востоке и были обнаружены в Соединенных Штатах. ВИМ-1 был обнаружен в P. aeruginosa в Италии в 1996 году; с тех пор ВИМ-2 - теперь преобладающий вариант - неоднократно обнаруживался в Европе и на Дальнем Востоке; VIM-3 и -4 - второстепенные варианты VIM-2 и -1 соответственно. Ферменты VIM встречаются в основном в P. aeruginosa, также P. putida и, в меньшей степени, Enterobacteriaceae.[14]
Разнообразие аминокислотных последовательностей составляет до 10% в семействе VIM, 15% в семействе IMP и 70% между VIM и IMP. Тем не менее, ферменты обоих семейств схожи. Оба они связаны с интегроном, иногда внутри плазмид. Оба гидролизуют все β-лактамы, кроме монобактамов, и уклоняются от всех ингибиторов β-лактама. Ферменты VIM являются одними из наиболее широко распространенных MBL, о которых сообщалось> 40 вариантов VIM. Биохимические и биофизические исследования показали, что варианты VIM имеют лишь небольшие вариации кинетических параметров, но существенные различия в их термической стабильности и профилях ингибирования.[15]
OXA (оксациллиназа) группа β-лактамаз (класс D)
Группа β-лактамаз OXA встречается в основном у видов Acinetobacter и делится на два кластера. OXA-карбапенемазы очень медленно гидролизуют карбапенемы. in vitro, а высокие значения МИК, наблюдаемые для некоторых хозяев Acinetobacter (> 64 мг / л), могут отражать вторичные механизмы. Иногда они усиливаются в клинических изолятах за счет дополнительных механизмов резистентности, таких как непроницаемость или отток. OXA-карбапенемазы также имеют тенденцию к снижению гидролитической эффективности по отношению к пенициллинам и цефалоспоринам.[16]
КПК (K. pneumoniae карбапенемаза) (класс А)
Некоторые ферменты класса A, наиболее известные из которых являются плазмид-опосредованными ферментами KPC, также являются эффективными карбапенемазами. Известно десять вариантов, от KPC-2 до KPC-11, и они различаются одним или двумя аминокислота замены (KPC-1 был повторно секвенирован в 2008 году и оказался на 100% гомологичным опубликованным последовательностям KPC-2). KPC-1 был обнаружен в Северной Каролине, KPC-2 в Балтиморе и KPC-3 в Нью-Йорке. Они имеют только 45% гомологии с ферментами SME и NMC / IMI и, в отличие от них, могут кодироваться самотрансмиссивными плазмидами.
По состоянию на февраль 2009 г.[Обновить], класс A Клебсиелла пневмонии карбапенемаза (КПК ) во всем мире была наиболее распространенной карбапенемазой и была впервые обнаружена в 1996 г. Северная Каролина, СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ.[17] В публикации 2010 года указывалось, что KPC, продуцирующие Enterobacteriaceae, становятся обычным явлением в США.[18]
CMY (класс C)
Первая карбапенемаза класса С была описана в 2006 г. и была выделена из вирулентного штамма Enterobacter aerogenes.[19] Он находится на плазмиде pYMG-1 и поэтому передается другим штаммам бактерий.[20]
SME (ферменты Serratia marcescens), IMI (β-лактамаза, гидролизующая IMIpenem), NMC и CcrA
В целом они не имеют большого клинического значения.
CcrA (CfiA). Его ген встречается ок. 1–3% B. fragilis изолятов, но меньшее их количество продуцирует фермент, поскольку экспрессия требует соответствующей миграции инсерционной последовательности. CcrA был известен до того, как был введен имипенем, и производители не показали его дальнейшего увеличения.
NDM-1 (металло-β-лактамаза Нью-Дели) (класс B)
Первоначально описано из Нью-Дели в 2009 году этот ген широко распространен у кишечная палочка и Клебсиелла пневмонии из Индии и Пакистана. По состоянию на середину 2010 года бактерии-переносчики NDM-1 были завезены в другие страны (включая США и Великобританию), скорее всего, из-за большого количества туристов, путешествующих по миру, которые, возможно, подхватили штамм из окружающей среды. поскольку штаммы, содержащие ген NDM-1, были обнаружены в образцах окружающей среды в Индии.[21] У NDM есть несколько вариантов, которые имеют разные свойства.[15]
Лечение ESBL / AmpC / карбапенемаз
Общий обзор
В общем, подозревается, что изолят является продуцентом ESBL, когда он показывает in vitro восприимчивость ко второму поколению цефалоспорины (цефокситин, цефотетан ), но устойчивость к цефалоспоринам третьего поколения и к азтреонам. Более того, следует заподозрить эти штаммы, когда лечение грамотрицательными инфекциями этими агентами не дает результатов, несмотря на сообщения in vitro восприимчивость. После обнаружения штамма, продуцирующего БЛРС, лаборатория должна сообщить о нем как о «устойчивом» ко всем пенициллинам, цефалоспоринам и азтреонаму, даже если он проверен (in vitro) как чувствительный.[нужна цитата ] Сопутствующее сопротивление аминогликозиды и триметоприм -сульфаметоксазол, а также высокая частота сосуществования фторхинолон сопротивление создает проблемы. Ингибиторы бета-лактамаз, такие как клавуланат, сульбактам, и тазобактам in vitro подавляют большинство БЛРС, но нельзя постоянно полагаться на клиническую эффективность комбинаций бета-лактам / ингибиторов бета-лактамаз для лечения. Цефамицины (цефокситин и цефотетан ) не гидролизуются большинством БЛРС, но гидролизуются ассоциированной β-лактамазой AmpC-типа. Кроме того, комбинации ингибиторов β-лактам / β-лактамаз могут быть неэффективными против организмов, продуцирующих β-лактамазу AmpC-типа. Иногда эти штаммы снижают экспрессию белков внешней мембраны, делая их устойчивыми к цефамицинам. В естественных условиях исследования дали смешанные результаты против БЛРС, вызывающих K. pneumoniae. (Цефепим, цефалоспорин четвертого поколения, продемонстрировал in vitro стабильность в присутствии многих штаммов ESBL / AmpC.) В настоящее время карбапенемы в целом считаются предпочтительным средством для лечения инфекций, вызванных организмами, продуцирующими БЛРС. Карбапенемы устойчивы к гидролизу, опосредованному БЛРС, и демонстрируют отличные in vitro активность против штаммов Энтеробактерии выражающие БЛРС.[нужна цитата ]
По генам
БЛРС
Штаммы, продуцирующие только БЛРС, чувствительны к цефамицины и карбапенемы in vitro и мало показывать, если вообще эффект посевного материала с этими агентами.
Для организмов, продуцирующих ТЕМ и SHV тип БЛРС, кажущиеся in vitro чувствительность к цефепим и чтобы пиперациллин / тазобактам является обычным явлением, но оба препарата проявляют эффект инокулята с уменьшенной чувствительностью, поскольку размер инокулята увеличивается с 105 до 107 организмы.
Штаммы с некоторыми CTX-M–Type и OXAБЛРС-типа устойчивы к цефепим на испытаниях, несмотря на использование стандартного посевного материала.
Устойчивые к ингибиторам β-лактамазы
Хотя устойчивые к ингибитору варианты ТЕА устойчивы к ингибированию клавулановая кислота и сульбактам, тем самым демонстрируя клиническую резистентность к комбинациям бета-лактам-бета-лактамазы ингибиторов амоксициллин -клавуланат (Ко-амоксиклав ), тикарциллин -клавуланат, и ампициллин / сульбактам, они остаются восприимчивыми к торможению тазобактам и впоследствии комбинация пиперациллин / тазобактам.
AmpC
Штаммы, продуцирующие AmpC, обычно устойчивы к оксиимино-бета-лактамы и чтобы цефамицины и восприимчивы к карбапенемы; однако пониженная экспрессия порина может также сделать такой штамм устойчивым к карбапенему.
Карбапенемазы
Штаммы с IMP-, VIM- и OXAкарбапенемазы -типа обычно остаются чувствительными. Устойчивость к небета-лактамным антибиотикам является обычным явлением для штаммов, вырабатывающих любой из этих ферментов, поэтому альтернативные варианты небета-лактамной терапии необходимо определять путем прямого тестирования чувствительности. Устойчивость к фторхинолоны и аминогликозиды особенно высок.
По видам
кишечная палочка или же Клебсиелла
Для инфекций, вызванных производством БЛРС кишечная палочка или же Клебсиелла виды, лечение с имипенем или же меропенем был связан с лучшими результатами с точки зрения выживаемости и бактериологического клиренса. Цефепим и пиперациллин / тазобактам были менее успешными. Цефтриаксон, цефотаксим, и цефтазидим даже чаще оказываются неудачными, несмотря на восприимчивость организма к антибиотику in vitro. В нескольких отчетах документально подтвержден отказ цефамицин терапия в результате резистентности из-за потери порина. Некоторые пациенты ответили на аминогликозид или же хинолон терапии, но в недавнем сравнении ципрофлоксацин и имипенем при бактериемии с участием БЛРС K. pneumoniae, имипенем дала лучший результат
Синегнойная палочка
Было проведено несколько клинических исследований для определения оптимальной терапии инфекций, вызванных производством БЛРС. Синегнойная палочка штаммы.
Обнаружение
Ферментативную активность бета-лактамазы можно определить с помощью нитроцефин, хромогенный цефалоспорин субстрат, который меняет цвет с желтого на красный при гидролизе, опосредованном бета-лактамазой.[22]
Эволюция
Бета-лактамазы - это древние бактериальные ферменты. Бета-лактамазы класса B (металло-бета-лактамазы) делятся на три подкласса: B1, B2 и B3. Подклассы B1 и B2, согласно теории, эволюционировали примерно из одного миллиард лет назад и подкласс B3s предположительно развился до расхождения грамположительных и грамотрицательных эубактерий около двух миллиардов лет назад.[23] PNGM-1 (металло-β-лактамаза-1 Папуа-Новой Гвинеи) обладает активностью как металло-β-лактамазы (MBL), так и тРНКазы Z, что позволяет предположить, что PNGM-1 произошел от тРНКазы Z, и что MBL B3 активность PNGM-1 является беспорядочной активностью, и считается, что MBL подкласса B3 эволюционировали в результате активности PNGM-1.[24]
Остальные три группы представляют собой сериновые ферменты, которые мало гомологичны друг другу. Структурные исследования показали, что группы A и D являются сестринскими таксонами, и что группа C расходится до A и D.[25] Эти ферменты на основе серина, такие как бета-лактамазы группы B, имеют древнее происхождение и предположительно появились около двух миллиардов лет назад.[26]
В частности, предполагается, что группа OXA (в классе D) развивалась на хромосомах и перемещалась в плазмиды по крайней мере в двух разных случаях.[27]
Этимология
"Β" (бета ) относится к азот положение на втором угле в кольце. Лактам это чемодан из лактон (от латинский лактис, молоко, поскольку молочная кислота был выделен из простокваши) и амид. Суффикс -ase, указывающий на фермент, происходит от диастаза (от Греческий диастаз, «разделение»), первый фермент, открытый в 1833 году Пайеном и Персозом.[28]
Смотрите также
Рекомендации
- ^ Neu HC (июнь 1969 г.). «Влияние локализации бета-лактамазы в Escherichia coli на синергию пенициллина». Прикладная микробиология. 17 (6): 783–6. Дои:10.1128 / AEM.17.6.783-786.1969. ЧВК 377810. PMID 4894721.
- ^ Абрахам Е.П., Цепь E (1940). «Фермент из бактерий, способный разрушить пенициллин». Природа. 46 (3713): 837. Bibcode:1940Натура.146..837А. Дои:10.1038 / 146837a0. S2CID 4070796.
- ^ а б Филиппон А., Арлет Дж., Якоби Г.А. (январь 2002 г.). «Плазмидно-определяемые бета-лактамазы AmpC-типа». Противомикробные препараты и химиотерапия. 46 (1): 1–11. Дои:10.1128 / AAC.46.1.1-11.2002. ЧВК 126993. PMID 11751104.
- ^ Сандерс С.К., Сандерс В.Е. (июнь 1979 г.). «Возникновение устойчивости к цефамандолу: возможная роль цефокситин-индуцируемых бета-лактамаз». Противомикробные препараты и химиотерапия. 15 (6): 792–7. Дои:10.1128 / AAC.15.6.792. ЧВК 352760. PMID 314270.
- ^ Спадафино Дж. Т., Коэн Б., Лю Дж., Ларсон Э (2014). «Временные тенденции и факторы риска для Escherichia coli, продуцирующей бета-лактамазы расширенного спектра действия, у взрослых с катетер-ассоциированными инфекциями мочевыводящих путей». Устойчивость к противомикробным препаратам и инфекционный контроль. 3 (1): 39. Дои:10.1186 / s13756-014-0039-у. ЧВК 4306238. PMID 25625011.
- ^ Эмери С.Л., Уэймут, Лос-Анджелес (август 1997 г.). «Выявление и клиническое значение бета-лактамаз расширенного спектра в медицинском центре третичного уровня». Журнал клинической микробиологии. 35 (8): 2061–7. Дои:10.1128 / JCM.35.8.2061-2067.1997. ЧВК 229903. PMID 9230382.
- ^ Кукси Р., Свенсон Дж., Кларк Н., Гей Е., Торнсберри С. (май 1990 г.). «Паттерны и механизмы устойчивости к бета-лактамам среди изолятов Escherichia coli из больниц в США». Противомикробные препараты и химиотерапия. 34 (5): 739–45. Дои:10.1128 / AAC.34.5.739. ЧВК 171683. PMID 2193616.
- ^ а б Патерсон Д.Л., Худжер К.М., Худжер А.М., Йейзер Б., Бономо, доктор медицины, Райс Л.Б., Бономо Р.А. (ноябрь 2003 г.). «Бета-лактамазы расширенного спектра в изолятах кровотока Klebsiella pneumoniae из семи стран: преобладание и широкое распространение бета-лактамаз SHV- и CTX-M-типов». Противомикробные препараты и химиотерапия. 47 (11): 3554–60. Дои:10.1128 / AAC.47.11.3554-3560.2003. ЧВК 253771. PMID 14576117.
- ^ а б Брэдфорд, штат Пенсильвания (октябрь 2001 г.). «Бета-лактамазы с расширенным спектром действия в 21 веке: характеристика, эпидемиология и обнаружение этой важной угрозы устойчивости». Обзоры клинической микробиологии. 14 (4): 933–51, содержание. Дои:10.1128 / CMR.14.4.933-951.2001. ЧВК 89009. PMID 11585791.
- ^ Якоби Г.А., Муньос-Прайс Л.С. (январь 2005 г.). «Новые бета-лактамазы». Медицинский журнал Новой Англии. 352 (4): 380–91. Дои:10.1056 / NEJMra041359. PMID 15673804.
- ^ Руис, Жоаким (2018). «Этимология: ТЕМ». Возникающие инфекционные заболевания. 24 (4): 709. Дои:10.3201 / eid2404.et2404.
- ^ а б Вудфорд Н., Уорд Э., Кауфманн М.Э. и др. "Молекулярная характеристика кишечная палочка изоляты, продуцирующие бета-лактамазу расширенного спектра CTX-M-15 (БЛРС) в Соединенном Королевстве " (PDF). Агентство по охране здоровья. Архивировано из оригинал (PDF) 15 июня 2007 г.. Получено 19 ноября 2006.
- ^ Hudson CM, Bent ZW, Meagher RJ, Williams KP (7 июня 2014 г.). «Детерминанты устойчивости и мобильные генетические элементы штамма Klebsiella pneumoniae, кодирующего NDM-1». PLOS ONE. 9 (6): e99209. Bibcode:2014PLoSO ... 999209H. Дои:10.1371 / journal.pone.0099209. ЧВК 4048246. PMID 24905728.
- ^ Гейт Д.М., Мохамед З.К., Фарахат М.Г., Абулкасем Шахин В., Мохамед Х.О. (март 2019 г.). «Колонизация кишечной микробиоты Enterobacteriaceae, продуцирующей карбапенемазу, в педиатрических отделениях интенсивной терапии в Каире, Египет». Арабский журнал гастроэнтерологии. 20 (1): 19–22. Дои:10.1016 / j.ajg.2019.01.002. PMID 30733176.
- ^ а б Makena A, Düzgün AÖ, Brem J, McDonough MA, Rydzik AM, Abboud MI, et al. (Декабрь 2015 г.). «Сравнение вариантов Verona Integron-Borne Metallo-β-Lactamase (VIM) выявляет различия в профилях стабильности и ингибирования». Противомикробные препараты и химиотерапия. 60 (3): 1377–84. Дои:10.1128 / AAC.01768-15. ЧВК 4775916. PMID 26666919.
- ^ Сантильяна Е., Бесейро А., Боу Г., Ромеро А. (март 2007 г.). «Кристаллическая структура карбапенемазы OXA-24 раскрывает механизм гидролиза карбапенема» (PDF). Труды Национальной академии наук Соединенных Штатов Америки. 104 (13): 5354–9. Bibcode:2007ПНАС..104.5354С. Дои:10.1073 / pnas.0607557104. ЧВК 1838445. PMID 17374723.
- ^ Нордманн П., Кузон Г., Наас Т. (апрель 2009 г.). «Реальная угроза бактерий, продуцирующих карбапенемазу Klebsiella pneumoniae». Ланцет. Инфекционные заболевания. 9 (4): 228–36. Дои:10.1016 / S1473-3099 (09) 70054-4. PMID 19324295.
- ^ Кузон Дж., Наас Т., Нордманн П. (февраль 2010 г.). «[Карбапенемазы KPC: что поставлено на карту в клинической микробиологии?]». Патология-Биология (На французском). 58 (1): 39–45. Дои:10.1016 / j.patbio.2009.07.026. PMID 19854586.
- ^ Ким Дж.Й., Чон Хи, Ан Ю.Дж., Ли Дж.Х., Ким С.Дж., Чжон Ш. и др. (Май 2006 г.). «Структурная основа для расширенного спектра субстратов CMY-10, плазмиды, кодируемой бета-лактамазой класса C». Молекулярная микробиология. 60 (4): 907–16. Дои:10.1111 / j.1365-2958.2006.05146.x. PMID 16677302. S2CID 44982704.
- ^ Ли Дж. Х., Юнг Х. И., Юнг Дж. Х., Пак Дж. С., Ан Дж. Б., Чон Ш. и др. (2004). «Распространение переносимой бета-лактамазы AmpC-типа (CMY-10) в корейской больнице». Устойчивость к микробным препаратам. 10 (3): 224–30. Дои:10.1089 / mdr.2004.10.224. PMID 15383166.
- ^ Уолш Т.Р., Уикс Дж., Ливермор Д.М., Толман М.А. (май 2011 г.). «Распространение NDM-1-положительных бактерий в окружающей среде Нью-Дели и его последствия для здоровья человека: исследование точечной распространенности в окружающей среде». Ланцет. Инфекционные заболевания. 11 (5): 355–62. Дои:10.1016 / S1473-3099 (11) 70059-7. PMID 21478057.
- ^ О'Каллаган СН, Моррис А., Кирби С.М., Шинглер А.Х. (апрель 1972 г.). «Новый метод обнаружения бета-лактамаз с использованием хромогенного цефалоспоринового субстрата». Противомикробные препараты и химиотерапия. 1 (4): 283–8. Дои:10.1128 / AAC.1.4.283. ЧВК 444209. PMID 4208895.
- ^ Холл Б.Г., Салипанте С.Дж., Барлоу М. (июль 2004 г.). «Независимое происхождение металло-бета-лактамаз подгруппы Bl + B2 и подгруппы B3». Журнал молекулярной эволюции. 59 (1): 133–41. Дои:10.1007 / s00239-003-2572-9. PMID 15383916. S2CID 30833168.
- ^ Ли Дж. Х., Такахаши М., Чон Дж. Х., Кан Л. В., Секи М., Пак К. С. и др. (2019). «β-лактамазы: молекулярное и эволюционное исследование». Новые микробы и инфекции. 8 (1): 1688–1700. Дои:10.1080/22221751.2019.1692638. ЧВК 6882493. PMID 31749408.
- ^ Холл Б.Г., Барлоу М. (сентябрь 2003 г.). «Филогения на основе структуры сериновых бета-лактамаз». Журнал молекулярной эволюции. 57 (3): 255–60. Дои:10.1007 / s00239-003-2473-у. PMID 14629035. S2CID 187389.
- ^ Холл Б.Г., Барлоу М. (апрель 2004 г.). «Эволюция сериновых бета-лактамаз: прошлое, настоящее и будущее». Обновления лекарственной устойчивости. 7 (2): 111–23. Дои:10.1016 / j.drup.2004.02.003. PMID 15158767.
- ^ Барлоу М., Холл Б.Г. (сентябрь 2002 г.). «Филогенетический анализ показывает, что гены бета-лактамаз OXA находятся на плазмидах миллионы лет». Журнал молекулярной эволюции. 55 (3): 314–21. Bibcode:2002JMolE..55..314B. Дои:10.1007 / s00239-002-2328-у. PMID 12187384. S2CID 8679468.
- ^ «Этимология: β-лактамаза». Возникающие инфекционные заболевания. 22 (9): 1689–1631. 2016. Дои:10.3201 / eid2209.ET2209.
внешняя ссылка
- Онлайн-инструмент для генотипирования ESBL (EGT)
- Онлайн-аминокислотные последовательности для ферментов БЛРС
- бета-лактамазы в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
