Клавулановая кислота - Википедия - Clavulanic acid
 | |
 | |
| Клинические данные | |
|---|---|
| Произношение | /ˌkлævjʊˈлæпɪk/ |
| AHFS /Drugs.com | Международные названия лекарств |
| Беременность категория |
|
| Маршруты администрация | Оральный, IV |
| Код УВД |
|
| Легальное положение | |
| Легальное положение |
|
| Фармакокинетический данные | |
| Биодоступность | «Хорошо впитывается» |
| Метаболизм | Печеночный (обширный) |
| Устранение период полураспада | 1 час |
| Экскреция | Почечный (30–40%) |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.055.500 |
| Химические и физические данные | |
| Формула | C8ЧАС9NО5 |
| Молярная масса | 199.162 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| (проверять) | |
Клавулановая кислота это β-лактамный препарат который функционирует как механический ингибитор β-лактамазы. Хотя сам по себе неэффективен антибиотик, в сочетании с пенициллин -группа антибиотиков, может побороть устойчивость к антибиотикам в бактерии что секрет β-лактамаза, который инактивирует большинство пенициллинов.
В наиболее распространенных препаратах клавуланат калия (клавулановая кислота в виде соли калия) сочетается с:
- амоксициллин (коамоксиклав, торговые наименования Аугментин, Тыцлав, Клавамокс (ветеринарный ), Синулокс (ветеринарный ), и другие)
- тикарциллин (co-ticarclav, торговое название Тиментин)
Клавулановая кислота была запатентована в 1974 году.[1]
Медицинское использование
Для лечения пиелонефрит во время беременности и для лечения пиелонефрита, вызванного грамположительные бактерии, амоксициллин или амоксициллин-клавуланат калия является предпочтительным.
Побочные эффекты
Использование клавулановой кислоты с пенициллинами было связано с увеличением числа случаев холестатическая желтуха и острый гепатит во время терапии или вскоре после нее. Сопутствующая желтуха обычно проходит самостоятельно и очень редко приводит к летальному исходу.[2][3]
В Великобритания Комитет по безопасности лекарственных средств (CSM) рекомендует применять препараты амоксициллина / клавулановой кислоты для лечения бактериальных инфекций, которые могут быть вызваны устойчивыми к амоксициллину штаммами, продуцирующими β-лактамазы, и что лечение обычно не должно превышать 14 дней.
Источники
Название происходит от сорта Streptomyces clavuligerus, который производит клавулановую кислоту.[5][6]
Биосинтез

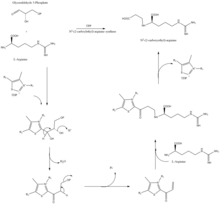
Клавулановая кислота - это биосинтезированный из аминокислоты аргинин и сахар глицеральдегид-3-фосфат. С β-лактам как и структура, клавулановая кислота структурно похожа на пенициллин, но биосинтез этой молекулы включает другой путь и набор ферментов. Клавулановая кислота биосинтезируется бактериями. Streptomyces clavuligerus, с помощью глицеральдегид-3-фосфат и L-аргинин в качестве исходных материалов пути.[7][8] Хотя все промежуточные продукты пути известны, точный механизм каждой ферментативной реакции полностью не изучен. В биосинтезе в основном участвуют 3 фермента: клаваминатсинтаза, β-лактамсинтетаза и N2- (2-карбоксиэтил) -L-аргининсинтаза (CEA).[7]Клаваминатсинтаза негемовое железо α-кето-глутарат зависимый оксигеназа который кодируется orf5 клавулановой кислоты кластер генов. Конкретный механизм работы этого фермента до конца не изучен, но этот фермент регулирует 3 этапа в общем синтезе клавулановой кислоты. Все 3 стадии происходят в одной и той же области каталитического центра железа, но не происходят последовательно и влияют на разные области структуры клавулановой кислоты.[9]
β-лактамсинтетаза представляет собой белок 54,5 кДа, кодируемый orf3 кластера генов клавулановой кислоты, и проявляет сходство с аспарагинсинтаза - Ферменты класса B. Точный механизм того, как этот фермент работает для синтеза β-лактам не доказано, но считается, что происходит в координации с РЭА-синтазой и АТФ.[10]

СЕА-синтаза представляет собой белок 60,9 кДа и является первым геном, обнаруженным в кластере генов биосинтеза клавулановой кислоты, кодируемом orf2 кластера генов клавулановой кислоты. Конкретный механизм работы этого фермента все еще исследуется; однако известно, что этот фермент обладает способностью соединяться вместе глицеральдегид-3-фосфат с L-аргинин в присутствии тиаминдифосфата (TDP или пирофосфат тиамина ), что является первым этапом биосинтеза клавулановой кислоты.[11]
История
Клавулановая кислота была открыта примерно в 1974-75 годах британскими учеными, работающими в фармацевтической компании. Бичем от бактерий Streptomyces clavuligerusПосле нескольких попыток Бичем наконец подал заявку на Патент США защита препарата в 1981 г., а в 1985 г. были выданы патенты США 4525352, 4529720 и 4560552.
Клавулановая кислота обладает незначительной внутренней антимикробной активностью, несмотря на то, что у нее есть бета-лактамное кольцо, характерное для β-лактамные антибиотики. Однако сходство химической структуры позволяет молекуле взаимодействовать с ферментом. β-лактамаза секретируются некоторыми бактериями, чтобы придать устойчивость к β-лактамным антибиотикам.
Клавулановая кислота - это ингибитор суицида, ковалентно связываясь с серин остаток в активный сайт β-лактамазы. Это реструктурирует молекулу клавулановой кислоты, создавая гораздо более реактивные частицы, которые атакуют другую аминокислоту в активном центре, навсегда инактивируя ее и, таким образом, инактивируя фермент.
Это ингибирование восстанавливает антимикробную активность β-лактамных антибиотиков в отношении резистентных бактерий, секретирующих лактамазы. Несмотря на это, появились штаммы бактерий, устойчивые даже к таким комбинациям.
Рекомендации
- ^ Фишер, Янош; Ганеллин, С. Робин (2006). Открытие лекарств на основе аналогов. Джон Вили и сыновья. п. 490. ISBN 9783527607495.
- ^ Объединенный формулярный комитет. Британский национальный формуляр, 47-е изд. Лондон: Британская медицинская ассоциация и Королевское фармацевтическое общество Великобритании; 2004 г.
- ^ «Лекарственная запись - Амоксициллин-Клавуланат». LiverTox - Клиническая и исследовательская информация о травмах печени, вызванных лекарственными средствами. Получено 24 апреля, 2013.
- ^ Тортахада Гирбес М., Феррер Франко А., Грасиа Антекера М., Клемент Паредес А., Гарсиа Муньос Е., Таллон Герола М. (2008). «Повышенная чувствительность к клавулановой кислоте у детей».. Аллергол Иммунопатол (Мадр). 36 (5): 308–10. Дои:10.1016 / S0301-0546 (08) 75228-5. PMID 19080805. Архивировано из оригинал на 2012-04-07. Получено 2011-11-11.
- ^ Аруланантам Х., Кершоу Нью-Джерси, Хьюитсон К.С., Хьюз К.Э., Тиркеттл Дж. Э., Скофилд С.Дж. (январь 2006 г.). «ORF17 из кластера генов биосинтеза клавулановой кислоты катализирует АТФ-зависимое образование N-глицил-клаваминовой кислоты». J. Biol. Chem. 281 (1): 279–87. Дои:10.1074 / jbc.M507711200. PMID 16251194.
- ^ Тахлан К., Пак Х.Ю., Вонг А, Битти PH, Дженсен С.Е. (март 2004 г.). «Два набора паралоговых генов кодируют ферменты, участвующие в ранних стадиях биосинтеза клавулановой кислоты и метаболита клавам у Streptomyces clavuligerus». Антимикробный. Агенты Chemother. 48 (3): 930–9. Дои:10.1128 / AAC.48.3.930-939.2004. ЧВК 353097. PMID 14982786.
- ^ а б c d е Таунсенд, Калифорния (октябрь 2002 г.). «Новые реакции в биосинтезе клавулановой кислоты». Современное мнение в области химической биологии. 6 (5): 583–9. Дои:10.1016 / S1367-5931 (02) 00392-7. PMID 12413541.
- ^ Чтение, C .; Коул, М. (1 мая 1977 г.). «Клавулановая кислота: бета-лактамаза, ингибирующая бета-лактам из Streptomyces clavuligerus». Противомикробные препараты и химиотерапия. 11 (5): 852–857. Дои:10.1128 / AAC.11.5.852. ЧВК 352086. PMID 879738.
- ^ Басби, RW; Таунсенд, Калифорния (июль 1996 г.). «Единый мономерный центр железа в клаваминатсинтазе катализирует три не последовательных окислительных превращения». Биоорганическая и медицинская химия. 4 (7): 1059–64. Дои:10.1016/0968-0896(96)00088-0. PMID 8831977.
- ^ Бахманн, Б.О. Таунсенд, Калифорния (19 сентября 2000 г.). «Кинетический механизм бета-лактамсинтетазы Streptomyces clavuligerus». Биохимия. 39 (37): 11187–93. Дои:10.1021 / bi000709i. PMID 10985764.
- ^ Халили, Нусрат; Ли, Ронгфэн; Таунсенд, Крейг А. (1999). «Происхождение β-лактамных углеродов в клавулановой кислоте из необычной реакции, опосредованной пирофосфатом тиамина». Журнал Американского химического общества. 121 (39): 9223–9224. Дои:10.1021 / ja9923134.
