Фосфатаза миозиновой легкой цепи - Myosin-light-chain phosphatase
| Фосфатаза легкой цепи миозина | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Структура комплекса между PP1 и частью MYPT1, образованная из 1s70[1] | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 3.1.3.53 | ||||||||
| Количество CAS | 86417-96-1 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Фосфатаза легкой цепи миозина, чаще называемый миозинфосфатаза (EC 3.1.3.53 ), является фермент (в частности серин / треонин-специфическая протеинфосфатаза ) который дефосфорилаты регуляторная легкая цепь миозин II. Эта реакция дефосфорилирования происходит в гладкая мышечная ткань и инициирует процесс расслабления мышечных клеток. Таким образом, миозинфосфатаза устраняет сокращение мышц процесс инициирован киназа легкой цепи миозина. Фермент состоит из трех субъединиц: каталитической области (протеинфосфатаза 1, или PP1), субъединица связывания миозина (MYPT1) и третья субъединица (M20) неизвестной функции. Каталитическая область использует два марганец ионы в качестве катализаторов дефосфорилирования легких цепей миозина, что вызывает изменение конформации миозина и расслабляет мышцы. Фермент очень консервативен[1] и содержится в гладкой мышечной ткани всех организмов. Хотя известно, что миозинфосфатаза регулируется rho-ассоциированные протеинкиназы, в настоящее время ведутся споры о том, могут ли другие молекулы, такие как арахидоновая кислота и лагерь, также регулируют фермент.[2]
Функция
Гладкая мышечная ткань в основном состоит из актин и миозин,[3] два белка, которые взаимодействуют друг с другом, чтобы вызвать сокращение и расслабление мышц. Миозин II, также известный как обычный миозин, имеет две тяжелые цепи, которые состоят из головного и хвостового доменов, и четыре легкие цепи (по две на голову), которые связываются с тяжелыми цепями в области «шеи». Когда мышце нужно сокращаться, кальций ионы попадают в цитозоль от саркоплазматический ретикулум, где они активируют кальмодулин, который, в свою очередь, активирует киназа легкой цепи миозина (Киназа MLC). Киназа MLC фосфорилирует легкую цепь миозина (MLC20) по остатку Ser-19. Это фосфорилирование вызывает конформационное изменение миозина, активируя Велоспорт через мост и заставляя мышцу сокращаться. Поскольку миозин претерпевает конформационные изменения, мышца будет продолжать сокращаться, даже если концентрации кальция и активированной киназы MLC доведены до нормального уровня. Конформационные изменения должны быть отменены, чтобы расслабить мышцу.[4]
Когда миозинфосфатаза связывается с миозином, она удаляет фосфатная группа. Без группы миозин возвращается к своей исходной конформации, в которой он не может взаимодействовать с актином и удерживать мышцы в напряжении, поэтому мышца расслабляется. Мышца будет оставаться в этом расслабленном положении до тех пор, пока миозин не будет фосфорилирован киназой MLC и не претерпит конформационных изменений.
Структура

Миозинфосфатаза состоит из трех субъединиц. Каталитическая субъединица PP1 является одной из наиболее важных Ser / Thr фосфатаз в эукариотические клетки, поскольку он играет роль в гликоген метаболизм, внутриклеточный транспорт, синтез белка и деление клеток а также сокращение гладких мышц.[5] Поскольку это так важно для основных клеточных функций, и поскольку в клетках гораздо меньше протеинфосфатаз, чем киназ,[6] Структура и функция PP1 высоко консервативны (хотя специфическая изоформа, используемая в миозинфосфатазе, - это δ-изоформа PP1δ).[7] PP1 работает, используя два иона марганца в качестве катализаторов дефосфорилирования (см. Ниже).
Эти ионы окружают Y-образную щель с тремя бороздками: гидрофобной, кислой и С-концевой. Когда PP1 не связан с какой-либо другой субъединицей, это не особенно специфично. Однако, когда он связывается со второй субъединицей миозинфосфатазы, MYPT1 (MW ~ 130 кДа), эта каталитическая щель изменяет конфигурацию. Это приводит к резкому увеличению специфичности миозина.[1] Таким образом, очевидно, что MYPT1 обладает большой регулирующей способностью по отношению к PP1 и миозинфосфатазе, даже без присутствия других активаторов или ингибиторов.
Третья субъединица, M20 (не путать с MLC20, критическая регуляторная субъединица миозина) является самой маленькой и загадочной субъединицей. В настоящее время мало что известно о M20, за исключением того, что он не является необходимым для катализа, поскольку удаление субъединицы не влияет на оборот или селективность.[1] Некоторые считают, что он может выполнять регулирующую функцию, но пока ничего не определено.[2]
Механизм
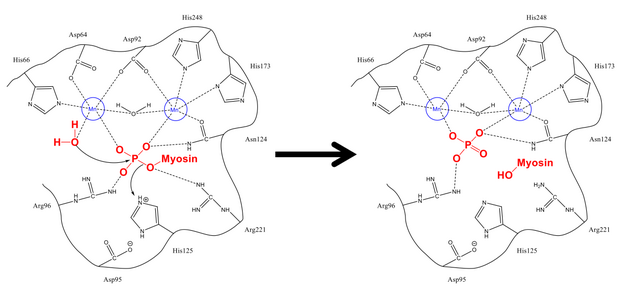
Механизм удаления фосфата из Ser-19 очень похож на другие реакции дефосфорилирования в клетке, такие как активация гликогенсинтаза. Регуляторная субъединица миозина MLC20 связывается как с гидрофобными, так и с кислотными бороздками PP1 и MYPT1, регуляторным сайтом на миозинфосфатазе.[1][8] В правильной конфигурации оба фиофорилированных серин и свободная молекула воды стабилизируются остатками водородной связи в активном центре, а также положительно заряженными ионами (которые сильно взаимодействуют с отрицательной фосфатной группой). His-125 (на миозинфосфатазе) отдает протон Ser-19 MLC20), а молекула воды атакует атом фосфора. После перетасовки протонов для стабилизации (что происходит быстро по сравнению с атакой на фосфор) образуются фосфат и спирт, и оба покидают активный центр.
Регулирование и здоровье человека
Пути регуляции MLC-киназы были хорошо изучены, но до конца 1980-х предполагалось, что миозинфосфатаза не регулируется, а сокращение / расслабление полностью зависит от активности MLC-киназы.[2] Однако с 1980-х годов был обнаружен и тщательно исследован ингибирующий эффект rho-ассоциированной протеинкиназы.[11] RhoA GTP активирует Ро-киназа, который фосфорилирует MYPT1 по двум основным ингибирующим сайтам, Thr-696 и Thr-866.[12][13] Это полностью демонстрирует ценность MYPT1 не только в повышении скорости и специфичности реакции, но и в значительном замедлении реакции. Однако когда телокин добавлен, он эффективно отменяет действие Rho-киназы, даже если он не дефосфорилирует MYPT1.[12]
Еще одна предлагаемая стратегия регулирования связана с арахидоновой кислотой. Когда арахидоновая кислота добавляется к напряженной мышечной ткани, кислота снижает скорость дефосфорилирования (и, следовательно, релаксации) миозина. Однако неясно, как арахидоновая кислота действует как ингибитор.[4] Две конкурирующие теории состоят в том, что либо арахидоновая кислота действует как сопутствующий агент в каскаде ро-киназ, упомянутых выше, либо она связывается с c-концом MYPT1.[4]
Когда системы регуляции миозинфосфатазы начинают давать сбои, это может иметь серьезные последствия для здоровья. Поскольку гладкие мышцы находятся в дыхательной, кровеносной и репродуктивной системах человека (а также в других местах), если гладкие мышцы больше не могут расслабляться из-за неправильной регуляции, возникает множество проблем, начиная от астма, гипертония, и Эректильная дисфункция может привести.[4][14]
Смотрите также
Рекомендации
- ^ а б c d е Террак, Мохаммед; Керфф, Фредерик; и другие. (17 июня 2004 г.). «Структурные основы регуляции протеинфосфатазы 1». Природа. 429 (6993): 780–4. Bibcode:2004Натура 429..780Т. Дои:10.1038 / природа02582. PMID 15164081.
- ^ а б c Хартшорн, диджей; Ито, М. (май 1998 г.). «Фосфатаза легкой цепи миозина: субъединичный состав, взаимодействия и регуляция». J Muscle Res Cell Motil. 19 (4): 325–41. Дои:10.1023 / А: 1005385302064. PMID 9635276. S2CID 27448238.
- ^ Стр. Решебника 174 в: Гладкомышечные клетки сосудов: молекулярные и биологические ответы на внеклеточный матрикс. Авторы: Стивен М. Шварц, Роберт П. Мешам. Редакторы: Стивен М. Шварц, Роберт П. Мешам. Авторы: Стивен М. Шварц, Роберт П. Мешам. Издательство: Academic Press, 1995. ISBN 0-12-632310-0, ISBN 978-0-12-632310-8
- ^ а б c d Уэбб, Р. Клинтон (ноябрь 2003 г.). «Сокращение и расслабление гладких мышц». Достижения в физиологическом образовании. 27 (4): 201–6. Дои:10.1152 / advan.00025.2003. PMID 14627615.
- ^ Херли, Томас; Ян, Цзе; и другие. (18 июля 2007 г.). «Структурные основы регуляции протеинфосфатазы 1 ингибитором-2». J. Biol. Chem. 282 (39): 28874–83. Дои:10.1074 / jbc.m703472200. PMID 17636256.
- ^ Коэн, Патриция Т. В. (15 января 2002 г.). «Протеиновая фосфатаза-1, направленная во многих направлениях». J Cell Sci. 115 (2): 780–4. PMID 11839776.
- ^ Fujioka, M; Такахаши, Н. (1 апреля 1998 г.). «Новая изоформа направленной / регулирующей субъединицы миозинфосфатазы человека (MYPT2): клонирование кДНК, тканевая экспрессия и хромосомное картирование». Геномика. 49 (1): 325–41. Дои:10.1006 / geno.1998.5222. PMID 9570949.
- ^ Гомпертс, Бастейн Д. (19 августа 2009 г.). Преобразование сигнала: 2-е издание. Лондон: Academic Press. ISBN 978-0123694416.
- ^ Ши Игун (30 октября 2009 г.). «Серин / треонинфосфатазы: механизм через структуру». Клетка. 139 (3): 468–84. Дои:10.1016 / j.cell.2009.10.006. PMID 19879837. S2CID 13903804. Получено 9 марта 2015.
- ^ Ли, Эрнест Ю.К .; Чжан, Лифанг; и другие. (15 марта 1999 г.). «Фосфорилаза-фосфатаза: новые горизонты старого фермента». Границы биологических наук. 4 (1–3): 270–85. Дои:10,2741 / ли. PMID 10077543. Получено 9 марта, 2015.
- ^ Ван, Юэпэн; Риддик, Надин; и другие. (27 февраля 2009 г.). «Регуляция изоформ ROCK миозинфосфатазы и сократимости гладкомышечных клеток сосудов». Circ. Res. 104 (4): 531–40. Дои:10.1161 / circresaha.108.188524. ЧВК 2649695. PMID 19131646.
- ^ а б Хромов Е.С.; Momotani, K .; и другие. (27 апреля 2012 г.). «Молекулярный механизм опосредованного телокином ингибирования фосфатазы легкой цепи миозина и расслабления гладких мышц желудочно-кишечного тракта, индуцированного цАМФ / цГМФ». J Biol Chem. 287 (25): 20975–85. Дои:10.1074 / jbc.m112.341479. ЧВК 3375521. PMID 22544752.
- ^ Somlyo, Andrew P .; Сомлё, Аврил В. (10 ноября 1999 г.). «Передача сигнала с помощью G-протеинов, Rho-киназы и протеинфосфатазы в гладкие мышцы и немышечный миозин II». Журнал физиологии. 522 (2): 177–85. Дои:10.1111 / j.1469-7793.2000.t01-2-00177.x. ЧВК 2269761. PMID 10639096.
- ^ Агилар, Гектор; Митчелл, Б.Ф. (7 мая 2010 г.). «Физиологические пути и молекулярные механизмы, регулирующие сократимость матки». Обновление репродукции человека. 16 (6): 725–44. Дои:10.1093 / humupd / dmq016. PMID 20551073. Получено 9 марта, 2015.
дальнейшее чтение
- Пато MD, Адельштейн RS (1983). «Очистка и характеристика мультисубъединичной фосфатазы из гладких мышц желудка индейки. Влияние связывания кальмодулина с киназой легкой цепи миозина на дефосфорилирование». J. Biol. Chem. 258 (11): 7047–54. PMID 6304072.
- Kimura K; и другие. (1996). «Регулирование миозинфосфатазы с помощью Rho и Rho-ассоциированной киназы (Rho-киназы)». Наука. 273 (5272): 245–248. Bibcode:1996Научный ... 273..245K. Дои:10.1126 / science.273.5272.245. PMID 8662509. S2CID 37249779.