Первичная стенограмма - Primary transcript


А первичная стенограмма одноцепочечная рибонуклеиновая кислота (РНК ) продукт, синтезированный транскрипция из ДНК, и обработаны для получения различных зрелых продуктов РНК, таких как мРНК, тРНК, и рРНК. Первичные транскрипты, обозначенные как мРНК, модифицируются при подготовке к перевод. Например, предшественник мРНК (пре-мРНК) представляет собой тип первичного транскрипта, который становится информационной РНК (мРНК) после обработка.
Пре-мРНК синтезируется из ДНК шаблон в ядро клетки к транскрипция. Пре-мРНК включает большую часть гетерогенная ядерная РНК (hnRNA). Как только пре-мРНК была полностью обработанный, это называется "зрелая информационная РНК ", или просто"информационная РНК ". Термин hnRNA часто используется как синоним пре-мРНК, хотя в строгом смысле hnRNA может включать в себя транскрипты ядерной РНК, которые не превращаются в цитоплазматическую мРНК.
Есть несколько шагов, которые способствуют производству первичных транскриптов. Все эти шаги включают серию взаимодействий для инициации и завершения транскрипции ДНК в ядро из эукариоты. Определенные факторы играют ключевую роль в активации и ингибировании транскрипции, где они регулируют производство первичных транскриптов. Транскрипция производит первичные транскрипты, которые в дальнейшем модифицируются несколькими процессами. Эти процессы включают Крышка 5 футов, 3'-полиаденилирование, и альтернативное сращивание. В частности, альтернативный сплайсинг напрямую способствует разнообразию мРНК, обнаруживаемой в клетках. Модификации первичных транскриптов были дополнительно изучены в исследованиях, направленных на получение более глубоких знаний о роли и значении этих транскриптов. Экспериментальные исследования, основанные на молекулярных изменениях первичных транскриптов и процессов до и после транскрипции, привели к лучшему пониманию заболеваний, связанных с первичными транскриптами.
Производство
Этапы, способствующие производству первичных транскриптов, включают серию молекулярных взаимодействий, которые инициируют транскрипцию ДНК в ядре клетки. В зависимости от потребностей данной клетки определенные последовательности ДНК транскрибируются для производства различных продуктов РНК, которые транслируются в функциональные белки для использования в клетке. Чтобы запустить процесс транскрипции в ядре клетки, двойные спирали ДНК разматываются и водородные связи соединяющие совместимые нуклеиновые кислоты ДНК разрываются с образованием двух несвязанных одиночных цепей ДНК.[1] Одна цепь ДНК-матрицы используется для транскрипции одноцепочечной мРНК первичного транскрипта. Эта цепь ДНК связана РНК-полимераза на промоутер область ДНК.[2]
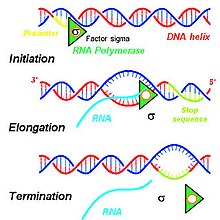
У эукариот три вида РНК -рРНК, тРНК, и мРНК - продуцируются на основе активности трех различных РНК-полимераз, тогда как в прокариоты существует только одна РНК-полимераза для создания всех видов молекул РНК.[3] РНК-полимераза II эукариот транскрибирует первичный транскрипт, транскрипт, предназначенный для обработки в мРНК, с антисмысловой ДНК-матрица в направлении от 5 'к 3', и этот вновь синтезированный первичный транскрипт комплементарен антисмысловой цепи ДНК.[1] РНК-полимераза II конструирует первичный транскрипт с использованием набора из четырех специфических рибонуклеозид монофосфатные остатки (аденозинмонофосфат (AMP), цитидин монофосфат (CMP), гуанозинмонофосфат (GMP) и монофосфат уридина (UMP)), которые непрерывно добавляются к 3'-гидроксильной группе на 3'-конце растущей мРНК.[1]
Исследования первичных транскриптов, продуцируемых РНК-полимеразой II, показывают, что средний первичный транскрипт составляет 7000 нуклеотиды в длину, а некоторые достигают в длину 20 000 нуклеотидов.[2] Включение обоих экзон и интрон Последовательности внутри первичных транскриптов объясняют разницу в размере между более крупными первичными транскриптами и более мелкой зрелой мРНК, готовой к трансляции в белок.
Регулирование
Ряд факторов способствует активации и ингибированию транскрипции и, следовательно, регулирует производство первичных транскриптов из данной матрицы ДНК.
Активация активности РНК-полимеразы для производства первичных транскриптов часто контролируется последовательностями ДНК, называемыми усилители. Факторы транскрипции белки, которые связываются с элементами ДНК, чтобы активировать или подавлять транскрипцию, связываются с энхансерами и привлекают ферменты, которые изменяют нуклеосома компоненты, в результате чего ДНК становится более или менее доступной для РНК-полимеразы. Уникальные комбинации либо активирующих, либо ингибирующих факторов транскрипции, которые связываются с участками энхансерной ДНК, определяют, активируется ли ген, с которым взаимодействует энхансер, для транскрипции или нет.[4] Активация транскрипции зависит от того, может ли комплекс элонгации транскрипции, состоящий из множества факторов транскрипции, индуцировать диссоциацию РНК-полимеразы от Посредник комплекс, который соединяет область энхансера с промотором.[4]

Торможение активности РНК-полимеразы также можно регулировать последовательностями ДНК, называемыми глушители. Подобно энхансерам, сайленсеры могут располагаться дальше вверх или вниз по течению от генов, которые они регулируют. Эти последовательности ДНК связываются с факторами, которые способствуют дестабилизации комплекса инициации, необходимого для активации РНК-полимеразы, и, следовательно, ингибируют транскрипцию.[5]
Гистон Модификация факторами транскрипции - еще один ключевой фактор регуляции транскрипции РНК-полимеразой. В целом факторы, приводящие к образованию гистона ацетилирование активируют транскрипцию, пока факторы, которые приводят к гистону деацетилирование подавляют транскрипцию.[6] Ацетилирование гистонов вызывает отталкивание между отрицательными компонентами в нуклеосомах, обеспечивая доступ РНК-полимеразы. Деацетилирование гистонов стабилизирует плотно свернутые нуклеосомы, ингибируя доступ РНК-полимеразы. В дополнение к паттернам ацетилирования гистонов паттерны метилирования в промоторных областях ДНК могут регулировать доступ РНК-полимеразы к данной матрице. РНК-полимераза часто неспособна синтезировать первичный транскрипт, если промоторная область целевого гена содержит специфические метилированные цитозины - остатки, которые препятствуют связыванию факторов, активирующих транскрипцию, и привлекают другие ферменты для стабилизации прочно связанной структуры нуклеосом, исключая доступ к РНК-полимеразе и предотвращая производство первичных транскриптов.[4]
R-петли
R-петли образуются при транскрипции. R-петля представляет собой трехцепочечную структуру нуклеиновой кислоты, содержащую гибридную область ДНК-РНК и связанную нематричную одноцепочечную ДНК. Активно транскрибируемые регионы ДНК часто образуют R-петли, которые уязвимы для Повреждение ДНК. Интроны уменьшают образование R-петли и повреждение ДНК в высокоэкспрессируемых генах дрожжей.[7]
Обработка РНК
Транскрипция, строго регулируемая фаза экспрессии генов, производит первичные транскрипты. Однако транскрипция - это только первый шаг, за которым должны следовать многие модификации, дающие функциональные формы РНК.[8] Иначе говоря, вновь синтезированные первичные транскрипты модифицируются несколькими способами для преобразования в их зрелые функциональные формы с образованием различных белков и РНК, таких как мРНК, тРНК и рРНК.
Обработка
Основной процесс модификации первичного транскрипта аналогичен для тРНК и рРНК как в эукариотических, так и в прокариотических клетках. С другой стороны, процессинг первичного транскрипта варьируется в мРНК прокариотических и эукариотических клеток.[8] Например, некоторые мРНК прокариотических бактерий служат матрицами для синтеза белков, в то же время, когда они продуцируются посредством транскрипции. С другой стороны, пре-мРНК эукариотических клеток претерпевает широкий спектр модификаций до их транспорта из ядра в цитоплазму, где транслируются их зрелые формы.[8] Эти модификации отвечают за различные типы закодированных сообщений, которые приводят к переводу различных типов продуктов. Кроме того, процессинг первичного транскрипта обеспечивает контроль экспрессии генов, а также регуляторный механизм скорости деградации мРНК. Процессинг пре-мРНК в эукариотических клетках включает: 5 'крышка, 3 'полиаденилирование, и альтернативное сращивание.
5 'крышка
Вскоре после начала транскрипции у эукариот 5'-конец пре-мРНК модифицируется путем добавления 7-метилгуанозиновый кэп, также известный как 5-футовый колпачок.[8] Модификация 5 'укупорки инициируется добавлением GTP к 5'-концевому нуклеотиду пре-мРНК в обратной ориентации с последующим добавлением метильных групп к остатку G.[8] 5'-кэппинг необходим для продукции функциональных мРНК, так как 5'-кэп отвечает за выравнивание мРНК с рибосомой во время трансляции.[8]
Полиаденилирование
У эукариот полиаденилирование дополнительно модифицирует пре-мРНК, при этом структура, называемая поли-А хвост добавлен.[8] Сигналы полиаденилирования, которые включают несколько элементов последовательности РНК, обнаруживаются группой белков, которые сигнализируют о добавлении поли-А-хвоста (длиной примерно 200 нуклеотидов). Реакция полиаденилирования обеспечивает сигнал об окончании транскрипции, и эта реакция заканчивается примерно на несколько сотен нуклеотидов ниже по ходу от места поли-A-хвоста.[8]
Альтернативная сварка
Интроны пре-мРНК эукариот сплайсированы сплайсосомы состоит из малые ядерные рибонуклеопротеины.[9][10]
В сложных эукариотических клетках один первичный транскрипт способен готовить большие количества зрелых мРНК за счет альтернативного сплайсинга. Альтернативный сплайсинг регулируется таким образом, что каждая зрелая мРНК может кодировать множество белков.

Эффект альтернативного сплайсинга на экспрессию генов можно увидеть у сложных эукариот, которые имеют фиксированное количество генов в своем геноме, но производят гораздо большее количество различных генных продуктов.[8] Большинство транскриптов пре-мРНК эукариот содержат несколько интронов и экзонов. Различные возможные комбинации 5'- и 3'-сайтов сплайсинга в пре-мРНК могут привести к различному вырезанию и комбинации экзонов, в то время как интроны удаляются из зрелой мРНК. Таким образом, генерируются различные виды зрелых мРНК.[8] Альтернативный сплайсинг имеет место в большом белковом комплексе, называемом сплайсосома. Альтернативный сплайсинг имеет решающее значение для тканеспецифической регуляции экспрессии генов и регуляции развития.[8] На альтернативный сплайсинг могут влиять различные факторы, включая такие мутации, как хромосомная транслокация.
У прокариот сплайсинг осуществляется автокаталитический расщеплением или эндолитическим расщеплением. Автокаталитическое расщепление, в котором не участвуют белки, обычно зарезервировано для участков, кодирующих рРНК, тогда как эндолитическое расщепление соответствует предшественникам тРНК.
Эксперименты
Исследование, проведенное Синди Л. Уиллс и Брюсом Дж. Дольником из отдела экспериментальной терапии в Мемориальном институте Розуэлл-Парк в Буффало, штат Нью-Йорк, и из программы клеточной и молекулярной биологии Университета Висконсина в Мэдисоне, штат Висконсин, было направлено на понимание клеточных процессы с участием первичных транскриптов. Исследователи хотели понять, действительно ли 5-Фторурацил (FUra), лекарство, известное своим применением для лечения рака, подавляет или блокирует дигидрофолатредуктаза (DHFR) процессинг пре-мРНК и / или стабильность ядерной мРНК в метотрексат -устойчивые клетки КБ. Длительное воздействие FUra не влияло на уровень пре-мРНК DHFR, содержащей определенные интроны, которые представляют собой участки пре-мРНК, которые обычно вырезаются из последовательности в процессе процессинга. Однако уровни общей мРНК DHFR снизились в два раза в клетках, подвергшихся воздействию 1,0 мкМ Фура. Значительных изменений в период полураспада, который относится ко времени, необходимому для распада 50% мРНК, общей мРНК DHFR или пре-мРНК, наблюдаемых в клетках, подвергнутых воздействию FUra. И эксперименты по мечению ядерной / цитоплазматической РНК продемонстрировали, что скорость превращения ядерной РНК DHFR в цитоплазматическую мРНК DHFR снижалась в клетках, обработанных FUra. Эти результаты предоставляют дополнительные доказательства того, что FUra может помочь в процессинге предшественников мРНК и / или влиять на стабильность ядерной мРНК DHFR.[11]
Джудит Ленджел и Шелдон Пенман с кафедры биологии Массачусетский Институт Технологий (Массачусетский технологический институт) в Кембридже, штат Массачусетс, написал статью об одном типе первичного транскрипта, участвующем в генах двух двукрылые, или насекомые с двумя крыльями: Дрозофила и Aedes. В статье описывается, как исследователи изучали первичные транскрипты гяРНК или пре-мРНК у двух видов насекомых. Размер транскриптов гяРНК и доля гяРНК, которая преобразуется в мРНК в клеточных линиях или группах клеток, полученных из одной клетки того, что изучается, Drosophila melanogaster и Aedes albopictus сравнивались. Оба насекомых двукрылые, но Aedes имеет больший геном, чем Дрозофила. Это означает, что у Aedes больше ДНК, а значит, больше генов. В Aedes линия производит большую гнРНК, чем Дрозофила линии, даже несмотря на то, что две клеточные линии росли в одинаковых условиях и продуцировали зрелую или процессированную мРНК одинакового размера и сложности последовательности. Эти данные предполагают, что размер hnRNA увеличивается с увеличением размера генома, что, очевидно, демонстрирует Aedes.[12]
Иво Мелчак, Степанка Мелчакова, Войтех Копский, Яромира Весерова и Иван Раска из отдела клеточной биологии Института экспериментальной медицины Академии наук Чешской Республики в Праге изучали влияние ядерные спеклы на пре-мРНК. Ядерные спеклы (спеклы) входят в состав ядер клеток и обогащены факторы сращивания известен своим участием в процессинге мРНК. Показано, что ядерные спеклы служат соседним активным генам в качестве хранилищ этих факторов сплайсинга. В этом исследовании исследователи показали, что в клетках HeLa, полученных из клеток человека с раком шейки матки, которые оказались полезными для экспериментов, первая группа сплайсосомы на пре-мРНК происходят из этих крапинок. Исследователи использовали микроинъекции сплайсосомы-акцептора и мутанта. аденовирус пре-мРНК с дифференциальным связыванием факторов сплайсинга с образованием разных групп, а затем следовали за сайтами, в которых они в значительной степени присутствовали. Принимающие сплайсосомы пре-мРНК быстро направлялись в спеклы, но было обнаружено, что нацеливание зависит от температуры. В полипиримидиновый тракт последовательности в мРНК способствуют построению групп сплайсосом и необходимы для нацеливания, но сами по себе этого недостаточно. Нижеследующие фланкирующие последовательности были особенно важны для нацеливания мутантных пре-мРНК в спеклах. В дополнительных экспериментах за поведением спеклов наблюдали после микроинъекции антисмысловых дезоксиолигорибонуклеотидов (комплементарных последовательностей ДНК и / или РНК к определенной последовательности) и, в этом случае, конкретных последовательностей мяРНК. snRNA также известны тем, что помогают в процессинге пре-мРНК. В этих условиях группы сплайсосом образуются на эндогенных пре-мРНК. Исследователи пришли к выводу, что группы сплайсосом на микроинъектированной пре-мРНК образуются внутри спеклов. Нацеливание и накопление пре-мРНК в спеклах является результатом загрузки факторов сплайсинга на пре-мРНК, и группы сплайсосом дали начало наблюдаемому пестрому паттерну.[13]
Сопутствующие заболевания
Исследования также привели к получению большего количества знаний об определенных заболеваниях, связанных с изменениями в первичных транскриптах. В одном исследовании участвовало рецепторы эстрогена и дифференциальная сварка. В статье Паолы Ферро, Алессандры Форлани, Марко Музелли и Ульриха Пфеффера из лаборатории молекулярной онкологии Национального института онкологических исследований в Генуе, Италия, говорится в статье «Альтернативный сплайсинг первичного транскрипта альфа-рецептора эстрогена человека: механизмы пропуска экзона». что 1785 нуклеотидов области в ДНК, которая кодирует рецептор эстрогена альфа (ER-альфа), распределены по области, содержащей более 300 000 нуклеотидов в первичном транскрипте. Сплайсинг этой пре-мРНК часто приводит к вариантам или различным видам мРНК, лишенным одного или нескольких экзонов или областей, необходимых для кодирования белков. Эти варианты были связаны с рак молочной железы прогрессия.[14] В жизненном цикле ретровирусы, провирусная ДНК включается в транскрипцию ДНК инфицированной клетки. Поскольку ретровирусам необходимо преобразовать свою пре-мРНК в ДНК, чтобы эта ДНК могла быть интегрирована в ДНК хозяина, на которого она воздействует, формирование этой матрицы ДНК является жизненно важным шагом для репликации ретровируса. Тип клетки, дифференцировка или изменение состояния клетки и физиологическое состояние клетки приводят к значительному изменению доступности и активности определенных факторов, необходимых для транскрипции. Эти переменные создают широкий диапазон экспрессии вирусных генов. Например, клетки тканевой культуры, активно продуцирующие инфекционные вирионы птиц или мышей. лейкемия вирусы (ASLV или MLV) содержат такие высокие уровни вирусной РНК, что 5–10% мРНК в клетке могут иметь вирусное происхождение. Это показывает, что первичные транскрипты, продуцируемые этими ретровирусами, не всегда следуют нормальному пути к производству белка и конвертируются обратно в ДНК для размножения и расширения.[15]
Смотрите также
Рекомендации
- ^ а б c Т. Страчан; Эндрю П. Рид (январь 2004 г.). Молекулярная генетика человека 3. Наука о гирляндах. С. 16–17. ISBN 978-0-8153-4184-0.
- ^ а б Альбертс Б. «Молекулярная биология клетки». NCBI (3-е изд.). Нью-Йорк: Наука Гарланд.
- ^ Гриффитс AJ. «Введение в генетический анализ». NCBI. Нью-Йорк: W.H. Фримен.
- ^ а б c Скотт Ф. Гилберт (15 июля 2013 г.). Биология развития. Sinauer Associates, Incorporated. С. 38–39, 50. ISBN 978-1-60535-173-5.
- ^ Браун Т.А. «Геномы» (2-е изд.). Оксфорд: Wiley-Liss.
- ^ Харви Лодиш (2008). Молекулярная клеточная биология. В. Х. Фриман. С. 303–306. ISBN 978-0-7167-7601-7.
- ^ Bonnet A, Grosso AR, Elkaoutari A, Coleno E, Presle A, Sridhara SC, Janbon G, Géli V, de Almeida SF, Palancade B (август 2017 г.). «Интроны защищают геномы эукариот от генетической нестабильности, связанной с транскрипцией». Молекулярная клетка. 67 (4): 608–621.e6. Дои:10.1016 / j.molcel.2017.07.002. PMID 28757210.
- ^ а б c d е ж грамм час я j k Купер GM. «Клетка: молекулярный подход» (2-е изд.). Сандерленд (Массачусетс): Sinauer Associates; 2000 г.
- ^ Уивер, Роберт Ф. (2005). Молекулярная биология, с.432-448. Макгроу-Хилл, Нью-Йорк, штат Нью-Йорк. ISBN 0-07-284611-9.
- ^ Wahl MC, Will CL, Lührmann R (февраль 2009 г.). «Сплайсосома: принципы проектирования динамической машины RNP». Клетка. 136 (4): 701–18. Дои:10.1016 / j.cell.2009.02.009. HDL:11858 / 00-001M-0000-000F-9EAB-8. PMID 19239890.
- ^ Уилл К.Л., Дольник Б.Дж. (декабрь 1989 г.). «5-Фторурацил ингибирует процессинг мРНК предшественника дигидрофолатредуктазы и / или стабильность ядерной мРНК в устойчивых к метотрексату клетках KB». Журнал биологической химии. 264 (35): 21413–21. PMID 2592384.
- ^ Lengyel J, Penman S (июль 1975 г.). «Размер hnRNA и процессинг в связи с различным содержанием ДНК у двух двукрылых: Drosophila и Aedes». Клетка. 5 (3): 281–90. Дои:10.1016/0092-8674(75)90103-8. PMID 807333.
- ^ Мельчак И., Мельчакова С., Копски В., Вецерова Ю., Раска И. (февраль 2001 г.). «Пресплицеосомная сборка на микроинъектированной мРНК предшественника происходит в ядерных спеклах». Молекулярная биология клетки. 12 (2): 393–406. CiteSeerX 10.1.1.324.8865. Дои:10.1091 / mbc.12.2.393. ЧВК 30951. PMID 11179423.
- ^ Ферро П., Форлани А., Музелли М., Пфеффер Ю. (сентябрь 2003 г.). «Альтернативный сплайсинг первичного транскрипта альфа рецептора эстрогена человека: механизмы пропуска экзона». Международный журнал молекулярной медицины. 12 (3): 355–63. PMID 12883652.
- ^ Coffin JM, Hughes SH, Varmus HE, редакторы. Ретровирусы. Колд-Спринг-Харбор (Нью-Йорк): Лаборатория Колд-Спринг-Харбор; 1997. Доступно с: https://www.ncbi.nlm.nih.gov/books/NBK19441/
