Индол алкалоид - Indole alkaloid
Индольные алкалоиды являются классом алкалоиды содержащий структурная составляющая из индол; многие индольные алкалоиды также включают изопрен группы и, таким образом, называются терпениндольными алкалоидами или триптаминовыми алкалоидами секологанина. Он содержит более 4100 известных различных соединений и является одним из самых больших классов алкалоидов.[1] Многие из них обладают значительной физиологической активностью и некоторые из них используются в медицине. В аминокислота триптофан это биохимический предшественник индольных алкалоидов.[2]
История

Действие некоторых индольных алкалоидов известно давно. Ацтеков использовал псилоцибиновые грибы которые содержат алкалоиды псилоцибин и псилоцин. Цветущее растение Раувольфия серпентина который содержит Резерпин было обычным лекарством в Индия около 1000 г. до н.э. Африканцы использовали корни многолетнее растение тропический лес кустарник Ибога, которые содержат ибогаин, как стимулятор. Настой Калабарская фасоль семена были переданы людям, обвиняемым в преступлениях в Нигерия: его отторжение желудком расценивалось как признак невиновности, в противном случае человек был убит действием физостигмин, который присутствует в растении и который вызывает паралич сердца и легких.[3]
Потребление рожь и связанные хлопья загрязненный грибок Claviceps purpurea причины спорынья отравление и эрготизм у человека и других млекопитающих. Связь между спорыньей и эрготизмом была установлена только в 1717 году, а алкалоид эрготамин, один из основных активных ингредиентов спорыньи, был выделен в 1918 году.[4]
Первый индольный алкалоид, стрихнин, был изолирован Пьер Жозеф Пеллетье и Джозеф Бьенэме Кавенту в 1818 г. из растений рода Стрихнос. Правильный структурная формула стрихнина была определена только в 1947 г., хотя наличие индольного ядра в структуре стрихнина было установлено несколько раньше.[5][6] Сам индол был впервые получен Адольф фон Байер в 1866 г. при разложении Индиго.[7]
Классификация
В зависимости от их биосинтеза различают два типа индольных алкалоидов; изопреноиды и неизопреноиды. К последним относятся терпеноид структурные элементы, синтезируемые живыми организмами из диметилаллил пирофосфат (DMAPP) и / или изопентенилпирофосфат (IPP):[8]
- Неизопреноидные:
- Простые производные от индол
- Простые производные от β-карболин
- Алкалоиды пирролоиндола
- Индол-3-карбинол
- Индол-3-уксусная кислота
- Триптамины
- Карбазолы
- Изопреноид:
- гемитерпеноиды: алкалоиды спорыньи
- монотерпеноиды.
- Стриктозидин
- Катарантин
- Йохимбин
- Винча
- Стрихнин
- Эллиптичность
Существуют и чисто структурные классификации, основанные на наличии карбазол, β-карболин или другие звенья углеродного скелета молекулы алкалоида.[9] Известно около 200 димерных индольных алкалоидов с двумя индольными группами.[10]
Неизопреноидные индольные алкалоиды
Количество известных неизопреноидных индольных алкалоидов невелико по сравнению с количеством индольных алкалоидов.[2]
Простые производные индола
Одними из самых простых и все же широко распространенных производных индола являются биогенные амины триптамин и 5-гидрокситриптамин (серотонин ).[11] Хотя их отнесение к алкалоидам не является общепринятым,[12] они оба содержатся в растениях и животных.[13] Триптаминовый скелет входит в состав подавляющего большинства индольных алкалоидов.[14] Например, N,N-диметилтриптамин (ДМТ), псилоцин и это фосфорилированный псилоцибин являются простейшими производными триптамина.[13] Некоторые простые индольные алкалоиды не содержат триптамин, например злак и гликозолин (последний является производным карбазол ).[15] Камалексин простой индольный алкалоид, производимый растением Arabidopsis thaliana, часто используется в качестве модели для биологии растений.[16]
Простые производные β-карболина
Распространенность β-карболин алкалоиды связаны с легкостью образования ядра β-карболина из триптамина во внутримолекулярном Реакция Манниха. Простые (не изопреноидные) производные β-карболина включают: гармин, гармалин, Harmane[17] и немного более сложная структура кантинона.[18] Гармалин был впервые выделен в 1838 году Гебелем.[19] и гармин в 1848 году Фрицче.[20][21][22]
Пироло-индольные алкалоиды
Пиролоиндольные алкалоиды образуют относительно небольшую группу производных триптамина. Их производит метилирование ядра индола в положении 3 и последующие нуклеофильное присоединение у атома углерода в положениях 2 с замыканием этиламиногруппы в кольцо. Типичный представитель этой группы - физостигмин,[23] который был выделен Йобстом и Гессе в 1864 году.[24][25]
Изопреноидные индольные алкалоиды

Изопреноидные индольные алкалоиды включают остатки триптофана или триптамина и строительные блоки изопреноидов, полученные из диметилаллил пирофосфат и изопентенилпирофосфат.[2]
Алкалоиды спорыньи
Спорынья алкалоиды - это класс гемитерпеноидных индольных алкалоидов, относящихся к лизергиновая кислота, который, в свою очередь, образуется в многостадийных реакциях с участием триптофан и DMAPP. Многие алкалоиды спорыньи амиды лизергиновой кислоты. Самый простой такой амид - это эргина, а более сложные можно разделить на следующие группы:[26][27]
- Вода аминоспирт производные, такие как эргометрин и это изомер эргометринин
- Не растворим в воде полипептид производные:
- Эрготамин группа, включающая эрготамин, эргозин и их изомеры
- Эргоксин группы, включая эргостин, эргоптин, эргонин и их изомеры
- Эрготоксин группа, в том числе эргокристин, α-эргокриптин, β-эргокриптин, эргокорнин и их изомеры.
Впоследствии было доказано, что эрготинин, открытый в 1875 году, и эрготоксин (1906) представляют собой смесь нескольких алкалоидов. В чистом виде первые алкалоиды спорыньи, эрготамин и его изомер эрготаминин были выделены Артуром Столлом в 1918 году.[27]
Монотерпеноидные индольные алкалоиды или триптаминовые алкалоиды секологанин
Большинство монотерпеноидных алкалоидов содержат фрагменты из 9 или 10 атомов углерода (выделены жирным шрифтом) (происходящие из секологанин ), а конфигурация позволяет группировать по Коринанта, Ибога и Аспидосперма классы. Монотерпеноидная часть их углеродного скелета проиллюстрирована ниже на примере алкалоидов аджмалицина и катарантина. Обведенные в кружки атомы углерода отсутствуют в алкалоидах, содержащих C9 фрагмент вместо C10.[14]
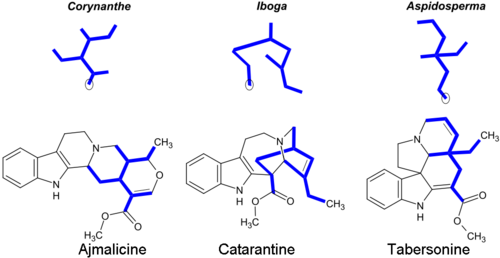
Коринанта алкалоиды включают неизмененный скелет секологанина, который модифицирован в Ибога и Аспидосперма алкалоиды.[28] Некоторые типичные представители монотерпеноидных индольных алкалоидов:[5][29][30]
| Тип | Число атомов углерода в монотерпеноидном фрагменте | |
|---|---|---|
| C9 | C10 | |
| Коринанта | Аджмалин, аквамицин, стрихнин, бруцин | Аджмалицин, йохимбин, Резерпин, сарпагин, митрагинин |
| Ибога | Ибогаин, ибогамин | Воакангин, катарантин |
| Аспидосперма | Эбурнамин | Таберсонин, виндолин, винкамин |
Также в растении присутствует небольшая группа алкалоидов. Аристотелия - около 30 соединений, наиболее важным из которых является педункуларин, которые содержат монотерпеноид C10 часть происходит не из секологанина.[31]
Бисиндольные алкалоиды
Димеры производных стриктозидина, условно называемые бисиндолами, но более сложные, чем это. Известно более 200 димерных индольных алкалоидов. Они образуются в живых организмах в результате димеризации мономерных оснований индола в следующих реакциях:[32]
- Реакция Манниха (воакамин)
- Реакция Майкла (виллалстонин)
- Конденсация из альдегиды с амины (токсиферин, калебасин)
- Окислительное связывание триптаминов (каликантин);
- Расщепление функциональной группы одного из мономеров (винбластин, винкристин ).
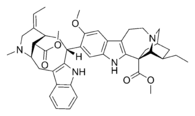 |  |  |  |
| Воакамин | Виллалстонин | Токсиферин | Винбластин |
Помимо бисиндольных алкалоидов, существуют димерные алкалоиды, которые образуются в результате димеризации мономера индола с другим типом алкалоидов. Примером является тубулозин, состоящий из индола и изохинолин фрагменты.[33]
Распространение в природе
Растения, богатые неизопреноидными индольными алкалоидами, включают: Harmal (Пеганум хармала), который содержит гарман, гармин и гармалин, и Калабарская фасоль (Physostigma venenosum) содержащий физостигмин.[34] Некоторые члены семьи Convolvulaceae, особенно Ipomoea violacea и Turbina corymbosa, содержать эрголины и лизергамиды.[35] Несмотря на значительное структурное разнообразие, большинство монотерпеноидных индольных алкалоидов локализовано в трех семействах двудольные растения: Apocynaceae (роды Альстония, Аспидосперма, Раувольфия и Catharanthus ), Rubiaceae (Коринанта ) и Loganiaceae (Стрихнос ).[36][37]
Индольные алкалоиды также присутствуют в грибах. Например, псилоцибиновые грибы содержит производные триптамина и Ключицы содержит производные лизергиновой кислоты.[34] Кожа многих видов жаб этого рода Bufo содержит производное триптамина, буфотенин, а также кожа и яд этого вида Буфо альвариус (Жаба реки Колорадо ) содержит 5-MeO-DMT.[38] Серотонин, что является важным нейротрансмиттер у млекопитающих также может быть отнесен к простым индольным алкалоидам.[39]

Harmal содержит β-карболиновые алкалоиды

Ipomoea violacea содержит эрголины

Альстония макрофилла содержит Коринанта алкалоиды

Раувольфия серпентина содержит Коринанта алкалоиды

Катарантус розовый содержит монотерпеноидные индольные алкалоиды

Псилоцибе кубенсис содержит псилоцибин и псилоцин
Спорынья содержит эрголины

Жаба реки Колорадо (Буфо альвариус) содержит буфотенин и 5-MeO-DMT

Tabernaemontana divaricata содержит индольные алкалоиды, в том числе катарантин, конофиллин, ибогамин, таберсонин и воакристина[40]
Биосинтез
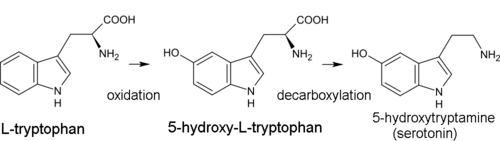
Биогенетическим предшественником всех индольных алкалоидов является аминокислота триптофан. Для большинства из них первым этапом синтеза является декарбоксилирование триптофана с образованием триптамин. Диметилтриптамин (DMT) образуется из триптамина метилирование с участием кофермент из S-аденозил метионин (СЭМ). Псилоцин производится спонтанным дефосфорилированием псилоцибин.[41]
В биосинтезе серотонина промежуточным продуктом является не триптамин, а 5-гидрокситриптофан, который, в свою очередь, декарбоксилируется с образованием 5-гидрокситриптамина (серотонина).[13]
Биосинтез β-карболин алкалоидов происходит за счет образования База Шиффа из триптамина и альдегид (или же кетокислота ) и последующие внутримолекулярные Реакция Манниха, где атом углерода C (2) индола служит нуклеофил. Затем ароматичность восстанавливается за счет потери протона при атоме C (2). Образующийся в результате скелет тетрагидро-β-карболина затем постепенно окисляется до дигидро-β-карболина и β-карболина. При образовании простых алкалоидов β-карболина, таких как гармин и гармалин, пировиноградная кислота действует как кетокислота. При синтезе монотерпеноидных индольных алкалоидов, секологанин играет роль альдегида. Аналогичным образом синтезируются пирролоиндольные алкалоиды в живых организмах.[42]

Биосинтез алкалоидов спорыньи начинается с алкилирования триптофана диметилаллил пирофосфат (DMAPP), где атом углерода C (4) в ядре индола играет роль нуклеофила. Полученный 4-диметилаллил-L-триптофан подвергается N-метилированию. Другими продуктами биосинтеза являются ханоклавин-I и агроклавин - последний гидроксилируется до элимоклавина, который, в свою очередь, окисляется до паспалевая кислота. В процессе перегруппировки аллила паспалевая кислота превращается в лизергиновую кислоту.[43]
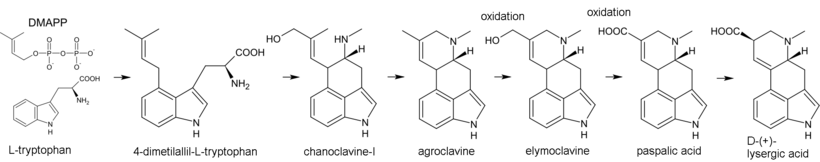
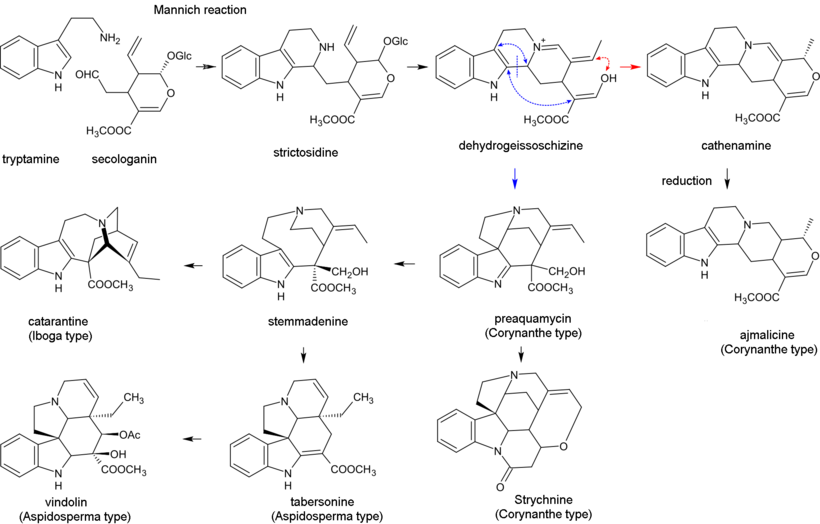
Биосинтез монотерпеноидных индольных алкалоидов начинается с реакции Манниха триптамина и секологанина; это дает стриктозидин который превращается в 4,21-дегидрогейсошизин. Затем, биосинтез большинства алкалоидов, содержащих невозмущенную монотерпеноидную часть (Коринанта типа) протекает через циклизацию с образованием катенамина и последующим восстановлением до аджмалицина в присутствии никотинамидадениндинуклеотидфосфат (НАДФН). В биосинтезе других алкалоидов, 4,21-дегидрогейсошизин сначала превращается в преакуаммицин (алкалоид подтипа стрихнос, тип Коринанта), который дает начало другим алкалоидам подтипа strychnos и типов Ибога и Аспидосперма. Бисиндольные алкалоиды винбластин и винкристин образуются в реакции с участием катарантина (алкалоид типа Ибога) и виндолин (типа Аспидосперма).[29][44]
Физиологическая активность

Индольные алкалоиды действуют на центральный и периферийный нервная система. Кроме того, бисиндольные алкалоиды винбластин и винкристин показывают противоопухолевый эффект.[45]
Из-за структурного сходства с серотонином многие триптамины могут взаимодействовать с серотонином. 5-HT рецепторы.[46] Главный эффект от серотонинергические психоделики Такие как ЛСД, ДМТ, и псилоцибин связано с тем, что они агонисты из 5-HT2А рецепторы.[47][48] Напротив, грамин является антагонистом 5-HT2А рецептор.[49]
Ergolines, Такие как лизергиновая кислота, включают структурные элементы как триптамина, так и фенилэтиламин и, таким образом, действуют на всю группу рецепторов 5-HT, адренорецепторы (в основном типа α) и дофаминовые рецепторы (в основном тип D2).[50][51] Так эрготамин частичный агонист α-адренорецепторов и 5-HT2 рецепторы, и таким образом сужается кровеносных сосудов и стимулирует сужение матка. Дигидроэрготамин более селективен к α-адренорецепторам и слабее влияет на рецепторы серотонина. Эргометрин является агонистом α-адренорецепторов, 5-HT2 и частично D2 рецепторы.[51][52] По сравнению с другими алкалоидами спорыньи, эргометрин обладает большей избирательностью при стимуляции матки.[52] ЛСД, полусинтетический психоделический эрголин, является агонистом 5-HT2А, 5-HT1А и в меньшей степени D2 рецепторов и обладает мощным психоделическим действием.[53][54]
Некоторые монотерпеноидные индольные алкалоиды также взаимодействуют с адренорецепторами. Например, аджмалицин является селективным антагонистом α1-адренорецепторы и, следовательно, антигипертензивный действие.[55][56] Йохимбин более селективен к α2 адренорецептор;[56] блокируя пресинаптическую α2-адренорецепторы, увеличивает выброс норэпинефрин тем самым повышая кровяное давление. Йохимбин использовался для лечения Эректильная дисфункция у мужчин до появления более эффективных препаратов.[57]
Некоторые алкалоиды косвенно влияют на оборот моноаминов. Итак, гармин и гармалин обратимы селективны. ингибиторы моноаминоксидазы-А.[58] Резерпин снижает концентрацию моноаминов в пресинаптических и синаптический нейроны, тем самым вызывая антигипертензивный и антипсихотический эффекты.[55]
Некоторые индольные алкалоиды взаимодействуют с другими типами рецепторов. Митрагинин является агонистом μ-опиоидный рецептор.[30] Хармальные алкалоиды являются антагонистами ГАМКА-рецептор,[59] и ибогаин - к NMDA-рецепторы.[60] Физостигмин обратимый ингибитор ацетилхолинэстеразы.[61]

Приложения
Растения и грибы, содержащие индольные алкалоиды, давно используются в традиционная медицина. Раувольфия серпентина, который содержит резерпин в качестве активного вещества, использовался более 3000 лет в Индия лечить укусы змей и безумие.[62] В средневековой Европе экстракты спорынья использовались в медикаментозный аборт.[63]
Позже к растениям добавились чистые препараты индольных алкалоидов. Резерпин был вторым (после хлорпромазин ) антипсихотик препарат, средство, медикамент; однако он показал относительно слабое действие и сильные побочные эффекты, и больше не используется для этой цели.[64] Вместо этого он прописывается как гипотензивный препарат, часто в сочетании с другими веществами.[65]
Другие препараты, влияющие на сердечно-сосудистая система включают аджмалин, который является антиаритмическим средством класса I,[66] и аджмалицин, который используется в Европе как гипотензивное средство.[55] Физостигмин - ингибитор ацетилхолинэстеразы - и его синтетические аналоги используются для лечения глаукома, Болезнь Альцгеймера (ривастигмин ) и миастения (неостигмин, пиридостигмин, дистигмин ).[67] Алкалоиды спорыньи эргометрин (эргобазин, эргоновин), эрготамин и их синтетические производные (метилэргометрин ) применяются против маточных кровотечений,[68] и бисиндольные алкалоиды винбластин и винкристин являются противоопухолевыми средствами.[69]
Исследования на животных показали, что ибогаин имеет потенциал в лечении героин, кокаин, и алкоголь зависимости, которая связана с антагонизмом ибогаина к NMDA-рецепторы. Медицинскому применению ибогаина препятствует его правовой статус, поскольку он запрещен во многих странах как мощный психоделический препарат с опасными последствиями передозировки. Однако нелегальная сеть в Европа и Соединенные Штаты предоставить ибогаин для лечения наркозависимости.[70][71]

С древних времен растения, содержащие индольные алкалоиды, использовались в качестве психоделические препараты. В Ацтеков использовали и Народ масатек продолжать использовать псилоцибиновые грибы и психоактивные семена утренняя слава виды как Ипомея трехцветная.[72] Племена амазонок употребляют психоделический настой, аяхуаска, сделан из Psychotria viridis и Банистериопсис каапи.[73] Psychotria viridis содержит психоделический препарат ДМТ, пока Банистериопсис каапи содержит алкалоиды гармалы, которые действуют как ингибиторы моноаминоксидазы. Считается, что основная функция алкалоидов гармалы в аяхуаске - предотвращать метаболизация ДМТ в пищеварительный тракт и печень, поэтому он может пересечь гематоэнцефалический барьер, тогда как прямое действие алкалоидов гармалы на центральную нервную систему минимально.[74] Яд Жаба реки Колорадо, Буфо альвариус, возможно, использовался в качестве психоделического препарата, так как его активные компоненты 5-MeO-DMT и буфотенин.[75] Один из самых распространенных развлекательный психоделические препараты, ЛСД, является полусинтетическим эрголин (который содержит индольный фрагмент).[76]
Рекомендации
- ^ Дэвид С. Зейглер (2001). Вторичный метаболизм растений. Springer. п. 628. ISBN 0-412-01981-7.
- ^ а б c И. Л. Кнунянц (1988). Химическая энциклопедия. Советская энциклопедия. п. 623.
- ^ Дьюик, стр. 348–367.
- ^ Гессен, стр. 333–335.
- ^ а б Гессен, стр. 316.
- ^ Орехов, с. 616
- ^ Л. Элдерфилд (1954). Гетероциклические соединения. 3. Москва. п. 5..
- ^ Дьюик, стр. 346–376.
- ^ Гессен, стр. 14–30.
- ^ Гессен, стр. 91–92.
- ^ Гессен, стр. 15
- ^ Леланд Дж. Чеке; и другие. (2006). Натуральные продукты из растений. Второе издание. CRC. п. 30. ISBN 0-8493-2976-0.
- ^ а б c Дьюик, стр. 347
- ^ а б Дьюик, стр. 350.
- ^ Гессен, стр. 16.
- ^ Главищниг (2007). «Камалексин». Фитохимия. 68 (4): 401–406. Дои:10.1016 / j.phytochem.2006.12.005.
- ^ Дьюик, стр. 349
- ^ Гессен, стр. 22
- ^ Гебель, о. (1838). «Убер дас Хармалин». Annalen der Chemie (на немецком). 38 (3): 363–366. Дои:10.1002 / jlac.18410380318.
- ^ Орехов, с. 565.
- ^ Фриче, Дж. (1848). "Untersuchungen über die Samen von Peganum Harmala". Journal für Praktische Chemie (на немецком). 43: 144–155. Дои:10.1002 / prac.18480430114.
- ^ "Bestandtheile der Samen von Peganum harmala". Annalen der Chemie (на немецком). 64 (3): 360–369. 1848. Дои:10.1002 / jlac.18480640353.
- ^ Дьюик, стр. 365–366
- ^ Jobst, J .; Гессен, О. (1864). "Ueber die Bohne von Calabar" (PDF). Annalen der Chemie (на немецком). 129 (1): 115–121. Дои:10.1002 / jlac.18641290114.
- ^ Голдфрэнк, Льюис Р. и Фломенбаум, Нил Токсикологические состояния Голдфрэнка, McGraw-Hill Professional, 2006 г. ISBN 0-07-147914-7 п. 794.
- ^ Дьюик, стр. 370–372.
- ^ а б Орехов, с. 627.
- ^ Дьюик, стр. 351
- ^ а б Дьюик, стр. 350–359.
- ^ а б Хиромицу Такаяма (2004). «Химия и фармакология анальгетических индольных алкалоидов из рубинового растения, Mitragyna speciosa". Химико-фармацевтический бюллетень. 52 (8): 916–928. Дои:10.1248 / cpb.52.916. PMID 15304982. Архивировано из оригинал 4 марта 2009 г.
- ^ Гессен, стр. 30
- ^ Гессен, стр. 91–105.
- ^ Гессен, стр. 99
- ^ а б Waksmundzka, стр. 625–626.
- ^ Тадеуш Анишевский (2007). Алкалоиды - секреты жизни. Амстердам: Эльзевир. п. 39. ISBN 978-0-444-52736-3.
- ^ Waksmundzka, p. 626
- ^ Тадеуш Анишевский (2007). Алкалоиды - секреты жизни. Амстердам: Эльзевир. С. 37–39. ISBN 978-0-444-52736-3.
- ^ Майкл Э. Петерсон; Патрисия А. Талкотт (2005). Токсикология мелких животных. Сондерс. п. 1086. ISBN 0-7216-0639-3.
- ^ Waksmundzka, p. 625
- ^ Кульшрешта, Анкита; Саксена, Джоти (2019). "Алкалоиды и не алкалоиды Tabernaemontana divaricata" (PDF). Международный журнал исследований и обзора. 6 (8): 517–524.
- ^ Фрике, Янис; Блей, Феликс; Хоффмайстер, Дирк (2017-09-25). «Ферментативный синтез псилоцибина». Angewandte Chemie International Edition. 56 (40): 12352–12355. Дои:10.1002 / anie.201705489. PMID 28763571.
- ^ Дьюик, стр. 349, 365.
- ^ Дьюик, стр. 369–370
- ^ Тадг П. Бегли (2009). Энциклопедия химической биологии. Вайли. С. 5–7. ISBN 978-0-471-75477-0.
- ^ Дьюик, стр. 356
- ^ Ричард А. Гленнон (2006). «Стратегии разработки селективных серотонинергических агентов». Рецепторы серотонина. От молекулярной фармакологии к терапии человека. Humana Press. п. 96. ISBN 1-58829-568-0.
- ^ Ричард А. Гленнон (2008). «Нейробиология галлюциногенов». Учебник американского психиатрического издательства по лечению наркозависимости. Американское Психиатрическое Издательство. п. 183. ISBN 978-1-58562-276-4.
- ^ Альпер, стр. 8
- ^ Фрольди Гульельмина; Сильвестрин Барбара; Дориго Паола; Капарротта Лаура (2004). «Грамин: алкалоид, расслабляющий сосуды, действующий на рецепторы 5-HT2A». Planta Medica. 70 (4): 373–375. Дои:10.1055 / с-2004-818953. PMID 15095157.
- ^ Дьюик, стр. 374–375
- ^ а б Б. Т. Ларсон; и другие. (1995). «Связывание эрговалина и активация дофаминовых рецепторов D2 в GH»4ZR7 Ячейки ». Журнал зоотехники. 73 (5): 1396–1400. Дои:10,2527 / 1995,7351396x. PMID 7665369.
- ^ а б Бертрам Г. Кацунг (2009). Фундаментальная и клиническая фармакология. McGraw-Hill Medical. п. 272. ISBN 978-0-07-160405-5.
- ^ Торстен Пасси; и другие. (2008). «Фармакология диэтиламида лизергиновой кислоты: обзор» (PDF). ЦНС нейробиология и терапия. 14 (4): 295–314. Дои:10.1111 / j.1755-5949.2008.00059.x. ЧВК 6494066. PMID 19040555.
- ^ Seeman, P. (2004). «Комментарий к» действию различных психотомиметиков через общий сигнальный путь"". Наука. 305 (5681): 180с. Дои:10.1126 / science.1096072. PMID 15247457.
- ^ а б c Дьюик, стр. 353
- ^ а б Demichel, P; Gomond, P; Рокбер, Дж (1982). «Альфа-адренорецепторные свойства раубазина у крыс, подвергнутых лечению». J Pharmacol. 77 (3): 449–454. Дои:10.1111 / j.1476-5381.1982.tb09317.x. ЧВК 2044614. PMID 6128043.
- ^ Бертрам Г. Кацунг (2009). Базовая и клиническая фармакология. McGraw-Hill Medical. п. 145. ISBN 978-0-07-160405-5.
- ^ Андреас Мозер (1998). Фармакология эндогенных нейротоксинов: справочник. Браун-Брамфилд. п. 138. ISBN 3-7643-3993-4.
- ^ Андреас Мозер (1998). Фармакология эндогенных нейротоксинов: справочник. Браун-Брамфилд. п. 131. ISBN 3-7643-3993-4.
- ^ Альпер, стр. 7
- ^ Дьюик, стр. 367
- ^ Дьюик, стр. 352
- ^ Гессен, стр. 332–333.
- ^ Алан Ф. Шацберг; Чарльз Б. Немерофф (2009). Американский психиатрический учебник по психофармакологии. Американское Психиатрическое Издательство. п. 533. ISBN 978-1-58562-309-9.
- ^ Симпатолитики (на русском).
- ^ Антиаритмические средства (на русском).
- ^ Дьюик, стр. 367–368
- ^ Утеротоники [(Утеротоники)].
- ^ «Противоопухолевые средства растительного происхождения (Противоопухолевые средства в растениях)» (на русском).
- ^ Альпер, стр. 2–19.
- ^ Дьюик, стр. 357
- ^ Дьюик, стр. 348
- ^ Кристина Пратт (2007) Энциклопедия шаманизма Том 1, Издательская группа "Розен", ISBN 1-4042-1140-3 п. 310
- ^ Хорди Риба; и другие. (2003). «Фармакология человека аяхуаски: субъективные и сердечно-сосудистые эффекты, экскреция метаболитов моноаминов и фармакокинетика». Журнал фармакологии и экспериментальной терапии. 306 (1): 73–83. Дои:10.1124 / jpet.103.049882. PMID 12660312.
- ^ В. Вейль; У. Дэвис (1994). "Буфо альвариус: сильнодействующий галлюциноген животного происхождения ". Журнал этнофармакологии. 41 (1–2): 1–8. Дои:10.1016/0378-8741(94)90051-5. PMID 8170151.
- ^ Дьюик, стр. 376
Библиография
- Альпер, Кеннет Р. (2001). «Ибогаин: обзор». Алкалоиды. Академическая пресса. ISBN 0-12-053206-9.
- Дьюик, Пол М (2002). Лекарственные натуральные продукты. Биосинтетический подход. Второе издание. Вайли. ISBN 0-471-49640-5.
- Гессен, Манфред (2002). Алкалоиды. Проклятие или благословение природы. Wiley-VCH. ISBN 978-3-906390-24-6.
- Орехов А.П. (1955). Химия Алкалоиды (2-е изд.). М .: СССР.
- Ваксмундзка-Хайнос, Моника; Шерма, Джозеф; Ковальска, Тереза (2008). Тонкослойная хроматография в фитохимии. CRC Press. ISBN 978-1-4200-4677-9.















