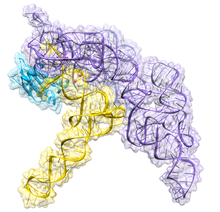
Рибонуклеаза P - Ribonuclease P
| Бактериальная РНКаза P класса A | |
|---|---|
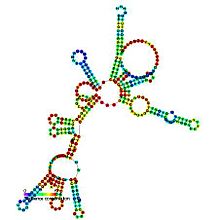 Предсказанный вторичная структура и сохранение последовательности РНКазыP_bact_a | |
| Идентификаторы | |
| Символ | РНКазаP_bact_a |
| Рфам | RF00010 |
| Прочие данные | |
| РНК тип | Ген; рибозим |
| Домен (ы) | Бактерии |
| ИДТИ | Термин GO должен начинаться с GO: Термин GO должен начинаться с GO: Термин GO должен начинаться с GO: |
| ТАК | ТАК: 0000386 |
| PDB структуры | PDBe |
| Бактериальная РНКаза P класса B | |
|---|---|
 Предсказанный вторичная структура и сохранение последовательности РНКазыP_bact_b | |
| Идентификаторы | |
| Символ | РНКазаP_bact_b |
| Рфам | RF00011 |
| Прочие данные | |
| РНК тип | Ген; рибозим |
| Домен (ы) | Бактерии |
| ИДТИ | Термин GO должен начинаться с GO: Термин GO должен начинаться с GO: Термин GO должен начинаться с GO: |
| ТАК | ТАК: 0000386 |
| PDB структуры | PDBe |
| Архейская РНКаза P | |
|---|---|
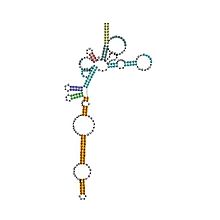 Предсказанный вторичная структура и сохранение последовательности архейной РНКазы P | |
| Идентификаторы | |
| Символ | RNaseP_arch |
| Рфам | RF00373 |
| Прочие данные | |
| РНК тип | Ген; рибозим |
| Домен (ы) | Археи |
| ИДТИ | Термин GO должен начинаться с GO: Термин GO должен начинаться с GO: Термин GO должен начинаться с GO: |
| ТАК | ТАК: 0000386 |
| PDB структуры | PDBe |
| Архейская РНКаза P класс T | |
|---|---|
| Идентификаторы | |
| Символ | РНКазаP-T |
| Рфам | RF02357 |
| Прочие данные | |
| РНК тип | Ген; рибозим |
| Домен (ы) | Археи |
| ИДТИ | Термин GO должен начинаться с GO: Термин GO должен начинаться с GO: Термин GO должен начинаться с GO: |
| ТАК | ТАК: 0000386 |
| PDB структуры | PDBe |
Рибонуклеаза P (ЕС 3.1.26.5, РНКаза P) является разновидностью рибонуклеаза который раскалывает РНК. РНКаза P отличается от других РНКаз тем, что рибозим - рибонуклеиновая кислота, которая действует как катализатор так же, как и белок на основе фермента. Его функция - отщеплять лишнюю или предшественницу последовательности РНК на тРНК молекулы.[1] Кроме того, РНКаза P является одним из двух известных в природе рибозимов с множественным оборотом (другим является рибосома ), открытие которых заработало Сидни Альтман и Томас Чех то Нобелевская премия по химии в 1989 г .: в 1970-х годах Альтман обнаружил существование тРНК-предшественницы с фланкирующими последовательностями и первым охарактеризовал РНКазу P и ее активность в процессинге 5 'лидерная последовательность предшественника тРНК. Недавние открытия также показали, что РНКаза P имеет новую функцию.[2] Было показано, что ядерная РНКаза P человека необходима для нормальной и эффективной транскрипции различных небольшие некодирующие РНК, например тРНК, 5S рРНК, SRP РНК и U6 мяРНК гены[3] которые транскрибируются РНК-полимераза III, одна из трех основных ядерных РНК-полимераз в клетках человека.
В бактериях
Бактериальный РНКаза P состоит из двух компонентов: цепи РНК, называемой РНК M1, и полипептидной цепи, или белка, называемого белком C5.[4][5] В естественных условиях, оба компонента необходимы для правильного функционирования рибозима, но in vitro, РНК M1 может действовать самостоятельно как катализатор.[1] Основная роль белка C5 заключается в повышении аффинности связывания субстрата и каталитической скорости фермента РНК M1, вероятно, за счет увеличения сродства к иону металла в активном центре. Кристаллическая структура холофермента бактериальной РНКазы P с тРНК была недавно решена, показывая, как большие, соосно уложенные друг на друга спиральные домены РНКазы P участвуют в избирательном распознавании формы пре-тРНК-мишени. Эта кристаллическая структура подтверждает более ранние модели распознавания и катализа субстрата, идентифицирует расположение активного сайта и показывает, как белковый компонент увеличивает функциональность РНКазы P.[6][7]
Бактериальная РНКаза P класса A и B
Рибонуклеаза P (РНКаза P) - это повсеместная эндорибонуклеаза, обнаруживаемая в архее, бактериях и эукариях, а также в хлоропластах и митохондриях. Его наиболее охарактеризованная активность - образование зрелых 5'-концов тРНК путем расщепления 5'-лидерных элементов тРНК-предшественников. Клеточные РНКазы Ps являются рибонуклеопротеины (РНП). РНК бактериальной РНКазы Ps сохраняет свою каталитическую активность в отсутствие белковой субъединицы, т.е. является рибозимом. Изолированная эукариотическая и архейная РНКаза Р РНК не сохраняет свою каталитическую функцию, но по-прежнему важна для каталитической активности холофермента. Хотя холоферменты архей и эукариот содержат гораздо большее количество белка, чем эубактериальные, ядра РНК всех трех линий гомологичны - спирали, соответствующие P1, P2, P3, P4 и P10 / 11, являются общими для всех клеточных РНКаз P. РНК. Тем не менее, существуют значительные вариации последовательностей, особенно среди эукариотических РНК.
В Архее
В археи, РНКаза P рибонуклеопротеины состоят из 4-5 белковых субъединиц, связанных с РНК. Как показал in vitro В экспериментах по восстановлению эти белковые субъединицы индивидуально необходимы для процессинга тРНК, который по существу опосредуется компонентом РНК.[8][9][10] Структуры белковых субъединиц архейной РНКазы P были определены с помощью рентгеновский снимок кристаллография и ЯМР, таким образом обнаруживая новые белковые домены и складывая фундаментальные функции.
Используя сравнительную геномику и усовершенствованные вычислительные методы, радикально минимизированная форма РНКазы P, получившая название «Тип T», была обнаружена во всех полных геномах кренархейного филогенетического семейства Thermoproteaceae, включая виды из родов Pyrobaculum, Caldivirga и Vulcanisaeta.[11] Все они сохраняют обычный каталитический домен, но не имеют узнаваемого домена специфичности. Активность обработки 5'-тРНК одной РНК была экспериментально подтверждена. РНК РНКазы P Pyrobaculum и Caldivirga являются наименьшими встречающимися в природе формами, которые, как было обнаружено, функционируют как транс-действующие рибозимы.[11] Потеря домена специфичности в этих РНК предполагает возможное изменение субстратной специфичности.
Недавно утверждалось, что архебактерии Nanoarchaeum equitans не обладает РНКазой P. Вычислительные и экспериментальные исследования не смогли найти доказательств его существования. В этом организме промотор тРНК близок к гену тРНК, и считается, что транскрипция начинается с первого основания тРНК, что устраняет потребность в РНКазе P.[12]
У эукариот
В эукариоты, например, люди и дрожжи, большая часть РНКазы P состоит из цепи РНК, которая структурно подобна цепи, обнаруженной у бактерий. [13] а также от девяти до десяти ассоциированных белков (в отличие от одного бактериального белка РНКазы Р, С5).[2][14] Пять из этих белковых субъединиц обладают гомологией с архейными аналогами. Эти белковые субъединицы РНКазы P общие с РНКаза MRP,[14][15][16] каталитический рибонуклеопротеин, участвующий в процессинге рибосомальной РНК в ядрышко.[17] РНКаза P из эукариот только недавно была продемонстрирована как рибозим.[18] Соответственно, многочисленные белковые субъединицы эукариальной РНКазы P вносят незначительный вклад в процессинг тРНК как таковой,[19] в то время как они кажутся важными для функции РНКазы P и РНКазы MRP в других биологических условиях, таких как транскрипция генов и клеточный цикл.[3][20] Несмотря на бактериальное происхождение митохондрий и хлоропластов, пластиды высших животных и растений, по-видимому, не содержат РНКазу P на основе РНК. Было показано, что митохондриальная РНКаза P человека представляет собой белок и не содержит РНК.[21] Шпинат хлоропласт Было также показано, что РНКаза P функционирует без субъединицы РНК.[22]
| Субъединица | Функция / взаимодействие (при обработке тРНК) |
|---|---|
| RPP14 | Связывание РНК |
| RPP20 | АТФаза, геликаза / Hsp27, SMN, Rpp25 |
| RPP21 | Связывание РНК, активность г / Rpp29 |
| RPP25 | Связывание РНК / Rpp20 |
| RPP29 | Связывание тРНК, активность / Rpp21 |
| RPP30 | Связывание РНК, активность / Pop5 |
| RPP38 | Связывание РНК, активность |
| RPP40 | |
| hPop1 | |
| hPop5 | Связывание РНК, активность / Rpp30 |
| H1 РНК | Активность / Rpp21, Rpp29, Rpp30, Rpp38 |
Терапия с использованием РНКазы P
РНКаза P в настоящее время изучается в качестве потенциального средства лечения таких заболеваний, как Вирус простого герпеса,[23] цитомегаловирус,[23][24] грипп и другие респираторные инфекции,[25] ВИЧ-1[26] и рак, вызванный гибридным геном BCR-ABL.[23][27] Внешние направляющие последовательности (EGS) формируются с взаимодополняемость к вирусной или онкогенной мРНК и структурам, имитирующим Т-петлю и акцепторную основу тРНК.[25] Эти структуры позволяют РНКазе P распознавать EGS и расщеплять мРНК-мишень. Показано, что терапия EGS эффективна в культуре и на живых мышах.[28]
Рекомендации
- ^ а б Guerrier-Takada C, Gardiner K, Marsh T, Pace N, Altman S (1983). «Фрагмент РНК рибонуклеазы P является каталитической субъединицей фермента». Клетка. 35 (3, часть 2): 849–57. Дои:10.1016/0092-8674(83)90117-4. PMID 6197186.
- ^ а б c Ярроус Н., Райнер Р. (2007). «Человеческая РНКаза P: фермент, обрабатывающий тРНК, и фактор транскрипции». Нуклеиновые кислоты Res. 35 (11): 3519–24. Дои:10.1093 / нар / гкм071. ЧВК 1920233. PMID 17483522.
- ^ а б Райнер Р., Бен-Асули Ю., Крыловецкий И., Ярроус Н. (2006). «Роль каталитической рибонуклеопротеидной РНКазы P в транскрипции РНК-полимеразы III». Genes Dev. 20 (12): 1621–35. Дои:10.1101 / gad.386706. ЧВК 1482482. PMID 16778078.
- ^ Эванс Д., Маркес С.М., Пейс Н.Р. (2006). «РНКаза P: интерфейс РНК и белкового мира». Trends Biochem. Наука. 31 (6): 333–41. Дои:10.1016 / j.tibs.2006.04.007. PMID 16679018.
- ^ Цай Х.Ю., Маскида Б., Бисвас Р., Вестхоф Э., Гопалан В. (2003). «Молекулярное моделирование трехмерной структуры холофермента бактериальной РНКазы P» (PDF). J. Mol. Биол. 325 (4): 661–75. Дои:10.1016 / S0022-2836 (02) 01267-6. PMID 12507471.
- ^ Рейтер Н., Остерман А., Торрес-Лариос А., Свингер К. К., Пан Т., Мондрагон А., Николас Дж .; Остерман, Эми; Торрес-Лариос, Альфредо; Свингер, Керрен К .; Пан, Дао; Мондрагон, Альфонсо (2010). «Структура холофермента бактериальной рибонуклеазы Р в комплексе с тРНК». Природа. 468 (7325): 784–789. Bibcode:2010Натура.468..784р. Дои:10.1038 / природа09516. ЧВК 3058908. PMID 21076397.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Masquida B, Westhof E, B .; Вестхоф, Э. (2011). «RNase P: наконец-то ключ нашел свой замок». РНК. 17 (9): 1615–1618. Дои:10.1261 / rna.2841511. ЧВК 3162327. PMID 21803972.
- ^ Холл Т.А., Браун Дж. В. (2002). «Архейская РНКаза Р имеет несколько белковых субъединиц, гомологичных эукариотическим ядерным белкам РНКазы Р». РНК. 8 (3): 296–306. Дои:10.1017 / S1355838202028492. ЧВК 1370252. PMID 12003490.
- ^ Фукухара Х, Кифуса М, Ватанабэ М, Терада А, Хонда Т, Нумата Т, Какута Й, Кимура М (2006). «Пятая белковая субъединица Ph1496p повышает оптимальную температуру для активности рибонуклеазы P из Pyrococcus horikoshii OT3». Biochem. Биофиз. Res. Сообщество. 343 (3): 956–64. Дои:10.1016 / j.bbrc.2006.02.192. PMID 16574071.
- ^ Цай Х.Ю., Пулуккунат Д.К., Возник В.К., Гопалан V (2006). «Функциональное восстановление и характеристика РНКазы P Pyrococcus furiosus». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 103 (44): 16147–52. Bibcode:2006ПНАС..10316147Т. Дои:10.1073 / pnas.0608000103. ЧВК 1637551. PMID 17053064.
- ^ а б Лай Л. Б., Чан П. П., Козен А. Е. и др. (Декабрь 2010 г.). «Открытие минимальной формы РНКазы P в Pyrobaculum». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 107 (52): 22493–8. Bibcode:2010PNAS..10722493L. Дои:10.1073 / pnas.1013969107. ЧВК 3012483. PMID 21135215.
- ^ Рандау Л., Шредер И., Зелл Д. (май 2008 г.). «Жизнь без РНКазы Р». Природа. 453 (7191): 120–3. Bibcode:2008Натура.453..120р. Дои:10.1038 / природа06833. PMID 18451863.
- ^ Маркес С.М., Чен Дж. Л., Эванс Д., Пейс Н. Р. (2006). «Структура и функция РНК эукариотической рибонуклеазы Р». Мол. Клетка. 24 (3): 445–56. Дои:10.1016 / j.molcel.2006.09.011. ЧВК 1716732. PMID 17081993.
- ^ а б Чемберлен JR, Ли Y, Lane WS, Engelke DR (1998). «Очистка и характеристика холоферментного комплекса ядерной РНКазы P выявляют обширное перекрытие субъединиц с РНКазой MRP». Genes Dev. 12 (11): 1678–90. Дои:10.1101 / gad.12.11.1678. ЧВК 316871. PMID 9620854.
- ^ Салинас К., Вежбицкий С., Чжоу Л., Шмитт М.Э. (2005). «Характеристика и очистка MRP РНКазы Saccharomyces cerevisiae раскрывает новый уникальный белковый компонент». J. Biol. Chem. 280 (12): 11352–60. Дои:10.1074 / jbc.M409568200. PMID 15637077.
- ^ Велтинг Т.Дж., Киккерт Б.Дж., ван Венройдж В.Дж., Пруейн Г.Дж. (2006). «Дифференциальная ассоциация белковых субъединиц с комплексами РНКазы MRP и РНКазы P человека». РНК. 12 (7): 1373–82. Дои:10.1261 / rna.2293906. ЧВК 1484433. PMID 16723659.
- ^ Клейтон Д.А. (2001). «Большое развитие для малой РНК». Природа. 410 (6824): 29–31. Дои:10.1038/35065191. PMID 11242026.
- ^ Киковска Э., Свярд С.Г., Кирсебом Л.А. (2007). «РНК эукариотической РНКазы Р опосредует расщепление в отсутствие белка». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 104 (7): 2062–7. Дои:10.1073 / pnas.0607326104. ЧВК 1892975. PMID 17284611.
- ^ Willkomm DK, Hartmann RK (2007). «Решена важная часть головоломки RNase P». Trends Biochem. Наука. 32 (6): 247–50. Дои:10.1016 / j.tibs.2007.04.005. PMID 17485211.
- ^ Gill T, Cai T., Aulds J, Wierzbicki S, Schmitt ME (2004). «РНКаза MRP расщепляет мРНК CLB2, чтобы способствовать прогрессированию клеточного цикла: новый метод деградации мРНК». Мол. Клетка. Биол. 24 (3): 945–53. Дои:10.1128 / MCB.24.3.945-953.2004. ЧВК 321458. PMID 14729943.
- ^ Дж. Хольцманн; П. Франк; Э. Лёффлер; К. Беннетт; К. Гернер; В. Россмани (2008). «РНКаза P без РНК: Идентификация и функциональное восстановление фермента процессинга митохондриальной тРНК человека». Клетка. 135 (3): 462–474. Дои:10.1016 / j.cell.2008.09.013. PMID 18984158.
- ^ Б. С. Томас; X. Li; П. Гегенхаймер (2000). «Рибонуклеаза Р хлоропласта не использует механизм расщепления пре-тРНК рибозимного типа». РНК. 6 (4): 545–553. Дои:10.1017 / S1355838200991465. ЧВК 1369935. PMID 10786845.
- ^ а б c Транг, П; Ким, К; Лю, Ф (6 июня 2004 г.). «Разработка рибозимов РНКазы P для нацеливания на гены и противовирусной терапии». Клеточная микробиология. 6 (6): 499–508. Дои:10.1111 / j.1462-5822.2004.00398.x. PMID 15104592.
- ^ Транг, П; Килани, А; Ли, Дж; Сюй, А; Liou, K; Kim, J; Наси, А; Ким, К; Лю Ф. (25 августа 2002 г.). «Рибозимы РНКазы P для изучения и лечения цитомегаловирусных инфекций человека». J Clin Virol. S2: S63–74. Дои:10.1016 / с 1386-6532 (02) 00097-5. PMID 12361758.
- ^ а б Дрейфус, Дэвид Х .; Томпкинс, С. Марк; Фулейхан, Рамзи; Года, Люси Y (2007). «Подавление гена в терапии гриппа и других респираторных заболеваний: нацеливание на РНКазу P с использованием внешних направляющих последовательностей (EGS)». Биологические препараты: цели и терапия. 1 (4): 425–32. ЧВК 2721295. PMID 19707312.
- ^ Цзэн, ВБ; Чен, YC; Bai, Y; Транг, П; Ву, ГП; Лу, ЮЗ; Wu, JG; Лю, ФГ (26 декабря 2012 г.). «Эффективное ингибирование репликации вируса иммунодефицита человека 1 с помощью инженерного рибозима РНКазы P». PLOS ONE. 7 (12): e51855. Bibcode:2012PLoSO ... 751855Z. Дои:10.1371 / journal.pone.0051855. ЧВК 3530568. PMID 23300569.
- ^ Cobaleda, C; Санчес-Гарсия, I (2000). «Ингибирование in vivo сайт-специфической каталитической субъединицей РНК РНКазы P, разработанной против онкогенных продуктов BCR-ABL: новый подход к лечению рака». Кровь. 95 (3): 731–7. Дои:10.1182 / кровь.V95.3.731.003k28_731_737. PMID 10648380.
- ^ Сойер, Эй Джей; Весоловски, Д; Гандотра, N; Стоядинович, А; Изаджу, М; Альтман, S; Кириакидес, Т.Р. (2013). «Конъюгат пептид-морфолиноолигомер, нацеленный на мРНК gyrA Staphylococcus aureus, улучшает заживление на модели инфицированной кожной раны мыши». Int. J. Pharm. 453 (2): 651–655. Дои:10.1016 / j.ijpharm.2013.05.041. ЧВК 3756894. PMID 23727592.
дальнейшее чтение
- Нобелевская лекция Сидни Альтмана, Нобелевская премия по химии 1989 г.
- Франк, Д. Н.; Пейс Н.Р. (1998). «Рибонуклеаза P: единство и разнообразие рибозима, обрабатывающего тРНК». Анну Рев Биохим. 67: 153–180. Дои:10.1146 / annurev.biochem.67.1.153. PMID 9759486.
- Браун, JW (1999). «База данных рибонуклеазы P». Нуклеиновые кислоты Res. 27 (1): 314–. Дои:10.1093 / nar / 27.1.314. ЧВК 148169. PMID 9847214.CS1 maint: лишняя пунктуация (ссылка на сайт)
внешняя ссылка
- База данных РНКазы P на ncsu.edu
- Страница для ядерной РНКазы P в Рфам
- Страница архейской РНКазы P в Рфам
- Страница для Бактериальной РНКазы P класса A в Рфам
- Страница для бактериальной РНКазы P класса B в Рфам
- РНКаза + P в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- ЕС 3.1.26.5