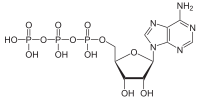
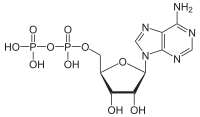
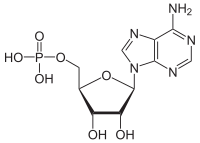
АТФаза - ATPase
| Аденозинтрифосфатаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 3.6.1.3 | ||||||||
| Количество CAS | 9000-83-3 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
АТФазы (ЕС 3.6.1.3, аденилпирофосфатаза, АТФ-монофосфатаза, трифосфатаза, Т-антиген SV40, аденозин-5'-трифосфатаза, АТФ-гидролаза, комплекс V (митохондриальный перенос электронов), (Ca2+ + Mg2+) -АТФаза, HCO3−-АТФаза, аденозинтрифосфатаза) представляют собой класс ферменты это катализировать то разложение из АТФ в ADP и бесплатный фосфат-ион[1][2][3][4][5][6] или обратная реакция. Эта дефосфорилирование релизы реакции энергия, который фермент (в большинстве случаев) использует для управления другими химические реакции иначе бы этого не произошло. Этот процесс широко используется во всех известных формах жизнь.
Некоторые из таких ферментов интегральные мембранные белки (закреплен в биологические мембраны ) и двигаться растворенные вещества через мембрану, обычно против градиента их концентрации. Их называют трансмембранными АТФазами.
Функции
Трансмембранные АТФазы импортируют многие метаболиты, необходимые для ячейка метаболизм и экспортировать токсины, отходы и растворенные вещества, которые могут препятствовать клеточным процессам. Важным примером является обменник натрий-калий (или Na+/ К+АТФаза ), который поддерживает потенциал клеточной мембраны. И еще один пример - водородная АТФаза калия (ЧАС+/ К+АТФаза или желудочный протонный насос), который подкисляет содержимое желудка. АТФаза генетически консервативна у животных; следовательно, карденолиды, которые представляют собой токсичные стероиды, продуцируемые растениями, действующими на АТФазы, вырабатывают общие и эффективные токсины животных, которые действуют дозозависимо.[7]
Помимо обменников, другие категории трансмембранной АТФазы включают: совместные перевозчики и насосы (однако некоторые теплообменники также являются насосами). Некоторые из них, например Na+/ К+АТФаза вызывают чистый поток заряда, а другие - нет. Их называют «электрогенными» и «неэлектрогенными» переносчиками соответственно.
Структура
В Мотивы Walker являются характерным мотивом белковой последовательности для связывания и гидролиза нуклеотидов. Помимо этой широкой функции, мотивы Уокера можно найти почти во всех природных АТФазах, за заметным исключением: тирозинкиназы. [8] Мотивы Уокера обычно образуют Бета-лист -очередь-Альфа-спираль который самоорганизуется как Гнездо (структурный мотив белка). Считается, что это связано с тем, что современные АТФазы произошли от небольших NTP-связывающих пептидов, которые должны были быть самоорганизованными.[9]
Белковый дизайн смог воспроизвести функцию АТФазы (слабо) без использования природных последовательностей или структур АТФазы. Важно отметить, что в то время как все природные АТФазы имеют некоторую структуру бета-листов, разработанная «Альтернативная АТФаза» не имеет структуры бета-листов, демонстрируя, что эта жизненно важная функция возможна с последовательностями и структурами, не встречающимися в природе. [10]
Механизм
Связь между гидролизом и транспортом АТФ является более или менее строгой химической реакцией, в которой фиксированное количество молекул растворенного вещества транспортируется для каждой молекулы АТФ, которая подвергается гидролизу; например, 3 Na+ ионы вне ячейки и 2 K+ ионов внутрь на гидролизованный АТФ, для Na+/ К+ обменник.
Трансмембранные АТФазы используют химическую потенциальную энергию АТФ, потому что они выполняют механическая работа: они переносят растворенные вещества в направлении, противоположном их термодинамически предпочтительное направление движения - то есть со стороны мембраны, где они находятся в низкой концентрации, к стороне, где они находятся в высокой концентрации. Этот процесс считается активный транспорт.
Например, блокировка везикулярной H+-АТФазы увеличивают pH внутри везикул и уменьшают pH цитоплазмы.
Трансмембранные АТФ-синтазы
В АТФ-синтаза из митохондрии и хлоропласты является анаболический фермент, использующий энергию трансмембранного протон градиент как источник энергии для добавления неорганический фосфат группа в молекулу аденозиндифосфат (АДФ) с образованием молекулы аденозинтрифосфата (АТФ).
Этот фермент работает, когда протон движется вниз по градиенту концентрации, давая ферменту вращательное движение. Это уникальное вращательное движение связывает АДФ и Р вместе, создавая АТФ.
АТФ-синтаза также может действовать в обратном направлении, то есть использовать энергию, высвобождаемую при гидролизе АТФ, для перекачки протонов против их электрохимического градиента.
Классификация
Существуют разные типы АТФаз, которые могут различаться по функции (синтез и / или гидролиз АТФ), структуре (F-, V- и A-АТФазы содержат вращающиеся двигатели) и типу переносимых ими ионов.
- Ротационные АТФазы[11][12]
- F-АТФазы (F1FO-ATPases) в митохондрии, хлоропласты и бактериальный плазматические мембраны являются основными продуцентами АТФ, используя протонный градиент, генерируемый окислительного фосфорилирования (митохондрии) или фотосинтез (хлоропласты).
- F-АТФазы, лишенные субъединица дельта / OSCP вместо этого переместите ионы натрия. Их предлагается назвать N-АТФазы, поскольку они, по-видимому, образуют отдельную группу, которая дальше от обычных F-ATPases, чем A-ATPases от V-ATPases.[13]
- В-АТФазы (V1VO-ATPases) в основном обнаруживаются в эукариотических вакуолях, катализируя гидролиз ATP для транспорта растворенных веществ и понижая pH в органеллах, таких как протонный насос лизосомы.
- А-АТФазы (A1AO-ATPases) находятся в Археи и некоторые экстремофильные бактерии. Они устроены как V-ATPases, но функционируют как F-ATPases в основном как ATP-синтазы.
- Существует много гомологов, которые не обязательно вращаются. Увидеть АТФ-синтаза § Эволюция.
- F-АТФазы (F1FO-ATPases) в митохондрии, хлоропласты и бактериальный плазматические мембраны являются основными продуцентами АТФ, используя протонный градиент, генерируемый окислительного фосфорилирования (митохондрии) или фотосинтез (хлоропласты).
- Р-АТФазы (E1E2-АТФазы) обнаруживаются в бактериях, грибах, а также в плазматических мембранах и органеллах эукариот и функционируют, чтобы транспортировать различные ионы через мембраны.
- Е-АТФазы находятся клеточная поверхность ферменты которые гидролизуют ряд NTP, включая внеклеточный АТФ. Примеры включают экто-АТФазы, CD39s и экто-АТФ / заболевания, все из которых являются членами "GDA1_CD39 "надсемейство.[14]
- Белки AAA семейство кольцевидных P-петля NTPases.
П-АТФаза
Р-АТФазы (иногда известные как АТФазы E1-E2) обнаруживаются в бактериях, а также в плазматических мембранах и органеллах эукариот. Его название связано с коротким временем присоединения неорганического фосфата к остаткам аспартата во время активации. Функция Р-АТФазы заключается в транспортировке множества различных соединений, таких как ионы и фосфолипиды, через мембрану с использованием гидролиза АТФ для получения энергии. Существует много различных классов P-ATPases, которые переносят определенный тип иона. P-АТФазы могут состоять из одного или двух полипептидов и обычно могут принимать две основные конформации, E1 и E2.
Гены человека
- Na+/ К+ транспортировка: ATP1A1, ATP1A2, ATP1A3, ATP1A4, ATP1B1, ATP1B2, ATP1B3, ATP1B4
- Ca++ транспортировка: ATP2A1, ATP2A2, ATP2A3, ATP2B1, ATP2B2, ATP2B3, ATP2B4, ATP2C1, ATP2C2
- Mg++ транспортировка: ATP3
- ЧАС+/ К+ обмен: ATP4A
- ЧАС+ транспортная, митохондриальная: ATP5A1, ATP5B, ATP5C1, ATP5C2, ATP5D, ATP5E, ATP5F1, ATP5G1, ATP5G2, ATP5G3, ATP5H, ATP5I, ATP5J, ATP5J2, ATP5L, ATP5L2, ATP5O, ATP5S
- ЧАС+ транспортная, лизосомная: ATP6AP1, ATP6AP2, ATP6V1A, ATP6V1B1, ATP6V1B2, ATP6V1C1, ATP6V1C2, ATP6V1D, ATP6V1E1, ATP6V1E2, ATP6V1F, ATP6V1G1, ATP6V1G2, ATP6V1G3, ATP6V1H, ATP6V0A1, ATP6V0A2, ATP6V0A4, ATP6V0B, ATP6V0C, ATP6V0D1, ATP6V0D2, ATP6V0E
- Cu++ транспортировка: ATP7A, ATP7B
- Класс I, тип 8: ATP8A1, ATP8B1, ATP8B2, ATP8B3, ATP8B4
- II сорт, тип 9: ATP9A, ATP9B
- Класс V, тип 10: ATP10A, ATP10B, ATP10D
- Класс VI, тип 11: ATP11A, ATP11B, ATP11C
- ЧАС+/ К+ транспортный, негастральный: ATP12A
- тип 13: ATP13A1, ATP13A2, ATP13A3, ATP13A4, ATP13A5
Смотрите также
использованная литература
- ^ Гейдер К., Хоффманн-Берлинг Х (1981). «Белки, контролирующие спиральную структуру ДНК». Ежегодный обзор биохимии. 50: 233–60. Дои:10.1146 / annurev.bi.50.070181.001313. PMID 6267987.
- ^ Килли WW (1961). «Миозин-аденозинтрифосфатаза». В Boyer PD, Lardy H, Myrbäck K (ред.). Ферменты. 5 (2-е изд.). Нью-Йорк: Academic Press. С. 159–168.
- ^ Мартин С.С., старший AE (ноябрь 1980 г.). «Активность мембранной аденозинтрифосфатазы в поджелудочной железе крысы». Biochimica et Biophysica Acta (BBA) - Биомембраны. 602 (2): 401–18. Дои:10.1016 / 0005-2736 (80) 90320-х. PMID 6252965.
- ^ Ньюс Д., Кнот Дж, Заллакян М. (1981). «Связанный протонами транспорт в хромаффинных гранулах». Актуальные темы биоэнергетики. 11: 107–147. Дои:10.1016 / B978-0-12-152511-8.50010-4.
- ^ Райли М.В., Петерс М.И. (июнь 1981 г.). «Локализация активности анион-чувствительной АТФазы в эндотелии роговицы». Biochimica et Biophysica Acta (BBA) - Биомембраны. 644 (2): 251–6. Дои:10.1016/0005-2736(81)90382-5. PMID 6114746.
- ^ Тьянь Р. (1981). «Регулирование вирусной транскрипции и репликации ДНК большим Т-антигеном SV40». Актуальные темы микробиологии и иммунологии. 93: 5–24. Дои:10.1007/978-3-642-68123-3_2. ISBN 978-3-642-68125-7. PMID 6269805.
- ^ Доблер С., Далла С., Вагшал В., Агравал А.А. (август 2012 г.). «Конвергентная эволюция в масштабах сообщества в адаптации насекомых к токсичным карденолидам путем замен в Na, K-АТФазе». Труды Национальной академии наук Соединенных Штатов Америки. 109 (32): 13040–5. Дои:10.1073 / pnas.1202111109. ЧВК 3420205. PMID 22826239.
- ^ Уокер Дж. Э., Сарасте М., Рансуик М. Дж., Гей Нью-Джерси (1982). «Дистанционно связанные последовательности в альфа- и бета-субъединицах АТФ-синтазы, миозина, киназ и других ферментов, требующих АТФ, и общая складка связывания нуклеотидов». EMBO J. 1 (8): 945–51. Дои:10.1002 / j.1460-2075.1982.tb01276.x. ЧВК 553140. PMID 6329717.
- ^ Romero Romero ML, Yang F, Lin YR, Toth-Petroczy A, Berezovsky IN, Goncearenco A, et al. (Декабрь 2018 г.). «Простые, но функциональные белки с фосфатной петлей». Труды Национальной академии наук Соединенных Штатов Америки. 115 (51): E11943 – E11950. Дои:10.1073 / pnas.1812400115. PMID 30504143.
- ^ Wang M, Hecht MH (август 2020 г.). «Полностью De Novo АТФаза от комбинаторного дизайна белка». Журнал Американского химического общества. Дои:10.1021 / jacs.0c02954. PMID 32833456.
- ^ Стюарт АГ, Ламинг Э.М., Собти М., Сток Д. (апрель 2014 г.). «Ротационные АТФазы - динамические молекулярные машины». Текущее мнение в структурной биологии. 25: 40–8. Дои:10.1016 / j.sbi.2013.11.013. PMID 24878343.
- ^ Кюльбрандт В., Дэвис К.М. (январь 2016 г.). «Роторные АТФазы: новый поворот к древней машине». Тенденции в биохимических науках. 41 (1): 106–116. Дои:10.1016 / j.tibs.2015.10.006. PMID 26671611.
- ^ Диброва, ДВ; Гальперин М.Ю .; Мулкиджанян, А.Ю. (15 июня 2010 г.). «Характеристика N-АТФазы, отдельной латерально переносимой Na + -транслокационной формы бактериальной мембранной АТФазы F-типа». Биоинформатика (Оксфорд, Англия). 26 (12): 1473–6. Дои:10.1093 / биоинформатика / btq234. PMID 20472544.
- ^ Ноулз, AF (март 2011 г.). «Суперсемейство GDA1_CD39: NTPDases с разнообразными функциями». Пуринергическая сигнализация. 7 (1): 21–45. Дои:10.1007 / s11302-010-9214-7. ЧВК 3083126. PMID 21484095.
внешние ссылки
- «АТФ-синтаза - великолепная молекулярная машина»
- АТФаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Электронно-микроскопические структуры АТФаз из банка данных EM (EMDB)