Магний в биологии - Magnesium in biology
Магний является важным элементом в биологических системах. Магний обычно происходит как Mg2+ ион. Это важный минерал питательное вещество (т.е. элемент) на всю жизнь[1][2][3][4] и присутствует в каждом клетка типа в каждом организме. Например, АТФ (аденозинтрифосфат), основной источник энергии в клетках, должен связываться с ионом магния, чтобы быть биологически активным. То, что называется АТФ, часто на самом деле является Mg-ATP.[5] Таким образом, магний играет роль в стабильности всех полифосфат соединения в клетках, в том числе связанные с синтезом ДНК и РНК.
Более 300 ферменты требуют присутствия ионов магния для их каталитического действия, в том числе все ферменты, использующие или синтезирующие АТФ, или те, которые используют другие нуклеотиды синтезировать ДНК и РНК.[нужна цитата ]
В растениях магний необходим для синтеза хлорофилл и фотосинтез.
Функция
Баланс магния жизненно важен для благополучия всех организмов. Магний является относительно распространенным ионом в земной коре и мантии и обладает высокой биодоступностью в гидросфера. Эта доступность в сочетании с полезной и очень необычной химией, возможно, привела к его использованию в эволюции в качестве иона для передачи сигналов, активации ферментов и катализ. Однако необычная природа ионного магния также привела к серьезным проблемам с использованием иона в биологических системах. Биологические мембраны непроницаемы для магния (и других ионов), поэтому транспортные белки должны облегчать поток магния как внутрь, так и из клеток и внутриклеточных компартментов.
Хлорофилл в растениях превращает воду в кислород как O2. Гемоглобин у позвоночных животных переносит кислород в виде O2 в крови. Хлорофилл очень похож на гемоглобин, за исключением того, что магний находится в центре молекулы хлорофилла, а железо находится в центре молекулы гемоглобина, с другими вариациями.[6] Этот процесс поддерживает живые клетки на Земле и поддерживает базовые уровни CO.2 и O2 в атмосфере.
Человеческое здоровье
Недостаточное потребление магния часто вызывает рост мышц судороги, и был связан с сердечно-сосудистые заболевания, сахарный диабет, высокое кровяное давление, беспокойство расстройства, мигрень, остеопороз, и инфаркт мозга.[7][8] Острый дефицит (см. гипомагниемия ) встречается редко и чаще встречается как побочный эффект лекарственного средства (например, при хроническом употреблении алкоголя или диуретиков), чем от низкого потребления пищи как такового, но он может возникать у людей, которых кормили внутривенно в течение продолжительного времени.
Наиболее частый симптом избыточного перорального приема магния: понос. Добавки на основе аминокислота хелаты (Такие как глицинат, лизинат и т. д.) гораздо лучше переносятся пищеварительная система и не имеют побочные эффекты старых используемых соединений, в то время как с замедленным выпуском пищевые добавки предотвратить возникновение диареи.[нужна цитата ] Поскольку почки взрослых людей эффективно выводят избыток магния, пероральное отравление магнием у взрослых с нормальным функция почек очень редко. Младенцам, которые имеют меньшую способность выводить избыток магния из организма, даже будучи здоровыми, нельзя давать добавки магния, за исключением случаев, когда они находятся под наблюдением врача.
Фармацевтические препараты с магнием используются для лечения состояний, включая дефицит магния и гипомагниемия, а также эклампсия.[9] Такие препараты обычно имеют вид сульфат магния или хлорид при введении парентерально. Магний усваивается организмом с разумной эффективностью (от 30% до 40%) из любой растворимой соли магния, такой как хлорид или цитрат. Магний аналогично всасывается из Английская соль, хотя сульфат в этих солях усиливает их слабительный эффект при более высоких дозах. Поглощение магния из нерастворимых оксидов и гидроксидных солей (молоко магнезии ) является беспорядочным и менее эффективным, поскольку зависит от нейтрализации и растворения соли кислотой желудка, что может быть (и обычно не является) полным.
Оротат магния может использоваться в качестве адъювантной терапии у пациентов, получающих оптимальное лечение тяжелого хроническая сердечная недостаточность, увеличивая выживаемость и улучшая клинические симптомы и состояние пациента. качество жизни.[10]
Нервная проводимость
Магний может влиять на расслабление мышц за счет прямого воздействия на клеточные мембраны. Mg2+ ионы закрывают определенные типы кальциевые каналы, которые проводят положительно заряженные ионы кальция в нейроны. При избытке магния будет заблокировано больше каналов, и активность нервных клеток снизится.[11][12]
Гипертония
Сульфат магния внутривенно используется для лечения преэклампсия.[13] В отношении артериальной гипертензии, не связанной с беременностью, метаанализ 22 клинических испытаний с диапазонами доз от 120 до 973 мг / день и средней дозой 410 мг пришел к выводу, что добавление магния имеет небольшой, но статистически значимый эффект, снижая систолическое артериальное давление. на 3–4 мм рт. ст. и диастолическое артериальное давление на 2–3 мм рт. Эффект был больше, когда доза составляла более 370 мг / день.[14]
Диабет и толерантность к глюкозе
Более высокое потребление магния с пищей соответствует более низкой заболеваемости диабетом.[15] Людям с диабетом или с высоким риском диабета добавка магния снижает уровень глюкозы натощак.[16]
Диетические рекомендации
Институт медицины США (IOM) обновил расчетные средние требования (EAR) и Рекомендуемая диета (RDAs) для магния в 1997 году. Если нет достаточной информации для установления EARs и RDAs, вместо этого используется оценка, обозначенная как «Адекватное потребление» (AI). Текущие EAR для женщин и мужчин в возрасте от 31 года и старше составляют 265 мг / день и 350 мг / день соответственно. Рекомендуемая суточная доза составляет 320 и 420 мг / день. RDA выше, чем EAR, чтобы определить суммы, которые покроют людей с потребностями выше среднего. Рекомендуемая суточная суточная норма при беременности составляет от 350 до 400 мг / день в зависимости от возраста женщины. Рекомендуемая суточная норма потребления для кормления грудью составляет от 310 до 360 мг / день по той же причине. Для детей в возрасте от 1 до 13 лет RDA увеличивается с 65 до 200 мг / день. Что касается безопасности, МОМ также устанавливает Допустимые верхние уровни потребления (UL) для витаминов и минералов, когда доказательств достаточно. В случае магния UL установлена на уровне 350 мг / день. UL специфичен для магния, потребляемого в качестве пищевой добавки, потому что слишком много магния, потребляемого за один раз, может вызвать диарею. UL не распространяется на пищевой магний. В совокупности EAR, RDA и UL именуются Рекомендуемая диета.[17]
| Возраст | Мужской | женский | Беременность | Кормление грудью |
|---|---|---|---|---|
| От рождения до 6 месяцев | 30 мг * | 30 мг * | ||
| 7–12 месяцев | 75 мг * | 75 мг * | ||
| 1–3 года | 80 мг | 80 мг | ||
| 4–8 лет | 130 мг | 130 мг | ||
| 9–13 лет | 240 мг | 240 мг | ||
| 14–18 лет | 410 мг | 360 мг | 400 мг | 360 мг |
| 19–30 лет | 400 мг | 310 мг | 350 мг | 310 мг |
| 31–50 лет | 420 мг | 320 мг | 360 мг | 320 мг |
| 51+ лет | 420 мг | 320 мг |
* = Достаточное потребление
В Европейское агентство по безопасности пищевых продуктов (EFSA) относится к совокупному набору информации как диетические контрольные значения, с контрольным потреблением населения (PRI) вместо RDA и средними потребностями вместо EAR. AI и UL определены так же, как в США. Для женщин и мужчин в возрасте 18 лет и старше ИА установлены на уровне 300 и 350 мг / день соответственно. ИА при беременности и кормлении грудью также составляют 300 мг / сут. Для детей в возрасте от 1 до 17 лет AI увеличивается с возрастом от 170 до 250 мг / день. Эти AI ниже, чем RDA США.[19] Европейское управление по безопасности пищевых продуктов рассмотрело тот же вопрос о безопасности и установило UL на уровне 250 мг / день - ниже, чем значение в США.[20] UL по магнию уникален тем, что он ниже, чем некоторые из RDA. Он применяется только к приему с фармакологическим средством или диетической добавкой и не включает прием с пищей и водой.
Для целей маркировки пищевых продуктов и пищевых добавок в США количество в порции выражается в процентах от дневной нормы (% DV). Для целей маркировки магния 100% дневной нормы составляли 400 мг, но по состоянию на 27 мая 2016 года она была пересмотрена до 420 мг, чтобы привести ее в соответствие с RDA.[21][22] Соблюдение обновленных правил маркировки требовалось к 1 января 2020 года для производителей с годовым объемом продаж продуктов питания 10 миллионов долларов США и более и к 1 января 2021 года для производителей с годовым объемом продаж продуктов питания менее 10 миллионов долларов США.[23][24][25] В течение первых шести месяцев после даты соответствия 1 января 2020 года FDA планирует сотрудничать с производителями, чтобы соответствовать новым требованиям к этикеткам Nutrition Facts, и не будет сосредоточиваться на принудительных мерах в отношении этих требований в течение этого времени.[23] Таблица старых и новых дневных значений для взрослых представлена на сайте Эталонное суточное потребление.
Источники питания

Зеленые овощи Такие как шпинат обеспечивают магний из-за обилия хлорофилл молекулы, которые содержат ион. Орехи (особенно бразильский орех, кешью и миндаль ), семена (например., семена тыквы ), темный шоколад, жареный соевые бобы, отруби, и немного цельное зерно также являются хорошими источниками магния.[26]
Хотя многие продукты содержат магний, его обычно не так много. Как и в случае с большинством питательных веществ, ежедневная потребность в магнии вряд ли будет удовлетворена одной порцией какого-либо отдельного продукта. Употребление в пищу разнообразных фруктов, овощей и злаков поможет обеспечить адекватное потребление магния.[нужна цитата ]
Поскольку магний легко растворяется в воде, рафинированные продукты, которые часто обрабатываются или готовятся в воде и сушатся, как правило, являются плохими источниками питательных веществ. Например, цельнозерновой хлеб содержит в два раза больше магния, чем белый хлеб, потому что богатые магнием зародыши и отруби удаляются при переработке белой муки. Таблица пищевых источников магния предлагает множество диетических источников магния.[нужна цитата ]
"Жесткая вода также может содержать магний, но "Мягкая вода содержит меньше иона. Обследования питания не оценивают потребление магния из воды, что может привести к недооценке общего потребления магния и его изменчивости.
Слишком много магния может затруднить усвоение организмом кальций.[нужна цитата ] Недостаток магния может привести к гипомагниемия как описано выше, с нерегулярным сердцебиением, высоким кровяным давлением (признак у людей, но не у некоторых экспериментальных животных, таких как грызуны), бессонницы и мышечных спазмов (фасцикуляция ). Однако, как уже отмечалось, симптомы низкого уровня магния из-за чистого диетического дефицита встречаются редко.
Ниже приведены некоторые продукты и количество в них магния:[27]
- Тыква семена без шелухи (1/4 стакана) = 303 мг
- Семена чиа, (1/4 стакана) = 162 мг[28]
- Гречневая крупа мука (1/2 стакана) = 151 мг
- бразильский орех (1/4 стакана) = 125 мг
- Овсяные отруби, сырые (1/2 стакана) = 110 мг
- Какао-порошок (1/4 стакана) = 107 мг
- Палтус (3 унции) = 103 мг
- Миндаль (1/4 стакана) = 99 мг
- Кешью (1/4 стакана) = 89 мг
- Цельнозерновая мука (1/2 стакана) = 83 мг
- Шпинат, вареные (1/2 стакана) = 79 мг
- швейцарский мангольд вареная (1/2 стакана) = 75 мг
- Шоколад, 70% какао (1 унция) = 73 мг
- Тофу, твердая (1/2 стакана) = 73 мг
- Черные бобы вареная (1/2 стакана) = 60 мг
- Лебеда приготовленные (1/2 стакана) = 59 мг
- Арахисовое масло (2 столовые ложки) = 50 мг
- Грецкие орехи (1/4 стакана) = 46 мг
- Семена подсолнечника, лущеный (1/4 стакана) = 41 мг
- Нут вареная (1/2 стакана) = 39 мг
- Капуста вареная (1/2 стакана) = 37 мг
- Чечевица вареная (1/2 стакана) = 36 мг
- Овсянка приготовленные (1/2 стакана) = 32 мг
- Рыбный соус (1 столовая ложка) = 32 мг
- Молоко, обезжиренное (1 стакан) = 27 мг
- Кофе, эспрессо (1 унция) = 24 мг
- Цельнозерновой хлеб (1 ломтик) = 23 мг
Биологический ареал, распространение и регулирование
В животные, было показано, что разные типы клеток поддерживают разные концентрации магния.[29][30][31][32] Кажется вероятным, что то же самое верно и для растения.[33][34] Это говорит о том, что разные типы клеток могут регулировать приток и отток магния по-разному в зависимости от их уникальных метаболических потребностей. Межклеточные и системные концентрации свободного магния должны аккуратно поддерживаться комбинированными процессами буферизации (связывание ионов с белками и другими молекулами) и приглушения (транспортировка ионов к хранилищам или внеклеточным пространствам).[35]).
У растений, а в последнее время и у животных, магний был признан важным сигнальным ионом, как активирующим, так и опосредующим многие биохимические реакции. Лучшим примером этого, возможно, является регулирование углерод фиксация в хлоропласты в Цикл Кальвина.[36][37]
Магний очень важен для клеточной функции. Дефицит питательное вещество вызывает заболевание пораженного организма. В одноклеточных организмах, таких как бактерии и дрожжи, низкий уровень магния проявляется в значительном снижении скорости роста. В транспорте магния нокаутировать Штаммы бактерий, здоровые показатели поддерживаются только при воздействии очень высоких внешних концентраций иона.[38][39] В дрожжах, митохондриальный Недостаток магния также приводит к заболеванию.[40]
Растения с дефицитом магния проявляют стрессовую реакцию. Первые наблюдаемые признаки как голодания, так и чрезмерного воздействия магния на растения - это снижение скорости магниевого голодания. фотосинтез. Это связано с центральным расположением Mg2+ ион в хлорофилл молекула. Последующие последствия дефицита магния для растений - значительное снижение роста и репродуктивной жизнеспособности.[4] Магний также может быть токсичным для растений, хотя обычно это наблюдается только в засуха условия.[41][42]

У животных дефицит магния (гипомагниемия ) наблюдается при низкой доступности магния в окружающей среде. У жвачных животных, особенно уязвимых к присутствию магния в пастбищных травах, это состояние известно как «травяная тетания». Гипомагниемия определяется потерей равновесия из-за мышечной слабости.[43] У людей также был идентифицирован ряд генетически обусловленных нарушений гипомагниемии.[44][45][46][47]
Чрезмерное воздействие магния может быть токсичным для отдельных клеток, хотя эти эффекты трудно показать экспериментально.[нужна цитата ] Гипермагниемия, переизбыток магния в крови обычно вызван потерей почка функция. Здоровые животные быстро выводят излишки магния с мочой и стулом.[48] Магний в моче называется магнезурия. Характерные концентрации магния в модельных организмах: в Кишечная палочка 30-100 мМ (связанный), 0,01-1 мМ (свободный), в почкующихся дрожжах 50 мМ, в клетках млекопитающих 10 мМ (связанный), 0,5 мМ (свободный) и в плазме крови 1 мМ.[49]
Биологическая химия
Mg2+ является четвертым по численности металл ион в камерах (на родинки ) и наиболее распространенный свободный двухвалентный катион - в результате он глубоко и внутренне вплетен в клеточные метаболизм. Действительно, Mg2+-зависимый ферменты появляются практически во всех метаболических путях: специфическое связывание Mg2+ к биологическим мембранам часто наблюдается, Mg2+ также используется в качестве сигнальной молекулы, и большая часть биохимии нуклеиновых кислот требует Mg2+, включая все реакции, требующие высвобождения энергии из АТФ.[50][51][37] В нуклеотидах тройной фосфатный фрагмент соединения неизменно стабилизируется за счет ассоциации с Mg2+ во всех ферментативных процессах.
Хлорофилл
В фотосинтезирующих организмах Mg2+ играет дополнительную жизненно важную роль координирующий ион в хлорофилл молекула. Эта роль была обнаружена Ричард Вильштеттер, получивший Нобелевскую премию по химии 1915 г. за очистку и структуру связывания хлорофилла с шестым числом углерода
Ферменты
Химия Mg2+ ion, применительно к ферментам, использует весь спектр необычных химических реакций этого иона для выполнения ряда функций.[50][52][53][54] Mg2+ взаимодействует с субстратами, ферментами, а иногда и с обоими (Mg2+ может быть частью активного сайта). В общем, Mg2+ взаимодействует с субстратами через координацию внутренней сферы, стабилизируя анионы или реакционноспособные промежуточные соединения, включая связывание с АТФ и активацию молекулы для нуклеофильной атаки. При взаимодействии с ферментами и другими белками Mg2+ может связываться с использованием внутренней или внешней координации сфер, чтобы либо изменить конформацию фермента, либо принять участие в химии каталитической реакции. В любом случае, поскольку Mg2+ очень редко полностью дегидратируется во время связывания лиганда, это может быть молекула воды, связанная с Mg2+ это важнее, чем сам ион. В Кислотность Льюиса Mg2+ (пKа 11.4) используется для проведения реакций как гидролиза, так и конденсации (наиболее распространенными из которых являются гидролиз сложного фосфатного эфира и перенос фосфорила), которые в противном случае потребовали бы значений pH, сильно отличающихся от физиологических значений.
Существенная роль в биологической активности АТФ
АТФ (аденозинтрифосфат), основной источник энергии в клетках, должен быть связан с ионом магния, чтобы быть биологически активным. То, что называется АТФ, часто на самом деле является Mg-ATP.[5]
Нуклеиновые кислоты
Нуклеиновые кислоты имеют важный диапазон взаимодействий с Mg2+. Связывание Mg2+ к ДНК и РНК стабилизирует структуру; это можно наблюдать по повышенной температуре плавления (Тм) двухцепочечной ДНК в присутствии Mg2+.[50] Кроме того, рибосомы содержат большое количество Mg2+ и обеспечиваемая стабилизация важна для комплексообразования этого рибо-протеина.[55] Большое количество ферментов, участвующих в биохимии нуклеиновых кислот, связывают Mg.2+ для активности, используя ион как для активации, так и для катализа. Наконец, автокатализ многих рибозимы (ферменты, содержащие только РНК) - Mg2+ зависимые (например, самосплайсинговые интроны митохондрий группы II дрожжей[56]).
Ионы магния могут иметь решающее значение в поддержании позиционной целостности тесно сгруппированных фосфатных групп. Эти кластеры появляются в многочисленных и различных частях ядро клетки и цитоплазма. Например, гексагидрат Mg2+ ионы связываются глубоко большая канавка и во внешнем устье нуклеиновой кислоты А-формы дуплексы.[57]
Клеточные мембраны и стенки
Биологические клеточные мембраны и клеточные стенки являются полианионными поверхностями. Это имеет важное значение для транспорта ионов, в частности потому, что было показано, что разные мембраны предпочтительно связывают разные ионы.[50] Оба Mg2+ и Ca2+ регулярно стабилизировать мембраны за счет сшивания карбоксилированный и фосфорилированный головные группы липидов. Однако оболочка мембраны Кишечная палочка также было показано, что связывает Na+, К+, Mn2+ и Fe3+. Транспорт ионов зависит как от градиента концентрации иона, так и от электрического потенциала (ΔΨ) через мембрану, на который будет влиять заряд на поверхности мембраны. Например, специфическое связывание Mg2+ к хлоропласт конверт был замешан в потере фотосинтетической эффективности из-за блокировки K+ поглощение и последующее закисление стромы хлоропластов.[36]
Белки
Mg2+ ион имеет тенденцию только слабо связываться с белки (Kа ≤ 105[50]), и это может быть использовано ячейкой для переключения ферментативный включение и выключение активности за счет изменения локальной концентрации Mg2+. Хотя концентрация свободного цитоплазматического Mg2+ составляет порядка 1 ммоль / л, общее содержание Mg2+ содержание клеток животных 30 ммоль / л[58] а у растений содержание энтодермальных клеток листа было измерено на уровне 100 ммоль / л (Stelzer и другие., 1990), большая часть которых хранится в отсеках для хранения вещей. Цитоплазматическая концентрация свободного Mg2+ буферизуется путем привязки к хелаторы (например, АТФ), но также, что более важно, хранением Mg2+ во внутриклеточных компартментах. Транспорт Mg2+ между внутриклеточными компартментами может быть основной частью регуляции активности фермента. Взаимодействие Mg2+ с белками также необходимо учитывать для транспорта иона через биологические мембраны.
Марганец
В биологических системах только марганец (Mn2+) легко заменяет Mg2+, но только в ограниченном наборе обстоятельств. Mn2+ очень похож на Mg2+ с точки зрения его химических свойств, включая комплексообразование внутренней и внешней оболочки. Mn2+ эффективно связывает АТФ и обеспечивает гидролиз энергетической молекулы большинством АТФаз. Mn2+ также может заменить Mg2+ в качестве активирующего иона для ряда Mg2+-зависимые ферменты, хотя некоторая ферментативная активность обычно теряется.[50] Иногда предпочтения таких ферментных металлов различаются среди близкородственных видов: например, обратная транскриптаза фермент лентивирусы подобно ВИЧ, SIV и FIV обычно зависит от Mg2+, тогда как аналогичный фермент для других ретровирусы предпочитает Mn2+.
Важность связывания лекарств
Статья[59] исследование структурных основ взаимодействий между клинически значимыми антибиотиками и рибосомой 50S появилось в журнале Nature в октябре 2001 года. Рентгеновская кристаллография с высоким разрешением установила, что эти антибиотики связываются только с 23S рРНК рибосомной субъединицы, и никаких взаимодействий с рибосомной субъединицей не происходит. белковая часть субъединицы. В статье подчеркивается, что результаты показывают «важность предполагаемого Mg2+ ионы для связывания некоторых лекарств ».
Измерение магния в биологических образцах
По радиоактивным изотопам
Использование радиоактивных индикаторных элементов в анализах поглощения ионов позволяет рассчитать km, Ki и Vmax и определить начальное изменение содержания ионов в клетках. 28Mg распадается за счет испускания высокоэнергетической бета- или гамма-частицы, что можно измерить с помощью сцинтилляционного счетчика. Однако период полураспада радиоактивного вещества 28Mg, самый стабильный из радиоактивных изотопов магния, составляет всего 21 час. Это сильно ограничивает эксперименты с нуклидом. Кроме того, с 1990 года ни одно предприятие в плановом порядке не производило 28Mg, а цена за миллиКи теперь прогнозируется примерно на уровне 30 000 долларов США.[60] Химическая природа Mg2+ таков, что он близко приближается к нескольким другим катионам.[61] Однако Co2+, Mn2+ и Ni2+ были успешно использованы для имитации свойств Mg2+ в некоторых ферментативных реакциях, и радиоактивные формы этих элементов были успешно использованы в исследованиях транспорта катионов. Сложность использования замены иона металла при изучении функции фермента заключается в том, что очень трудно установить взаимосвязь между активностями фермента с замещающим ионом по сравнению с исходным.[61]
По флуоресцентным индикаторам
Ряд хелаторов двухвалентных катионов имеют разные спектры флуоресценции в связанном и несвязанном состояниях.[62] Хелаторы для Ca2+ хорошо установлены, имеют высокое сродство к катиону и низкое влияние других ионов. Mg2+ хелаторы отстают, и основной флуоресцентный краситель для Mg2+ (маг-фура 2[63]) на самом деле имеет более высокое сродство к Ca2+.[64] Это ограничивает применение этого красителя для типов клеток, в которых уровень покоя Ca2+ составляет <1 мкМ и не меняется в зависимости от условий эксперимента, при которых Mg2+ подлежит измерению. Недавно Оттен и другие. (2001) описали работу над новым классом соединений, которые могут оказаться более полезными, имея значительно лучшее сродство связывания с Mg.2+.[65] Использование флуоресцентных красителей ограничивается измерением свободного Mg.2+. Если концентрация ионов буферизуется клеткой путем хелатирования или удаления в субклеточные компартменты, измеренная скорость поглощения даст только минимальные значения km и Vmax.
По электрофизиологии
Во-первых, ионоспецифические микроэлектроды можно использовать для измерения внутренней концентрации свободных ионов в клетках и органеллах. Основные преимущества заключаются в том, что показания могут быть получены с клеток в течение относительно длительных периодов времени, и что в отличие от красителей к клеткам добавляется очень небольшая дополнительная ионная буферная способность.[66]
Во-вторых, двухэлектродный фиксатор напряжения позволяет напрямую измерять поток ионов через мембрану ячейки.[67] Мембрана удерживается под электрическим потенциалом, и измеряется ответный ток. Все ионы, проходящие через мембрану, вносят вклад в измеряемый ток.
В-третьих, метод фиксации напряжения использует изолированные участки естественной или искусственной мембраны почти так же, как фиксация напряжения, но без побочных эффектов клеточной системы. В идеальных условиях можно измерить проводимость отдельных каналов. Эта методика позволяет наиболее точно измерить действие ионных каналов.[67]
Методом абсорбционной спектроскопии
Пламя атомно-абсорбционная спектроскопия (AAS) определяет общее содержание магния в биологическом образце.[62] Этот метод деструктивен; биологические образцы необходимо разложить в концентрированных кислотах, чтобы избежать засорения мелкого распылителя. Помимо этого, единственным ограничением является то, что образцы должны быть в объеме примерно 2 мл и в диапазоне концентраций 0,1–0,4 мкмоль / л для оптимальной точности. Поскольку этот метод не может различить Mg2+ уже присутствующий в клетке и поглощенный во время эксперимента, можно количественно оценить только непринятый контент.
Индуктивно связанная плазма (ICP) с помощью масс-спектрометрии (MS) или атомно-эмиссионная спектроскопия (AES) модификации также позволяют определять общее содержание ионов в биологических образцах.[68] Эти методы более чувствительны, чем пламенная ААС, и позволяют одновременно измерять количество нескольких ионов. Однако они также значительно дороже.
Транспорт магния
Химические и биохимические свойства Mg2+ представляют собой серьезную проблему для клеточной системы при транспортировке иона через биологические мембраны. Догма ионного транспорта гласит, что переносчик распознает ион, затем постепенно удаляет гидратную воду, удаляя большую часть или всю воду в селективной поре перед высвобождением иона на противоположной стороне мембраны.[69] Благодаря свойствам Mg2+, большое изменение объема от гидратированного до чистого иона, высокая энергия гидратации и очень низкая скорость обмена лиганда во внутреннем сфера координации, эти шаги, вероятно, более трудны, чем для большинства других ионов. На сегодняшний день только белок ZntA Парамеций было показано, что это Mg2+ канал.[70] Механизмы Mg2+ транспорт оставшимися белками начинает раскрываться с помощью первой трехмерной структуры Mg2+ транспортный комплекс решается в 2004 году.[71]
В гидратная оболочка магния2+ ion имеет очень плотно связанную внутреннюю оболочку из шести молекул воды и относительно прочно связанную вторую оболочку, содержащую 12–14 молекул воды (Markham и другие., 2002). Таким образом, предполагается, что признание Mg2+ иону требуется какой-то механизм для первоначального взаимодействия с гидратной оболочкой Mg2+с последующим прямым распознаванием / связыванием иона с белком.[60] Из-за силы комплексообразования внутренней сферы между Mg2+ и любого лиганда, множественные одновременные взаимодействия с транспортным белком на этом уровне могут значительно задерживать ион в транспортной поре. Следовательно, возможно, что большая часть гидратной воды остается во время транспортировки, что обеспечивает более слабую (но все же специфическую) координацию внешней сферы.
Несмотря на механическую сложность, Mg2+ должны транспортироваться через мембраны, и большое количество Mg2+ были описаны потоки через мембраны из множества систем.[72] Однако лишь небольшой выбор Mg2+ переносчики были охарактеризованы на молекулярном уровне.
Блокада лиганд-ионного канала
Магний ионы (Мг2+) в клеточная биология обычно почти во всех смыслах противоположны Ca2+ ионов, потому что они двухвалентный тоже, но есть больше электроотрицательность и, таким образом, оказывают большее притяжение на молекулы воды, предотвращая прохождение через канал (хотя сам магний меньше). Таким образом, Mg2+ ионы блокируют Са2+ каналы, такие как (Каналы NMDA ) и было показано, что они влияют на формирование каналов щелевых соединений. электрические синапсы.
Физиология растений магния
В предыдущих разделах подробно рассматривались химические и биохимические аспекты Mg.2+ и его транспорт через клеточные мембраны. В этом разделе мы применим эти знания к аспектам физиологии растений в целом, чтобы показать, как эти процессы взаимодействуют с более крупной и сложной средой многоклеточного организма.
Пищевые потребности и взаимодействия
Mg2+ необходим для роста растений и присутствует в высших растениях в количествах порядка 80 мкмоль г−1 сухой вес.[4] Количество Mg2+ варьируются в разных частях растения и зависят от статуса питания. В периоды изобилия избыток Mg2+ может храниться в сосудистых клетках (Stelzer и другие., 1990;[34] и во времена голода Mg2+ перераспределяется у многих растений от старых к более новым листьям.[4][73]
Mg2+ попадает в растения через корни. Взаимодействие с другими катионами в ризосфера может иметь значительное влияние на поглощение иона (Курвиц и Киркби, 1980;[74] Структура клеточных стенок корня очень проницаема для воды и ионов, и, следовательно, захват ионов клетками корня может происходить где угодно, от корневых волосков до клеток, расположенных почти в центре корня (ограничено только Каспарская полоса ). Стенки и мембраны растительных клеток несут большое количество отрицательных зарядов, и взаимодействие катионов с этими зарядами является ключом к поглощению катионов клетками корня, что обеспечивает локальный концентрирующий эффект.[75] Mg2+ относительно слабо связывается с этими зарядами и может замещаться другими катионами, препятствуя захвату и вызывая дефицит в растении.
Внутри отдельных растительных клеток Mg2+ требования во многом такие же, как и для всей клеточной жизни; Mg2+ используется для стабилизации мембран, жизненно важен для утилизации АТФ, активно участвует в биохимии нуклеиновых кислот и является кофактором многих ферментов (включая рибосомы). Также Mg2+ координирующий ион в молекуле хлорофилла. Это внутриклеточная компартментализация Mg.2+ в клетках растений, что приводит к дополнительной сложности. В четырех компартментах растительной клетки сообщается о взаимодействии с Mg.2+. Первоначально Mg2+ войдет в клетку в цитоплазму (еще не идентифицированной системой), но свободный Mg2+ концентрации в этом отсеке строго регулируются на относительно низком уровне (≈2 ммоль / л), поэтому любой избыток Mg2+ либо быстро экспортируется, либо хранится во втором внутриклеточном компартменте - вакуоли.[76] Потребность в Mg2+ в митохондриях было продемонстрировано на дрожжах[77] и весьма вероятно, что то же самое применимо и к растениям. Хлоропластам также требуется значительное количество внутреннего Mg.2+, и низкие концентрации цитоплазматического Mg2+.[78][79] Кроме того, вполне вероятно, что другие субклеточные органеллы (например, Гольджи, эндоплазматический ретикулум и т. Д.) Также требуют Mg2+.
Распределение ионов магния в растении
Попав в цитоплазматическое пространство клеток корня Mg2+вместе с другими катионами, вероятно, радиально переносится в стелу и сосудистую ткань.[80] Из клеток, окружающих ксилему, ионы выпускаются или перекачиваются в ксилему и переносятся вверх через растение. В случае Mg2+, который очень подвижен как в ксилеме, так и во флоэме,[81] ионы будут транспортироваться к верху растения и снова вниз в непрерывном цикле пополнения. Следовательно, поглощение и высвобождение из сосудистых клеток, вероятно, является ключевой частью цельного растительного Mg.2+ гомеостаз. На рис. 1 показано, как мало процессов связано с их молекулярными механизмами (только вакуумное поглощение связано с транспортным белком AtMHX).
Диаграмма показывает схематическое изображение завода и предполагаемых процессов Mg2+ транспорт в корне и листе, где Mg2+ загружается и разгружается из сосудистых тканей.[4] Mg2+ поглощается пространством клеточной стенки корня (1) и взаимодействует с отрицательными зарядами, связанными с клеточными стенками и мембранами. Mg2+ может сразу попадать в клетки (симпластический путь) или может пройти до каспариновой полосы (4), прежде чем всасываться в клетки (апопластический путь; 2). Концентрация Mg2+ в клетках корня, вероятно, накапливается в вакуолях клеток корня (3). Обратите внимание, что клетки кончика корня не содержат вакуолей. Попадая в цитоплазму корневой клетки, Mg2+ движется к центру корня по плазмодесматы, где он загружается в ксилему (5) для транспортировки к верхним частям растения. Когда Mg2+ достигает листьев, выгружается из ксилемы в клетки (6) и снова накапливается в вакуолях (7). Цикл Mg2+ во флоэму происходит через общие клетки листа (8) или непосредственно из ксилемы во флоэму через передаточные клетки (9) неизвестно. Mg2+ может вернуться к корням в соке флоэмы.
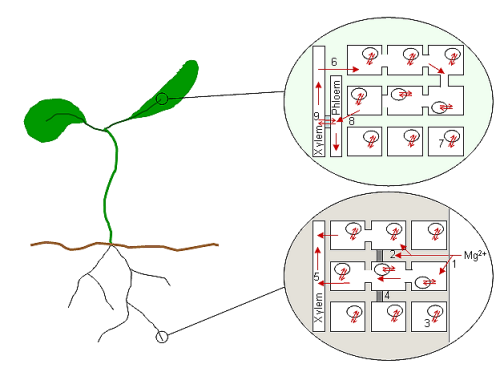
When a Mg2+ ion has been absorbed by a cell requiring it for metabolic processes, it is generally assumed that the ion stays in that cell for as long as the cell is active.[4] In vascular cells, this is not always the case; in times of plenty, Mg2+ is stored in the vacuole, takes no part in the day-to-day metabolic processes of the cell (Stelzer и другие., 1990), and is released at need. But for most cells it is death by senescence or injury that releases Mg2+ and many of the other ionic constituents, recycling them into healthy parts of the plant. In addition, when Mg2+ in the environment is limiting, some species are able to mobilise Mg2+ from older tissues.[73] These processes involve the release of Mg2+ from its bound and stored states and its transport back into the vascular tissue, where it can be distributed to the rest of the plant. In times of growth and development, Mg2+ is also remobilised within the plant as source and sink relationships change.[4]
The homeostasis of Mg2+ within single plant cells is maintained by processes occurring at the plasma membrane and at the vacuole membrane (see Figure 2). The major driving force for the translocation of ions in plant cells is ΔpH.[82] ЧАС+-ATPases pump H+ ions against their concentration gradient to maintain the pH differential that can be used for the transport of other ions and molecules. ЧАС+ ions are pumped out of the cytoplasm into the extracellular space or into the vacuole. The entry of Mg2+ into cells may occur through one of two pathways, via channels using the ΔΨ (negative inside) across this membrane or by symport with H+ ions. To transport the Mg2+ ion into the vacuole requires a Mg2+/H+ antiport transporter (such as AtMHX). The H+-ATPases are dependent on Mg2+ (bound to ATP) for activity, so that Mg2+ is required to maintain its own homeostasis.
A schematic of a plant cell is shown including the four major compartments currently recognised as interacting with Mg2+. ЧАС+-ATPases maintain a constant ΔpH across the plasma membrane and the vacuole membrane. Mg2+ is transported into the vacuole using the energy of ΔpH (in A. thaliana by AtMHX). Transport of Mg2+ into cells may use either the negative ΔΨ or the ΔpH. The transport of Mg2+ into mitochondria probably uses ΔΨ as in the mitochondria of yeast, and it is likely that chloroplasts take Mg2+ by a similar system. The mechanism and the molecular basis for the release of Mg2+ from vacuoles and from the cell is not known. Likewise, the light-regulated Mg2+ concentration changes in chloroplasts are not fully understood, but do require the transport of H+ ions across the thylakoid membrane.

Magnesium, chloroplasts and photosynthesis
Mg2+ is the coordinating metal ion in the chlorophyll molecule, and in plants where the ion is in high supply about 6% of the total Mg2+ is bound to chlorophyll.[4][83][84] Thylakoid stacking is stabilised by Mg2+ and is important for the efficiency of photosynthesis, allowing phase transitions to occur.[85]
Mg2+ is probably taken up into chloroplasts to the greatest extent during the light-induced development from proplastid to chloroplast or etioplast to chloroplast. At these times, the synthesis of chlorophyll and the biogenesis of the thylakoid membrane stacks absolutely require the divalent cation.[86][87]
Whether Mg2+ is able to move into and out of chloroplasts after this initial developmental phase has been the subject of several conflicting reports. Deshaies и другие. (1984) found that Mg2+ did move in and out of isolated chloroplasts from young pea plants,[88] but Gupta and Berkowitz (1989) were unable to reproduce the result using older spinach chloroplasts.[89] Deshaies и другие. had stated in their paper that older pea chloroplasts showed less significant changes in Mg2+ content than those used to form their conclusions. The relative proportion of immature chloroplasts present in the preparations may explain these observations.
The metabolic state of the chloroplast changes considerably between night and day. During the day, the chloroplast is actively harvesting the energy of light and converting it into chemical energy. The activation of the metabolic pathways involved comes from the changes in the chemical nature of the stroma on the addition of light. ЧАС+ is pumped out of the stroma (into both the cytoplasm and the lumen) leading to an alkaline pH.[90][91] Mg2+ (along with K+) is released from the lumen into the stroma, in an electroneutralisation process to balance the flow of H+.[92][93][94][95] Finally, thiol groups on enzymes are reduced by a change in the redox state of the stroma.[96] Examples of enzymes activated in response to these changes are fructose 1,6-bisphosphatase, sedoheptulose bisphosphatase and ribulose-1,5-bisphosphate carboxylase.[4][53][96] During the dark period, if these enzymes were active a wasteful cycling of products and substrates would occur.
Two major classes of the enzymes that interact with Mg2+ in the stroma during the light phase can be identified.[53] Firstly, enzymes in the glycolytic pathway most often interact with two atoms of Mg2+. The first atom is as an allosteric modulator of the enzymes’ activity, while the second forms part of the active site and is directly involved in the catalytic reaction. The second class of enzymes includes those where the Mg2+ is complexed to nucleotide di- and tri-phosphates (ADP and ATP), and the chemical change involves phosphoryl transfer. Mg2+ may also serve in a structural maintenance role in these enzymes (e.g., enolase).
Magnesium stress
Plant stress responses can be observed in plants that are under- or over-supplied with Mg2+. The first observable signs of Mg2+ stress in plants for both starvation and toxicity is a depression of the rate of photosynthesis, it is presumed because of the strong relationships between Mg2+ and chloroplasts/chlorophyll. In pine trees, even before the visible appearance of yellowing and necrotic spots, the photosynthetic efficiency of the needles drops markedly.[73] In Mg2+ deficiency, reported secondary effects include carbohydrate immobility, loss of RNA transcription and loss of protein synthesis.[97] However, due to the mobility of Mg2+ within the plant, the deficiency phenotype may be present only in the older parts of the plant. For example, in Pinus radiata starved of Mg2+, one of the earliest identifying signs is the chlorosis in the needles on the lower branches of the tree. This is because Mg2+ has been recovered from these tissues and moved to growing (green) needles higher in the tree.[73]
A Mg2+ deficit can be caused by the lack of the ion in the media (soil), but more commonly comes from inhibition of its uptake.[4] Mg2+ binds quite weakly to the negatively charged groups in the root cell walls, so that excesses of other cations such as K+, NH4+, Ca2+, and Mn2+ can all impede uptake.(Kurvits and Kirkby, 1980;[74] In acid soils Al3+ is a particularly strong inhibitor of Mg2+ uptake.[98][99] The inhibition by Al3+ and Mn2+ is more severe than can be explained by simple displacement, hence it is possible that these ions bind to the Mg2+ uptake system directly.[4] In bacteria and yeast, such binding by Mn2+ has already been observed. Stress responses in the plant develop as cellular processes halt due to a lack of Mg2+ (e.g. maintenance of ΔpH across the plasma and vacuole membranes). In Mg2+-starved plants under low light conditions, the percentage of Mg2+ bound to chlorophyll has been recorded at 50%.[100] Presumably, this imbalance has detrimental effects on other cellular processes.
Mg2+ toxicity stress is more difficult to develop. When Mg2+ is plentiful, in general the plants take up the ion and store it (Stelzer и другие., 1990). However, if this is followed by drought then ionic concentrations within the cell can increase dramatically. High cytoplasmic Mg2+ concentrations block a K+ channel in the inner envelope membrane of the chloroplast, in turn inhibiting the removal of H+ ions from the chloroplast stroma. This leads to an acidification of the stroma that inactivates key enzymes in carbon fixation, which all leads to the production of oxygen free radicals in the chloroplast that then cause oxidative damage.[101]
Смотрите также
- Ion channels
- Myers' cocktail
- Magnesium deficiency (medicine)
- Magnesium deficiency (agriculture)
- Calcium in biology
Примечания
- ^ "Magnesium (In Biological Systems)". Van Nostrand's Scientific Encyclopedia. 2006. Дои:10.1002/0471743984.vse4741. ISBN 978-0471743989. Отсутствует или пусто
| название =(помощь) - ^ Leroy, J. (1926). "Necessite du magnesium pour la croissance de la souris". Comptes Rendus des Séances de la Société de Biologie. 94: 431–433.
- ^ Lusk, J.E.; Williams, R.J.P.; Kennedy, E.P. (1968). "Magnesium and the growth of Escherichia coli". Журнал биологической химии. 243 (10): 2618–2624. PMID 4968384.
- ^ а б c d е ж грамм час я j k Marschner, H. (1995). Mineral Nutrition in Higher Plants. San Diego: Academic Press. ISBN 978-0-12-473542-2.
- ^ а б "Definition: magnesium from Online Medical Dictionary". 25 December 2007. Archived from оригинал on 2007-12-25. Получено 17 января 2018.
- ^ Granick S, Evolution of Heme and Chlorophyll in book, Bryson V, HJ Vogel, ed., Evolving Genes and Proteins. Academic Press, NY and London, 1965, pp. 67-88.
- ^ Romani, Andrea, M.P. (2013). "Chapter 3. Magnesium in Health and Disease". In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. 13. Springer. pp. 49–79. Дои:10.1007/978-94-007-7500-8_3. ISBN 978-94-007-7499-5. PMID 24470089.
- ^ Larsson S. C.; Virtanen M. J.; Mars M.; и другие. (March 2008). "Magnesium, calcium, potassium, and sodium intakes and risk of stroke in male smokers". Arch. Intern. Med. 168 (5): 459–65. Дои:10.1001/archinte.168.5.459. PMID 18332289.
- ^ Euser, A. G.; Cipolla, M. J. (2009). "Magnesium Sulfate for the Treatment of Eclampsia: A Brief Review". Гладить. 40 (4): 1169–1175. Дои:10.1161/STROKEAHA.108.527788. ЧВК 2663594. PMID 19211496.
- ^ Stepura OB, Martynow AI (February 2008). "Magnesium orotate in severe congestive heart failure (MACH)". Int. J. Cardiol. 131 (2): 293–5. Дои:10.1016/j.ijcard.2007.11.022. PMID 18281113.
- ^ Slutsky, I.; Sadeghpour, S.; Li, B.; Liu, G. (2004). "Enhancement of Synaptic Plasticity through Chronically Reduced Ca2+ Flux during Uncorrelated Activity". Нейрон. 44 (5): 835–49. Дои:10.1016/j.neuron.2004.11.013. PMID 15572114.Full Text
- ^ Slutsky, I.; Abumaria, N.; Wu, L. J.; Huang, C.; Zhang, L.; Li, B.; Zhao, X.; Govindarajan, A.; Zhao, M. G.; Zhuo, M.; Tonegawa, S.; Liu, G. (2010). "Enhancement of Learning and Memory by Elevating Brain Magnesium". Нейрон. 65 (2): 165–77. Дои:10.1016/j.neuron.2009.12.026. PMID 20152124.Full Text
- ^ Duley L, Gülmezoglu AM, Henderson-Smart DJ, Chou D (2010). "Magnesium sulphate and other anticonvulsants for women with pre-eclampsia". Кокрановская база данных Syst Rev (11): CD000025. Дои:10.1002/14651858.CD000025.pub2. ЧВК 7061250. PMID 21069663.
- ^ Kass L, Weekes J, Carpenter L (2012). "Effect of magnesium supplementation on blood pressure: a meta-analysis". Eur J Clin Nutr. 66 (4): 411–8. Дои:10.1038/ejcn.2012.4. PMID 22318649.
- ^ Fang X, Han H, Li M, Liang C, Fan Z, Aaseth J, He J, Montgomery S, Cao Y (2016). "Dose-Response Relationship between Dietary Magnesium Intake and Risk of Type 2 Diabetes Mellitus: A Systematic Review and Meta-Regression Analysis of Prospective Cohort Studies". Nutrients. 8 (11): 739. Дои:10.3390/nu8110739. ЧВК 5133122. PMID 27869762.
- ^ Veronese N, Watutantrige-Fernando S, Luchini C, Solmi M, Sartore G, Sergi G, Manzato E, Barbagallo M, Maggi S, Stubbs B (2016). "Effect of magnesium supplementation on glucose metabolism in people with or at risk of diabetes: a systematic review and meta-analysis of double-blind randomized controlled trials". Eur J Clin Nutr. 70 (12): 1354–1359. Дои:10.1038/ejcn.2016.154. HDL:10447/297358. PMID 27530471. S2CID 24998868.
- ^ "Magnesium", pp.190-249 in "Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride". Национальная академия прессы. 1997.
- ^ "Magnesium". Национальные институты здоровья, Office of Dietary Supplements. Updated: September 26, 2018
- ^ "Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies" (PDF). 2017.
- ^ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF), European Food Safety Authority, 2006
- ^ "Federal Register May 27, 2016 Food Labeling: Revision of the Nutrition and Supplement Facts Labels. FR page 33982" (PDF).
- ^ "Daily Value Reference of the Dietary Supplement Label Database (DSLD)". Dietary Supplement Label Database (DSLD). Получено 16 мая 2020.
- ^ а б "FDA provides information about dual columns on Nutrition Facts label". НАС. Food and Drug Administration (FDA). 30 декабря 2019 г.. Получено 16 мая 2020.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ "Changes to the Nutrition Facts Label". НАС. Food and Drug Administration (FDA). 27 мая 2016. Получено 16 мая 2020.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ "Industry Resources on the Changes to the Nutrition Facts Label". НАС. Food and Drug Administration (FDA). 21 December 2018. Получено 16 мая 2020.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ "Top 10 Foods Highest in Magnesium + Printable One Page Sheet". HealthAliciousNess. Получено 17 января 2018.
- ^ "SELF Nutrition Data - Food Facts, Information & Calorie Calculator". Nutritiondata.self.com.
- ^ "Food Composition Databases Show Foods List12006". ndb.nal.usda.gov.
- ^ Valberg, L. S.; Holt, J.M.; Paulson, E.; Szivek, J. (1965). "Spectrochemical Analysis of Sodium, Potassium, Calcium, Magnesium, Copper, and Zinc in Normal Human Erythrocytes". Журнал клинических исследований. 44 (3): 379–389. Дои:10.1172/JCI105151. ЧВК 292488. PMID 14271298.
- ^ Seiler, R. H.; Ramirez, O.; Brest, A. N.; Moyer, J. H. (1966). "Serum and erythrocytic magnesium levels in congestive heart failure: effect of hydrochlorothiazide". American Journal of Cardiology. 17 (6): 786–791. Дои:10.1016/0002-9149(66)90372-9.
- ^ Walser, M. (1967). "Magnesium metabolism". Ergebnisse der Physiologie Biologischen Chemie und Experimentellen Pharmakologie. 59: 185–296. Дои:10.1007/BF02269144. PMID 4865748. S2CID 43703938.
- ^ Iyengar, G.V.; Kollmer, W. E.; Bowen, H. J. M. (1978). The Elemental Composition of Human Tissues and Body Fluids. Weinheim, New York: Verlag Chemie. ISBN 978-0-89573-003-9.
- ^ Stelzer, R.; Lehmann, H.; Krammer, D.; Luttge, U. (1990). "X-Ray microprobe analysis of vacuoles of spruce needle mesophyll, endodermis and transfusion parenchyma cells at different seasons of the year". Botanica Acta. 103 (4): 415–423. Дои:10.1111/j.1438-8677.1990.tb00183.x.
- ^ а б Shaul, O.; Hilgemann, D. W.; de-Almeida-Engler, J.; Van, M.M.; Inze, D.; Galili, G. (1999). "Cloning and characterization of a novel Mg(2+)/H(+) exchanger". EMBO Journal. 18 (14): 3973–3980. Дои:10.1093/emboj/18.14.3973. ЧВК 1171473. PMID 10406802.
- ^ Thomas, R.C.; Coles, J. A.; Deitmer, J. W. (1991). "Homeostatic muffling". Природа. 350 (6319): 564. Bibcode:1991Natur.350R.564T. Дои:10.1038/350564b0. PMID 2017256. S2CID 4346618.
- ^ а б Berkowitz, G. A.; Wu, W. (1993). "Magnesium, potassium flux and photosynthesis". Magnesium Research. 6 (3): 257–265. PMID 8292500.
- ^ а б Shaul, O. (2002). "Magnesium transport and function in plants: the tip of the iceberg". BioMetals. 15 (3): 309–323. Дои:10.1023/A:1016091118585. PMID 12206396. S2CID 32535554.
- ^ Hmiel, S. P.; Snavely, M. D.; Florer, J. B.; Maguire, M. E.; Miller, C. G. (1989). "Magnesium transport in Salmonella typhimurium: genetic characterization and cloning of three magnesium transport loci". Journal of Bacteriology. 171 (9): 4742–4751. Дои:10.1128/jb.171.9.4742-4751.1989. ЧВК 210275. PMID 2548998.
- ^ MacDiarmid, C.W.; Gardner, R. C. (1998). "Overexpression of the Saccharomyces cerevisiae magnesium transport system confers resistance to aluminum ion". J. Biol. Chem. 273 (3): 1727–1732. Дои:10.1074/jbc.273.3.1727. PMID 9430719.
- ^ Wiesenberger, G.; Waldherr, M.; Schweyen, R. J. (1992). "The nuclear gene MRS2 is essential for the excision of group II introns from yeast mitochondrial transcripts in vivo". J. Biol. Chem. 267 (10): 6963–6969. PMID 1551905.
- ^ Kaiser, W. M. (1987). "Effects of water deficit on photosynthetic capacity". Physiologia Plantarum. 71: 142–149. Дои:10.1111/j.1399-3054.1987.tb04631.x.
- ^ Rao, I. M.; Sharp, R. E.; Boyer, J.S. (1987). "Leaf Phosphate Status, Photosynthesis, and Carbon Partitioning in Sugar Beet: III. Diurnal Changes in Carbon Partitioning and Carbon Export". Физиология растений. 92 (1): 29–36. Дои:10.1104/pp.92.1.29. ЧВК 1062243. PMID 16667261.
- ^ Grunes, D. L.; Stout, P. R.; Brownwell, J.R. (1970). Grass tetany of ruminants. Advances in Agronomy. 22. pp. 332–374. Дои:10.1016/S0065-2113(08)60272-2. ISBN 978-0-12-000722-6.
- ^ Paunier, L.; Radde, I. C.; Kooh, S.W.; Conen, P.E.; Fraser, D. (1968). "Primary hypomagnesemia with secondary hypocalcemia in an infant". Педиатрия. 41 (2): 385–402. PMID 5637791.
- ^ Weber S, Hoffmann K, Jeck N, Saar K, Boeswald M, Kuwertz-Broeking E, Meij II, Knoers NV, Cochat P, Suláková T, Bonzel KE, Soergel M, Manz F, Schaerer K, Seyberth HW, Reis A, Konrad M (2000). "Familial hypomagnesaemia with hypercalciuria and nephrocalcinosis maps to chromosome 3q27 and is associated with mutations in the PCLN-1 gene". European Journal of Human Genetics. 8 (6): 414–422. Дои:10.1038/sj.ejhg.5200475. PMID 10878661.
- ^ Weber S, Schneider L, Peters M, Misselwitz J, Rönnefarth G, Böswald M, Bonzel KE, Seeman T, Suláková T, Kuwertz-Bröking E, Gregoric A, Palcoux JB, Tasic V, Manz F, Schärer K, Seyberth HW, Konrad M (2001). "Novel paracellin-1 mutations in 25 families with familial hypomagnesemia with hypercalciuria and nephrocalcinosis". Journal of the American Society of Nephrology. 12 (9): 1872–1881. PMID 11518780.
- ^ Chubanov V, Waldegger S, Mederos y Schnitzler M, Vitzthum H, Sassen MC, Seyberth HW, Konrad M, Gudermann T (2004). "Disruption of TRPM6/TRPM7 complex formation by a mutation in the TRPM6 gene causes hypomagnesemia with secondary hypocalcemia". Труды Национальной академии наук Соединенных Штатов Америки. 101 (9): 2894–2899. Bibcode:2004PNAS..101.2894C. Дои:10.1073/pnas.0305252101. ЧВК 365716. PMID 14976260.
- ^ Harrison’s Principles of Internal Medicine, Online Edition
- ^ Milo, Ron; Philips, Rob. "Cell Biology by the Numbers: What are the concentrations of different ions in cells?". book.bionumbers.org. Получено 23 March 2017.
- ^ а б c d е ж Cowan, J. A. (1995). J.A. Cowan (ed.). Introduction to the biological chemistry of magnesium. The Biological Chemistry of Magnesium. New York: VCH.
- ^ Romani, A. M. P.; Maguire, M. E. (2002). "Hormonal regulation of Mg2+ transport and homeostasis in eukaryotic cells". BioMetals. 15 (3): 271–283. Дои:10.1023/A:1016082900838. PMID 12206393. S2CID 20835803.
- ^ Black, C. B.; Cowan, J.A. (1995). J.A. Cowan (ed.). "Magnesium-dependent enzymes in nucleic acid biochemistry". The Biological Chemistry of Magnesium. New York: VCH.
- ^ а б c Black, C.B.; Cowan, J. A. (1995). J.A. Cowan (ed.). "Magnesium-dependent enzymes in general metabolism". The Biological Chemistry of Magnesium. New York: VCH.
- ^ Cowan, J. A. (2002). "Structural and catalytic chemistry of magnesium-dependent enzymes". BioMetals. 15 (3): 225–235. Дои:10.1023/A:1016022730880. PMID 12206389. S2CID 40446313.
- ^ Sperazza, J. M.; Spremulli, L. L. (1983). "Quantitation of cation binding to wheat germ ribosomes: influences on subunit association equilibria and ribosome activity". Исследования нуклеиновых кислот. 11 (9): 2665–2679. Дои:10.1093/nar/11.9.2665. ЧВК 325916. PMID 6856472.
- ^ Smith, R. L.; Thompson, L.J.; Maguire, M. E. (1995). "Cloning and characterization of MgtE, a putative new class of Mg2+ transporter from Bacillus firmus OF4". Journal of Bacteriology. 177 (5): 1233–1238. Дои:10.1128/jb.177.5.1233-1238.1995. ЧВК 176728. PMID 7868596.
- ^ Robinson, Howard; Gao, Yi-Gui; Sanishvili, Ruslan; Joachimiak, Andrzej; Wang, Andrew H.-J. (15 April 2000). "Hexahydrated magnesium ions bind in the deep major groove and at the outer mouth of A-form nucleic acid duplexes". Исследования нуклеиновых кислот. 28 (8): 1760–1766. Дои:10.1093/nar/28.8.1760. ЧВК 102818. PMID 10734195.
- ^ Ebel, H.; Gunther, T. (1980). "Magnesium metabolism: a review". Journal of Clinical Chemistry and Clinical Biochemistry. 18 (5): 257–270. Дои:10.1515/cclm.1980.18.5.257. PMID 7000968. S2CID 37427719.
- ^ Schlünzen, Frank; Zarivach, Raz; Harms, Jörg; Bashan, Anat; Tocilj, Ante; Albrecht, Renate; Yonath, Ada; Franceschi, François (2001). "Structural basis for the interaction of antibiotics with the peptidyl transferase centre in eubacteria". Природа. 413 (6858): 814–21. Bibcode:2001Natur.413..814S. Дои:10.1038/35101544. PMID 11677599. S2CID 205022511.
- ^ а б Maguire, M.E.; Cowan, J. A. (2002). "Magnesium chemistry and biochemistry". BioMetals. 15 (3): 203–210. Дои:10.1023/A:1016058229972. PMID 12206387. S2CID 31622669.
- ^ а б Tevelev, A.; Cowan, J. A. (1995). J.A. Cowan (ed.). Metal substitution as a probe of the biological chemistry of magnesium ion. The Biological Chemistry of Magnesium. New York: VCH.
- ^ а б Drakenberg, T. (1995). J. A. Cowan (ed.). Physical methods for studying the biological chemistry of magnesium. The Biological Chemistry of Magnesium. New York: VCH.
- ^ Raju, B.; Murphy, E.; Levy, L. A.; Hall, R. D.; London, R. E. (1989). "A fluorescent indicator for measuring cytosolic free magnesium". Am J Physiol Cell Physiol. 256 (3 Pt 1): C540–548. Дои:10.1152/ajpcell.1989.256.3.C540. PMID 2923192.
- ^ Grubbs, R. D. (2002). "Intracellular magnesium and magnesium buffering". BioMetals. 15 (3): 251–259. Дои:10.1023/A:1016026831789. PMID 12206391. S2CID 20873166.
- ^ Otten, P.A.; London, R.E.; Levy, L. A. (2001). "4-Oxo-4H-quinolizine-3-carboxylic acids as Mg2+ selective, fluorescent indicators". Bioconjugate Chemistry. 12 (2): 203–212. Дои:10.1021/bc000087d. PMID 11312681.
- ^ Gunzel, D.; Schlue, W.-R. (2002). "Determination of [Mg2+]i - an update on the use of Mg2+-selective electrodes". BioMetals. 15 (3): 237–249. Дои:10.1023/A:1016074714951. PMID 12206390. S2CID 27877817.
- ^ а б Hille, B. (1992). "2". Ionic channels of excitable membranes. Sunderland: Sinauer Associates Inc. ISBN 978-0-87893-322-8.
- ^ See Chapters 5 and 6 in Dean, J.R. (1997). Atomic Absorption and Plasma Spectroscopy. Chichester: John Wiley & Sons. ISBN 978-0-471-97255-6. for descriptions of the methodology as applied to analytical chemistry.
- ^ Hille, 1992. Chapter 11
- ^ Haynes, W. J.; Kung, C.; Saimi, Y.; Preston, R. R. (2002). "An exchanger-like protein underlies the large Mg2+ current in Paramecium". PNAS. 99 (24): 15717–15722. Bibcode:2002PNAS...9915717H. Дои:10.1073/pnas.242603999. ЧВК 137782. PMID 12422021.
- ^ Warren, M. A.; Kucharski, L. M.; Veenstra, A.; Shi, L.; Grulich, P. F.; Maguire, M. E. (2004). "The CorA Mg2+ Transporter Is a Homotetramer". Journal of Bacteriology. 186 (14): 4605–4612. Дои:10.1128/JB.186.14.4605-4612.2004. ЧВК 438605. PMID 15231793.
- ^ Gardner, R. C. (2003). "Genes for magnesium transport". Current Opinion in Plant Biology. 6 (3): 263–267. Дои:10.1016/S1369-5266(03)00032-3. PMID 12753976.
- ^ а б c d Laing, W.; Greer, D.; Sun, O.; Beets, P.; Lowe, A.; Payn, T. (2000). "Physiological impacts of Mg deficiency in Pinus radiata: growth and photosynthesis". New Phytol. 146: 47–57. Дои:10.1046/j.1469-8137.2000.00616.x.
- ^ а б Heenan, D.P.; Campbell, L.C. (1981). "Influence of potassium and manganese on growth and uptake of magnesium by soybeans (Glycine max (L.) Merr. cv Bragg". Plant Soil. 61 (3): 447–456. Дои:10.1007/BF02182025. S2CID 12271923.
- ^ Hope, A. B.; Stevens, P. G. (1952). "Electrical potential differences in bean roots on their relation to salt uptake". Australian Journal of Scientific Research, Series B. 5: 335–343.
- ^ Section 8.5.2 in Marschner, 1995
- ^ Bui, D.M.; Gregan, J.; Jarosch, E.; Ragnini, A.; Schweyen, R. J. (1999). "The bacterial magnesium transporter CorA can functionally substitute for its putative homologue Mrs2p in the yeast inner mitochondrial membrane". Журнал биологической химии. 274 (29): 20438–20443. Дои:10.1074/jbc.274.29.20438. PMID 10400670.
- ^ Demmig, B.; Gimmler, H. (1979). "Effect of divalent cations on cation fluxes across the chloroplast envelope and on photosynthesis of intact chloroplasts". Zeitschrift für Naturforschung. 24C (3–4): 233–241. Дои:10.1515/znc-1979-3-413. S2CID 42750442.
- ^ Huber, S.C.; Maury, W. J. (1980). "Effects of Magnesium on Intact Chloroplasts: I. EVIDENCE FOR ACTIVATION OF (SODIUM) POTASSIUM/PROTON EXCHANGE ACROSS THE CHLOROPLAST ENVELOPE". Физиология растений. 65 (2): 350–354. Дои:10.1104/pp.65.2.350. ЧВК 440325. PMID 16661188.
- ^ Section 2.7 in Marschner, 1995
- ^ Section 3.3 in Marschner, 1995
- ^ Section 2.4 in Marschner, 1995
- ^ Scott, B. J.; Robson, A. D. (1990). "Distribution of magnesium in subterranean clover (Trifolium subterranean L.) in relation to supply". Australian Journal of Agricultural Research. 41 (3): 499–510. Дои:10.1071/AR9900499.
- ^ Scott, B. J.; Robson, A. D. (1990b). "Changes in the content and form of magnesium in the first trifoliate leaf of subterranean clover under altered or constant root supply". Australian Journal of Agricultural Research. 41 (3): 511–519. Дои:10.1071/AR9900511.
- ^ Fork, D.C. (1986). "The control by state transitions of the distribution of excitation energy in photosynthesis". Annual Review of Plant Physiology and Plant Molecular Biology. 37: 335–361. Дои:10.1146/annurev.arplant.37.1.335.
- ^ Gregory, R. P. F. (1989). Structure and function of the photosynthesising cell. Biochemistry of Photosynthesis. New York: John Wiley and Sons.
- ^ Lu YK, Chen YR, Yang CM, Ifuku K (1995). "Influence of Fe- and Mg-deficiency on the thylakoid membranes of a chlorophyll-deficient ch5 mutant of Arabidopsis thaliana". Botanical Bulletin of Academia Sinica. 36.
- ^ Deshaies, R. J.; Fish, L. E.; Jagendorf, A. T. (1984). "Permeability of Chloroplast Envelopes to Mg2+: Effects on Protein Synthesis". Физиология растений. 74 (4): 956–961. Дои:10.1104/pp.74.4.956. ЧВК 1066800. PMID 16663541.
- ^ Gupta, A. S.; Berkowitz, G. A. (1989). "Development and Use of Chlorotetracycline Fluorescence as a Measurement Assay of Chloroplast Envelope-Bound Mg2+". Физиология растений. 89 (3): 753–761. Дои:10.1104/pp.89.3.753. ЧВК 1055918. PMID 16666617.
- ^ Heldt, H.W.; Werdan, K.; Milovancev, M.; Geller, G. (1973). "Alkalization of the chloroplast stroma caused by light-dependent proton flux into the thylakoid space". Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 314 (2): 224–241. Дои:10.1016/0005-2728(73)90137-0. PMID 4747067.
- ^ Hind, G.; Nakatani, H. Y.; Izawa, S. (1974). "Light-Dependent Redistribution of Ions in Suspensions of Chloroplast Thylakoid Membranes". Труды Национальной академии наук Соединенных Штатов Америки. 71 (4): 1484–1488. Bibcode:1974PNAS...71.1484H. Дои:10.1073/pnas.71.4.1484. ЧВК 388254. PMID 4524652.
- ^ Bulychev, A. A.; Vredenberg, W. J. (1976). "Effect of ionophores A-23187 and nigericin on the light induced redistribution of magnesium potassium and hydrogen ions across the thylakoid membrane". Biochimica et Biophysica Acta. 449 (1): 48–58. Дои:10.1016/0005-2728(76)90006-2. PMID 10009.
- ^ Krause, G. H. (1977). "Light-induced movement of magnesium ions in intact chloroplasts. Spectroscopic determination with Eriochrome Blue SE". Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 460 (3): 500–510. Дои:10.1016/0005-2728(77)90088-3. PMID 880298.
- ^ Portis, A. R. (1981). "Evidence of a Low Stromal Mg2+ Concentration in Intact Chloroplasts in the Dark: I. STUDIES WITH THE IONOPHORE A23187". Физиология растений. 67 (5): 985–989. Дои:10.1104/pp.67.5.985. ЧВК 425814. PMID 16661806.
- ^ Ishijima, S.; Uchibori, A.; Takagi, H.; Maki, R.; Ohnishi, M. (2003). "Light-induced increase in free Mg2+ concentration in spinach chloroplasts: Measurement of free Mg2+ by using a fluorescent probe and intensity of stromal alkalinization". Archives of Biochemistry and Biophysics. 412 (1): 126–132. Дои:10.1016/S0003-9861(03)00038-9. PMID 12646275.
- ^ а б Sharkey, T. D. (1998). A. Raghavendra (ed.). "Photosynthetic carbon reduction". Photosynthesis: A Comprehensive Treatise. Cambridge: Cambridge University Press: 111–122.
- ^ Section 8.5.6 of Marschner, 1995
- ^ Rengel, Z.; Robinson, D. L. (1989). "Competitive Al3+ Inhibition of Net Mg2+ Uptake by Intact Lolium multiflorum Roots : I. Kinetics". Физиология растений. 91 (4): 1407–1413. Дои:10.1104/pp.91.4.1407. ЧВК 1062198. PMID 16667193.
- ^ Marschner, H. (1991). Y. Waisel; A. Eshel; U. Kafikfai (eds.). Root-induced changes in the availability of micronutrients in the rhizosphere. Plant Roots: The Hidden Half. New York: Marcel Dekker.
- ^ Dorenstouter, H.; Pieters, G.A.; Findenegg, G. R. (1985). "Distribution of magnesium between chloroplhyll and other photosynthetic functions in magnesium deficient 'sun' and 'shade' leaves of poplar". Journal of Plant Nutrition. 8 (12): 1088–1101. Дои:10.1080/01904168509363409.
- ^ Wu, W.; Peters, J.; Berkowitz, G.A. (1991). "Surface Charge-Mediated Effects of Mg2+ on K+ Flux across the Chloroplast Envelope Are Associated with Regulation of Stromal pH and Photosynthesis". Физиология растений. 97 (2): 580–587. Дои:10.1104/pp.97.2.580. ЧВК 1081046. PMID 16668438.
Рекомендации
- Romani, Andrea M.P. (2013). "Chapter 4 Magnesium Homeostasis in Mammalian Cells". In Banci, Lucia (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. 12. Springer. Дои:10.1007/978-94-007-5561-l_4 (inactive 2020-10-22). ISBN 978-94-007-5560-4.CS1 maint: DOI неактивен по состоянию на октябрь 2020 г. (связь) electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402
- Findling, R. L.; Maxwell, K; Scotese-Wojtila, L; Huang, J; Yamashita, T; Wiznitzer, M (1997). "High-dose pyridoxine and magnesium administration in children with autistic disorder: an absence of salutary effects in a double-blind, placebo-controlled study". J Autism Dev Disord. 27 (4): 467–478. Дои:10.1023/A:1025861522935. PMID 9261669. S2CID 39143708.
- Green, V.; Pituch, K.; Itchon, J.; Choi, A.; O'Reilly, M.; Sigafoos, J. (2006). "Internet Survey of Treatments Used by Parents of Children with Autism". Research in Developmental Disabilities. 27 (1): 70–84. Дои:10.1016/j.ridd.2004.12.002. PMID 15919178.
- Lelord, G.; Muh, JP; Barthelemy, C; Martineau, J; Garreau, B; Callaway, E (1981). "Effects of pyridoxine and magnesium on autistic symptoms--initial observations". J Autism Dev Disord. 11 (2): 219–230. Дои:10.1007/BF01531686. PMID 6765503. S2CID 7898722.
- Martineau, J.; и другие. (1985). "Vitamin B6, magnesium, and combined B6-Mg: therapeutic effects in childhood autism." Biol". Psychiatry. 20 (5): 467–478. Дои:10.1016/0006-3223(85)90019-8. PMID 3886023. S2CID 631153.
- Tolbert, L.; Haigler, T; Waits, MM; Dennis, T (1993). "Brief report: lack of response in an autistic population to a low dose clinical trial of pyridoxine plus magnesium". J Autism Dev Disord. 23 (1): 193–199. Дои:10.1007/BF01066428. PMID 8463199. S2CID 21450498.
- Mousain-Bosc M, Roche M, Polge A, Pradal-Prat D, Rapin J, Bali JP (Mar 2006). "Improvement of neurobehavioral disorders in children supplemented with magnesium-vitamin B6. I. Attention deficit hyperactivity disorders". Magnes. Res. 19 (1): 46–52. PMID 16846100.
- Mousain-Bosc M, Roche M, Polge A, Pradal-Prat D, Rapin J, Bali JP (Mar 2006). "Improvement of neurobehavioral disorders in children supplemented with magnesium-vitamin B6. II. Pervasive developmental disorder-autism". Magnes. Res. 19 (1): 53–62. PMID 16846101.
внешняя ссылка
Эта статья использование внешняя ссылка может не следовать политикам или рекомендациям Википедии. (Январь 2018) (Узнайте, как и когда удалить этот шаблон сообщения) |
- Magnesium Deficiency
- List of foods rich in Magnesium
- The Magnesium Website - Includes full text papers and textbook chapters by leading magnesium authorities Mildred Seelig, Jean Durlach, Burton M. Altura and Bella T. Altura. Links to over 300 articles discussing magnesium and magnesium deficiency.
- Dietary Reference Intake
- Healing Thresholds - description of research studies regarding supplementation with magnesium and other therapies for autism
