Рецептор NMDA - NMDA receptor

В N-метил-D-аспартат рецептор (также известный как Рецептор NMDA или NMDAR), это рецептор глутамата и ионный канал белок нашел в нервные клетки. Рецептор NMDA - один из трех типов ионотропные рецепторы глутамата. Остальные рецепторы - это AMPA и каинатные рецепторы. Активируется, когда глутамат и глицин (или D-серин ) привязывается к нему, а при активации позволяет положительно заряженные ионы течь через клеточная мембрана.[2] Рецептор NMDA очень важен для контроля синаптическая пластичность и объем памяти функция.[3]
NMDAR - это особый тип ионотропный рецептор глутамата.[4] Рецептор NMDA назван так потому, что агонист молекула N-метил-D-аспартат (NMDA) избирательно связывается с ним, а не с другими рецепторами глутамата. Активация рецепторов NMDA приводит к открытию ионный канал это неселективно для катионы, с комбинированным обратный потенциал около 0 мВ. В то время как открытие и закрытие ионного канала в основном регулируется лиганд связывания, ток, протекающий через ионный канал, зависит от напряжения. Внеклеточный магний (Mg2+) и цинк (Zn2+) ионы могут связываться с определенными участками рецептора, блокируя прохождение других катионов через открытый ионный канал. Деполяризация клетки смещает и отталкивает Mg2+ и Zn2+ ионы из поры, тем самым обеспечивая зависящий от напряжения поток натрия (Na+) и небольшое количество кальция (Ca2+) ионов в клетку и калия (K+) из клетки.[5][6][7][8]
Ca2+ поток через NMDAR считается критическим в синаптическая пластичность, клеточный механизм для обучение и объем памяти. Открытие и закрытие (стробирование) рецептора NMDA сложны. Хотя это в первую очередь канал, управляемый лигандом, он действительно демонстрирует более слабую модуляцию зависимого от напряжения лиганд-зависимого переключения. Для стробирования лиганда требуется совместная активация двумя лигандами: глутамат и либо D-серин или глицин.[9] Зависимость тока через канал от напряжения в основном связана с связыванием Mg2+ или Zn2+ ионы к белку, как описано выше.
На активность рецептора NMDA влияют многие психоактивный наркотики, такие как фенциклидин (PCP), алкоголь (этиловый спирт ) и декстрометорфан (ДХМ). В анестетик и обезболивающее эффекты лекарств кетамин и оксид азота частично из-за их влияния на активность рецептора NMDA. С 1989 г. мемантин был признан неконкурентоспособный антагонист из N-метил-Dрецептор аспартата (рецептор NMDA), попадающий в канал рецептора после его активации и тем самым блокируя поток ионов.[10][11][12]
Каналы рецепторов NMDA играют важную роль в синаптическая пластичность и формирование синапсов, лежащих в основе памяти, обучение и формирование нейронных сетей во время развития в Центральная нервная система (ЦНС). Гиперактивация рецептора, вызывающая чрезмерный приток Са2+ может привести к эксайтотоксичность который, как предполагается, участвует в некоторых нейродегенеративных расстройствах. Следовательно, блокирование рецепторов NMDA могло бы теоретически быть полезным при лечении таких заболеваний.[12][13][14][15]
Однако гипофункция рецепторов NMDA (из-за глутатион дефицит или другие причины) могут быть вовлечены в нарушение синаптической пластичности[16] и может иметь другие негативные последствия. Основная проблема с утилизацией Антагонисты рецепторов NMDA для нейрозащита заключается в том, что физиологические действия рецептора NMDA необходимы для нормальной функции нейронов. Чтобы получить клиническое признание, успешное клиническое применение антагонистов NMDA должно блокировать чрезмерную активацию без нарушения нормальных функций.[17]
История
За открытием рецепторов NMDA последовали синтез и изучение N-метил-D-аспарагиновая кислота (NMDA) в 1960-х годах Джеффом Уоткинсом и его коллегами. В начале 1980-х было показано, что рецепторы NMDA участвуют в нескольких центральных синаптических путях.[18][19] Селективность субъединицы рецептора была открыта в начале 1990-х годов, что привело к открытию нового класса соединений, которые избирательно ингибируют NR2B субъединица. Эти результаты привели к активной кампании в фармацевтической промышленности.[20] Исходя из этого, считалось, что рецепторы NMDA связаны с множеством неврологические расстройства такие как эпилепсия, Болезнь Паркинсона, Болезнь Альцгеймера, Хантингтона и другие расстройства ЦНС.[5]
В 2002 году он был обнаружен Хильмар Бадинг и соавт., что клеточные последствия стимуляции рецептора NMDA зависят от расположения рецептора на поверхности нейрональной клетки.[21][22] Синаптические рецепторы NMDA способствуют экспрессии генов, событиям, связанным с пластичностью, и приобретенным нейрозащита. Внесинаптические рецепторы NMDA способствуют передаче сигналов смерти; они вызывают отключение транскрипции, дисфункцию митохондрий и структурную дезинтеграцию.[21][22] Эта патологическая триада внесинаптической передачи сигналов рецептора NMDA представляет собой общую точку конверсии в этиологии нескольких острых и хронических нейродегенеративных состояний.[23] Молекулярная основа передачи сигналов токсичных внесинаптических рецепторов NMDA была открыта Хилмаром Бадингом и его сотрудниками в 2020 году.[24] Внесинаптические рецепторы NMDA образуют сигнальный комплекс смерти с TRPM4. Ингибиторы интерфейса взаимодействия NMDAR / TRPM4 (также известные как «ингибиторы интерфейса») разрушают комплекс NMDAR / TRPM4 и выводят токсины на внесинаптические рецепторы NMDA.[24]
Случайная находка была сделана в 1968 году, когда женщина принимала амантадин как лекарство от гриппа, и у нее наступила замечательная ремиссия симптомов Паркинсона. Это открытие, о котором сообщает Scawab et al., Было началом медицинская химия производных адамантана при заболеваниях ЦНС.[25] До этого открытия мемантин, еще одно производное адамантана, был синтезирован компанией Eli Lilly and Company в 1963 году. Цель заключалась в разработке гипогликемический препарат, но он не показал такого эффективность. Только в 1972 году было обнаружено возможное терапевтическое значение мемантина для лечения нейродегенеративных расстройств. С 1989 г. было признано, что мемантин является неконкурентным антагонистом рецептора NMDA.[11]
Структура
Функциональные рецепторы NMDA представляют собой гетеротетрамеры, состоящие из двух субъединиц GluN1 и обычно двух субъединиц GluN2.[26] Существует один гены, кодирующие субъединицу GluN1, четыре GluN2 и два GluN3, и каждый ген может продуцировать более одного варианта сплайсинга.
- GluN1 - GRIN1
- GluN2
- GluN3
Ворота

Рецептор NMDA представляет собой глутамат и ионный канал рецептор белка, который активируется при глицин и глутамат связываются с ним.[2] Рецептор представляет собой гетеромерный комплекс, который взаимодействует с множеством внутриклеточных белков с помощью трех различных субъединиц: GluN1, GluN2 и GluN3. GluN1 имеет восемь различных изоформ из-за альтернативного сплайсинга гена GRIN1. Существует четыре разных субъединицы GluN2 (A-D) и две разные субъединицы Glun3 (A и B). Шесть отдельных генов кодируют GluN2 и GluN3.[27][28] Все субъединицы имеют общую мембранную топологию, в которой преобладает большой внеклеточный N-конец, мембранная область, состоящая из трех трансмембранных сегментов, петля входящей поры, внеклеточная петля между трансмембранными сегментами, которые структурно малоизвестны, и внутриклеточный C-конец, который различается по размеру в зависимости от субъединицы и обеспечивает множественные сайты взаимодействия со многими внутриклеточными белками.[27][29] На рисунке 1 показана базовая структура субъединиц GluN1 / GluN2, которая формирует сайт привязки для мемантина, мг2+ и кетамин.

Mg2+ блокирует канал рецептора NMDA в зависимости от напряжения. Каналы также очень проницаемы для Ca2+. Активация рецептора зависит от связывания глутамата, D-серин или связывание глицина в его GluN1-связанном сайте связывания иРецептор AMPA -опосредованный деполяризация постсинаптической мембраны, которая снимает блокировку зависимого от напряжения канала Mg2+. Таким образом, активация и открытие рецепторного канала позволяет потоку K+, Na+ и Ca2+ ионов, а приток Са2+ запускает внутриклеточные сигнальные пути.[10][30] Сайты связывания аллостерических рецепторов для цинка, белков и полиаминов, спермидина и спермина также являются модуляторами каналов рецептора NMDA.[31]
Субъединица GluN2B участвует в модуляции такой активности, как обучение, память, обработка информации и пищевое поведение, а также участвует в ряде расстройств человека. Основная структура и функции, связанные с рецептором NMDA, могут быть отнесены к субъединице GluN2B. Например, сайт связывания глутамата и контроль Mg2+ block образованы субъединицей GluN2B. Сайты с высоким сродством к глицину антагонист также исключительно выводятся рецептором GluN1 / GluN2B.[28]
Считается, что трансмембранные сегменты GluN1 / GluN2B являются частью рецептора, которая формирует карманы связывания для неконкурентоспособных антагонистов рецептора NMDA, но структуры трансмембранных сегментов полностью не известны, как указано выше. Утверждается, что три сайта связывания внутри рецептора, A644 на субъединице GluNB и A645 и N616 на субъединице GluN1, важны для связывания мемантина и родственных соединений, как показано на рисунке 2.[29]
Рецептор NMDA образует гетеротетрамер между двумя субъединицами GluN1 и двумя субъединицами GluN2 (субъединицы ранее обозначались как GluN1 и GluN2), двумя обязательными субъединицами GluN1 и двумя регионально локализованными субъединицами GluN2. Связанный ген Семейство субъединиц GluN3 A и B оказывает ингибирующее действие на активность рецепторов. Множественный рецептор изоформы с четким распределением в головном мозге и функциональными свойствами, возникают в результате избирательного сплайсинга транскриптов GluN1 и дифференциальной экспрессии субъединиц GluN2.
Каждая рецепторная субъединица имеет модульную конструкцию, и каждый структурный модуль также представляет собой функциональную единицу:
- В внеклеточный домен содержит две глобулярные структуры: модуляторный домен и лиганд -связывающий домен. Субъединицы GluN1 связываются с коагонистом глицином, а субъединицы GluN2 связываются с глутаматом нейромедиатора.
- В модуль связывания агонистов связывается с мембранным доменом, который состоит из трех трансмембранных сегментов и возвратной петли, напоминающей фильтр селективности калиевые каналы.
- В мембранный домен вносит остатки в поры канала и отвечает за высокую унитарность рецептора. проводимость, кальциевая проницаемость и потенциал-зависимый блок магния.
- Каждое подразделение имеет обширную цитоплазматический домен, которые содержат остатки, которые можно непосредственно модифицировать серией протеинкиназы и протеинфосфатазы, а также остатки, которые взаимодействуют с большим количеством структурных, адапторных и каркасных белков.
Глицин-связывающие модули субъединиц GluN1 и GluN3 и глутамат-связывающий модуль субъединицы GluN2A были выражены как растворимые белки, и их трехмерная структура была решена с атомарным разрешением с помощью рентгеновская кристаллография. Это выявило общую укладку со связывающими аминокислоты бактериальными белками и с глутамат-связывающим модулем AMPA-рецепторов и каинатных рецепторов.
Механизм действия
Гиперактивация рецепторов NMDA, вызывающая чрезмерный приток Са2+ может привести к эксайтотоксичности. Предполагается, что эксайтотоксичность связана с некоторыми нейродегенеративными расстройствами, такими как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона.[12][13][14][15] Следовательно, блокирование рецепторов NMDA могло бы теоретически быть полезным при лечении таких заболеваний.[12][13][14] Однако важно сохранить физиологическую активность рецептора NMDA, пытаясь блокировать его чрезмерную эксайтотоксическую активность. Это может быть достигнуто с помощью неконкурентоспособных антагонистов, блокирующих ионный канал рецепторов при чрезмерном открытии.[14]
Неконкурентные антагонисты рецептора NMDA или блокаторы каналов проникают в канал рецептора NMDA после его активации и тем самым блокируют поток ионов.[10][12] МК-801, кетамин, амантадин и мемантин примеры таких антагонистов,[10] см. рисунок 1. Скорость отклонения антагониста от рецепторного канала является важным фактором, так как слишком медленное отклонение может нарушить нормальную функцию рецептора, а слишком быстрое отклонение может привести к неэффективной блокаде чрезмерно открытого рецептора.[14]
Мемантин является примером неконкурентного блокатора каналов рецептора NMDA с относительно быстрым выходом из строя и низким сродством. При физиологическом pH его аминогруппа заряжена положительно, и его антагонизм к рецепторам зависит от напряжения.[14] Таким образом, он имитирует физиологическую функцию Mg.2+ как блокировщик каналов.[11] Мемантин блокирует каналы, связанные с рецептором NMDA, только во время длительной активации рецептора, как это происходит в эксайтотоксических условиях, путем замены магния в сайте связывания. Во время нормальной активности рецепторов каналы остаются открытыми только в течение нескольких миллисекунд, и в этих условиях мемантин не может связываться внутри каналов и, следовательно, не мешает нормальной синаптической активности.[17]
Варианты
GluN1
Есть восемь вариантов GluN1 субъединица, полученная альтернативным сплайсингом GRIN1:[32]
- GluN1-1a, GluN1-1b; GluN1-1a - наиболее выраженная форма.
- GluN1-2a, GluN1-2b;
- GluN1-3a, GluN1-3b;
- GluN1-4a, GluN1-4b;
GluN2

В то время как одна субъединица GluN2 обнаружена в организмах беспозвоночных, четыре различные изоформы субъединицы GluN2 экспрессируются у позвоночных и обозначаются номенклатурой GluN2A через GluN2D (кодируемой GRIN2A, GRIN2B, GRIN2C, GRIN2D ). Убедительные доказательства показывают, что гены, кодирующие субъединицы GluN2 у позвоночных, прошли по крайней мере два раунда дупликации генов.[33] Они содержат сайт привязки для нейротрансмиттер глутамат. Что еще более важно, каждая субъединица GluN2 имеет отдельный внутриклеточный C-концевой домен, который может взаимодействовать с разными наборами сигнальных молекул.[34] В отличие от субъединиц GluN1, субъединицы GluN2 по-разному экспрессируются в разных типах клеток и временных точках развития и контролируют электрофизиологические свойства рецептора NMDA. GluN2B в основном присутствует в незрелых нейронах и во внесинаптических местах и содержит сайт связывания селективного ингибитора. ифенпродил.
Переключатель GluN2B на GluN2A

В то время как GluN2B преобладает в раннем постнатальном мозге, количество субъединиц GluN2A увеличивается на раннем этапе развития; в конце концов, GluN2A субъединиц становится больше, чем у GluN2B. Это называется переключением развития GluN2B-GluN2A и примечательно из-за различной кинетики, которую каждая субъединица GluN2 вносит в рецепторную функцию.[36] Например, более высокие соотношения субъединицы GluN2B приводят к рецепторам NMDA, которые остаются открытыми дольше по сравнению с рецепторами с большим количеством GluN2A.[37] Частично это может объяснить более высокие способности памяти в послеродовой период по сравнению с поздним периодом жизни, что лежит в основе генетически измененных ''мыши doogie Подробный временной ход этого переключения в мозжечке человека был оценен с использованием микроматрицы экспрессии и последовательности РНК и показан на рисунке справа.
Существует три гипотетических модели для описания этого механизма переключения:
- Увеличение синаптического GluN2A вместе с уменьшением GluN2B
- Экстрасинаптическое смещение GluN2B от синапса с увеличением GluN2A
- Увеличение GluN2A при разбавлении количества GluN2B без уменьшения последнего.
Субъединицы GluN2B и GluN2A также играют разные роли в посредничестве эксайтотоксический гибель нейронов.[38] Считается, что онтогенетический переключатель в составе субъединиц объясняет онтогенетические изменения нейротоксичности NMDA.[39] Гомозиготное нарушение гена GluN2B у мышей вызывает перинатальный летальность, тогда как нарушение гена GluN2A дает жизнеспособных мышей, хотя и с нарушенной пластичностью гиппокампа.[40] Одно исследование предполагает, что катушка может играть роль в созревании рецептора NMDA, увеличивая GluN2B субъединичная подвижность.[41]
Переключатель GluN2B на GluN2C
Предшественники гранулярных клеток (GCP) мозжечка после симметричного деления клеток[42] во внешнем слое гранулярных клеток (EGL) мигрируют во внутренний слой гранулярных клеток (IGL), где они подавляют GluN2B и активируют GluN2C, процесс, который не зависит от передачи сигналов нейрегулина бета через рецепторы ErbB2 и ErbB4.[43]
Роль в эксайтотоксичности
Ряд исследований показал, что рецепторы NMDA тесно связаны с эксайтотоксичность.[44][45][46] Поскольку рецепторы NMDA играют важную роль в здоровье и функционировании нейроны, было много дискуссий о том, как эти рецепторы могут влиять на выживаемость и гибель клеток.[47] Недавние данные подтверждают гипотезу о том, что чрезмерная стимуляция внесинаптические рецепторы NMDA больше связано с эксайтотоксичностью, чем со стимуляцией их синаптический аналоги.[44][48] Кроме того, при стимуляции внесинаптические рецепторы NMDA по-видимому, способствуют гибели клеток, есть данные, позволяющие предположить, что стимуляция синаптических рецепторов NMDA способствует здоровью и долголетию клетки. Существует достаточно доказательств, подтверждающих двойную природу рецепторов NMDA, основанную на локализации, и гипотеза, объясняющая два различных механизма, известна как «гипотеза локализации».[44][47]
Различные каскадные пути
Чтобы поддержать гипотезу локализации, необходимо было бы показать разные клеточные сигнальные пути активируются рецепторами NMDA в зависимости от его расположения в клеточной мембране.[44] Эксперименты были разработаны для стимуляции исключительно синаптических или несинаптических рецепторов NMDA. Эти типы экспериментов показали, что разные пути активируются или регулируются в зависимости от местоположения источника сигнала.[49] Многие из этих путей используют одни и те же белковые сигналы, но регулируются NMDAR противоположным образом в зависимости от его местоположения. Например, синаптическое возбуждение NMDA вызывает снижение внутриклеточной концентрации митоген-активируемой протеинкиназы p38 (p38MAPK ). Внесинаптическая стимуляция. NMDAR регулируют p38MAPK противоположным образом, вызывая повышение внутриклеточной концентрации.[50][51] С тех пор эксперименты этого типа были повторены, и результаты показали, что эти различия охватывают многие пути, связанные с выживанием клеток и эксайтотоксичностью.[44]
Два специфических белка были идентифицированы как основной путь, ответственный за эти разные клеточные ответы. ERK1 / 2, и Иаков.[44] ERK1 / 2 отвечает за фосфорилирование Якоба при возбуждении синаптическими NMDAR. Эта информация затем транспортируется в ядро. Фосфорилирование Якоба не происходит при внесинаптической стимуляции NMDA. Это позволяет факторы транскрипции в ядре реагировать по-разному в зависимости от состояния фосфорилирования Джейкоба.[52]
Нервная пластичность
Рецепторы NMDA также связаны с синаптической пластичностью. Идея, что и синаптические, и внесинаптические рецепторы NMDA может повлиять на долгосрочное потенцирование (LTP) и длительная депрессия (LTD) также были исследованы по-разному.[44][53] Экспериментальные данные свидетельствуют о том, что внесинаптические рецепторы NMDA ингибировать LTP при производстве LTD.[54] Ингибирование LTP можно предотвратить с помощью введения Антагонист NMDA.[44] А стимуляция тета-взрывом который обычно индуцирует LTP с синаптическими NMDAR, при селективном применении к внесинаптическим NMDAR производит LTD.[55] Эксперименты также показывают, что внесинаптическая активность не требуется для образования LTP. Кроме того, в экспрессии полной LTD участвуют как синаптические, так и внесинаптические.[56]
Роль различных субъединиц
Другой фактор, который, по-видимому, влияет на токсичность, вызванную NMDAR, - это наблюдаемые вариации в подразделение составить. Рецепторы NMDA представляют собой гетеротетрамеры с двумя субъединицами GluN1 и двумя вариабельными субъединицами.[44][57] Было показано, что две из этих вариабельных субъединиц, GluN2A и GluN2B, предпочтительно приводят к каскадам выживания и гибели клеток соответственно. Хотя обе субъединицы обнаруживаются в синаптических и внесинаптических NMDAR, есть некоторые свидетельства того, что субъединица GluN2B чаще встречается во внесинаптических рецепторах. Это наблюдение может помочь объяснить двойственную роль, которую рецепторы NMDA играют в эксайтотоксичности.[58][59]
Несмотря на убедительные доказательства и относительную простоту этих двух теорий, работающих в тандеме, до сих пор существуют разногласия по поводу значения этих утверждений. Некоторые проблемы при доказательстве этих теорий возникают из-за сложности использования фармакологических средств для определения подтипов конкретных NMDAR.[44][60] Кроме того, теория субъединичной вариации не объясняет, как этот эффект может преобладать, поскольку широко распространено мнение, что наиболее распространенный тетрамер, состоящий из двух субъединиц GluN1 и по одной каждой субъединице GluN2A и GluN2B, составляет высокий процент NMDAR. .[44]
Эксайтотоксичность в клинических условиях
Считается, что эксайтотоксичность играет роль в дегенеративных свойствах нейродегенеративный условия с конца 1950-х гг.[61] Рецепторы NMDA, по-видимому, играют важную роль во многих из этих дегенеративных заболеваний, поражающих мозг. В частности, эксайтотоксические явления с участием рецепторов NMDA были связаны с болезнью Альцгеймера и Хантингтона, а также с другими заболеваниями, такими как инсульты и эпилепсия.[44][62] Однако лечение этих состояний одним из многих известных антагонистов рецепторов NMDA приводит к множеству нежелательных побочных эффектов, некоторые из которых могут быть серьезными. Эти побочные эффекты отчасти наблюдаются потому, что рецепторы NMDA не только сигнализируют о гибели клетки, но также играют важную роль в ее жизнеспособности.[47] Лечение этих состояний можно найти в блокировании рецепторов NMDA, которых нет в синапсе.[44][63] Один класс эксайтотоксичности при заболевании включает мутации увеличения функции в GRIN2B и GRIN1, связанные с корковыми пороками, такими как полимикрогирия.[64]
Лиганды
Агонисты


Активация рецепторов NMDA требует связывания глутамат или аспартат (аспартат не так сильно стимулирует рецепторы).[65] Кроме того, NMDAR также требуют привязки коагонист глицин для эффективного открытия ионного канала, который является частью этого рецептора.
D-Серин также было обнаружено, что он коагонизирует рецептор NMDA с даже большей эффективностью, чем глицин.[66] Производится серин рацемаза, и обогащен теми же областями, что и рецепторы NMDA. Удаление D-серин может блокировать NMDA-опосредованную нервную передачу возбуждения во многих областях. Недавно было показано, что D-серин может высвобождаться как нейронами, так и астроцитами для регулирования рецепторов NMDA.
Токи, опосредованные рецептором NMDA (NMDAR), напрямую связаны с деполяризацией мембраны. Следовательно, агонисты NMDA быстро Mg2+ кинетика развязывания, увеличение вероятности открытия канала с деполяризацией. Это свойство является фундаментальным для роли рецептора NMDA в объем памяти и обучение, и было высказано предположение, что этот канал является биохимическим субстратом Hebbian обучение, где он может действовать как детектор совпадений для деполяризации мембраны и синаптической передачи.
Примеры
Некоторые известные агонисты рецепторов NMDA включают:
- Аланин (D-аланин, L-аланин ) - эндогенный агонист сайта глицина
- Аспарагиновая кислота (аспартат) - агонист эндогенного глутамата
- Глютаминовая кислота (глутамат) - эндогенный агонист глутаматного сайта
- Глицин - агонист эндогенного сайта глицина
- Гомоцистеиновая кислота - агонист эндогенного глутаматного сайта
- Иботеновая кислота - природный агонист глутаматного сайта, обнаруженный в Мухомор мухомор
- Миласемид - синтетический агонист сайтов глицина; пролекарство глицин
- Хинолиновая кислота (хинолинат) - агонист эндогенного глутамата
- Саркозин - агонист эндогенного сайта глицина
- Серин (D-серин, L-серин ) - эндогенный агонист сайта глицина
- Спермидин - агонист эндогенного полиаминового сайта
- Спермин - агонист эндогенного полиаминового сайта
- Тетразолилглицин - синтетический агонист глутаматного сайта
Положительные аллостерические модуляторы включают:
- Церебростерин - эндогенный слабоположительный аллостерический модулятор
- Холестерин - эндогенный слабоположительный аллостерический модулятор
- Дегидроэпиандростерон (DHEA) - эндогенный слабоположительный аллостерический модулятор
- Дегидроэпиандростерона сульфат (DHEA-S) - эндогенный слабоположительный аллостерический модулятор
- Небостинель (небогламин) - синтетический положительный аллостерический модулятор сайта глицина
- Прегненолона сульфат - эндогенный слабоположительный аллостерический модулятор
Нерамексан

Примером производного мемантина является нерамексан что было обнаружено при изучении количества аминоалкила циклогексаны с мемантином в качестве матрицы в качестве антагонистов рецепторов NMDA. Нерамексан, который можно увидеть на фиг. 6, связывается с тем же сайтом, что и мемантин, в канале, связанном с рецептором NMDA, и с сопоставимой аффинностью. Он также показывает очень похожую биодоступность и кинетику блокирования. in vivo как мемантин. Нерамексан отправился клинические испытания по четырем показаниям, включая болезнь Альцгеймера.[25]
Частичные агонисты

N-Метил-D-аспарагиновая кислота (NMDA), в честь которого был назван рецептор NMDA, является частичным агонистом активного сайта или сайта узнавания глутамата.
3,5-дибром-L-фенилаланин, встречающееся в природе галогенированное производное L-фенилаланин, является слабым частичным агонистом рецептора NMDA, действующим на сайт глицина.[67] 3,5-дибром-L-фенилаланин был предложен в качестве нового терапевтического лекарственного средства для лечения психоневрологических расстройств и заболеваний, таких как шизофрения,[68] и неврологические расстройства, такие как ишемический приступ и Эпилептические припадки.[69]
Другие слабые частичные агонисты глицинового сайта рецептора NMDA, такие как рапастинель (GLYX-13) и апимостинель (NRX-1074) в настоящее время рассматриваются для разработки новых препаратов с антидепрессивным и обезболивающим действием без очевидной психотомиметической активности.[70]
Примеры
- Аминоциклопропанкарбоновая кислота (АСС) - частичный агонист синтетического сайта глицина
- Циклосерин (D-циклосерин ) - встречающийся в природе частичный агонист сайта глицина, обнаруженный в Streptomyces orchidaceus
- HA-966 - слабый частичный агонист синтетического сайта глицина
- Гомохинолиновая кислота - частичный агонист синтетического глутаматного сайта
- N-Метил-D-аспарагиновая кислота (NMDA) - частичный агонист синтетического глутаматного сайта
Положительные аллостерические модуляторы включают:
- Апимостинель (NRX-1074) - синтетический слабый частичный агонист аллостерического сайта глицинового сайта
- Рапастинель (GLYX-13) - синтетический слабый частичный агонист аллостерического сайта глицинового сайта
Антагонисты

Антагонисты рецептора NMDA используются в качестве анестетики для животных, а иногда и людей, и часто используются как рекреационные наркотики из-за их галлюциногенный свойства, в дополнение к их уникальным эффектам в повышенных дозировках, таких как диссоциация. Когда определенные антагонисты рецепторов NMDA вводятся грызунам в больших дозах, они могут вызвать форму повреждение мозга называется Поражения Олни. Антагонисты рецепторов NMDA, которые, как было показано, вызывают поражения Олни, включают: кетамин, фенциклидин, и декстрорфан (метаболит декстрометорфан ), а также некоторые антагонисты рецепторов NMDA, используемые только в исследовательской среде. До сих пор опубликованные исследования поражений Олни неубедительны в отношении их возникновения в тканях мозга человека или обезьяны в отношении увеличения присутствия антагонистов рецепторов NMDA.[71]
Большинство антагонистов NMDAR являются неконкурентоспособен или неконкурентные блокаторы канала поры или являются антагонистами ко-регуляторного сайта глицина, а не антагонистами активного / глутаматного сайта.
Примеры
Общие агенты, в которых антагонизм к рецепторам NMDA является основным или основным механизмом действия:
- 4-хлорокинуренин (AV-101) - антагонист глицинового сайта; пролекарство 7-хлоркинуреновая кислота[72][73]
- 7-хлорокинуреновая кислота - антагонист сайта глицина
- Агматин - антагонист эндогенного полиаминового сайта[74][75]
- Аргиотоксин-636 - встречающийся в природе дизоцилпин или антагонист родственного сайта, обнаруженный в Аргиопа яд
- AP5 - антагонист глутаматного сайта
- AP7 - антагонист глутаматного сайта
- CGP-37849 - антагонист глутаматного сайта
- Делукемин (NPS-1506) - дизоцилпин или антагонист родственного сайта; полученный из аргиотоксин-636[76][77]
- Декстрометорфан (ДХМ) - антагонист сайта дизоцилпина; пролекарство декстрорфан
- Декстрорфан (DXO) - антагонист сайта дизоцилпина
- Дексанабинол - антагонист сайтов, связанных с дизоцилпином[78][79][80]
- Диэтиловый эфир - неизвестный антагонист сайта
- Дифенидин - антагонист сайта дизоцилпина
- Дизоцилпин (MK-801) - антагонист сайта дизоцилпина
- Элипродил - антагонист сайта ифенпродила
- Эскетамин - антагонист сайта дизоцилпина
- Ходжкинсин - неопределенный антагонист сайта
- Ифенпродил - антагонист сайта ифенпродила[81]
- Кайтоцефалин - встречающийся в природе антагонист глутаматного сайта, обнаруженный в Eupenicillium shearii
- Кетамин - антагонист сайта дизоцилпина
- Кинуреновая кислота - антагонист эндогенного сайта глицина
- Ланисемин - антагонист сайтов дизоцилпина с низким улавливанием
- LY-235959 - антагонист глутаматного сайта
- Мемантин - антагонист сайтов дизоцилпина с низким улавливанием
- Метоксетамин - антагонист сайта дизоцилпина
- Midafotel - антагонист глутаматного сайта
- Оксид азота (N2O) - неопределенный антагонист сайта
- PEAQX - антагонист глутаматного сайта
- Перзинфотель - антагонист глутаматного сайта
- Фенциклидин (PCP) - антагонист сайта дизоцилпина
- Фенилаланин - встречающаяся в природе аминокислота, антагонист сайта глицина[82][83]
- Психотридин - неопределенный антагонист сайта
- Сельфотель - антагонист глутаматного сайта
- Тилетамин - антагонист сайта дизоцилпина
- Траксопродил - антагонист сайта ифенпродила
- Ксенон - неизвестный антагонист сайта
Некоторые распространенные агенты, у которых слабый антагонизм к рецепторам NMDA является вторичным или дополнительным действием, включают:
- Амантадин - ан противовирусное средство и противопаркинсонический препарат, средство, медикамент; антагонист сайтов дизоцилпина с низким захватом[84]
- Атомоксетин - а ингибитор обратного захвата норэпинефрина используется для лечения СДВГ[85]
- Декстропропоксифен - ан опиоидный анальгетик
- Этиловый спирт (алкоголь ) - а эйфорический, успокаивающее, и анксиолитик используется в рекреационных целях; неизвестный антагонист сайта
- Гвайфенезин - ан отхаркивающее средство
- Гуперзин А - встречающийся в природе ингибитор ацетилхолинэстеразы и потенциал антидеменция агент
- Ибогаин - встречающийся в природе галлюциноген и антиаддиктивный агент
- Кетобемидон - опиоидный анальгетик
- Метадон - опиоидный анальгетик
- Миноциклин - ан антибиотик[86]
- Трамадол - атипичный опиоидный анальгетик и агент, высвобождающий серотонин
Нитромемантин
Рецептор NMDA регулируется через нитрозилирование и аминоадамантан можно использовать в качестве нацеленного на цель челнока, чтобы доставить оксид азота (NO) близко к участку внутри рецептора NMDA, где он может нитрозилировать и регулировать проводимость ионного канала.[25] Донором NO, который можно использовать для снижения активности рецептора NMDA, является алкилнитрат нитроглицерин. В отличие от многих других доноров NO, алкилнитраты не имеют потенциально связанных с NO нейротоксичный эффекты. Алкилнитраты отдают NO в форме нитрогруппы, как показано на рисунке 7, -NO.2-, который является безопасным донором, избегающим нейротоксичности. Нитрогруппа должна быть нацелена на рецептор NMDA, в противном случае другие эффекты NO, такие как расширение кровеносных сосудов и последующее гипотония может привести.[87]Нитромемантин является производным мемантина второго поколения, он снижает эксайтотоксичность, опосредованную гиперактивацией глутаматергической системы, блокируя рецептор NMDA без ущерба для безопасности. Предварительные исследования на животных моделях показывают, что нитромемантины более эффективны, чем мемантин, в качестве нейропротекторов, как in vitro и in vivo. Мемантин и его новые производные могут стать очень важным оружием в борьбе с повреждением нейронов.[14]

Отрицательные аллостерические модуляторы включают:
- 25-гидроксихолестерин - эндогенный слабонегативный аллостерический модулятор
- Конантокинс - встречающиеся в природе отрицательные аллостерические модуляторы полиаминового сайта, обнаруженные в Conus geographus[88]
Модуляторы
Примеры
Рецептор NMDA модулируется рядом эндогенный и экзогенный соединения:[89]
- Аминогликозиды было показано, что они обладают эффектом, аналогичным полиаминам, и этим можно объяснить их нейротоксический эффект.
- CDK5 регулирует количество NR2B -содержащие рецепторы NMDA на синаптической мембране, тем самым влияя на синаптическая пластичность.[90][91]
- Полиамины не активируют рецепторы NMDA напрямую, а вместо этого действуют, усиливая или подавляя опосредованные глутаматом ответы.
- Reelin модулирует функцию NMDA через Киназы семейства SRC и DAB1.[92] значительно увеличивая LTP в гиппокамп.
- Src киназа усиливает токи рецепторов NMDA.[93]
- Na+, K+ и Ca2+ не только проходят через канал рецептора NMDA, но и модулируют активность рецепторов NMDA.[нужна цитата ]
- Zn2+ и Cu2+ обычно блокируют текущую активность NMDA неконкурентоспособным и независимым от напряжения способом. Однако цинк может усиливать или подавлять ток в зависимости от нервной активности.[94]
- Pb2+[95] является сильным антагонистом NMDAR. Пресинаптический дефицит, вызванный Pb2+ Воздействие во время синаптогенеза опосредуется нарушением NMDAR-зависимой передачи сигналов BDNF.
- Белки главный комплекс гистосовместимости класс I - эндогенные негативные регуляторы NMDAR-опосредованных токов в гиппокампе взрослых,[96] и требуются для соответствующих вызванных NMDAR изменений в AMPAR торговля людьми [96] и NMDAR-зависимые синаптическая пластичность и обучение и объем памяти.[97][98]
- Активность рецепторов NMDA также чрезвычайно чувствительна к изменениям pH, и частично ингибируется окружающей концентрацией H+ в физиологических условиях.[99] Уровень торможения H+ значительно снижается в рецепторах, содержащих подтип NR1a, который содержит положительно заряженную вставку Exon 5. Эффект этой вставки может имитироваться положительно заряженными полиаминами и аминогликозидами, что объясняет их способ действия.
- Функция рецептора NMDA также строго регулируется химическим восстановлением и окислением через так называемый «окислительно-восстановительный модуль».[100] Через этот сайт восстановители резко увеличивают активность канала NMDA, тогда как окислители либо обращают действие восстановителей, либо подавляют нативные ответы. Обычно считается, что рецепторы NMDA модулируются эндогенными окислительно-восстановительными агентами, такими как глутатион, липоевая кислота, и необходимое питательное вещество пирролохинолинхинон.
Разработка антагонистов рецепторов NMDA
Основная проблема с разработкой антагонистов NMDA для нейрозащиты заключается в том, что физиологическая активность рецептора NMDA важна для нормальной функции нейронов. Полная блокада всей активности рецепторов NMDA приводит к побочным эффектам, таким как: галлюцинации, агитация и анестезия. Чтобы быть клинически значимым, антагонист рецептора NMDA должен ограничивать свое действие блокадой чрезмерной активации, не ограничивая нормальную функцию рецептора.[17] На рисунке 3 показаны упрощенные модели различных типов антагонистов рецептора NMDA, которые будут обсуждаться далее.
Конкурентоспособные антагонисты рецепторов NMDA
Конкурентоспособный Антагонисты рецептора NMDA, которые были разработаны первыми, не являются хорошим вариантом, потому что они конкурируют и связываются с тем же участком (субъединица NR2) на рецепторе, что и агонист, глутамат, и, следовательно, также блокируют нормальную функцию.[17][101] Они будут блокировать здоровые области мозга до того, как окажут влияние на патологические области, потому что здоровые области содержат более низкие уровни агонист чем патологические области. Эти антагонисты могут вытесняться из рецептора высокой концентрацией глутамата, который может существовать в эксайтотоксических условиях.[12]
Неконкурентные антагонисты рецепторов NMDA
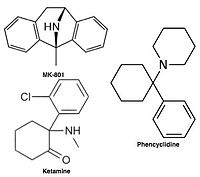
Антагонисты неконкурентоспособных рецепторов NMDA блокируют ионный канал на Mg2+ сайт (область пор) и предотвращает чрезмерный приток Са2+. Неконкурентный антагонизм относится к типу блока, который не может преодолеть повышенная концентрация глутамата, и зависит от предшествующей активации рецептора агонистом, то есть он входит в канал только тогда, когда он открывается агонистом.[17][102]

Из-за этих неблагоприятных побочных эффектов высокоаффинных блокаторов поиск клинически эффективных антагонистов NMDA-рецепторов для нейродегенеративных заболеваний продолжался и был сосредоточен на разработке низкоаффинных блокаторов. Однако сродство не может быть слишком низким, а время пребывания не слишком коротким (как видно на примере Mg2+), где деполяризация мембраны снимает блок. Таким образом, открытием стало создание неконкурентоспособного антагониста с более длительным временем пребывания, чем у Mg.2+ в канале но короче МК-801. Таким образом, полученное лекарство будет блокировать только чрезмерно открытые каналы, связанные с рецептором NMDA, но не нормальную нейротрансмиссию.[17][102] Мемантин - это лекарство. Это производное амантадина, который сначала был противогриппозным агентом, но позже случайно было обнаружено, что он эффективен при болезни Паркинсона. Химические структуры мемантина и амантадина можно увидеть на рисунке 5. Первоначально считалось, что это соединение дофаминергический или холинолитик но позже было обнаружено, что он является антагонистом рецептора NMDA.[11][17]
Мемантин - первый препарат, одобренный для лечения тяжелых и запущенных Болезнь Альцгеймера, от которых, например, антихолинергические препараты мало пользы.[102] Это помогает восстановить синаптическую функцию и, таким образом, улучшает нарушенную память и обучение.[15] В 2015 году мемантин также проходит испытания на предмет терапевтического значения при других неврологических расстройствах.[87]
Многие производные мемантина второго поколения находятся в стадии разработки, которые могут проявлять даже лучшие нейропротективные эффекты, при этом основная мысль заключается в использовании других безопасных, но эффективных модулирующих сайтов на рецепторе NMDA в дополнение к его связанному ионному каналу.[87]
Взаимосвязь структурной деятельности (SAR)

Мемантин (1-амино-3,5-диметиладамантан) представляет собой производное аминоалкилциклогексана и атипичное лекарственное соединение с неплоской трехмерной трициклической структурой. На рис. 8 показана SAR для производного аминоалкилциклогексана. Мемантин имеет несколько важных особенностей в своей структуре для его эффективности:
- Трехкольцевая структура с амином-плацдармом -NH2
- -NH2 группа протонируется при физиологическом pH тела, чтобы нести положительный заряд, -NH3+
- Два метиловых (CH3) боковые группы, которые служат для продления времени пребывания и повышения стабильности, а также сродства к каналу рецептора NMDA по сравнению с амантадином (1-адамантанамином).[14][102]
Несмотря на небольшое структурное различие между мемантином и амантадином, двумя производными адамантана, сродство к сайту связывания субъединицы NR1 / NR2B намного больше для мемантина. В патч-зажим измерения мемантин имеет IC50 (2,3 + 0,3) мкМ, в то время как амантадин имеет IC50 (71,0 + 11,1) мкМ.[25]Сайт связывания с наивысшим сродством называется доминантным сайтом связывания. Он включает связь между аминогруппой мемантина и связывающим карманом NR1-N161 субъединицы NR1 / NR2B. Боковые метильные группы играют важную роль в увеличении сродства к открытым каналам рецептора NMDA и делают его гораздо лучшим нейрозащитным препаратом, чем амантадин. Считается, что связывающие карманы для метильных групп находятся в NR1-A645 и NR2B-A644 NR1 / NR2B.[29] Карманы для связывания показаны на рисунке 2. Мемантин связывается на уровне Mg или рядом с ним.2+ сайт внутри канала, связанного с рецептором NMDA. -NH2 группа мемантина, которая протонируется при физиологическом pH организма, представляет собой область, которая связывается с Mg2+ сайт.[14] Добавление двух метильных групп к -N в структуре мемантина показало снижение аффинности, давая IC50 значение (28,4 + 1,4) мкМ.[25]
Производное мемантина второго поколения; нитромемантин
Несколько производных нитромемантина, производного мемантина второго поколения, были синтезированы с целью проведения детального исследования. структура деятельности отношения (SAR) этих новых препаратов. Один класс, содержащий нитро (NO2) группа напротив амина-плацдарма (NH2), показал многообещающий результат. Нитромемантин использует сайт связывания мемантина на рецепторе NMDA для нацеливания на NOИкс (X = 1 или 2) группа для взаимодействия с сайтом S-нитрозилирования / редокс, внешним по отношению к сайту связывания мемантина. Удлинение боковых цепей мемантина компенсирует худшее сродство к лекарству в канале, связанное с добавлением –ONO2 группа[103]
Терапевтическое применение
Предполагается, что эксайтотоксичность связана с некоторыми нейродегенеративными расстройствами, такими как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона и боковой амиотрофический склероз.[12][13][14][15] Следовательно, блокирование рецепторов NMDA могло бы теоретически быть полезным при лечении таких заболеваний.[12][13][14] Однако важно сохранить физиологическую активность рецептора NMDA, пытаясь блокировать его чрезмерную эксайтотоксическую активность. Это может быть достигнуто с помощью неконкурентоспособных антагонистов, блокирующих ионный канал рецепторов при чрезмерно открытом [14]
Мемантин является примером неконкурентоспособного антагониста рецептора NMDA, который имеет одобренные показания для лечения нейродегенеративного заболевания, болезни Альцгеймера. В 2015 году мемантин все еще проходит клинические испытания при других неврологических заболеваниях.[29][87]
Рецепторная модуляция
Рецептор NMDA - это неспецифический катионный канал, который может пропускать Са2+ и Na+ в ячейку и K+ из клетки. В возбуждающий постсинаптический потенциал (ВПСП), образующийся при активации рецептора NMDA, увеличивает концентрацию Са2+ в камере. CA2+ может в свою очередь функционировать как второй посланник в различных сигнальные пути. Однако катионный канал рецептора NMDA блокируется Mg2+ в состоянии покоя мембранный потенциал.[104] Разблокировка магнием не происходит мгновенно, чтобы разблокировать все доступные каналы, постсинаптическая клетка должна быть деполяризована на достаточно длительный период времени (в масштабе миллисекунд).[105]
Следовательно, рецептор NMDA функционирует как «молекулярный детектор совпадений Его ионный канал открывается только при выполнении следующих двух условий: глутамат связан с рецептором, а постсинаптическая клетка деполяризуется (что удаляет Mg2+ блокировка канала). Это свойство рецептора NMDA объясняет многие аспекты долгосрочное потенцирование (LTP) и синаптическая пластичность.[106]
Рецепторы NMDA модулируются рядом эндогенных и экзогенных соединений и играют ключевую роль в широком диапазоне физиологический (например., объем памяти ) и патологический процессы (например, эксайтотоксичность ).
Клиническое значение
Антагонисты NMDAR, такие как кетамин, эскетамин, тилетамин, фенциклидин, оксид азота, и ксенон используются как общие анестетики. Эти и подобные препараты, такие как декстрометорфан и метоксетамин также производят диссоциативный, галлюциногенный, и эйфорический эффекты и используются как рекреационные наркотики.
Ингибиторы NMDAR, включая кетамин, эскетамин (JNJ-54135419), рапастинель (GLYX-13), апимостинель (NRX-1074), 4-хлорокинуренин (AV-101) и рисленемдаз (CERC-301, MK-0657), разрабатываются для лечения расстройства настроения, в том числе сильное депрессивное расстройство и устойчивая к лечению депрессия.[72][73][107] Кроме того, кетамин уже используется для этой цели в некоторых клиниках в качестве нерекомендуемой терапии.[108][109]
Исследования показывают, что тианептин оказывает антидепрессивное действие за счет непрямого изменения и ингибирования глутамат рецепторная активность и высвобождение BDNF, в свою очередь, затрагивая нейронная пластичность.[110][111][112][113][114] Тианептин также действует на NMDA и Рецепторы AMPA.[110][114] В моделях на животных тианептин подавляет вызванные патологическим стрессом изменения глутаматергической нейротрансмиссии в миндалине и гиппокампе.
Мемантин, антагонист NMDAR с низким улавливанием, одобрен в Соединенные Штаты и Европа для лечения болезни Альцгеймера средней и тяжелой степени,[115] и теперь получил ограниченную рекомендацию британского Национальный институт здравоохранения и передового опыта для пациентов, которым не удалось выполнить другие варианты лечения.[116]
Кохлеарные NMDAR являются целью интенсивных исследований для поиска фармакологических решений для лечения тиннитус. NMDAR связаны с редким аутоиммунный болезнь, энцефалит против рецепторов NMDA (также известный как энцефалит NMDAR[117]), что обычно происходит из-за перекрестной реактивности антител, вырабатываемых иммунной системой, против эктопических тканей головного мозга, таких как тератома. Они известны как антитела против рецептора глутамата.
В сравнении с дофаминергический стимуляторы любить метамфетамин, антагонист NMDAR фенциклидин может вызывать более широкий спектр симптомов, напоминающих шизофрению у здоровых добровольцев, что привело к глутаматная гипотеза шизофрении.[118] Эксперименты, в которых грызунов лечат антагонистами рецепторов NMDA, сегодня являются наиболее распространенной моделью, когда дело доходит до тестирования новых методов лечения шизофрении или изучения точного механизма препаратов, уже одобренных для лечения шизофрении.
Антагонисты NMDAR, например элипродил, далстинель, ликостинель, и селфиотель были всесторонне исследованы для лечения эксайтотоксичность -опосредованный нейротоксичность в таких ситуациях, как ишемический приступ и травматическое повреждение мозга, но безуспешно клинические испытания используются в малых дозах, чтобы избежать седативного эффекта, но антагонисты NMDAR могут блокировать Распространение деполяризации у животных и у пациентов с черепно-мозговой травмой.[119] Это использование еще не проходило клинических испытаний.
Смотрите также
использованная литература
- ^ Лаубе Б., Хираи Х, Стерджесс М., Бец Х., Кухсе Дж. (Март 1997 г.). «Молекулярные детерминанты дискриминации агонистов по субъединицам рецептора NMDA: анализ сайта связывания глутамата на субъединице NR2B». Нейрон. 18 (3): 493–503. Дои:10.1016 / S0896-6273 (00) 81249-0. PMID 9115742.
Поскольку считается, что для активации канала необходимы две молекулы глутамата и глицина (3, 6), это означает, что рецептор NMDA должен состоять по крайней мере из четырех субъединиц.
- ^ а б Фурукава Х., Сингх С.К., Манкуссо Р., Гуо Э. (ноябрь 2005 г.). «Структура и функция субъединиц в рецепторах NMDA». Природа. 438 (7065): 185–192. Bibcode:2005Натура.438..185F. Дои:10.1038 / природа04089. PMID 16281028. S2CID 4400777.
- ^ Ли Ф, Цзянь Дж. З. (июль 2009 г.). «Память и рецепторы NMDA». Медицинский журнал Новой Англии. 361 (3): 302–303. Дои:10.1056 / NEJMcibr0902052. ЧВК 3703758. PMID 19605837.
- ^ Мориёси К., Масу М., Исии Т., Шигемото Р., Мизуно Н., Наканиши С. (ноябрь 1991 г.). «Молекулярное клонирование и характеристика рецептора NMDA крысы». Природа. 354 (6348): 31–37. Bibcode:1991Натура.354 ... 31М. Дои:10.1038 / 354031a0. PMID 1834949. S2CID 4368947.
- ^ а б Дингледин Р., Борхес К., Боуи Д., Трейнелис С.Ф. (март 1999 г.). «Ионные каналы глутаматного рецептора». Фармакологические обзоры. 51 (1): 7–61. PMID 10049997.
- ^ Лю И, Чжан Дж (октябрь 2000 г.). «Последние разработки в рецепторах NMDA». Китайский медицинский журнал. 113 (10): 948–956. PMID 11775847.
- ^ Cull-Candy S, Brickley S, Farrant M (июнь 2001 г.). «Субъединицы рецептора NMDA: разнообразие, развитие и болезнь». Текущее мнение в нейробиологии. 11 (3): 327–335. Дои:10.1016 / S0959-4388 (00) 00215-4. PMID 11399431. S2CID 11929361.
- ^ Паолетти П., Нейтон Дж. (Февраль 2007 г.). «Субъединицы рецептора NMDA: функции и фармакология». Текущее мнение в фармакологии. 7 (1): 39–47. Дои:10.1016 / j.coph.2006.08.011. PMID 17088105.
- ^ Kleckner NW, Dingledine R (август 1988 г.). «Потребность в глицине для активации NMDA-рецепторов, экспрессируемых в ооцитах Xenopus». Наука. 241 (4867): 835–837. Bibcode:1988Научный ... 241..835K. Дои:10.1126 / science.2841759. PMID 2841759.
- ^ а б c d Джонсон Дж. В., Котермански С. Е. (февраль 2006 г.). «Механизм действия мемантина». Текущее мнение в фармакологии. 6 (1): 61–67. Дои:10.1016 / j.coph.2005.09.007. PMID 16368266.
- ^ а б c d Домингес Э., Чин Т.Ю., Чен С.П., Ву Т.Ю. (декабрь 2011 г.). «Ведение умеренной и тяжелой болезни Альцгеймера: акцент на мемантин». Тайваньский журнал акушерства и гинекологии. 50 (4): 415–423. Дои:10.1016 / j.tjog.2011.10.004. PMID 22212311.
- ^ а б c d е ж г час Чен Х.С., Липтон С.А. (июнь 2006 г.). «Химическая биология клинически переносимых антагонистов рецепторов NMDA». Журнал нейрохимии. 97 (6): 1611–1626. Дои:10.1111 / j.1471-4159.2006.03991.x. PMID 16805772. S2CID 18376541.
- ^ а б c d е Кемп Дж. А., МакКернан Р. М. (ноябрь 2002 г.). «Пути рецепторов NMDA как мишени для лекарств». Природа Неврология. 5 Дополнение (11): 1039–1042. Дои:10.1038 / nn936. PMID 12403981. S2CID 41383776.
- ^ а б c d е ж г час я j k л Lipton SA (февраль 2006 г.). «Смена парадигмы нейрозащиты посредством блокады рецепторов NMDA: мемантин и не только». Обзоры природы. Открытие наркотиков. 5 (2): 160–170. Дои:10.1038 / nrd1958. PMID 16424917. S2CID 21379258.
- ^ а б c d Koch HJ, Szecsey A, Haen E (1 января 2004 г.). «NMDA-антагонизм (мемантин): альтернативный фармакологический терапевтический принцип при болезни Альцгеймера и сосудистой деменции». Текущий фармацевтический дизайн. 10 (3): 253–259. Дои:10.2174/1381612043386392. PMID 14754385.
- ^ Steullet P, Neijt HC, Cuénod M, Do KQ (февраль 2006 г.). «Нарушение синаптической пластичности и гипофункция рецепторов NMDA, вызванная дефицитом глутатиона: актуальность для шизофрении». Неврология. 137 (3): 807–819. Дои:10.1016 / j.neuroscience.2005.10.014. PMID 16330153. S2CID 1417873.
- ^ а б c d е ж г Lipton SA (январь 2004 г.). «Неудачи и успехи антагонистов рецепторов NMDA: молекулярная основа для использования блокаторов открытых каналов, таких как мемантин, в лечении острых и хронических неврологических нарушений». NeuroRx. 1 (1): 101–110. Дои:10.1602 / Neurorx.1.1.101. ЧВК 534915. PMID 15717010.
- ^ Ямакура Т., Симодзи К. (октябрь 1999 г.). «Субъединичная и сайт-специфическая фармакология канала рецептора NMDA». Прогресс в нейробиологии. 59 (3): 279–298. Дои:10.1016 / S0301-0082 (99) 00007-6. PMID 10465381. S2CID 24726102.
- ^ Уоткинс JC, Джейн DE (январь 2006 г.). «История глутамата». Британский журнал фармакологии. 147 Приложение 1 (S1): S100 – S108. Дои:10.1038 / sj.bjp.0706444. ЧВК 1760733. PMID 16402093.
- ^ Паолетти П., Нейтон Дж. (Февраль 2007 г.). «Субъединицы рецептора NMDA: функции и фармакология» (PDF). Текущее мнение в фармакологии. 7 (1): 39–47. Дои:10.1016 / j.coph.2006.08.011. PMID 17088105.
- ^ а б Hardingham, G.E .; Fukunaga, Y .; Бадинг, Х. (май 2002 г.). «Внесинаптические NMDAR противостоят синаптическим NMDAR, вызывая отключение CREB и пути гибели клеток». Природа Неврология. 5 (5): 405–414. Дои:10.1038 / nn835. ISSN 1097-6256. PMID 11953750. S2CID 659716.
- ^ а б Hardingham, Giles E .; Бадинг, Хилмар (октябрь 2010 г.). «Синаптическая против внесинаптической передачи сигналов рецептора NMDA: последствия для нейродегенеративных расстройств». Обзоры природы. Неврология. 11 (10): 682–696. Дои:10.1038 / nrn2911. ISSN 1471-003X. ЧВК 2948541. PMID 20842175.
- ^ Бадинг, Хилмар (6 марта 2017 г.). «Терапевтическое нацеливание на патологическую триаду внесинаптической передачи сигналов рецептора NMDA при нейродегенерациях». Журнал экспериментальной медицины. 214 (3): 569–578. Дои:10.1084 / jem.20161673. ISSN 1540-9538. ЧВК 5339681. PMID 28209726.
- ^ а б Ян, Цзин; Бенгтсон, К. Питер; Бухталь, Беттина; Хагенстон, Анна М .; Бадинг, Хилмар (9 октября 2020 г.). «Сочетание рецепторов NMDA и TRPM4 ведет к открытию нетрадиционных нейропротекторов». Наука. 370 (6513): eaay3302. Дои:10.1126 / science.aay3302. ISSN 1095-9203. PMID 33033186. S2CID 222210921.
- ^ а б c d е Ванка Л., Икбал К., Шрайнер ПР (май 2013 г.). «Липофильная пуля поражает мишени: медицинская химия производных адамантана». Химические обзоры. 113 (5): 3516–3604. Дои:10.1021 / cr100264t. ЧВК 3650105. PMID 23432396.
- ^ Salussolia CL, Prodromou ML, Borker P, Wollmuth LP (август 2011 г.). «Расположение субъединиц в функциональных рецепторах NMDA». Журнал неврологии. 31 (31): 11295–11304. Дои:10.1523 / JNEUROSCI.5612-10.2011. ЧВК 3207322. PMID 21813689.
- ^ а б Лофтис Дж. М., Яновский А. (январь 2003 г.). "The Nсубъединица NR2B рецептора -метил-D-аспартата: локализация, функциональные свойства, регуляция и клиническое значение ". Фармакология и терапия. 97 (1): 55–85. Дои:10.1016 / s0163-7258 (02) 00302-9. PMID 12493535.
- ^ а б Кристиансен Л.В., Уэрта I, Бенейто М., Мидор-Вудрафф Дж. Х. (февраль 2007 г.). «NMDA-рецепторы и шизофрения». Текущее мнение в фармакологии. 7 (1): 48–55. Дои:10.1016 / j.coph.2006.08.013. PMID 17097347.
- ^ а б c d Limapichat W, Yu WY, Branigan E, Lester HA, Dougherty DA (февраль 2013 г.). «Ключевые связывающие взаимодействия мемантина в рецепторе NMDA». ACS Chemical Neuroscience. 4 (2): 255–260. Дои:10.1021 / cn300180a. ЧВК 3751542. PMID 23421676.
- ^ Maher, T.J. (2013). Анестетики: общие и местные анестетики. В: T.L. Лемке и Д.А. Уильямс (редакторы). Принципы медицинской химии Фуа.(Глава 16). Филадельфия: Липпинкотт Уильямс и Уилкинс
- ^ Даниш В., Парсонс К. Г. (сентябрь 2003 г.). «Антагонист рецепторов NMDA мемантин как симптоматологическое и нейропротективное лечение болезни Альцгеймера: доклинические данные». Международный журнал гериатрической психиатрии. 18 (Приложение 1): S23 – S32. Дои:10.1002 / GPS.938. PMID 12973747. S2CID 14852616.
- ^ Стивенсон Ф.А. (ноябрь 2006 г.). «Структура и торговля рецепторами NMDA и GABAA». Сделки Биохимического Общества. 34 (Pt 5): 877–881. Дои:10.1042 / BST0340877. PMID 17052219. S2CID 24875113.
- ^ Teng H, Cai W., Zhou L, Zhang J, Liu Q, Wang Y и др. (Октябрь 2010 г.). «Эволюционный режим и функциональная дивергенция генов субъединицы 2 рецептора NMDA позвоночных». PLOS ONE. 5 (10): e13342. Bibcode:2010PLoSO ... 513342T. Дои:10.1371 / journal.pone.0013342. ЧВК 2954789. PMID 20976280.
- ^ Райан TJ, Grant SG (октябрь 2009 г.). «Происхождение и эволюция синапсов». Обзоры природы. Неврология. 10 (11): 701–712. Дои:10.1038 / Nrn2748. PMID 19738623.
- ^ Бар-Шира О., Маор Р., Чечик Г. (декабрь 2015 г.). «Переключение экспрессии генов рецепторных субъединиц в развитии человеческого мозга». PLOS вычислительная биология. 11 (12): e1004559. Bibcode:2015PLSCB..11E4559B. Дои:10.1371 / journal.pcbi.1004559. ЧВК 4670163. PMID 26636753.
- ^ Лю XB, Мюррей KD, Джонс EG (октябрь 2004 г.). «Переключение субъединиц NMDA рецепторов 2A и 2B в таламических и корковых синапсах во время раннего постнатального развития». Журнал неврологии. 24 (40): 8885–8895. Дои:10.1523 / JNEUROSCI.2476-04.2004. ЧВК 6729956. PMID 15470155.
- ^ последняя, первая (апрель 2000 г.). "заглавие". Scientific American.
- ^ Лю Ю., Вонг Т.П., Аартс М., Рояккерс А., Лю Л., Лай Т.В. и др. (Март 2007 г.). «Субъединицы рецептора NMDA играют разные роли в опосредовании эксайтотоксической гибели нейронов как in vitro, так и in vivo». Журнал неврологии. 27 (11): 2846–2857. Дои:10.1523 / JNEUROSCI.0116-07.2007. ЧВК 6672582. PMID 17360906.
- ^ Чжоу М., Бодри М. (март 2006 г.). «Изменения в развитии нейротоксичности NMDA отражают изменения субъединичного состава рецепторов NMDA».. Журнал неврологии. 26 (11): 2956–2963. Дои:10.1523 / JNEUROSCI.4299-05.2006. ЧВК 6673978. PMID 16540573.
- ^ Шпренгель Р., Сучанек Б., Амико С., Бруса Р., Бурнашев Н., Розов А. и др. (Январь 1998 г.). «Важность внутриклеточного домена субъединиц NR2 для функции рецептора NMDA in vivo». Ячейка. 92 (2): 279–289. Дои:10.1016 / S0092-8674 (00) 80921-6. PMID 9458051. S2CID 9791935.
- ^ Groc L, Choquet D., Stephenson FA, Verrier D, Manzoni OJ, Chavis P (сентябрь 2007 г.). «Поверхностный транспорт рецептора NMDA и состав синаптических субъединиц в процессе развития регулируются белком внеклеточного матрикса Reelin». Журнал неврологии. 27 (38): 10165–10175. Дои:10.1523 / JNEUROSCI.1772-07.2007. ЧВК 6672660. PMID 17881522.
- ^ Espinosa JS, Luo L (март 2008 г.). «Сроки нейрогенеза и дифференцировки: выводы из количественного клонального анализа гранулярных клеток мозжечка». Журнал неврологии. 28 (10): 2301–2312. Дои:10.1523 / JNEUROSCI.5157-07.2008. ЧВК 2586640. PMID 18322077.
- ^ Гаджендран Н., Капфхаммер Дж. П., Лайн Е., Канепари М., Фогт К., Висден В., Бреннер Х. Р. (февраль 2009 г.). «Передача сигналов нейрегулина незаменима для экспрессии NMDA- и GABA (A) -рецепторов в мозжечке in vivo». Журнал неврологии. 29 (8): 2404–2413. Дои:10.1523 / JNEUROSCI.4303-08.2009. ЧВК 6666233. PMID 19244516.
- ^ а б c d е ж г час я j k л м Парсонс депутат, Раймонд Л.А. (апрель 2014 г.). «Вовлечение внесинаптических рецепторов NMDA в заболевания центральной нервной системы». Нейрон. 82 (2): 279–293. Дои:10.1016 / j.neuron.2014.03.030. PMID 24742457.
- ^ Чой Д.В., Ко Дж. Ю., Петерс С. (январь 1988 г.). «Фармакология нейротоксичности глутамата в культуре клеток коры: ослабление антагонистами NMDA». Журнал неврологии. 8 (1): 185–196. Дои:10.1523 / JNEUROSCI.08-01-00185.1988. ЧВК 6569373. PMID 2892896.
- ^ Хенчклифф С (2007). Справочник по клинической неврологии. Нью-Йорк, Нью-Йорк, США: Медицинский колледж Вейля Корнельского университета, факультет неврологии и нейробиологии. С. 553–569.
- ^ а б c Hardingham GE, Bading H (февраль 2003 г.). «Инь и Ян передачи сигналов рецептора NMDA». Тенденции в неврологии. 26 (2): 81–89. Дои:10.1016 / s0166-2236 (02) 00040-1. PMID 12536131. S2CID 26207057.
- ^ Hardingham GE, Fukunaga Y, Bading H (май 2002 г.). «Внесинаптические NMDAR противостоят синаптическим NMDAR, запуская пути отключения CREB и гибели клеток». Природа Неврология. 5 (5): 405–414. Дои:10.1038 / nn835. PMID 11953750. S2CID 659716.
- ^ Ся П, Чен Х.С., Чжан Д., Липтон С.А. (август 2010 г.). «Мемантин предпочтительно блокирует внесинаптические, а не синаптические токи рецепторов NMDA при аутапсах гиппокампа». Журнал неврологии. 30 (33): 11246–11250. Дои:10.1523 / JNEUROSCI.2488-10.2010. ЧВК 2932667. PMID 20720132.
- ^ Ван И, Бриз В, Чишти А, Би Х, Бодри М. (ноябрь 2013 г.). «Различная роль μ-кальпаина и м-кальпаина в синаптической NMDAR-опосредованной нейропротекции и внесинаптической NMDAR-опосредованной нейродегенерации». Журнал неврологии. 33 (48): 18880–18892. Дои:10.1523 / JNEUROSCI.3293-13.2013. ЧВК 3841454. PMID 24285894.
- ^ Xu J, Kurup P, Zhang Y, Goebel-Goody SM, Wu PH, Hawasli AH, et al. (Июль 2009 г.). «Внесинаптические рецепторы NMDA связываются преимущественно с эксайтотоксичностью через кальпаин-опосредованное расщепление STEP». Журнал неврологии. 29 (29): 9330–9343. Дои:10.1523 / JNEUROSCI.2212-09.2009. ЧВК 2737362. PMID 19625523.
- ^ Карпова А., Михайлова М., Бера С., Бэр Дж., Редди П.П., Бехниш Т. и др. (Февраль 2013). «Кодирование и преобразование синаптического или внесинаптического происхождения сигналов рецептора NMDA в ядро». Ячейка. 152 (5): 1119–1133. Дои:10.1016 / j.cell.2013.02.002. PMID 23452857.
- ^ Берг Л.К., Ларссон М., Морланд С., Гундерсен В. (январь 2013 г.). «Пре- и постсинаптическая локализация субъединиц рецептора NMDA в синапсах мшистых волокон гиппокампа». Неврология. 230: 139–150. Дои:10.1016 / j.neuroscience.2012.10.061. PMID 23159309. S2CID 30241191.
- ^ Ли С., Джин М., Кегльспергер Т., Шепардсон Н.Э., Шанкар Г.М., Селкое Д.Д. (май 2011 г.). «Растворимые олигомеры Aβ ингибируют долгосрочное потенцирование посредством механизма, включающего чрезмерную активацию внесинаптических NR2B-содержащих рецепторов NMDA». Журнал неврологии. 31 (18): 6627–6638. Дои:10.1523 / JNEUROSCI.0203-11.2011. ЧВК 3100898. PMID 21543591.
- ^ Лю Д.Д., Ян Цюй, Ли СТ (апрель 2013 г.). «Активация внесинаптических рецепторов NMDA индуцирует LTD в нейронах СА1 гиппокампа крысы». Бюллетень исследований мозга. 93: 10–16. Дои:10.1016 / j.brainresbull.2012.12.003. PMID 23270879. S2CID 7836184.
- ^ Папуин Т., Ладепеш Л., Руэль Дж, Сакки С., Лабаск М., Ханини М. и др. (Август 2012 г.). «Синаптические и внесинаптические рецепторы NMDA управляются разными эндогенными коагонистами». Ячейка. 150 (3): 633–646. Дои:10.1016 / j.cell.2012.06.029. PMID 22863013.
- ^ Sanz-Clemente A, Nicoll RA, Roche KW (февраль 2013 г.). «Разнообразие в составе рецепторов NMDA: много регуляторов, много последствий». Нейробиолог. 19 (1): 62–75. Дои:10.1177/1073858411435129. ЧВК 3567917. PMID 22343826.
- ^ Petralia RS, Wang YX, Hua F, Yi Z, Zhou A, Ge L и др. (Апрель 2010 г.). «Организация NMDA рецепторов во внесинаптических местах». Неврология. 167 (1): 68–87. Дои:10.1016 / j.neuroscience.2010.01.022. ЧВК 2840201. PMID 20096331.
- ^ Лай Т.В., Шю В.К., Ван Ю.Т. (май 2011 г.). «Пути вмешательства при инсульте: рецепторы NMDA и не только». Тенденции в молекулярной медицине. 17 (5): 266–275. Дои:10.1016 / j.molmed.2010.12.008. PMID 21310659.
- ^ Фури К., Ли Д., Монтгомери Дж. М. (февраль 2014 г.). «Якорный белок SAP97 влияет на перемещение и локализацию множества мембранных каналов». Biochimica et Biophysica Acta (BBA) - Биомембраны. 1838 (2): 589–594. Дои:10.1016 / j.bbamem.2013.03.015. PMID 23535319.
- ^ Лукас Д.Р., Ньюхаус JP (август 1957 г.). «Токсическое действие L-глутамата натрия на внутренние слои сетчатки». Архив офтальмологии AMA. 58 (2): 193–201. Дои:10.1001 / archopht.1957.00940010205006. PMID 13443577.
- ^ Милнервуд А.Дж., Гладдинг С.М., Пулади М.А., Кауфман А.М., Хайнс Р.М., Бойд Дж.Д. и др. (Январь 2010 г.). «Раннее усиление передачи сигналов и экспрессии внесинаптического рецептора NMDA способствует возникновению фенотипа у мышей с болезнью Хантингтона». Нейрон. 65 (2): 178–190. Дои:10.1016 / j.neuron.2010.01.008. PMID 20152125. S2CID 12987037.
- ^ Hardingham GE, Bading H (октябрь 2010 г.). «Синаптическая против внесинаптической передачи сигналов рецептора NMDA: последствия для нейродегенеративных расстройств». Обзоры природы. Неврология. 11 (10): 682–696. Дои:10.1038 / nrn2911. ЧВК 2948541. PMID 20842175.
- ^ Смит, RS; Уолш, Калифорния (февраль 2020 г.). «Функции ионных каналов в раннем развитии мозга». Тенденции в неврологии. 43 (2): 103–114. Дои:10.1016 / j.tins.2019.12.004. ЧВК 7092371. PMID 31959360.
- ^ Chen PE, Geballe MT, Stansfeld PJ, Johnston AR, Yuan H, Jacob AL, et al. (Май 2005 г.). «Структурные особенности сайта связывания глутамата в рекомбинантном NR1 / NR2A Nрецепторы -метил-D-аспартата, определяемые сайт-направленным мутагенезом и молекулярным моделированием ». Молекулярная фармакология. 67 (5): 1470–1484. Дои:10.1124 / моль 104.008185. PMID 15703381. S2CID 13505187.
- ^ Волоскер Х (октябрь 2006 г.). «D-сериновая регуляция активности рецептора NMDA». STKE науки. 2006 (356): pe41. Дои:10.1126 / стке.3562006pe41. PMID 17033043. S2CID 39125762.
- ^ Яроцкий В., Глушаков А.В., Самнерс С., Гравенштейн Н., Деннис Д.М., Зеуберт С.Н., Мартынюк А.Е. (май 2005 г.). «Дифференциальная модуляция глутаматергической передачи 3,5-дибром-L-фенилаланином». Молекулярная фармакология. 67 (5): 1648–1654. Дои:10.1124 / моль 104.005983. PMID 15687225. S2CID 11672391.
- ^ Мартынюк А.Е., Зеуберт С.Н., Яроцкий В., Глушаков А.В., Гравенштейн Н., Самнерс К., Деннис Д.М. (ноябрь 2006 г.). «Галогенированные производные ароматических аминокислот обладают сбалансированным антиглутаматергическим действием: потенциальные возможности применения для лечения неврологических и психоневрологических расстройств». Последние патенты на открытие лекарств для ЦНС. 1 (3): 261–270. Дои:10.2174/157488906778773706. PMID 18221208.
- ^ Цао В., Шах Х.П., Глушаков А.В., Мекка А.П., Ши П., Самнерс С. и др. (Декабрь 2009 г.). «Эффективность 3,5-дибром-L-фенилаланина в моделях инсульта, судорог и сенсомоторного стробирования у крыс». Британский журнал фармакологии. 158 (8): 2005–2013. Дои:10.1111 / j.1476-5381.2009.00498.x. ЧВК 2807662. PMID 20050189.
- ^ Дж. Москаль, Д. Леандер, Р. Берч (2010). Раскрытие терапевтического потенциала рецептора NMDA. Новости открытия и разработки лекарств. Проверено 19 декабря 2013 года.
- ^ Андерсон С (01.06.2003). «Плохих новостей нет: взгляд на диссоциативное повреждение мозга и когнитивные нарушения». Хранилища Erowid DXM: Здоровье. Получено 2008-12-17.
- ^ а б Рейс MH (декабрь 2013 г.). «Наблюдение за испытаниями: усиление фазы II для антидепрессантов, нацеленных на глутамат». Обзоры природы. Открытие наркотиков. 12 (12): 897. Дои:10.1038 / nrd4178. PMID 24287771. S2CID 33113283.
- ^ а б Vécsei L, Szalárdy L, Fülöp F, Toldi J (январь 2013 г.). «Кинуренины в ЦНС: последние достижения и новые вопросы». Обзоры природы. Открытие наркотиков. 12 (1): 64–82. Дои:10.1038 / nrd3793. PMID 23237916. S2CID 31914015.
- ^ Reis DJ, Regunathan S (май 2000 г.). «Является ли агматин новым нейромедиатором в головном мозге?». Тенденции в фармакологических науках. 21 (5): 187–193. Дои:10.1016 / s0165-6147 (00) 01460-7. PMID 10785653.
- ^ Гибсон Д.А., Харрис Б.Р., Роджерс Д.Т., Литтлтон Дж. М. (октябрь 2002 г.). «Исследования связывания радиолиганда показывают, что агматин является более селективным антагонистом полиаминового сайта на рецепторе NMDA, чем аркаин или ифенпродил». Исследование мозга. 952 (1): 71–77. Дои:10.1016 / с0006-8993 (02) 03198-0. PMID 12363406. S2CID 38065910.
- ^ Мюллер А.Л., Артман Л.Д., Баландрин М.Ф., Брэди Э., Чиен Й., ДелМар Э.Г. и др. (2000). «NPS 1506, неконкурентный антагонист рецептора NMDA с умеренным сродством: доклиническое заключение и клинический опыт». Аминокислоты. 19 (1): 177–179. Дои:10.1007 / s007260070047. PMID 11026487. S2CID 2899648.
- ^ Monge-Fuentes V, Gomes FM, Campos GA, Silva J, Biolchi AM, Dos Anjos LC и др. (2015). «Нейроактивные соединения, полученные из ядов членистоногих, как новые терапевтические платформы для лечения неврологических расстройств». Журнал ядовитых животных и токсинов, включая тропические болезни. 21: 31. Дои:10.1186 / с40409-015-0031-х. ЧВК 4529710. PMID 26257776.
- ^ Pop E (сентябрь 2000 г.). «Непсихотропные синтетические каннабиноиды». Текущий фармацевтический дизайн. 6 (13): 1347–1360. Дои:10.2174/1381612003399446. PMID 10903397.
- ^ Фейгенбаум Дж. Дж., Бергманн Ф., Ричмонд С. А., Мешулам Р., Надлер В., Клоог Ю., Соколовский М. (декабрь 1989 г.). "Непсихотропный каннабиноид действует как функциональный Nблокатор рецепторов -метил-D-аспартата ». Труды Национальной академии наук Соединенных Штатов Америки. 86 (23): 9584–9587. Bibcode:1989PNAS ... 86.9584F. Дои:10.1073 / пнас.86.23.9584. ЧВК 298542. PMID 2556719.
- ^ Надлер В., Мечоулам Р., Соколовский М. (сентябрь 1993 г.). "Блокада притока 45Ca2 + через Nионный канал рецептора -метил-D-аспартата непсихоактивным каннабиноидом HU-211 ». Исследование мозга. 622 (1–2): 79–85. Дои:10.1016 / 0006-8993 (93) 90804-в. PMID 8242387. S2CID 36689761.
- ^ Каракас Э., Симоровски Н., Фурукава Х (июнь 2011 г.). «Расположение субъединиц и связывание фенилэтаноламина в рецепторах GluN1 / GluN2B NMDA». Природа. 475 (7355): 249–253. Дои:10.1038 / природа10180. ЧВК 3171209. PMID 21677647.
- ^ Глушаков А.В., Деннис Д.М., Мори Т.Е., Самнерс К., Куккьяра Р.Ф., Зеуберт С.Н., Мартынюк А.Е. (2002). "Специфическое ингибирование Nфункция рецептора -метил-D-аспартата в нейронах гиппокампа крысы за счет L-фенилаланина в концентрациях, наблюдаемых во время фенилкетонурии ». Молекулярная психиатрия. 7 (4): 359–367. Дои:10.1038 / sj.mp.4000976. PMID 11986979.
- ^ Глушаков А.В., Глушакова О., Варшней М., Байпай Л.К., Самнерс С., Лайпис П.Дж. и др. (Февраль 2005 г.). «Долгосрочные изменения глутаматергической синаптической передачи при фенилкетонурии». Мозг. 128 (Pt 2): 300–307. Дои:10.1093 / мозг / awh354. PMID 15634735.
- ^ Номер клинического исследования NCT00188383 для "Эффекты N-Метил-D-аспартат (NMDA) -рецепторный антагонизм при гипералгезии, употреблении опиоидов и боли после радикальной простатэктомии » ClinicalTrials.gov
- ^ Ludolph AG, Udvardi PT, Schaz U, Henes C, Adolph O, Weigt HU и др. (Май 2010 г.). «Атомоксетин действует как блокатор рецепторов NMDA в клинически значимых концентрациях». Британский журнал фармакологии. 160 (2): 283–291. Дои:10.1111 / j.1476-5381.2010.00707.x. ЧВК 2874851. PMID 20423340.
- ^ Шульц РБ, Чжун Ю (май 2017 г.). «Миноциклин нацелен на множественные механизмы вторичного повреждения при травматическом повреждении спинного мозга». Исследование нейронной регенерации. 12 (5): 702–713. Дои:10.4103/1673-5374.206633. ЧВК 5461601. PMID 28616020.
- ^ а б c d Lipton SA (октябрь 2007 г.). «Патологически активированные терапевтические средства для нейрозащиты». Обзоры природы. Неврология. 8 (10): 803–808. Дои:10.1038 / номер 2229. PMID 17882256. S2CID 34931289.
- ^ Сколник П., Бойе К., Миллер Р., Пеннингтон М., Maccecchini ML (октябрь 1992 г.). «Неконкурентное торможение N-метил-D-аспартат конантокином-G: доказательства аллостерического взаимодействия на полиаминовых сайтах ». Журнал нейрохимии. 59 (4): 1516–1521. Дои:10.1111 / j.1471-4159.1992.tb08468.x. PMID 1328523. S2CID 25871948.
- ^ Huggins DJ, Grant GH (январь 2005 г.). «Функция аминоконцевого домена в модуляции рецептора NMDA». Журнал молекулярной графики и моделирования. 23 (4): 381–388. Дои:10.1016 / j.jmgm.2004.11.006. PMID 15670959.
- ^ Хавасли А.Х., Бенавидес Д.Р., Нгуен К., Канси Дж. В., Хаяши К., Чамбон П. и др. (Июль 2007 г.). «Циклин-зависимая киназа 5 регулирует обучение и синаптическую пластичность посредством контроля деградации NMDAR». Природа Неврология. 10 (7): 880–886. Дои:10.1038 / nn1914. ЧВК 3910113. PMID 17529984.
- ^ Чжан С., Эдельманн Л., Лю Дж., Крэндалл Дж. Э., Морабито М. А. (январь 2008 г.). «Cdk5 регулирует фосфорилирование тирозина 1472 NR2B и поверхностную экспрессию рецепторов NMDA». Журнал неврологии. 28 (2): 415–424. Дои:10.1523 / JNEUROSCI.1900-07.2008. ЧВК 6670547. PMID 18184784.
- ^ Чен Ю., Бефферт У., Эртунч М., Тан Т.С., Кавалали Е.Т., Безпрозванный И., Герц Дж. (Сентябрь 2005 г.). «Рилин модулирует активность рецептора NMDA в нейронах коры головного мозга». Журнал неврологии. 25 (36): 8209–8216. Дои:10.1523 / JNEUROSCI.1951-05.2005. ЧВК 6725528. PMID 16148228.
- ^ Ю. Х.М., Аскалан Р., Кейл Г.Дж., Солтер М.В. (январь 1997 г.). «Регулирование канала NMDA с помощью связанной с каналом протеинтирозинкиназы Src». Наука. 275 (5300): 674–678. Дои:10.1126 / science.275.5300.674. PMID 9005855. S2CID 39275755.
- ^ Хорнинг М.С., Тромбли П.К. (октябрь 2001 г.). «Цинк и медь влияют на возбудимость нейронов обонятельной луковицы крысы по множеству механизмов». Журнал нейрофизиологии. 86 (4): 1652–1660. Дои:10.1152 / ян.2001.86.4.1652. PMID 11600628. S2CID 6141092.
- ^ Нил А. П., Стэнсфилд К. Х., Уорли П. Ф., Томпсон Р. Е., Гиларте Т. Р. (июль 2010 г.). «Воздействие свинца во время синаптогенеза изменяет везикулярные белки и ухудшает везикулярное высвобождение: потенциальная роль передачи сигналов BDNF, зависимой от рецептора NMDA». Токсикологические науки. 116 (1): 249–263. Дои:10.1093 / toxsci / kfq111. ЧВК 2886862. PMID 20375082.
- ^ а б Фуржо Л., Давенпорт К.М., Тайлер С.М., Ченг Т.Т., Спенсер МБ, Буланже Л.М. (декабрь 2010 г.). «MHC класса I модулирует функцию рецептора NMDA и передачу рецептора AMPA». Труды Национальной академии наук Соединенных Штатов Америки. 107 (51): 22278–22283. Bibcode:2010PNAS..10722278F. Дои:10.1073 / pnas.0914064107. ЧВК 3009822. PMID 21135233.
- ^ Huh GS, Boulanger LM, Du H, Riquelme PA, Brotz TM, Shatz CJ (декабрь 2000 г.). «Функциональные требования для класса I MHC в развитии и пластичности ЦНС». Наука. 290 (5499): 2155–2159. Bibcode:2000Sci ... 290.2155H. Дои:10.1126 / science.290.5499.2155. ЧВК 2175035. PMID 11118151.
- ^ Нельсон PA, Sage JR, Wood SC, Davenport CM, Anagnostaras SG, Boulanger LM (сентябрь 2013 г.). «Иммунные белки MHC класса I имеют решающее значение для гиппокампа-зависимой памяти и выхода из NMDAR-зависимой гиппокампа длительной депрессии». Обучение и память. 20 (9): 505–517. Дои:10.1101 / лм. 031351.113. ЧВК 3744042. PMID 23959708.
- ^ Трайнелис С.Ф., Калл-Кэнди С.Г. (май 1990 г.). "Протонное ингибирование N-метил-D-аспартатные рецепторы в нейронах мозжечка ». Природа. 345 (6273): 347–350. Bibcode:1990 Натур.345..347T. Дои:10.1038 / 345347a0. PMID 1692970. S2CID 4351139.
- ^ Айзенман Э., Липтон С.А., Лоринг Р.Х. (март 1989 г.). «Селективная модуляция ответов NMDA путем восстановления и окисления». Нейрон. 2 (3): 1257–1263. Дои:10.1016/0896-6273(89)90310-3. PMID 2696504. S2CID 10324716.
- ^ Монаган Д.Т., Джейн Д.Е. (2009). «Фармакология рецепторов NMDA». В Ван Донген AM (ред.). Биология рецептора NMDA. Бока-Ратон, Флорида: CRC Press. ISBN 978-1-4200-4414-0. PMID 21204415.
- ^ а б c d Сонкусаре С.К., Каул С.Л., Рамарао П. (январь 2005 г.). «Деменция при болезни Альцгеймера и других нейродегенеративных расстройствах - мемантин, новая надежда». Фармакологические исследования. 51 (1): 1–17. Дои:10.1016 / j.phrs.2004.05.005. PMID 15519530.
- ^ Такахаши Х., Ся П, Цуй Дж., Талантова М., Бодхинатан К., Ли В. и др. (Октябрь 2015 г.). «Фармакологически направленный антагонизм к рецепторам NMDA с помощью нитромемантина при цереброваскулярных заболеваниях». Научные отчеты. 5: 14781. Bibcode:2015НатСР ... 514781Т. Дои:10.1038 / srep14781. ЧВК 4609936. PMID 26477507.
- ^ Purves D, Augustine GJ, Fitzpatrick D, Hall WC, LaMantia A, McNamara JO, White LE (2008). Неврология (4-е изд.). Sinauer Associates. С. 129–131. ISBN 978-0-87893-697-7. Архивировано из оригинал 27 сентября 2011 г.
- ^ Варгас-Кабальеро М, Робинсон Х.П. (июль 2004 г.). «Быстрая и медленная зависимая от напряжения динамика магниевого блока в рецепторе NMDA: модель асимметричного блока захвата». Журнал неврологии. 24 (27): 6171–6180. Дои:10.1523 / jneurosci.1380-04.2004. ЧВК 6729657. PMID 15240809.
- ^ Purves D, Augustine GJ, Fitzpatrick D, Hall WC, LaMantia A, McNamara JO, White LE (2008). Неврология (4-е изд.). Sinauer Associates. С. 191–195. ISBN 978-0-87893-697-7. Архивировано из оригинал 27 сентября 2011 г.
- ^ Wijesinghe R (2014). «Новые методы лечения устойчивой депрессии». Клиника Ment Health. 4 (5): 56. Дои:10.9740 / mhc.n207179. ISSN 2168-9709.
- ^ Пун Л. (2014). «Растет количество доказательств того, что наркотики для вечеринок могут помочь в тяжелой депрессии». ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР.
- ^ Стикс G (2014). «Из клуба в клинику: врачи продвигают кетамин не по назначению как средство быстрого лечения депрессии». Scientific American.
- ^ а б McEwen BS, Chattarji S, Diamond DM, Jay TM, Reagan LP, Svenningsson P, Fuchs E (март 2010 г.). «Нейробиологические свойства тианептина (Stablon): от гипотезы моноаминов к глутаматергической модуляции». Молекулярная психиатрия. 15 (3): 237–249. Дои:10.1038 / mp.2009.80. ЧВК 2902200. PMID 19704408.
- ^ McEwen BS, Chattarji S (декабрь 2004 г.). «Молекулярные механизмы нейропластичности и фармакологические последствия: на примере тианептина». Европейская нейропсихофармакология. 14 Приложение 5: S497 – S502. Дои:10.1016 / j.euroneuro.2004.09.008. PMID 15550348. S2CID 21953270.
- ^ McEwen BS, Olié JP (июнь 2005 г.). «Нейробиология настроения, беспокойства и эмоций, выявленная в исследованиях уникального антидепрессанта: тианептина». Молекулярная психиатрия. 10 (6): 525–537. Дои:10.1038 / sj.mp.4001648. PMID 15753957.
- ^ Brink CB, Harvey BH, Brand L (январь 2006 г.). «Тианептин: новый атипичный антидепрессант, который может дать новое понимание биомолекулярных основ депрессии». Последние патенты на открытие лекарств для ЦНС. 1 (1): 29–41. Дои:10.2174/157488906775245327. PMID 18221189. Архивировано из оригинал на 2013-04-14. Получено 2020-04-12.
- ^ а б Каспер С., МакИвен Б.С. (2008). «Нейробиологические и клинические эффекты антидепрессанта тианептина». Препараты ЦНС. 22 (1): 15–26. Дои:10.2165/00023210-200822010-00002. PMID 18072812. S2CID 30330824.
- ^ Гора C, Даунтон C (июль 2006 г.). «Болезнь Альцгеймера: прогресс или прибыль?». Природа Медицина. 12 (7): 780–784. Дои:10,1038 / нм0706-780. PMID 16829947.
- ^ Оценка технологий NICE 18 января 2011 г. Болезнь Ажеймера - донепезил, галантамин, ривастигмин и мемантин (обзор): определение окончательной оценки
- ^ Тодд А. Харди, Реддел, Барнетт, Палас, Лучинетти, Вайншенкер, Атипичные воспалительные демиелинизирующие синдромы ЦНС, Ланцетная неврология, Том 15, выпуск 9, август 2016 г., страницы 967-981, doi: https://doi.org/10.1016/S1474-4422(16)30043-6, доступны на [1]
- ^ Лисман Дж. Э., Койл Дж. Т., Грин Р. У., Джавитт, округ Колумбия, Бенеш FM, Хекерс С., Грейс А.А. (май 2008 г.). «Схема на основе схем для понимания взаимодействий нейротрансмиттеров и генов риска при шизофрении». Тенденции в неврологии. 31 (5): 234–242. Дои:10.1016 / j.tins.2008.02.005. ЧВК 2680493. PMID 18395805.
- ^ Сантос Э., Оливарес-Ривера А., Майор С., Санчес-Поррас Р., Ульманн Л., Кунцманн К. и др. (Декабрь 2019 г.). «Длительный блок s-кетамина распространяющейся деполяризации при субарахноидальном кровоизлиянии: ретроспективное когортное исследование». Критический уход. 23 (1): 427. Дои:10.1186 / s13054-019-2711-3. ЧВК 6937792. PMID 31888772.
внешние ссылки
 СМИ, связанные с Рецептор NMDA в Wikimedia Commons
СМИ, связанные с Рецептор NMDA в Wikimedia Commons- Фармакология рецепторов NMDA
- Двигательная дискоординация возникает в результате комбинированного разрушения гена субъединиц NR2A и NR2C рецептора NMDA, но не в результате однократного разрушения субъединицы NR2A или NR2C
- Схематическая диаграмма суммирует три возможные модели переключения субъединиц NR2A и NR2B при развитии синапсов.
- Дрозофила NMDA рецептор 1 - Интерактивная муха
