Убиквитин-конъюгированный фермент - Ubiquitin-conjugating enzyme
| Убиквитин - протеинлигаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 6.3.2.19 | ||||||||
| Количество CAS | 74812-49-0 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| Убиквитин-конъюгированный фермент, E2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | UBQ-конъюгат_E2 | ||||||||
| Pfam | PF00179 | ||||||||
| ИнтерПро | IPR000608 | ||||||||
| УМНАЯ | SM00212 | ||||||||
| PROSITE | PDOC00163 | ||||||||
| Мембранома | 241 | ||||||||
| |||||||||
Убиквитин-конъюгирующие ферменты, также известный как Ферменты E2 и реже как ферменты-носители убиквитина, выполните второй шаг в убиквитинирование реакция, нацеленная на белок для деградации через протеасома. Процесс убиквитинирования ковалентно прикрепляет убиквитин, короткий белок 76 аминокислоты, в лизин остаток на целевом белке. После того, как белок был помечен одной молекулой убиквитина, дополнительные раунды убиквитинирования образуют цепь полиубиквитина, которая распознается регуляторной частицей 19S протеасомы, запускающей АТФ -зависимый разворачиваться целевого белка, который позволяет проходить в частицу ядра 20S протеасомы, где протеазы свести цель к минимуму пептид фрагменты для переработки клетка.
Отношения
А убиквитин-активирующий фермент, или E1, сначала активирует убиквитин, ковалентно присоединяя молекулу к ее активный сайт цистеин остаток. Затем активированный убиквитин переносится на цистеин E2. После конъюгирования с убиквитином молекула E2 связывает один из нескольких убиквитинлигазы или E3 через конструктивно консервированный привязка область, край. Молекула E3 отвечает за связывание целевого белка. субстрат и перенос убиквитина из цистеина E2 в остаток лизина на целевом белке.[1]
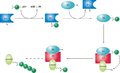
Принципиальная схема системы убиквитилирования.
Конкретная клетка обычно содержит только несколько типов молекул E1, большее разнообразие E2 и очень большое разнообразие E3. Молекулы E3, ответственные за идентификацию и связывание субстрата, таким образом, являются механизмами субстратной специфичности при протеасомной деградации. Каждый тип E2 может ассоциироваться со многими E3.[2]
Изоферменты
Следующие гены человека кодируют ферменты, конъюгирующие с убиквитином:
- UBE2A
- UBE2B
- UBE2C
- UBE2D1, UBE2D2, UBE2D3, UBE2D4 (последнее предполагаемое)
- UBE2E1, UBE2E2, UBE2E3
- UBE2F (предполагаемый)
- UBE2G1, UBE2G2
- UBE2H
- UBE2I
- UBE2J1, UBE2J2
- UBE2K
- UBE2L3, UBE2L6; (UBE2L1, UBE2L2, UBE2L4 являются псевдогенами)
- UBE2M
- UBE2N
- UBE2O
- UBE2Q1, UBE2Q2
- UBE2R1 (CDC34), UBE2R2
- UBE2S
- UBE2T (предполагаемый)
- UBE2U (предполагаемый)
- UBE2V1, UBE2V2
- UBE2W (предполагаемый)
- UBE2Z
- ATG3
- BIRC6
- UFC1
Смотрите также
Рекомендации
- ^ Нанди Д., Тахилиани П., Кумар А., Чанду Д. (2006). «Убиквитин-протеасомная система» (PDF). Журнал биологических наук. 31 (1): 137–55. Дои:10.1007 / BF02705243. PMID 16595883. S2CID 21603835.
- ^ Risseeuw EP, Daskalchuk TE, Banks TW, Liu E, Cotelesage J, Hellmann H, Estelle M, Somers DE, Crosby WL (2003). "Анализ взаимодействия белков субъединиц SCF убиквитин E3 лигазы из Arabidopsis". Журнал растений. 34 (6): 753–67. Дои:10.1046 / j.1365-313X.2003.01768.x. PMID 12795696.
внешняя ссылка
- Ресурс Eukaryotic Linear Motif класс мотива MOD_SUMO
- Убиквитин-конъюгирование + ферменты в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
| Этот фермент -связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |

