Адаптивная иммунная система - Adaptive immune system
В адаптивная иммунная система, также называемый приобретенная иммунная система, является подсистемой иммунная система который состоит из специализированных системных клеток и процессов, устраняющих патогены предотвращая их рост. Приобретенная иммунная система - одна из двух основных иммунитет стратегии найдены в позвоночные (другой врожденная иммунная система ).
Приобретенный иммунитет создает иммунологическая память после первоначального ответа на конкретный патоген и приводит к усиленному ответу на последующие встречи с этим патогеном. Этот процесс приобретенного иммунитета является основой вакцинация. Подобно врожденной системе, приобретенная система включает в себя как гуморальный иммунитет компоненты и клеточный иммунитет компоненты.

В отличие от врожденной иммунной системы, приобретенная иммунная система очень специфична к определенному патогену. Приобретенный иммунитет также может обеспечить длительную защиту; например, тот, кто выздоравливает от кори, теперь защищен от кори на всю жизнь. В других случаях он не обеспечивает пожизненной защиты; Например, ветрянка. Приобретенный ответ системы уничтожает вторгшиеся патогены и любые производимые ими токсичные молекулы. Иногда приобретенная система не может отличить вредные от безвредных чужеродных молекул; последствия этого могут быть Сенная лихорадка, астма или любой другой аллергия.
Антигены любые вещества, вызывающие приобретенный иммунный ответ (адаптивный или неадаптивный к организму).
Клетки, которые осуществляют приобретенный иммунный ответ, - это белые кровяные тельца, известные как лимфоциты. Две основные активности - ответы антител и клеточно-опосредованный иммунный ответ - также осуществляются двумя разными лимфоцитами (В-клетками и Т-клетками). В ответах антител В-клетки активируются, чтобы секретировать антитела, которые представляют собой белки, также известные как иммуноглобулины. Антитела проходят через кровоток и связываются с чужеродным антигеном, вызывая его инактивацию, что не позволяет антигену связываться с хозяином.[1]
При приобретенном иммунитете патоген-специфический рецепторы «приобретаются» в течение жизни организма (тогда как при врожденном иммунитете патоген-специфические рецепторы уже закодированы в зародышевый ). Приобретенный ответ называется «адаптивным», потому что он подготавливает иммунную систему организма к будущим вызовам (хотя на самом деле он также может быть неадаптивный когда это приводит к аутоиммунитет ).[n 1]
Система очень адаптируемый потому что соматическая гипермутация (процесс ускоренного соматический мутации ), и V (D) J рекомбинация (необратимый генетическая рекомбинация сегментов гена рецептора антигена). Этот механизм позволяет небольшому количеству генов генерировать огромное количество различных антигенных рецепторов, которые затем уникально экспрессируются в каждом индивидууме. лимфоцит. Поскольку перестройка генов приводит к необратимому изменению ДНК каждой ячейки, все потомство (потомство) этой клетки наследует гены, которые кодируют такую же рецепторную специфичность, включая В-клетки памяти и Т-клетки памяти это ключи к долгоживущему специфическому иммунитету.
Теоретическая основа, объясняющая работу приобретенной иммунной системы, обеспечивается теория иммунных сетей. Эта теория, основанная на устоявшихся представлениях о клональный отбор, применяется в поисках Вакцина против ВИЧ.
Именование
Термин «адаптивный» впервые был использован Роберт Гуд в отношении ответа антител у лягушек как синонима «приобретенного иммунного ответа» в 1964 году. Гуд признал, что использовал эти термины как синонимы, но объяснил только, что он «предпочитает» использовать термин «адаптивный». Он, возможно, думал о тогда неправдоподобной теории образования антител, в которой антитела были пластичными и могли адаптироваться к молекулярной форме антигенов и / или к концепции «адаптивных ферментов», описанной Monod у бактерий, то есть ферментов, экспрессия которых может быть вызвана их субстратами. Эта фраза использовалась почти исключительно Гудом и его учениками, а также несколькими другими иммунологами, работающими с маргинальными организмами, до 1990-х годов, когда она стала широко использоваться в тандеме с термином «врожденный иммунитет», который стал популярным после открытия системы рецепторов Толля. в Дрозофила, ранее маргинальный организм для изучения иммунологии. Термин «адаптивный», используемый в иммунологии, является проблематичным, поскольку приобретенные иммунные ответы могут быть как адаптивными, так и дезадаптивными в физиологическом смысле. Действительно, как приобретенный, так и врожденный иммунные ответы могут быть как адаптивными, так и дезадаптивными в эволюционном смысле. Большинство учебников сегодня, после раннего использования Джейнвей, используйте почти исключительно слово «адаптивный» и отмечая в глоссариях, что этот термин является синонимом слова «приобретенный».
Классическое понятие «приобретенный иммунитет» стало означать, поскольку Тонегава открытие, «антиген-специфический иммунитет, опосредованный перестройками соматических генов, которые создают определяющие клон рецепторы антигена». В последнее десятилетие термин «адаптивный» все чаще применяется к другому классу иммунного ответа, до сих пор не связанному с перестройками соматических генов. К ним относятся распространение естественных киллеров (NK) с до сих пор необъяснимой специфичностью в отношении антигенов, рост NK-клеток, экспрессирующих рецепторы, закодированные в зародышевой линии, и активация других врожденных иммунных клеток до активированного состояния, которое дает кратковременную «иммунную память». ". В этом смысле «адаптивный иммунитет» больше напоминает концепцию «активированного состояния» или «гетеростаза», возвращаясь, таким образом, к физиологическому смыслу «адаптации» к изменениям окружающей среды.
Функции
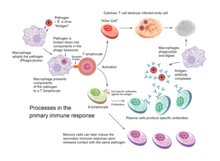
Приобретенный иммунитет запускается у позвоночных, когда патоген уклоняется от врожденной иммунной системы и (1) генерирует пороговый уровень антигена и (2) генерирует «незнакомые» или «опасные» сигналы, активирующие дендритные клетки.[2]
Основные функции приобретенной иммунной системы включают:
- Распознавание специфических «чужих» антигенов в присутствии «я», в процессе презентация антигена.
- Генерация ответов, адаптированных для максимального устранения конкретных патогенов или инфицированных патогенами клеток.
- Развитие иммунологическая память, в котором патогены «запоминаются» через В-клетки памяти и Т-клетки памяти.
У людей адаптивной иммунной системе требуется 4-7 дней, чтобы вызвать значительный ответ.[3]
Лимфоциты
Клетки приобретенной иммунной системы - это Т и В лимфоциты; лимфоциты - это подмножество лейкоциты. В-клетки и Т-клетки являются основными типами лимфоцитов. В организме человека около 2 триллионов лимфоцитов, составляющих 20–40% белых кровяных телец (WBC); их общая масса примерно такая же, как у мозг или печень. Периферическая кровь содержит 2% циркулирующих лимфоцитов; остальные перемещаются в тканях и лимфатическая система.[1]
В-клетки и Т-клетки происходят из одного и того же мультипотентные гемопоэтические стволовые клетки, и морфологически неотличимы друг от друга до тех пор, пока не активируются. В-клетки играют большую роль в гуморальный иммунный ответ, тогда как Т-клетки непосредственно участвуют в клеточно-опосредованные иммунные ответы. В целом позвоночные Кроме Агната, В-клетки и Т-клетки продуцируются стволовыми клетками костного мозга.[4]
Предшественники Т мигрируют из костного мозга в вилочковая железа где они называются тимоцитами и где они развиваются в Т-клетки. У людей примерно 1-2% пула лимфоцитов рециркулирует каждый час, чтобы оптимизировать возможности антиген-специфических лимфоцитов найти свой специфический антиген во вторичных лимфоидных тканях.[5]У взрослого животного периферические лимфоидные органы содержат смесь В- и Т-клеток как минимум на трех стадиях дифференцировки:
- наивный B и наивные Т-клетки (клетки, которые не созрели), вышли из костного мозга или тимуса, попали в лимфатическую систему, но еще не встретили свой родственный антиген,
- эффекторные клетки которые были активированы своим родственным антигеном и активно участвуют в устранении патогена.
- клетки памяти - выжившие после перенесенных инфекций.
Презентация антигена
Приобретенный иммунитет зависит от способности иммунных клеток различать собственные клетки организма и нежелательных захватчиков. Клетки хозяина выражают «я» антигены. Эти антигены отличаются от антигенов на поверхности бактерий или на поверхности инфицированных вирусом клеток-хозяев («чужие» или «чужие» антигены). Приобретенный иммунный ответ запускается путем распознавания чужеродного антигена в клеточном контексте активированной дендритной клетки.
За исключением безъядерных клеток (включая эритроциты ), все клетки способны презентировать антиген через функцию молекул главного комплекса гистосовместимости (MHC).[4] Некоторые клетки специально оборудованы для представления антигена и примирования наивных Т-клеток. Дендритные клетки, B-клетки и макрофаги оснащены специальными «костимулирующими» лигандами, распознаваемыми костимулирующими рецепторами на Т-клетках, и называются профессиональными антигенпрезентирующие клетки (БТР).
Профессиональные APC могут активировать несколько подгрупп Т-клеток, и каждый тип Т-клеток специально оборудован для борьбы с каждым уникальным токсином или микробным патогеном. Тип активированных Т-клеток и тип генерируемого ответа частично зависят от контекста, в котором APC впервые столкнулся с антигеном.[2]
Экзогенные антигены

Дендритные клетки поглощают экзогенный патогены, такие как бактерии, паразиты или токсины в тканях, а затем мигрируют через хемотаксический сигналы к лимфатическим узлам, обогащенным Т-клетками. Во время миграции дендритные клетки претерпевают процесс созревания, в ходе которого они теряют большую часть своей способности поглощать другие патогены и развивают способность связываться с Т-клетками. Дендритная клетка использует ферменты измельчить возбудитель на более мелкие кусочки, называемые антигены. В лимфатическом узле дендритная клетка отображает эти несамоантигены на своей поверхности, связывая их с рецептором, называемым главный комплекс гистосовместимости, или MHC (также известный у людей как человеческий лейкоцитарный антиген (HLA)). Этот комплекс MHC: антиген распознается Т-клетками, проходящими через лимфатический узел. Экзогенные антигены обычно отображаются на MHC класс II молекулы, которые активируют CD4 +Т-хелперные клетки.[2]
Эндогенные антигены
Эндогенный антигены продуцируются внутриклеточными бактериями и вирусами, размножающимися внутри клетки-хозяина. Клетка-хозяин использует ферменты для переваривания белков, связанных с вирусами, и отображает эти части на своей поверхности для Т-клеток, связывая их с MHC. Эндогенные антигены обычно отображаются на MHC класс I молекулы и активируют CD8 + цитотоксические Т-клетки. За исключением безъядерных клеток (включая эритроциты ), MHC класса I экспрессируется всеми клетками-хозяевами.[2]
Т-лимфоциты
CD8 + Т-лимфоциты и цитотоксичность
Цитотоксические Т-клетки (также известные как ТС, Т-киллеры или цитотоксические Т-лимфоциты (CTL)) представляют собой подгруппу Т-клеток, которые вызывают гибель клеток, инфицированных вирусами (и другими патогенами) или иным образом повреждены или неисправны.[2]
Наивные цитотоксические Т-клетки активируются, когда их Т-клеточный рецептор (TCR) сильно взаимодействует с пептидной молекулой MHC класса I. Это сродство зависит от типа и ориентации комплекса антиген / MHC, и это то, что удерживает CTL и инфицированную клетку связанными вместе.[2] После активации CTL проходит процесс, называемый клональный отбор, в котором он получает функции и быстро делится, чтобы произвести армию «вооруженных» эффекторных клеток. Затем активированные CTL путешествуют по телу в поисках клеток, несущих этот уникальный пептид MHC Class I +.[нужна цитата ]
При контакте с инфицированными или дисфункциональными соматические клетки, высвобождение эффекторных CTL перфорин и гранулизин: цитотоксины, образующие поры в клетках-мишенях плазматическая мембрана, позволяя ионы и вода поступает в инфицированную клетку, вызывая ее разрыв или лизировать. Выпуск CTL гранзим, а сериновая протеаза инкапсулирован в гранулу, которая проникает в клетки через поры, чтобы вызвать апоптоз (смерть клетки). Чтобы ограничить обширное повреждение тканей во время инфекции, активация CTL строго контролируется и обычно требует очень сильного сигнала активации MHC / антигена или дополнительных сигналов активации, обеспечиваемых «вспомогательными» Т-клетками (см. Ниже).[2]
При разрешении инфекции большинство эффекторных клеток погибают и фагоциты очистите их - но некоторые из этих клеток остаются ячейками памяти.[4] При более позднем столкновении с тем же антигеном эти клетки памяти быстро дифференцируются в эффекторные клетки, резко сокращая время, необходимое для установления эффективного ответа.[нужна цитата ]
Т-хелперы

CD4 + лимфоциты, также называемые «вспомогательными» Т-клетками, являются медиаторами иммунного ответа и играют важную роль в установлении и максимизации возможностей приобретенного иммунного ответа.[2] Эти клетки не обладают цитотоксической или фагоцитарной активностью; и не может убивать инфицированные клетки или устранять патогены, но, по сути, «управляет» иммунным ответом, направляя другие клетки на выполнение этих задач.
Хелперные Т-клетки экспрессируют Т-клеточные рецепторы (TCR), которые распознают антиген, связанный с молекулами MHC класса II. Активация наивной хелперной Т-клетки заставляет ее выделять цитокины, которые влияют на активность многих типов клеток, включая APC (антигенпрезентирующую клетку), которая ее активировала. Хелперные Т-клетки требуют гораздо более мягкого активационного стимула, чем цитотоксические Т-клетки. Хелперные Т-клетки могут подавать дополнительные сигналы, которые «помогают» активировать цитотоксические клетки.[4]
Th1 и Th2: ответы хелперных Т-клеток
Классически два типа эффекторного CD4+ Ответы Т-хелперов могут быть вызваны профессиональными APC, обозначенными Th1 и Th2, каждый из которых предназначен для устранения различных типов патогенов. Факторы, определяющие, вызывает ли инфекция ответ типа Th1 или Th2, до конца не изучены, но генерируемый ответ действительно играет важную роль в избавлении от различных патогенов.[2]
Ответ Th1 характеризуется образованием Интерферон-гамма, что активирует бактерицидный активности макрофагов и побуждает В-клетки производить опсонизация (маркировка фагоцитоза) и антител, фиксирующих комплемент, и приводит к клеточный иммунитет.[2] В целом ответы Th1 более эффективны против внутриклеточный патогены (вирусы и бактерии, находящиеся внутри клеток-хозяев).
Ответ Th2 характеризуется высвобождением Интерлейкин 5, что вызывает эозинофилы в очистке от паразитов.[7] Th2 также производят Интерлейкин 4, который способствует развитию B-клеток переключение изотипа.[2] В целом ответы Th2 более эффективны против внеклеточный бактерии, паразиты, включая гельминты и токсины.[2] Как и цитотоксические Т-клетки, большая часть CD4+ клетки-помощники умирают при разрешении инфекции, а некоторые остаются в виде CD4+ ячейки памяти.
Все чаще появляются убедительные доказательства более широкого разнообразия CD4 в результате научных исследований на мышах и людях.+ подмножества эффекторных Т-хелперных клеток.[8][9] Регуляторные Т (Treg) клетки, были определены как важные негативные регуляторы адаптивного иммунитета, поскольку они ограничивают и подавляет иммунная система для контроля аберрантных иммунных ответов на аутоантигены; важный механизм в контроле развития аутоиммунных заболеваний.[4] Фолликулярные хелперные Т (Tfh) клетки являются еще одной отдельной популяцией эффекторных CD4+ Т-клетки, которые развиваются из наивных Т-клеток после активации антигена. Клетки Tfh специализируются на помощи В-клеткам гуморальный иммунитет поскольку они уникально способны перейти на фолликулярные В-клетки во вторичных лимфоидных органах и обеспечивают им положительные паракринные сигналы, позволяющие генерировать и воспроизводить продукцию высокого качества созревший сродством антитела. Подобно Treg, клетки Tfh также играют роль в иммунологическая толерантность поскольку аномальное увеличение количества клеток Tfh может привести к неограниченному производству аутореактивных антител, вызывая тяжелые системные аутоиммунные нарушения.[10]
Актуальность CD4+ Т-хелперы подсвечиваются во время ВИЧ инфекция. ВИЧ способен подорвать иммунную систему, специфически атакуя CD4+ Т-клетки, а именно клетки, которые могут управлять уничтожением вируса, но также и клетки, которые обеспечивают иммунитет против всех других патогенов, встречающихся в течение жизни организма.[4]
Гамма-дельта Т-клетки
Гамма-дельта Т-клетки (γδ Т-клетки) обладают альтернативой Рецептор Т-клеток (TCR) в отличие от CD4 + и CD8 + αβ Т-клеток и имеют общие характеристики хелперных Т-клеток, цитотоксических Т-клеток и естественных клеток-киллеров. Как и другие «нетрадиционные» подмножества Т-клеток, несущие инвариантные TCR, такие как CD1d -ограниченный естественные Т-клетки-киллеры, γδ Т-клетки обладают характеристиками, которые ставят их на границу между врожденным и приобретенным иммунитетом. С одной стороны, γδ Т-клетки можно рассматривать как компонент адаптивного иммунитета, поскольку они реорганизуют гены TCR посредством V (D) J рекомбинация, который также производит функциональное разнообразие, и развить фенотип памяти. С другой стороны, однако, различные подмножества также могут считаться частью врожденной иммунной системы, где ограниченные рецепторы TCR или NK могут использоваться в качестве рецептор распознавания образов. Например, согласно этой парадигме, большое количество Т-клеток Vγ9 / Vδ2 в течение нескольких часов реагирует на общие молекулы продуцируемые микробами, и сильно ограниченные интраэпителиальные Т-клетки Vδ1 отвечают на стрессовые эпителиальные клетки.
В-лимфоциты и выработка антител
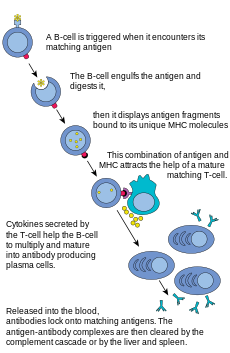
В-клетки являются основными клетками, участвующими в создании антитела которые циркулируют в плазма крови и лимфа, известная как гуморальный иммунитет. Антитела (также известные как иммуноглобулин, Ig) - это большие Y-образные белки, используемые иммунной системой для идентификации и нейтрализации посторонних предметов. У млекопитающих существует пять типов антител: IgA, IgD, IgE, IgG, и IgM, различающиеся биологическими свойствами; каждый эволюционировал для обработки разных видов антигенов. После активации В-клетки продуцируют антитела, каждое из которых распознает уникальный антиген и нейтрализует определенные патогены.[2]
Связывание антигена и антитела может вызвать пять различных защитных механизмов:
- Агглютинация: уменьшает количество инфекционных единиц, с которыми необходимо иметь дело
- Активация комплемента: вызывает воспаление и лизис клеток
- Опсонизация: покрытие антигена антителом усиливает фагоцитоз
- Антителозависимая клеточно-опосредованная цитотоксичность: антитела, прикрепленные к клетке-мишени, вызывают разрушение макрофагами, эозинофилами и NK-клетками.
- Нейтрализация: блокирует адгезию бактерий и вирусов к слизистой оболочке.
Подобно Т-клетке, В-клетки экспрессируют уникальный В-клеточный рецептор (BCR), в данном случае молекулу мембраносвязанного антитела. Все BCR любого клона B-клеток распознают и связываются только с одним конкретным антигеном. Критическое различие между В-клетками и Т-клетками заключается в том, как каждая клетка «видит» антиген. Т-клетки распознают свой родственный антиген в процессированной форме - как пептид в контексте молекулы MHC,[2] тогда как В-клетки распознают антигены в их естественной форме.[2] Как только В-клетка встречает свой родственный (или специфический) антиген (и получает дополнительные сигналы от вспомогательная Т-клетка (преимущественно Th2 типа)), далее отличает в эффекторную клетку, известную как плазматическая клетка.[2]
Плазматические клетки представляют собой короткоживущие клетки (2–3 дня), секретирующие антитела. Эти антитела связываются с антигенами, что делает их более легкими мишенями для фагоцитов и запускает каскад дополнений.[2] Около 10% плазматических клеток выживают и становятся долгоживущими антиген-специфическими В-клетки памяти.[2] Эти клетки, уже подготовленные к выработке специфических антител, могут быть призваны быстро отреагировать, если тот же патоген повторно заразит хозяина, в то время как хозяин испытывает мало симптомов, если таковые имеются.
Альтернативные системы
У бесчелюстных позвоночных
Примитивный бесчелюстные позвоночные, такой как минога и миксина, имеют адаптивную иммунную систему, которая показывает 3 различных клеточных линии, каждая из которых имеет общее происхождение с В-клетками, αβ Т-клетками и врожденными γΔ Т-клетками.[11][12] Вместо классического антитела и Рецепторы Т-клеток, эти животные обладают большим набором молекул, называемых вариабельные рецепторы лимфоцитов (Сокращенно VLR), которые, как и рецепторы антигенов челюстных позвоночных, производятся только из небольшого числа (одного или двух) гены. Считается, что эти молекулы связывают патогенные антигены аналогично антителам и с той же степенью специфичности.[13]
У насекомых
Долгое время считалось, что насекомые и другие беспозвоночные обладать только врожденная иммунная система. Однако в последние годы у насекомых были обнаружены некоторые из основных признаков адаптивного иммунитета. Эти черты иммунная память и специфичность. Несмотря на наличие клейм, механизмы отличаются от тех, что на позвоночные.
Иммунная память у насекомых была открыта благодаря феномену прайминга. Когда насекомые подвергаются воздействию нелетальной дозы или погибают от тепла бактерии они могут запоминать эту инфекцию, что позволяет им противостоять смертельной дозе тех же бактерий, которым они подвергались раньше.[14][15] В отличие от позвоночных, насекомые не обладают клетками, специфичными для адаптивного иммунитета. Вместо этого эти механизмы опосредуются гемоциты. Гемоциты действуют так же, как фагоциты, и после прайминга они способны более эффективно распознавать и поглощать патоген.[16] Также было показано, что можно передавать память потомству. Например, в пчелы если матка заражена бактериями, то у новорожденных рабочих улучшаются способности бороться с теми же бактериями.[17] Другая экспериментальная модель на основе красный мучной жук также показали, что специфическая для патогена праймированная память передается потомству как от матери, так и от отца.[18]
Наиболее общепринятая теория специфичности основана на Dscam ген. Dscam ген, также известный как клеточная адгезивная молекула синдрома Дауна, представляет собой ген, содержащий 3 переменных Ig домены. Эти домены могут быть альтернативно сращены, достигая большого количества вариаций.[19] Было показано, что после воздействия различных патогенов образуются разные формы сплайсинга dscam. После того, как животные с разными формами сплайсинга подвергаются воздействию одного и того же патогена, выживают только особи со сплайсинговой формой, специфичной для этого патогена.[19]
Другие механизмы, поддерживающие специфичность иммунитета насекомых: РНК-интерференция (РНКи). РНКи - это форма противовирусного иммунитета с высокой специфичностью.[20] У него есть несколько различных путей, которые заканчиваются тем, что вирус не может размножаться. Один из путей - миРНК в котором длинная двухцепочечная РНК разрезана на части, которые служат матрицами для белкового комплекса Ago2-RISC, который находит и разрушает комплементарную РНК вируса. МиРНК Путь в цитоплазме связывается с комплексом Ago1-RISC и действует как матрица для деградации вирусной РНК. Последний пиРНК где малая РНК связывается с семейством белков Piwi и контролирует транспозоны и другие мобильные элементы.[21] Несмотря на исследования, точные механизмы, ответственные за иммунное праймирование и специфичность у насекомых, описаны недостаточно хорошо.
Иммунологическая память
Когда B-клетки и T-клетки активируются, некоторые из них становятся В-клетки памяти и немного Т-клетки памяти. На протяжении всей жизни животного эти клетки памяти формируют базу данных эффективных В- и Т-лимфоцитов. При взаимодействии с ранее встреченным антигеном выбираются и активируются соответствующие клетки памяти. Таким образом, второе и последующие воздействия антигена вызывают более сильный и быстрый иммунный ответ. Это «адаптивный» в том смысле, что иммунная система организма готовится к будущим вызовам, но, конечно, «неадаптивный», если рецепторы являются аутоиммунными. Иммунологическая память может быть в виде пассивный кратковременная память или активный Долгосрочная память.
Пассивная память
Пассивная память обычно кратковременна и длится от нескольких дней до нескольких месяцев. Новорожденный младенцы ранее не подвергались воздействию микробов и особенно уязвимы для инфекций. Мать обеспечивает несколько уровней пассивной защиты. В утробе матери, материнский IgG транспортируется прямо через плацента Таким образом, при рождении человеческие младенцы имеют высокий уровень антител с тем же диапазоном антигенной специфичности, что и их мать.[2] Грудное молоко содержит антитела (в основном IgA), которые переносятся в кишечник младенца, защищая от бактериальных инфекций, пока новорожденный не сможет синтезировать свои собственные антитела.[2]
Это пассивный иммунитет потому что плод на самом деле не производит никаких клеток памяти или антител: он только их заимствует. Кратковременный пассивный иммунитет также может передаваться искусственно от одного человека к другому через богатые антителами сыворотка.
Активная память
Как правило, активный иммунитет является долгосрочным и может быть приобретен путем инфицирования с последующей активацией В-клеток и Т-клеток или приобретен искусственно с помощью вакцин в процессе, называемом иммунизацией.
Иммунизация
Исторически инфекционные заболевания были основной причиной смерти населения. За последнее столетие для борьбы с их распространением были разработаны два важных фактора: санитария и иммунизация.[4] Иммунизация (обычно называемая вакцинация ) является преднамеренной индукцией иммунного ответа и представляет собой единственное наиболее эффективное средство манипулирования иммунной системой, разработанное учеными.[4] Иммунизация успешна, потому что они используют естественную специфичность иммунной системы, а также ее индуцируемость.
Принцип иммунизации заключается во введении антигена, полученного из болезнетворного организма, который стимулирует иммунную систему к выработке защитного иммунитета против этого организма, но не действует. сам вызывают патогенные эффекты этого организма. An антиген (Короче для антитело генerator), определяется как любое вещество, которое связывается с конкретным антителом и вызывает адаптивный иммунный ответ.[1]
Самый вирусный вакцина основаны на живом ослабленный вирусов, тогда как многие бактериальные вакцины основаны на бесклеточный компоненты микроорганизмов, в том числе безвредные токсин компоненты.[1] Многие антигены, полученные из бесклеточных вакцин, не вызывают сильного адаптивного ответа, и большинство бактериальных вакцин требуют добавления адъюванты которые активируют антигенпрезентирующие клетки врожденная иммунная система усилить иммуногенность.[4]
Иммунологическое разнообразие

Большинство крупных молекул, включая практически все белки и много полисахариды, могут служить антигенами.[2] Части антигена, которые взаимодействуют с молекулой антитела или рецептором лимфоцитов, называются эпитопы, или антигенные детерминанты. Большинство антигенов содержат множество эпитопов и могут стимулировать выработку антител, специфические Т-клеточные ответы или и то, и другое.[2] Очень небольшая часть (менее 0,01%) от общего числа лимфоцитов способна связываться с конкретным антигеном, что предполагает, что только несколько клеток реагируют на каждый антиген.[4]
Чтобы приобретенный ответ «запоминал» и устранял большое количество патогенов, иммунная система должна уметь различать множество различных антигенов,[1] и рецепторы, которые распознают антигены, должны быть продуцированы в огромном разнообразии конфигураций, по сути, по одному рецептору (по крайней мере) для каждого патогена, который может когда-либо встречаться. Даже в отсутствие стимуляции антигеном человек может продуцировать более 1 триллиона различных молекул антител.[4] Для хранения генетической информации, которая производит эти рецепторы, потребуются миллионы генов, но весь геном человека содержит менее 25000 гены.[22]
Мириады рецепторов производятся с помощью процесса, известного как клональный отбор.[1][2] Согласно теории клонального отбора, при рождении животное случайным образом генерирует огромное разнообразие лимфоцитов (каждый из которых несет уникальный антигенный рецептор) из информации, закодированной в небольшом семействе генов. Чтобы создать каждый уникальный рецептор антигена, эти гены прошли процесс, называемый V (D) J рекомбинация, или комбинаторная диверсификация, в котором один сегмент гена рекомбинирует с другими сегментами гена с образованием единственного уникального гена. Этот процесс сборки генерирует огромное разнообразие рецепторов и антител еще до того, как организм когда-либо сталкивается с антигенами, и позволяет иммунной системе реагировать на почти неограниченное разнообразие антигенов.[2] На протяжении всей жизни животного лимфоциты, которые могут реагировать против антигенов, с которыми оно фактически сталкивается, отбираются для действия, направленного против всего, что экспрессирует этот антиген.
Обратите внимание, что врожденная и приобретенная части иммунной системы работают вместе, а не вопреки друг другу. Приобретенные руки, В и Т-клетки не могли функционировать без врожденной системы. Т-клетки бесполезны без антигенпрезентирующих клеток, которые их активируют, а В-клетки калечат без помощи Т-клеток. С другой стороны, врожденная система, вероятно, была бы переполнена патогенами без специального действия адаптивного иммунного ответа.
Приобретенный иммунитет при беременности
Краеугольным камнем иммунной системы является распознавание «я» и «не-я». Следовательно, механизмы, защищающие человека плод (который считается «чужим») от атаки иммунной системы, особенно интересны. Хотя не появилось исчерпывающего объяснения этого загадочного и часто повторяющегося отсутствия отторжения, две классические причины могут объяснить, как переносится плод. Во-первых, плод занимает часть тела, защищенную неиммунологическим барьером, т.е. матка, которые иммунная система обычно не патрулирует.[2] Во-вторых, сам плод может способствовать местной иммуносупрессии у матери, возможно, в результате процесса активного истощения питательных веществ.[2] Более современное объяснение этой индукции толерантности заключается в том, что определенные гликопротеины экспрессируются в матке во время беременность подавляют иммунный ответ матки (см. ЕС-ФРС ).
Во время беременности в живородящий млекопитающие (все млекопитающие, кроме Монотремы ), эндогенные ретровирусы (ERV) активируются и производятся в больших количествах во время имплантации эмбриона. В настоящее время известно, что они обладают иммуносупрессивными свойствами, что предполагает их роль в защите эмбриона от иммунной системы его матери. Также, вирусные слитые белки вызвать образование плаценты синцитий[23] ограничить обмен мигрирующими клетками между развивающимся эмбрионом и телом матери (что-то эпителий не может сделать достаточно, поскольку некоторые клетки крови специализируются, чтобы вставлять себя между соседними эпителиальными клетками). Иммунодепрессивное действие было исходным нормальным поведением вируса, аналогичным ВИЧ. Слитые белки были способом распространения инфекции на другие клетки путем простого слияния их с инфицированной (ВИЧ тоже). Считается, что предки современных живородящих млекопитающих развились после заражения этим вирусом, что позволило плоду выжить в иммунной системе матери.[24]
В проект генома человека найдено несколько тысяч ERV разделены на 24 семьи.[25]
Теория иммунных сетей
Теоретическая основа, объясняющая работу приобретенной иммунной системы, обеспечивается теория иммунных сетей, основанный на взаимодействии между идиотипы (уникальные молекулярные особенности одного клонотипа, т.е. уникальный набор антигенные детерминанты вариабельной части антитела) и «антиидиотипы» (рецепторы антигена, которые реагируют с идиотипом, как если бы он был чужеродным антигеном). Эта теория, основанная на существующих клональный отбор гипотезы и с 1974 г. Нильс Йерн и Джеффри В. Хоффманн, рассматривается как имеющий отношение к пониманию Патогенез ВИЧ и поиск Вакцина против ВИЧ.
Стимуляция адаптивного иммунитета
Одним из наиболее интересных достижений в биомедицинской науке за последние несколько десятилетий стало выяснение механизмов, опосредующих врожденный иммунитет. Один набор врожденных иммунных механизмов - гуморальный, например: активация комплемента. Другой набор включает рецепторы распознавания образов, такие как толл-подобные рецепторы, которые индуцируют выработку интерферонов и других цитокинов, повышающих устойчивость клеток, таких как моноциты, к инфекциям.[26] Цитокины, продуцируемые во время врожденных иммунных ответов, входят в число активаторов адаптивных иммунных ответов.[26] Антитела оказывают аддитивное или синергетическое действие с механизмами врожденного иммунитета. Нестабильные кластеры HbS Band-3, главный интегральный белок эритроцитов;[27] антитела распознают эти кластеры и ускоряют их удаление фагоцитарными клетками. Кластерные белки Band 3 с прикрепленными антителами активируют комплемент, а фрагменты C3 комплемента представляют собой опсонины, распознаваемые рецептором комплемента CR1 на фагоцитарных клетках.[28]
Популяционное исследование показало, что защитный эффект серповидно-клеточного признака против малярии falciparum включает усиление приобретенного, а также врожденного иммунного ответа на малярийного паразита, что иллюстрирует ожидаемый переход от врожденного иммунитета к приобретенному.[29]
Повторные заражения малярией усиливают приобретенный иммунитет и расширяют его действие против паразитов с различной поверхностью. антигены. К школьному возрасту у большинства детей выработался эффективный адаптивный иммунитет против малярии. Эти наблюдения вызывают вопросы о механизмах, которые способствуют выживанию большинства детей в Африке, позволяя некоторым из них развить потенциально смертельные инфекции.
При малярии, как и при других инфекциях,[26] врожденные иммунные ответы приводят к адаптивным иммунным ответам и стимулируют их. Генетический контроль врожденного и приобретенного иммунитета в настоящее время является обширной и процветающей дисциплиной.
Гуморальные и клеточно-опосредованные иммунные ответы ограничивают размножение малярийных паразитов, и многие цитокины вносят вклад в патогенез малярии, а также в разрешение инфекций.[30]
Эволюция
Приобретенная иммунная система, которая лучше всего изучена у млекопитающих, возникла у челюстей примерно 500 миллионов лет назад. Большинство молекул, клеток, тканей и связанных с ними механизмов этой системы защиты находятся в хрящевые рыбы.[31] Лимфоцит рецепторы Ig и TCR обнаружены у всех позвоночных с челюстями. Самый древний класс Ig, IgM, связывается с мембраной и затем секретируется при стимуляции В-клеток хряща рыб. Другой изотип, IgW акулы, связан с IgD млекопитающих. TCR, как α / β, так и γ / δ, обнаруживаются у всех животных из гнатомы млекопитающим. Организация генных сегментов, которые подвергаются генная перестройка отличается у хрящевых рыб, которые имеют кластерную форму, по сравнению с транслоконной формой у костных рыб для млекопитающих. Подобно TCR и Ig, MHC обнаруживается только у челюстных позвоночных. Гены, участвующие в обработка антигена и презентация, так же хорошо как класс I и класс II гены, тесно связаны в пределах MHC почти всех изученных видов.
Лимфоидные клетки могут быть идентифицированы у некоторых предпозвоночных. дейтеростомы (т.е. морские ежи).[32] Они связывают антиген с рецепторы распознавания образов (PRR) врожденная иммунная система. В бесчелюстные рыбы, два подмножества лимфоциты использовать вариабельные рецепторы лимфоцитов (VLR) для связывания антигена.[33] Разнообразие порождается цитозиндезаминаза -опосредованная перестройка LRR сегменты ДНК.[34] Нет никаких доказательств гены, активирующие рекомбинацию (RAG), которые перестраивают сегменты генов Ig и TCR у челюстных позвоночных.
Считается, что эволюция AIS, основанная на молекулах Ig, TCR и MHC, возникла в результате двух основных эволюционных событий: переноса Тряпка транспозон (возможно вирусного происхождения) и два дупликации всего генома.[31] Хотя молекулы AIS хорошо сохраняются, они также быстро развиваются. Тем не менее, сравнительный подход показывает, что многие признаки довольно однородны для разных таксонов. Все основные особенности АИС возникли рано и быстро. У бесчелюстных рыб есть разные АИС который основан на перестройке генов для генерации различных иммунных рецепторов с функциональной дихотомией, которая аналогична молекулам Ig и TCR.[35] В врожденная иммунная система, который играет важную роль в активации АИС, является важнейшей защитной системой беспозвоночные и растения.
Виды приобретенного иммунитета
Иммунитет может быть приобретен активно или пассивно. Иммунитет приобретается активно, когда человек подвергается воздействию чужеродных веществ и иммунная система реагирует. Пассивный иммунитет - это когда антитела передаются от одного хозяина к другому. Как активно приобретаемый, так и пассивно приобретаемый иммунитет можно получить естественным или искусственным путем.
- Естественно приобретенный активный иммунитет - когда человек естественным образом подвергается воздействию антигенов, заболевает, затем выздоравливает.
- Естественно приобретенный пассивный иммунитет - включает естественный перенос антител от матери к ее младенцу. Антитела проникают через плаценту женщины к плоду. Антитела также могут передаваться через грудное молоко с выделениями молозива.
- Искусственно приобретенный активный иммунитет - проводится вакцинацией (введением мертвого или ослабленного антигена в хозяйскую клетку).
- Искусственно приобретенный пассивный иммунитет - Это предполагает введение в организм человека антител, а не антигенов. Эти антитела получены от животного или человека, который уже невосприимчив к болезни.
| Естественно приобретенный | Искусственно приобретенный |
|---|---|
| Активный - Антиген попадает в организм естественным путем | Активный - Антигены вводятся в вакцины. |
| Пассивный - Антитела передаются от матери к плоду через плаценту или младенца через материнское молоко. | Пассивный - Преформированные антитела в иммунную сыворотку вводятся путем инъекции. |
Смотрите также
- Созревание аффинности
- Исключение аллелей
- Анергия
- Иммунная толерантность
- Иммуносупрессия
- Первородный антигенный грех
- Соматическая гипермутация
- Поликлональный ответ
Примечания и ссылки
- Заметки
- ^ В техническом смысле как врожденная, так и приобретенная иммунные системы являются «адаптивными» в физиологическом и эволюционном смысле, позволяя организму адаптироваться к изменяющимся внешним обстоятельствам (и обе могут быть неадаптивными, если сверхактивны, вызывая патологическое воспаление или аутоиммунитет). Кроме того, патоген-рецепторы механизмов врожденного и приобретенного иммунитета специфичны: специфичность врожденного иммунитета эволюционировала с течением времени в ответ на высококонсервативные молекулярные особенности микробного мира, тогда как специфичность приобретенного иммунитета созревает в каждом организме. По этой причине в целом термин «приобретенный» предпочтительнее «адаптивного» или «специфического».[нужна цитата ]
- использованная литература
- ^ а б c d е ж Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтерс П. (2002). Молекулярная биология клетки (4-е изд.). Нью-Йорк и Лондон: Наука о гирляндах. ISBN 0-8153-3218-1.
- ^ а б c d е ж г час я j k л м п о п q р s т ты v ш Икс y z Джейнвей CA, Трэверс П., Уолпорт М, Шломчик MJ (2001). Иммунобиология (5-е изд.). Нью-Йорк и Лондон: Наука о гирляндах. ISBN 0-8153-4101-6.
- ^ Врожденная и адаптивная иммунные системы. Институт качества и эффективности в здравоохранении (IQWiG). 4 августа 2016 г.
- ^ а б c d е ж г час я j k Джейнвей CA, Трэверс П., Уолпорт М, Шломчик MJ (2005). Иммунобиология (6-е изд.). Наука о гирляндах. ISBN 0-443-07310-4.
- ^ «Электронный учебник микробиологии и иммунологии». Школа медицины Университета Южной Каролины. Архивировано из оригинал 2 сентября 2008 г.
- ^ а б c «Понимание того, как иммунная система работает» (PDF). Публикация NIH № 03-5423. Национальный институт аллергии и инфекционных заболеваний, Национальный институт рака, Министерство здравоохранения и социальных служб США, Национальные институты здравоохранения. Сентябрь 2003 г. Архивировано с оригинал (PDF) на 2007-01-03.
- ^ Спенсер Л.А., Веллер П.Ф. (2010). «Эозинофилы и Th2 иммунитет: современные взгляды». Иммунология и клеточная биология. 88 (3): 250–56. Дои:10.1038 / icb.2009.115. ЧВК 3589820. PMID 20065995.
- ^ Сабо П.А., Левитин Н.М., Мирон М., Снайдер М.Э., Сенда Т., Юань Дж. И др. (Октябрь 2019 г.). «Одноклеточная транскриптомика человеческих Т-клеток выявляет ткани и признаки активации в здоровье и болезни». Nature Communications. 10 (1): 4706. Bibcode:2019НатКо..10.4706S. Дои:10.1038 / s41467-019-12464-3. ЧВК 6797728. PMID 31624246.
- ^ Маген А., Ни Дж., Чуччи Т., Тамутунур С., Чжао Ю., Мехта М. и др. (Декабрь 2019 г.). «+ Т-клетки». Отчеты по ячейкам. 29 (10): 3019–3032.e6. Дои:10.1016 / j.celrep.2019.10.131. ЧВК 6934378. PMID 31801070.
- ^ Вайнштейн Дж. С., Эрнандес С. Г., Крафт Дж. (Май 2012 г.). «Т-клетки, которые способствуют созреванию В-клеток при системном аутоиммунитете». Иммунологические обзоры. 247 (1): 160–71. Дои:10.1111 / j.1600-065x.2012.01122.x. ЧВК 3334351. PMID 22500839.
- ^ Флайник, Мартин Ф. (19 марта 2018 г.). «Хладнокровный взгляд на адаптивный иммунитет». Nature Reviews Иммунология. 18 (7): 438–53. Дои:10.1038 / с41577-018-0003-9. ЧВК 6084782. PMID 29556016.
- ^ Касамацу, июн (январь 2013 г.). «Эволюция врожденной и адаптивной иммунной системы у бесчелюстных позвоночных». Микробиология и иммунология. 57 (1): 1–12. Дои:10.1111 / j.1348-0421.2012.00500.x. ISSN 0385-5600. PMID 22924515.
- ^ Альдер М.Н., Рогозин И.Б., Иер Л.М., Глазко Г.В., Купер М.Д., Пансер З. (декабрь 2005 г.). «Разнообразие и функции адаптивных иммунных рецепторов у безчелюстных позвоночных». Наука. 310 (5756): 1970–73. Bibcode:2005Наука ... 310.1970А. Дои:10.1126 / science.1119420. PMID 16373579.
- ^ Миконранта Л., Маппес Дж., Каукониитти М., Фрейтак Д. (март 2014 г.). «Иммунитет к насекомым: пероральное воздействие бактериального патогена вызывает реакцию свободных радикалов и защищает от рецидивирующей инфекции». Границы зоологии. 11 (1): 23. Дои:10.1186/1742-9994-11-23. ЧВК 3975449. PMID 24602309.
- ^ Садд Б.М., Шмид-Хемпель П. (июнь 2006 г.). «Иммунитет насекомых проявляет специфичность в защите от вторичного воздействия патогенов». Текущая биология. 16 (12): 1206–10. Дои:10.1016 / j.cub.2006.04.047. PMID 16782011. S2CID 14436004.
- ^ Фам Л.Н., Дионн М.С., Ширасу-Хиза М., Шнайдер Д.С. (март 2007 г.). «Специфический примированный иммунный ответ у дрозофилы зависит от фагоцитов». Патогены PLOS. 3 (3): e26. Дои:10.1371 / journal.ppat.0030026. ЧВК 1817657. PMID 17352533.
- ^ Эрнандес Лопес Дж., Шуэли В., Крайльсхайм К., Риссбергер-Галле Ю (июнь 2014 г.). «Трансмиссионный иммунный прайм у пчел». Ход работы. Биологические науки. 281 (1785): 20140454. Дои:10.1098 / rspb.2014.0454. ЧВК 4024302. PMID 24789904.
- ^ Рот О, Юп Дж., Эггерт Х., Гильберт Дж., Даниэль Дж., Шмид-Хемпель П., Курц Дж. (Март 2010 г.). «Отцовский иммунный прайм для потомства красного мучного жука Tribolium castaneum». Журнал экологии животных. 79 (2): 403–13. Дои:10.1111 / j.1365-2656.2009.01617.x. PMID 19840170.
- ^ а б Донг Й., Тейлор Х.Э., Димопулос Дж. (Июль 2006 г.). «AgDscam, гипервариабельный рецептор иммуноглобулинового домена врожденной иммунной системы Anopheles gambiae». PLOS Биология. 4 (7): e229. Дои:10.1371 / journal.pbio.0040229. ЧВК 1479700. PMID 16774454.
- ^ Меки И.К., Кариити Х.М., Parker AG, Врейсен М.Дж., Рос В.И., Влак Дж.М., ван Оерс М.М., Абд-Алла А.М. (ноябрь 2018 г.). «Противовирусный иммунный ответ на основе РНК-интерференции против вируса гипертрофии слюнных желез у Glossina pallidipes». BMC Microbiology. 18 (Приложение 1): 170. Дои:10.1186 / s12866-018-1298-1. ЧВК 6251114. PMID 30470195.
- ^ Rubio M, Maestro JL, Piulachs MD, Belles X (июнь 2018 г.). «Консервированная ассоциация белков Argonaute 1 и 2 с путями миРНК и миРНК на протяжении всей эволюции насекомых, от тараканов до мух». Biochimica et Biophysica Acta (BBA) - механизмы регуляции генов. 1861 (6): 554–60. Дои:10.1016 / j.bbagrm.2018.04.001. HDL:10261/168051. PMID 29656113.
- ^ Международный консорциум по секвенированию генома человека (октябрь 2004 г.). «Завершение эухроматической последовательности генома человека». Природа. 431 (7011): 931–45. Bibcode:2004Натура.431..931H. Дои:10.1038 / природа03001. PMID 15496913.
- ^ Ми С., Ли Икс, Ли Икс, Велдман GM, Финнерти Х, Рэйси Л., ЛаВалли Э, Тан XY, Эдуард П., Хоус С., Кейт Дж. С., Маккой Дж. М. (февраль 2000 г.). «Синцитин - это белок неволей ретровирусной оболочки, участвующий в морфогенезе плаценты человека». Природа. 403 (6771): 785–89. Bibcode:2000Натура 403..785М. Дои:10.1038/35001608. PMID 10693809. S2CID 4367889.
- ^ Вильярреал LP. «Вирусы, которые делают нас: роль эндогенного ретровируса в эволюции видов плаценты». Калифорнийский университет в Ирвине (конспект лекций). Архивировано из оригинал на 2007-07-15. Получено 2008-02-03.
- ^ Вильярреал LP (октябрь 2001 г.). «Сохраняющиеся вирусы могут сыграть роль в развитии хоста». Новости ASM. Архивировано из оригинал на 2009-05-08.
- ^ а б c Уэмацу С., Акира С. (май 2007 г.). «Толл-подобные рецепторы и интерфероны I типа». Журнал биологической химии. 282 (21): 15319–23. Дои:10.1074 / jbc.R700009200. PMID 17395581.
- ^ Куросс С.А., Ранг BH, Хеббель Р.П. (апрель 1988 г.). «Избыток гема в мембранах серповидных эритроцитов наизнанку: возможная роль в окислении тиолов» (PDF). Кровь. 71 (4): 876–82. Дои:10.1182 / кровь.V71.4.876.876. PMID 3355895.
- ^ Арезе П., Туррини Ф., Шварцер Э. (2005). «Полоса 3 / опосредованное комплементом распознавание и удаление нормально стареющих и патологических эритроцитов человека». Клеточная физиология и биохимия. 16 (4–6): 133–46. Дои:10.1159/000089839. PMID 16301814.
- ^ Уильямс Т.Н., Мванги Т.В., Робертс Диджей, Александр Н.Д., Уэтеролл Диджей, Вамбуа С., Корток М., Сноу РВ, Марш К. (май 2005 г.). «Иммунная основа защиты от малярии за счет серповидноклеточного признака». PLOS Медицина. 2 (5): e128. Дои:10.1371 / journal.pmed.0020128. ЧВК 1140945. PMID 15916466.
- ^ Скофилд Л., Грау Г.Е. (сентябрь 2005 г.). «Иммунологические процессы в патогенезе малярии». Обзоры природы. Иммунология. 5 (9): 722–35. Дои:10.1038 / nri1686. PMID 16138104. S2CID 19594405.
- ^ а б Флайник М.Ф., Касахара М. (январь 2010 г.). «Происхождение и эволюция адаптивной иммунной системы: генетические события и давление отбора». Обзоры природы. Генетика. 11 (1): 47–59. Дои:10.1038 / nrg2703. ЧВК 3805090. PMID 19997068.
- ^ Хибино Т., Лоза-Колл М., Мессье К., Мажеске А.Дж., Коэн А.Х., Тервиллигер Д.П., Бакли К.М., Броктон В., Наир С.В., Берни К., Фугманн С.Д., Андерсон М.К., Пансер З., Кэмерон Р.А., Смит Л.К., Раст Дж. Декабрь 2006 г.). «Репертуар иммунных генов, закодированных в геноме пурпурного морского ежа» (PDF). Биология развития. 300 (1): 349–65. Дои:10.1016 / j.ydbio.2006.08.065. PMID 17027739.
- ^ Pancer Z, Amemiya CT, Ehrhardt GR, Ceitlin J, Gartland GL, Cooper MD (июль 2004 г.). «Соматическая диверсификация вариабельных рецепторов лимфоцитов у агнатановой морской миноги» (PDF). Природа. 430 (6996): 174–80. Bibcode:2004Натура430..174П. Дои:10.1038 / природа02740. HDL:2027.42/62870. PMID 15241406. S2CID 876413.
- ^ Рогозин И.Б., Иер Л.М., Лян Л., Глазко Г.В., Листон В.Г., Павлов Ю.И., Аравинд Л., Пансер З. (июнь 2007 г.). «Эволюция и диверсификация рецепторов антигенов миноги: доказательства участия цитозиндезаминазы семейства AID-APOBEC». Иммунология природы. 8 (6): 647–56. Дои:10.1038 / ni1463. PMID 17468760. S2CID 3658963.
- ^ Бём Т. (май 2011 г.). «Принципы построения адаптивных иммунных систем». Обзоры природы. Иммунология. 11 (5): 307–17. Дои:10.1038 / nri2944. PMID 21475308. S2CID 25989912.
