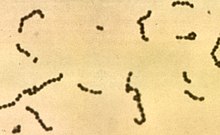Стрептококк - Streptococcus
Стрептококк это род из грамположительный кокк (множественное число кокки ) или сферические бактерии, принадлежащие к семейству Streptococcaceae, в порядке Лактобациллы (молочнокислые бактерии), в типе Фирмикуты.[2] Деление клеток у стрептококков происходит по одному ось, поэтому по мере роста они имеют тенденцию образовывать пары или цепочки, которые могут казаться изогнутыми или скрученными. Это отличается от стафилококки, которые делятся по нескольким осям, образуя неправильные гроздья, похожие на виноград. клетки. Большинство стрептококков оксидаза-отрицательный и каталаза-отрицательный, и многие из них факультативные анаэробы (способен расти как в аэробных, так и в анаэробных условиях).
Термин был придуман в 1877 году венским хирургом. Альберт Теодор Бильрот (1829–1894),[3] сочетанием приставки "strepto-" (от Древнегреческий: στρεπτός, романизированный: Streptós, горит "легко скручивается, податливый"[4]) вместе с суффиксом «-coccus» (от Modern латинский: кокк, с древнегреческого: κόκκος, романизированный:коккос, горит «зерно, семя, ягода».[5]) В 1984 г. многие бактерии, ранее входившие в род Стрептококк были выделены в роды Энтерококк и Лактококк.[6] В настоящее время насчитывается более 50 видов этого рода. Было обнаружено, что этот род является частью микробиом слюны.[7]
Патогенез и классификация
В добавление к стрептококковый фарингит (стрептококковое горло), определенные Стрептококк виды ответственны за многие случаи розовый глаз,[8] менингит, бактериальная пневмония, эндокардит, рожа, и некротический фасциит (бактериальные инфекции, поедающие плоть). Однако многие виды стрептококков не являются патогенными и входят в состав комменсальный человек микробиота полости рта, кожи, кишечника и верхних дыхательных путей. Стрептококки также являются необходимым ингредиентом при производстве Эмменталер («Швейцарский») сыр.
Виды Стрептококк классифицируются на основе их гемолитический характеристики.[9] Альфа-гемолитические формы вызывают окисление железа в гемоглобин молекулы в красных кровяных тельцах, придавая им зеленоватый цвет на кровяном агаре. Бета-гемолитические виды вызывают полный разрыв красных кровяных телец. На кровяном агаре это выглядит как обширные области, свободные от клеток крови, окружающие колонии бактерий. Гамма-гемолитические виды не вызывают гемолиза.
Бета-гемолитические стрептококки далее классифицируются по Лэнсфилд группировка, а серотип классификация (то есть описание конкретных углеводов, присутствующих на стенке бактериальной клетки).[6] 21 описанный серотип назван группами Lancefield от A до W (за исключением I и J). Эта система классификации была разработана Ребекка Лэнсфилд, ученый из Рокфеллеровский университет.
В медицине наиболее важными группами являются альфа-гемолитические стрептококки. S. pneumoniae и Стрептококк вириданс группа, и бета-гемолитические стрептококки групп А и В Лансфилда (также известные как «стрептококки группы А» и «стрептококки группы В»).
Таблица: Стрептококки, имеющие отношение к медицине (не все альфа-гемолитики)[9]
| Разновидность | Хозяин | Болезнь |
| S. pyogenes | человек | фарингит, целлюлит, рожа |
| S. agalactiae | человек, крупный рогатый скот | неонатальный менингит и сепсис |
| С. dysgalactiae | человек, животные | эндокардит, бактериемия, пневмония, менингит, респираторные инфекции |
| S. gallolyticus | человек, животные | желчный или инфекция мочеиспускательного канала, эндокардит |
| S. anginosus | человек, животные | подкожный / орган абсцессы, менингит, респираторные инфекции |
| S. sanguinis | человек | эндокардит, кариес |
| S. suis | свинья | менингит |
| С. митис | человек | эндокардит |
| S. mutans | человек | кариес |
| S. pneumoniae | человек | пневмония |
Альфа-гемолитический
Когда присутствует альфа-гемолиз (альфа-гемолиз), агар под колонией будет темным и зеленоватым из-за превращения гемоглобина в зеленый. биливердин. Пневмококк и группа оральных стрептококков (Streptococcus viridans или viridans streptococci) проявляют альфа-гемолиз. Альфа-гемолиз также называют неполным гемолизом или частичным гемолизом, поскольку клеточные мембраны эритроцитов остаются нетронутыми. Это также иногда называют зеленым гемолизом из-за изменения цвета агара.
Пневмококки
- S. pneumoniae (иногда называемый пневмококком), является основной причиной бактериального пневмония и нерегулярной этиологии средний отит, синусит, менингит, и перитонит. Воспаление считается основной причиной того, как пневмококки вызывают заболевание, отсюда и тенденция диагнозов, связанных с ними, включать воспаление.
Группа viridans: альфа-гемолитики
- В стрептококки viridans большая группа комменсальный бактерии, которые либо альфа-гемолитический, вызывая зеленую окраску крови чашки с агаром (отсюда и название «viridans», от латинского vĭrĭdis, зеленый), или негемолитический. У них нет антигенов Лэнсфилда.[2]
Бета-гемолитический
Бета-гемолиз (β-гемолиз), иногда называемый полным гемолизом, представляет собой полный лизис эритроцитов в среде вокруг и под колониями: область становится светлой (желтой) и прозрачной. Стрептолизин, экзотоксин, представляет собой фермент, вырабатываемый бактериями, который вызывает полный лизис красных кровяных телец. Существует два типа стрептолизина: стрептолизин O (SLO) и стрептолизин S (SLS). Стрептолизин O - это чувствительный к кислороду цитотоксин, секретируемый большинством групп А Стрептококк (ГАЗ) и взаимодействует с холестерином в мембране эукариотических клеток (в основном красных и белых кровяных телец, макрофагов и тромбоцитов) и обычно приводит к бета-гемолизу под поверхностью кровяного агара. Стрептолизин S представляет собой устойчивый к кислороду цитотоксин, который также продуцируется большинством штаммов ГАЗ, что приводит к очищению поверхности кровяного агара. SLS влияет на иммунные клетки, включая полиморфно-ядерные лейкоциты и лимфоциты, и, как полагают, предотвращает избавление иммунной системы хозяина от инфекции. Streptococcus pyogenes, или ГАЗ, показывает бета-гемолиз.
Некоторые слабо бета-гемолитические виды вызывают интенсивный гемолиз при совместном выращивании со штаммом Стафилококк. Это называется тестом CAMP. Streptococcus agalactiae отображает это свойство. Clostridium perfringens можно предположительно идентифицировать с помощью этого теста. Listeria monocytogenes также положительный на агаре с овечьей кровью.

Группа А
Группа А S. pyogenes является возбудителем в широком диапазоне стрептококковые инфекции группы А (ГАЗ). Эти инфекции может быть неинвазивным или инвазивным. Неинвазивные инфекции обычно встречаются чаще и менее серьезны. Наиболее распространенные из этих инфекций включают: стрептококковый фарингит (стрептококковое горло) и импетиго.[10] Скарлатина также является неинвазивной инфекцией, но в последние годы не так распространен.
Инвазивные инфекции, вызываемые бета-гемолитическими стрептококками группы А, имеют тенденцию быть более тяжелыми и менее распространенными. Это происходит, когда бактерия может заразить участки, где она обычно не встречается, например, кровь и органы.[11] Заболевания, которые могут быть вызваны, включают стрептококковые инфекции. синдром токсического шока, некротический фасциит, пневмония, и бактериемия.[10] По оценкам, во всем мире ГАЗ является причиной более 500 000 смертей ежегодно, что делает его одним из ведущих в мире. патогены.[10]
Дополнительные осложнения могут быть вызваны ГАЗ, а именно острые ревматическая лихорадка и острый гломерулонефрит. Ревматическая лихорадка, заболевание, поражающее суставы, почки, и сердечные клапаны, является следствием нелеченой инфекции стрептококка A, вызванной не самой бактерией. Ревматическая лихорадка вызывается антителами, вырабатываемыми иммунной системой для борьбы с инфекцией, которые перекрестно реагируют с другими белками в организме. Эта «перекрестная реакция» заставляет тело атаковать себя и приводит к вышеуказанным повреждениям. Похожий аутоиммунный механизм, инициированный Бета-гемолитическая стрептококковая инфекция группы А (БГСА) предполагается, чтобы вызвать детские аутоиммунные нервно-психические расстройства, связанные со стрептококковыми инфекциями (PANDAS), при этом аутоиммунные антитела воздействуют на базальные ганглии, вызывая быстрое появление психических, моторных, сонных и других симптомов у педиатрических пациентов.
GAS-инфекция обычно диагностируется экспресс-тест на стрептококк или по культуре.
Группа B
S. agalactiae, или группа B стрептококк, GBS, вызывает пневмонию и менингит у новорожденные и пожилой, с редкими системными бактериемия. Важно отметить, что Streptococcus agalactiae является наиболее частой причиной менингита у младенцы от одного месяца до трех месяцев. Они также могут колонизировать кишечник и женские половые пути, увеличивая риск преждевременных родов. разрыв плодных оболочек во время беременности и коробка передач организма младенцу. В Американский колледж акушеров и гинекологов, Американская академия педиатрии, а Центры по контролю за заболеваниями рекомендуют всем беременным женщинам на сроке от 35 до 37 недель пройти тестирование на СГБ. Женщинам с положительным результатом теста следует назначать профилактические антибиотики во время родов, которые обычно предотвращают передачу инфекции младенцу.[12]
Соединенное Королевство решило принять протокол, основанный на факторах риска, а не протокол, основанный на культуре, как в США.[13] В текущих руководствах указано, что при наличии одного или нескольких из следующих факторов риска женщину следует лечить: во время родов антибиотики:
- Преждевременные роды (<37 недель)
- Длительный разрыв плодных оболочек (> 18 часов)
- Внутриродовая лихорадка (≥38 ° C)
- История болезни СГБ у предыдущего ребенка
- GBS бактериурия во время этой беременности
Этот протокол приводит к назначению антибиотиков во время родов 15–20% беременных женщин и предотвращению 65–70% случаев раннего сепсиса СГБ.[14]
Группа C
В эту группу входят S. equi, что приводит к душит в лошадях,[15] и S. zooepidemicus —S. equi это клональный потомок или биовар предков S. zooepidemicus—Который вызывает инфекции у нескольких видов млекопитающих, включая крупный рогатый скот и лошадей. С. dysgalactiae[противоречивый ] также является членом группы C, бета-гемолитические стрептококки это может вызвать фарингит и другие пиогенный инфекции, подобные стрептококки группы А.
Группа D (энтерококки)
Многие бывшие стрептококки группы D были реклассифицированы и помещены в род Энтерококк (включая E. faecalis, E. faecium, E. durans, и E. avium).[16] Например, Streptococcus faecalis сейчас Enterococcus faecalis. E. faecalis иногда является альфа-гемолитическим и E. faecium иногда является бета-гемолитическим.[17]
Остальные неэнтерококковые штаммы группы D включают: Streptococcus gallolyticus, Streptococcus bovis и Стрептококк эквинус.
Негемолитические стрептококки вызывают заболевание редко. Однако слабогемолитические бета-гемолитические стрептококки группы D и Listeria monocytogenes (что на самом деле грамположительный bacillus) не следует путать с негемолитическими стрептококками.
Стрептококки группы F
Стрептококки группы F были впервые описаны в 1934 г. Лонгом и блаженство среди «мелких гемолитических стрептококков».[18] Они также известны как Streptococcus anginosus (согласно системе классификации Лэнсфилда) или как члены S. milleri группа (по европейской системе).
Стрептококки группы G
Эти стрептококки обычно, но не исключительно, являются бета-гемолитиками. Streptococcus dysgalactiae[противоречивый ] является преобладающим видом, особенно при заболеваниях человека. S. canis является примером GGS, который обычно встречается у животных, но может вызывать инфекцию у людей. S. phocae это подвид GGS, который был обнаружен у морских млекопитающих и морских рыб. У морских млекопитающих это в основном связано с менингоэнцефалит, сепсис, и эндокардит, но также связан со многими другими патологиями. Его природный резервуар и способы передачи у морских млекопитающих недостаточно изучены.
Стрептококки группы H
Стрептококки группы H вызывают инфекции у собак среднего размера. Стрептококки группы H редко вызывают заболевание, если человек не имеет прямого контакта со ртом собаки. Один из наиболее распространенных способов распространения - это контакт человека с собакой изо рта в рот. Однако собака может лизать руку человека, и инфекция также может распространяться.[19]
Молекулярная таксономия и филогенетика

Стрептококки были разделены на шесть групп на основе их 16S Последовательности рДНК: S. anginosus, S. gallolyticus, S. mitis, S. mutans, S. pyogenes и S. salivarius.[21] Группы 16S были подтверждены секвенированием всего генома (см. Рисунок). Важные патогены S. pneumoniae и S. pyogenes принадлежат к С. митис и S. pyogenes группы соответственно,[22] в то время как возбудитель кариес, Streptococcus mutans, базальна к Стрептококк группа.
Геномика

Секвенированы геномы сотен видов.[24] Наиболее Стрептококк геномы имеют размер от 1,8 до 2,3 Мбайт и кодируют от 1700 до 2300 белков. Некоторые важные геномы перечислены в таблице.[25] Четыре вида, представленные в таблице (S. pyogenes, S. agalactiae, S. pneumoniae, и S. mutans) имеют среднюю идентичность попарной белковой последовательности около 70%.[25]
| особенность | S. pyogenes | S. agalactiae | S. pneumoniae | S. mutans |
|---|---|---|---|---|
| пар оснований | 1,852,442 | 2,211,488 | 2,160,837 | 2,030,921 |
| ORF | 1792 | 2118 | 2236 | 1963 |
| профаги | да | нет | нет | нет |
Бактериофаг
Бактериофаги были описаны для многих видов Стрептококк. 18 профаги были описаны в S. pneumoniae которые имеют размер от 38 до 41 т.п.н., кодируя от 42 до 66 генов каждый.[нужна цитата ] Некоторые из первых Стрептококк обнаружены фаги Dp-1[26][27]и ω1 (псевдоним ω-1).[28][29][30]В 1981 году Cp (фаг Complutense 1, официально Вирус стрептококка Cp1, Picovirinae ) было обнаружено с Cp-1 в качестве первого члена.[31] Dp-1 и Cp-1 заражают оба S. pneumoniae и S. mitis.[32] Однако диапазон хостов большинства Стрептококк фаги систематически не исследовались.
Естественная генетическая трансформация
Естественная генетическая трансформация включает передачу ДНК от одной бактерии к другой через окружающую среду. Трансформация - это сложный процесс, зависящий от экспрессии множества генов. Чтобы быть способной к трансформации, бактерия должна войти в особое физиологическое состояние, называемое компетентность. S. pneumoniae, S. mitis и С. оралис могут стать компетентными и в результате активно приобретать гомологичную ДНК для трансформации по хищническому братоубийственному механизму [33] Этот братоубийственный механизм в основном использует некомпетентных братьев и сестер, находящихся в той же нише. [34] Среди высококомпетентных изолятов S. pneumoniae, Ли и др.[35] показали, что приспособленность к назальной колонизации и вирулентность (инфекционность легких) зависят от целостной системы компетентности. Компетенция может позволить стрептококковому патогену использовать внешнюю гомологичную ДНК для рекомбинационной репарации повреждений ДНК, вызванных окислительной атакой хозяина.[36]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае аф аг ах ай эй ак аль являюсь ан ао ap водный ар в качестве в au средний ау топор ай az ба bb до н.э bd быть парень bg бх би Ъ bk бл бм млрд бо бп бк br bs bt Parte, A.C. «Стрептококк». LPSN.
- ^ а б Райан К.Дж., Рэй К.Г., ред. (2004). Шеррис Медицинская микробиология (4-е изд.). Макгроу Хилл. стр.293 –4. ISBN 978-0-8385-8529-0.
- ^ «стрептококк». Интернет-словарь этимологии. Получено 25 июля 2018.
- ^ στρεπτός в Лидделл, Генри Джордж; Скотт, Роберт (1940) Греко-английский лексикон, исправлено и дополнено Джонс, сэр Генри Стюарт, с помощью Маккензи, Родерик. Оксфорд: Clarendon Press. в Цифровая библиотека Персея, Университет Тафтса.
- ^ κόκκος в Liddell и Скотт
- ^ а б Facklam R (октябрь 2002 г.). «Что случилось со стрептококками: обзор таксономических и номенклатурных изменений». Clin. Microbiol. Rev. 15 (4): 613–30. Дои:10.1128 / CMR.15.4.613-630.2002. ЧВК 126867. PMID 12364372.
- ^ Ван, Кун; Лу, Вэньсинь; Ту, Цичао; Ге, Ичэнь; Он, Цзиньчжи; Чжоу, Ю; Гоу, Япин; Ностранд, Джой Д Ван; Цинь, Юйцзя; Ли, Цзяо; Чжоу, Цзичжун; Ли, Ян; Сяо, Лиин; Чжоу Сюэдун (10 марта 2016 г.). «Предварительный анализ микробиома слюны и их потенциальной роли в развитии красного плоского лишая». Научные отчеты. 6 (1): 22943. Bibcode:2016НатСР ... 622943W. Дои:10.1038 / srep22943. ЧВК 4785528. PMID 26961389.
- ^ «Как избавиться от конъюнктивита, симптомы, лечение, причины и изображения».
- ^ а б Паттерсон MJ (1996). Барон С; и другие. (ред.). Стрептококк. В: Медицинская микробиология Барона (4-е изд.). Univ Техасского медицинского отделения. ISBN 978-0-9631172-1-2. (через книжную полку NCBI).
- ^ а б c Коэн-Порадосу Р., Каспер Д.Л. (2007). «Эпидемиология стрептококка группы А и последствия вакцины». Clin. Заразить. Дис. 45 (7): 863–5. Дои:10.1086/521263. PMID 17806050.
- ^ «Стрептококковые инфекции (инвазивные стрептококки группы А)». Департамент здравоохранения и психической гигиены г. Нью-Йорка. Получено 21 ноября 2012.
- ^ Шраг С., Горвиц Р., Фульц-Баттс К., Шухат А. (2002). «Профилактика перинатального стрептококкового заболевания группы B. Пересмотренное руководство CDC». MMWR Recomm Rep. 51 (RR-11): 1–22. PMID 12211284.
- ^ Hughes, RG; Brocklehurst, P; Стир, ПиДжей; Хит, П; Стенсон, Б.М. (ноябрь 2017 г.). «Профилактика стрептококковой инфекции группы B с ранним началом у новорожденных. Рекомендация № 36». BJOG. 124 (12): e280 – e305. Дои:10.1111/1471-0528.14821. PMID 28901693.
- ^ Norwitz, E.R .; Шорге, Дж. (2013). Краткий обзор акушерства и гинекологии (4-е изд.). Чичестер: John Wiley & Sons, Ltd. ISBN 978-1118341735.
- ^ Харрингтон DJ, Sutcliffe IC, Chanter N (2002). «Молекулярные основы инфекции и болезни Streptococcus equi». Микробы заражают. 4 (4): 501–10. Дои:10.1016 / S1286-4579 (02) 01565-4. PMID 11932201.
- ^ Кёлер В. (июнь 2007 г.). «Современное состояние видов в пределах родов Streptococcus и Enterococcus». Международный журнал медицинской микробиологии. 297 (3): 133–50. Дои:10.1016 / j.ijmm.2006.11.008. PMID 17400023.
- ^ Holt et al. (1994). Руководство Берджи по детерминантной бактериологии (9-е изд.). Липпинкотт Уильямс и Уилкинс. ISBN 0-683-00603-7
- ^ Уитворт Дж. М. (ноябрь 1990 г.). «Lancefield группа F и родственные стрептококки» (PDF). J. Med. Микробиол. 33 (3): 135–51. Дои:10.1099/00222615-33-3-135. PMID 2250284.
- ^ «Бактериальная инфекция (стрептококк) у собак». petmd.com. Получено 12 декабря 2014.
- ^ «Бактерии-Firmicutes-Bacilli-Lactobacillales-Streptococcaceae-Streptococcus». ПАТРИК, Чикагский университет. Получено 12 декабря 2014.
- ^ Кавамура Y, Хоу XG, Султана Ф, Миура Х, Эзаки Т (1995). «Определение последовательностей 16S рРНК Стрептококковый митит и Streptococcus gordonii и филогенетические отношения между членами рода Стрептококк". Int J Syst Bacteriol. 45 (2): 406–408. Дои:10.1099/00207713-45-2-406. PMID 7537076.
- ^ Лю Д., Молекулярное обнаружение бактериальных патогенов человека (Бока-Ратон: CRC Press, 2011), п. 324.
- ^ Сюй, П; Alves, J.M .; Котенок, Т; Браун, А; Чен, Z; Ozaki, L. S .; Manque, P; Ge, X; Серрано, М. Г .; Puiu, D; Хендрикс, S; Ван, Y; Чаплин, М. Д .; Акан, Д; Paik, S; Петерсон, Д. Л .; MacRina, F. L .; Бак, Г. А. (2007). «Геном условно-патогенного микроорганизма Streptococcus sanguinis». Журнал бактериологии. 189 (8): 3166–75. Дои:10.1128 / JB.01808-06. ЧВК 1855836. PMID 17277061.
- ^ Стрептококк геномы и связанную информацию на ПАТРИК
- ^ а б Ферретти Дж. Дж., Аждич Д., МакШан В. М. (2004). «Сравнительная геномика видов стрептококков». Индийский журнал медицинских исследований. 119 Дополнение: 1–6. PMID 15232152.
- ^ McDonnell M, Ronda C, Tomasz A (1975) «Диплофаг»: бактериофаг Diplococcus pneumoniae. Вирусология 63: 577–582
- ^ NCBI: Стрептококковый фаг Dp-1 (разновидность)
- ^ Tiraby JG, Tiraby E, Fox MS (декабрь 1975 г.) Пневмококковые бактериофаги. Вирусология 68: 566–569. DOI: 10.1016 / 0042-6822 (75) 90300-1. PMID 844
- ^ Лопес Р. (2004). «Streptococcus pneumoniae и его бактериофаги: один длинный аргумент». Int. Микробиол. 7 (3): 163–71. PMID 15492930. PDF через веб-архив (9 августа 2017 г.)
- ^ Рубенс Лопес, Эрнесто Гарсия: Последние тенденции в молекулярной биологии пневмококковых капсул, литических ферментов и бактериофагов, Oxford Academic FEMS Microbiology Reviews. Том 28, Выпуск 5. 1 ноября 2004 г., стр. 554–580, DOI: 10.1016 / j.femsre.2004.05.002 (Бесплатный полный текст)
- ^ Ронда С., Лопес Р., Гарсия Э. (1981). «Выделение и характеристика нового бактериофага Cp-1, заражающего Streptococcus pneumoniae». Дж. Вирол. 40 (2): 551–9. Дои:10.1128 / JVI.40.2.551-559.1981. ЧВК 256658. PMID 6275103.
- ^ Оуэннан С., Лепрохон П., Мойно С. (2015). «Различные вирулентные пневмофаги заражают Streptococcus mitis». PLOS ONE. 10 (2): e0118807. Bibcode:2015PLoSO..1018807O. Дои:10.1371 / journal.pone.0118807. ЧВК 4334900. PMID 25692983.
- ^ Johnsborg O, Eldholm V, Bjørnstad ML, Håvarstein LS (2008). «Хищный механизм резко увеличивает эффективность латерального переноса генов у Streptococcus pneumoniae и родственных комменсальных видов». Мол. Микробиол. 69 (1): 245–53. Дои:10.1111 / j.1365-2958.2008.06288.x. PMID 18485065. S2CID 30923996.
- ^ Claverys JP, Håvarstein LS (2007). «Каннибализм и братоубийство: механизмы и причины существования». Nat. Rev. Microbiol. 5 (3): 219–29. Дои:10.1038 / nrmicro1613. PMID 17277796. S2CID 35433490.
- ^ Ли Г, Лян З, Ван Х, Ян И, Шао З, Ли М, Ма И, Цю Ф, Моррисон Д. А., Чжан Дж. Р. (2016). «Пристрастие гипертрансформируемых изолятов пневмококков к естественной трансформации для пригодности и вирулентности in vivo». Заразить. Иммунная. 84 (6): 1887–901. Дои:10.1128 / IAI.00097-16. ЧВК 4907133. PMID 27068094.
- ^ Мичод Р. Э., Бернштейн Х, Неделку А. М. (2008). «Адаптивное значение секса у микробных патогенов». Заразить. Genet. Evol. 8 (3): 267–85. Дои:10.1016 / j.meegid.2008.01.002. PMID 18295550.
внешняя ссылка
- Стрептококк геномы и связанную информацию на ПАТРИК Ресурсный центр по биоинформатике, финансируемый НИАИД
- Центры профилактики заболеваний (CDC) (март 2000 г.). «Принятие рекомендаций по профилактике перинатальных стрептококковых заболеваний группы B поставщиками дородовой помощи - Коннектикут и Миннесота, 1998». MMWR Morb. Смертный. Wkly. Представитель. 49 (11): 228–32. PMID 10763673.
- Канадский фонд Strep B
- Великобритания Поддержка Strep группы B благотворительность
- Вдохновленные природой открытия ферментов CRISPR значительно расширяют возможности редактирования генома . На сайте: SciTechDaily. 16 июня 2020 г. Источник: Media Lab, Массачусетский технологический институт.