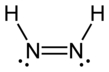Диимид - Diimide
| |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Диазин | |||
| Другие имена Диимид Diimine | |||
| Идентификаторы | |||
| |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| КЕГГ | |||
| MeSH | Диазин | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Свойства | |||
| ЧАС2N2 | |||
| Молярная масса | 30.030 г · моль−1 | ||
| Внешность | Желтый газ | ||
| Температура плавления | -80 ° С (-112 ° F, 193 К) | ||
| Родственные соединения | |||
Другой анионы | дифосфен дифторид диазота | ||
Другой катионы | азосоединения | ||
Связанный двоичный азаны | аммиак диазан триазан | ||
Родственные соединения | изодиазен триазен тетразен | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
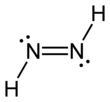
Диимид, также называется диазен или диимин, представляет собой соединение формулы (NH)2. Он существует как два геометрические изомеры, E (транс) и Z (СНГ). Термин диазен чаще используется для органических производных диимида. Таким образом, азобензол является примером органического диазена.
Синтез
Традиционный способ получения диимида включает окисление гидразин перекисью водорода или воздухом.[1] Альтернативно декарбоксилирование азодикарбоновая кислота дает диимид:[2]
- (NCOOH)2 → (NH)2 + 2 СО2
В настоящее время диимид получают путем термического разложения 2,4,6-триизопропилбензолсульфонилгидразида.[3]
Из-за его нестабильности диимид образуется и используется на месте. Смесь обоих СНГ (Z-) и транс (E-) изомеры. Оба изомера нестабильны и претерпевают медленное взаимопревращение. В транс изомер более устойчив, но СНГ изомер - это тот, который реагирует с ненасыщенными субстратами, поэтому равновесие между ними смещается в сторону СНГ изомер из-за Принцип Ле Шателье. Некоторые процедуры требуют добавления карбоновых кислот, которые катализируют цис-транс-изомеризацию.[4] Диимид легко разлагается. Даже при низких температурах более стабильный транс изомер быстро претерпевает различные реакции диспропорционирования, в первую очередь с образованием гидразин и газообразный азот:[5]
- 2 HN = NH → H2N – NH2 + N2
Из-за этой конкурирующей реакции разложения для восстановления диимидом обычно требуется большой избыток реагента-предшественника.
Приложения к органическому синтезу
Диимид иногда используется в качестве реагента в органический синтез.[4] Он гидрирует алкены и алкины с селективной доставкой водорода с одной стороны субстрата, что приводит к той же стереоселективности, что и при катализе металлами. син добавление H2. Единственный побочный продукт - это азот. Хотя этот способ является громоздким, использование диимида позволяет избежать необходимости использования высоких давлений или использования газообразного водорода и металлических катализаторов, которые могут быть дорогими.[6] В механизме гидрирования участвует шестичленный C2ЧАС2N2 переходное состояние:
Селективность
Диимид полезен, потому что он избирательно восстанавливает алкены и алкины и не реагирует со многими функциональные группы это будет мешать нормальному каталитическое гидрирование. Таким образом, перекиси, алкилгалогениды, и тиолы допускаются диимидом, но эти же группы обычно разлагаются металлическими катализаторами. Реагент предпочтительно восстанавливает алкины и беспрепятственные или напряженные алкены.[1] к соответствующим алкенам и алканам.[4]
Связанный
В дикатионный форма, HNNH2+ (дипротонированный диазот), по расчетам, имеет самую прочную химическую связь из известных. Этот ион можно рассматривать как дважды протонированную молекулу азота. В относительный порядок прочности связи (RBSO) составляет 3,38.[7] FNNH2+ и FNNF2+ имеют несколько более низкую прочность связи.[7]
использованная литература
- ^ а б Оно, М .; Окамото, М. (1973). «цис-циклододецен». Органический синтез.; Коллективный объем, 5, п. 281
- ^ Wiberg, E .; Холлеман, А. Ф. (2001). "1.2.7: Диимин, N2ЧАС2". Неорганическая химия. Эльзевир. п. 628. ISBN 9780123526519.
- ^ Чемберлин, А. Ричард; Шеппек, Джеймс Э .; Сомоса, Альваро (2008). «2,4,6-Триизопропилбензолсульфонилгидразид». Энциклопедия реагентов для органического синтеза. Дои:10.1002 / 047084289X.rt259.pub2. ISBN 978-0471936237.
- ^ а б c Пасто, Д. Дж. (2001). «Диимиде». Энциклопедия реагентов для органического синтеза. Джон Вили и сыновья. Дои:10.1002 / 047084289X.rd235.
- ^ Виберг, Нильс; Холлеман, А. Ф .; Виберг, Эгон, ред. (2001). "1.2.7 Diimine N2ЧАС2 [1.13.17]". Неорганическая химия. Академическая пресса. С. 628–632. ISBN 978-0123526519.
- ^ Миллер, К. Э. (1965). «Гидрирование диимидом». Журнал химического образования. 42 (5): 254–259. Дои:10.1021 / ed042p254.
- ^ а б Калески, Роберт; Крака, Эльфи; Кремер, Дитер (12 сентября 2013 г.). «Выявление самых сильных связей в химии». Журнал физической химии A. 117 (36): 8981–8995. Дои:10.1021 / jp406200w. PMID 23927609.