Риоцигуат - Riociguat
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Адемпас |
| Другие имена | ЗАЛ 63-2521 |
| AHFS /Drugs.com | адемпас |
| Данные лицензии | |
| Беременность категория |
|
| Маршруты администрация | Устный |
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Фармакокинетический данные | |
| Биодоступность | 94% |
| Связывание с белками | 95% |
| Метаболизм | CYP1A1, CYP3A4, CYP2C8, CYP2J2 |
| Метаболиты | N-десметилриоцигуат (активный), глюкуронид (неактивный) |
| Устранение период полураспада | 5–10 ч |
| Экскреция | 33–45% почечный, 48–59% желчный |
| Идентификаторы | |
| |
| Количество CAS | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.169.606 |
| Химические и физические данные | |
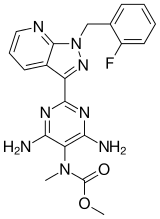
| Формула | C20ЧАС19FN8О2 |
| Молярная масса | 422.424 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| | |
Риоцигуат (торговое наименование Адемпас) является наркотиком Байер это стимулятор растворимая гуанилатциклаза (sGC). Он используется для лечения двух форм легочная гипертония (PH): хроническая тромбоэмболическая легочная гипертензия (CTEPH) и легочная артериальная гипертензия (ПАУ). Риоцигуат представляет собой первый препарат класса стимуляторов рГЦ.[1]
Противопоказания
Риоцигуат может вызвать плод вред и поэтому противопоказан беременным женщинам.[2]
Вещество также противопоказано при легочной гипертензии в сочетании с идиопатическая интерстициальная пневмония (PH-IIP). Клинические испытания риоцигуата для этой цели были преждевременно прекращены, поскольку он усиливал серьезные побочные эффекты и смертность у пациентов с легочной гипертензией, вызванной идиопатической интерстициальной пневмонией, по сравнению с плацебо.[3]
Побочные эффекты
Серьезные побочные эффекты в клинических испытаниях включали кровотечение. Гипотония (низкое кровяное давление), головная боль и желудочно-кишечные расстройства тоже произошло.[2]
Взаимодействия
Нитраты и ингибиторы фосфодиэстеразы (включая Ингибиторы ФДЭ5 ) усиливают гипотензивный (понижающий артериальное давление) эффект риоцигуата. Поэтому комбинирование таких препаратов противопоказано. Уровень риоцигуата в крови снижается за счет курение табака и сильные индукторы печеночного фермента CYP3A4, и усилен сильным цитохром ингибиторы.[2]
Химия и механизм действия
У здоровых людей оксид азота (NO) действует как сигнальная молекула на гладкомышечные клетки сосудов, индуцируя расширение сосудов. NO связывается с растворимой гуанилатциклазой (рГЦ) и опосредует синтез вторичного мессенджера циклический гуанозинмонофосфат (cGMP). формы sGC гетеродимеры состоящий из более крупной альфа-субъединицы и меньшей бета-субъединицы, связывающейся с гемом. Синтезированный cGMP действует как вторичный мессенджер и активирует цГМФ-зависимая протеинкиназа (протеинкиназа G) для регулирования цитозольный кальций концентрация ионов. Это меняет актин –миозин сократимость, что приводит к расширению сосудов. NO продуцируется ферментом эндотелиальной синтетазой оксида азота (eNOS ). У пациентов с легочной артериальной гипертензией уровень eNOS снижен. Это приводит к общему снижению уровня NO, полученного из эндотелиальных клеток, и снижению вазодилатации гладкомышечных клеток. NO также снижает рост гладкомышечных клеток легких и противодействует ингибированию тромбоцитов, факторов, которые играют ключевую роль в патогенезе ПАУ.[4]В отличие от NO- и гем-независимых активаторов рГК, таких как cinaciguat, стимулятор sGC риоцигуат напрямую стимулирует активность sGC независимо от NO[5] а также действует в синергии с NO, вызывая антиагрегационные, антипролиферативные и сосудорасширяющие эффекты.[6][7]
Фармакология
Риоцигуат в концентрации от 0,1 до 100мкМ стимулирует дозозависимую активность рГЦ до 73 раз. Кроме того, он действует синергетически с диэтиламином / NO, донором NO, увеличивая активность рГЦ in vitro до 112 раз.[8] Исследование фазы I показало, что риоцигуат быстро всасывается, а максимальная концентрация в плазме достигается через 0,5–1,5 часа.[9] Средний период полувыведения составляет 5-10 часов.[9] Было также показано, что концентрации риоцигуата в плазме крови у разных пациентов сильно различаются, что указывает на то, что для клинического применения, вероятно, необходимо титровать препарат специально для каждого человека.
История
Открытие
Первый оксид азота (НЕТ) независимый, гем -зависимый стимулятор sGC, YC-1, синтетический бензилиндазол производная, была описана в 1978 г.[10] Характеристика 20 лет спустя продемонстрировала, что помимо увеличения активности sGC, YC-1 действует в синергии с NO, стимулируя sGC. Однако YC-1 был относительно слабым вазодилататором и имел побочные эффекты.[нечеткий ] Поэтому начался поиск новых соединений индазола, которые были бы более мощными и более специфическими стимуляторами рГЦ. В результате были идентифицированы BAY 41-2272 и BAY 41-8543.[11] Оба соединения были протестированы в различных доклинических исследованиях на различных моделях животных, и оказалось, что они улучшают системную артериальную оксигенацию. Для улучшения фармакологических и фармакокинетический profile еще 1000 соединений были проверены, что привело к открытию риоцигуата.[5][12] Риоцигуат был протестирован на моделях болезней мышей и крыс, где он эффективно уменьшал легочную гипертензию и обращал вспять связанный с ней гипертрофия правых отделов сердца и ремоделирование желудочков.
Было проведено несколько клинических испытаний для изучения и оценки различных аспектов риоцигуата, и некоторые из них все еще продолжаются.[13]
Клинические испытания фазы I
Одно из первых исследований было разработано для проверки профиля безопасности, фармакокинетики и фармакодинамика однократных пероральных доз риоцигуата (0,25–5 мг). 58 здоровым мужчинам давали риоцигуат перорально (раствор для перорального приема или таблетки с немедленным высвобождением) в рандомизированном плацебо-контролируемом исследовании. Дозы риоцигуата увеличивались ступенчато, риоцигуат хорошо переносился до 2,5 мг.[9]
Фаза II клинических испытаний
А доказательство концепции исследование, сообщенное Гиссенский университет Lung Center был первым небольшим исследованием (с участием 4 пациентов с ЛАГ) по изучению параметров безопасности, переносимости, фармакокинетики и эффективности.[6] Препарат хорошо переносился и превосходил NO по эффективности и продолжительности действия.
Открытое, неконтролируемое исследование фазы II риоцигуата у 75 взрослых пациентов (42 с ХТЛГ и 33 с ЛАГ, все в Всемирная организация здоровья (ВОЗ) функциональный класс II или III) оценивали безопасность и переносимость, а также влияние на гемодинамику, переносимость физической нагрузки и функциональный класс. Риоцигуат вводили три раза в день в течение 12 недель. Дозы титровались с 2-недельными интервалами от 1,0 мг три раза в день до максимальной 2,5 мг три раза в день. Риоцигуат имел благоприятный профиль безопасности, а также значительно улучшил переносимость физической нагрузки и гемодинамические параметры, такие как сопротивление легочных сосудов, сердечный выброс и давление в легочной артерии, по сравнению с исходными значениями.[14]
Кроме того, в настоящее время проводится исследование фазы II риоцигуата у пациентов, страдающих другими формами ЛГ, например, ассоциированной с интерстициальное заболевание легких (PH-ILD).[15]
Клинические испытания фазы III
Фаза III испытаний риоцигуата - это многоцентровые исследования. Программа исследования включала крупную рандомизированную, двойную слепую, плацебо-контролируемую фазу основного исследования (CHEST-1 и PATENT-1), а также открытые расширения этих исследований (CHEST-2 и PATENT-2). Подробности этих исследований представлены на ClinicalTrials.gov, реестр исследований, который ведется Национальные институты здоровья (НАЦИОНАЛЬНЫЕ ИНСТИТУТЫ ЗДРАВООХРАНЕНИЯ США).[13]
ГРУДЬ
В Chронический тромбоеmbolic легочная гипертензия sGC-Sтимулятор Тrial (CHEST) - рандомизированное плацебо-контролируемое исследование, направленное на анализ эффективности и безопасности риоцигуата у пациентов с ХТЛГ.[16] После 16-недельного лечения риоцигуатом способность пациента к физической нагрузке оценивалась путем измерения изменений в тесте с шестиминутной ходьбой (6-MWT).[17] Пациенты, завершившие CHEST-1, были приглашены принять участие в расширенном исследовании CHEST-2. Первый промежуточный анализ CHEST-2 показал, что риоцигуат хорошо переносится с хорошим долгосрочным профилем безопасности у пациентов с ХТЛГ.[18]
ПАТЕНТ
В пплечевой Аритериальный гипердесятьsion sGC-стимулятор Тrial (PATENT) - рандомизированное плацебо-контролируемое исследование, в котором изучалась эффективность и безопасность риоцигуата у пациентов с ЛАГ. После 12-недельного лечения переносимость физической нагрузки пациента оценивалась путем измерения изменения 6-MWT.[19] Пациенты, завершившие ПАТЕНТ-1, были приглашены для участия в расширенном исследовании ПАТЕНТ-2.[20] Первый промежуточный анализ PATENT-2 показал, что через один год длительный риоцигуат хорошо переносился пациентами с ЛАГ и показал устойчивые преимущества при 6MWD и ФК ВОЗ. Профиль безопасности риоцигуата в PATENT-2 был аналогичен профилю безопасности в PATENT-1.
Другие исследования
Влияние риоцигуата на метаболизм костей
В этом рандомизированном двойном слепом плацебо-контролируемом исследовании фазы I изучалось влияние риоцигуата, вводимого в виде таблеток с немедленным высвобождением (IR) 2,5 мг два раза в день в течение 14 дней, на метаболизм костей.[21] Влияние на формирование костной ткани было замечено у растущих, молодых и подростков крыс. У молодых крыс изменения заключались в утолщении губчатой кости и гиперостозе и ремоделировании метафизарной и диафизарной кости, тогда как у крыс-подростков наблюдалось общее увеличение костной массы. С другой стороны, у взрослых крыс таких эффектов не наблюдалось.
Исследование взаимодействия с силденафилом
В этом исследовании изучали безопасность, переносимость, фармакокинетику и влияние на легочную и системную гемодинамику однократных доз 0,5 и 1 мг риоцигуата у пациентов с ЛАГ и стабильным лечением силденафил (20 мг трижды в день) в нерандомизированном неконтролируемом исследовании.[22] Исследование показало потенциально неблагоприятные сигналы безопасности при применении силденафила в сочетании с риоцигуатом и отсутствие доказательств положительного соотношения польза / риск. Поэтому одновременный прием риоцигуата с ингибиторами фосфодиэстеразы-5 противопоказан.
Смотрите также
- Cinaciguat, активатор sGC (не стимулятор sGC).
- Ингибиторы ФДЭ5 действуют ниже по сигнальному пути оксида азота, уменьшая циклическую деградацию GMP.
- Антагонист рецепторов эндотелина, еще один класс препаратов, используемых при ЛАГ
Рекомендации
- ^ "Фон Риоцигуат". Bayer HealthCare. Архивировано из оригинал 18 июля 2011 г.. Получено 15 декабря 2009.
- ^ а б c Информация о профессиональных лекарствах FDA
- ^ «Адемпас не для использования у пациентов с легочной гипертензией, вызванной идиопатической интерстициальной пневмонией». Европейское агентство по лекарствам. 24 июня 2016 г.
- ^ Гиайд А., Салех Д. (июль 1995 г.). «Пониженная экспрессия эндотелиальной синтазы оксида азота в легких у пациентов с легочной гипертензией». Медицинский журнал Новой Англии. 333 (4): 214–21. Дои:10.1056 / NEJM199507273330403. PMID 7540722.
- ^ а б Евгенов О.В., Пахер П., Шмидт П.М., Хаско Г., Шмидт Х.Х., Сташ Дж.П. (сентябрь 2006 г.). «NO-независимые стимуляторы и активаторы растворимой гуанилатциклазы: открытие и терапевтический потенциал». Обзоры природы. Открытие наркотиков. 5 (9): 755–68. Дои:10.1038 / nrd2038. ЧВК 2225477. PMID 16955067.
- ^ а б Гриммингер Ф., Вейманн Дж., Фрей Р., Фосвинкель Р., Тамм М., Бёлков Д. и др. (Апрель 2009 г.). «Первое острое гемодинамическое исследование стимулятора растворимой гуанилатциклазы риоцигуат при легочной гипертензии». Европейский респираторный журнал. 33 (4): 785–92. Дои:10.1183/09031936.00039808. PMID 19129292.
- ^ Сташ Дж. П., Хоббс А. Дж. (2009). «NO-независимые, гемзависимые стимуляторы растворимой гуанилатциклазы». Справочник по экспериментальной фармакологии. 191 (191): 277–308. Дои:10.1007/978-3-540-68964-5_13. ISBN 978-3-540-68960-7. PMID 19089334. Цитировать журнал требует
| журнал =(помощь) - ^ Schermuly RT, Stasch JP, Pullamsetti SS, Middendorff R, Müller D, Schlüter KD, et al. (Октябрь 2008 г.). «Экспрессия и функция растворимой гуанилатциклазы при легочной артериальной гипертензии». Европейский респираторный журнал. 32 (4): 881–91. Дои:10.1183/09031936.00114407. PMID 18550612.
- ^ а б c Frey R, Mück W., Unger S, Artmeier-Brandt U, Weimann G, Wensing G (декабрь 2008 г.). «Фармакокинетика, фармакодинамика, переносимость и безопасность растворимого активатора гуанилатциклазы цинацигуата (BAY 58-2667) у здоровых добровольцев мужского пола». Журнал клинической фармакологии. 48 (12): 1400–10. Дои:10.1177/0091270008322906. PMID 18779378.
- ^ Йошина С., Танака А., Куо С.К. (март 1978 г.). "[Исследования гетероциклических соединений. XXXVI. Синтез производных фуро [3,2-c] пиразола. (4) Синтез 1,3-дифенилфуро [3,2-c] пиразол-5-карбоксальдегида и его производных (авторский перевод )] ". Якугаку Засши (на японском языке). 98 (3): 272–9. Дои:10.1248 / yakushi1947.98.3_272. PMID 650406.
- ^ Сташ Дж. П., Беккер Е. М., Алонсо-Алия К., Апелер Х., Дембовски К., Ферер А. и др. (Март 2001 г.). «NO-независимый регуляторный сайт растворимой гуанилатциклазы». Природа. 410 (6825): 212–5. Bibcode:2001Натура.410..212С. Дои:10.1038/35065611. PMID 11242081.
- ^ Миттендорф Дж., Вейганд С., Алонсо-Алия С., Бишофф Е., Ферер А., Гериш М. и др. (Май 2009 г.). «Открытие риоцигуата (BAY 63-2521): мощного перорального стимулятора растворимой гуанилатциклазы для лечения легочной гипертензии». ChemMedChem. 4 (5): 853–65. Дои:10.1002 / cmdc.200900014. ЧВК 3313366. PMID 19263460.
- ^ а б ClinicalTrials.gov: Риоцигуат
- ^ «Международная конференция ATS». Американское торакальное общество. 2009. Архивировано с оригинал 30 декабря 2009 г.
- ^ Номер клинического исследования NCT00694850 для «Влияние нескольких доз BAY 63-2521 на безопасность, переносимость, фармакокинетику и фармакодинамику у пациентов с легочной гипертензией, связанной с интерстициальной болезнью легких (ILD)» в ClinicalTrials.gov
- ^ Гофрани Х.А., Д'Армини А.М., Гриммингер Ф., Хопер М.М., Янса П., Ким Н.Х. и др. (Июль 2013). «Риоцигуат для лечения хронической тромбоэмболической легочной гипертензии» (PDF). Медицинский журнал Новой Англии. 369 (4): 319–29. Дои:10.1056 / NEJMoa1209657. PMID 23883377.
- ^ Номер клинического исследования NCT00855465 для «Исследования по оценке эффективности и безопасности перорального BAY63-2521 у пациентов с ХТЛГ» в ClinicalTrials.gov
- ^ Номер клинического исследования NCT00910429 для "BAY63-2521 - Долгосрочное расширенное исследование у пациентов с хронической тромбоэмболической легочной гипертензией" в ClinicalTrials.gov
- ^ Номер клинического исследования NCT00810693 для «Исследования по оценке эффективности и безопасности перорального BAY63-2521 у пациентов с легочной артериальной гипертензией (ЛАГ)» в ClinicalTrials.gov
- ^ Номер клинического исследования NCT00863681 для "BAY63-2521: Долгосрочное расширенное исследование у пациентов с легочной артериальной гипертензией" в ClinicalTrials.gov
- ^ Номер клинического исследования NCT00855660 за «Влияние риоцигуата на метаболизм костей» в ClinicalTrials.gov
- ^ Номер клинического исследования NCT00680654 для «Исследования взаимодействия у пациентов с легочной гипертензией и стабильным лечением силденафила 20 мг три раза в сутки» при ClinicalTrials.gov
