Сшивание ДНК - Crosslinking of DNA

В генетика, сшивание ДНК возникает, когда различные экзогенные или эндогенные агенты реагируют с двумя нуклеотиды из ДНК, образуя между ними ковалентную связь. Это поперечное сшивание может происходить внутри одной и той же цепи (внутрицепочечная) или между противоположными цепями двухцепочечной ДНК (межцепочечная). Эти аддукты влияют на клеточный метаболизм, например: Репликация ДНК и транскрипция, запуск смерть клетки. Однако эти сшивки могут быть отремонтирован через пути удаления или рекомбинации.
Сшивание ДНК также полезно при химиотерапии и поражении раковых клеток при апоптоз,[1] а также в понимании того, как белки взаимодействуют с ДНК.
Сшивающие агенты
Многие охарактеризованные сшивающие агенты имеют две независимо реакционноспособные группы в одной и той же молекуле, каждая из которых способна связываться с нуклеотидным остатком ДНК. Эти агенты разделены на основе их источника происхождения и помечены как экзогенные или эндогенные. Экзогенные сшивающие агенты представляют собой химические вещества и соединения, как натуральные, так и синтетические, которые возникают в результате воздействия окружающей среды, такого как фармацевтические препараты, сигаретный дым или автомобильные выхлопные газы. Эндогенные сшивающие агенты представляют собой соединения и метаболиты, которые вводятся клеточными или биохимическими путями внутри клетки или организма.
Экзогенные агенты
- Азотные горчицы экзогенные алкилирующие агенты которые реагируют с N7 положение гуанина. Эти соединения имеют структуру ядра бис- (2-этилхлор) амина с переменной р-группа, с двумя реактивными функциональными группами, служащими для алкилирования азотистых оснований и образования поперечно-сшивающего повреждения. Эти агенты наиболее предпочтительно образуют сшивку между нитями 1,3 5'-d (GNC). Введение этого агента немного изгибает дуплекс ДНК, чтобы приспособиться к присутствию агента внутри спирали.[2] Эти агенты часто вводятся как фармацевтические препараты и используются в цитотоксический химиотерапия.[3]
- Цисплатин (цис-диамминдихлорплатина (II)) и его производные в основном действуют на соседние гуанины на своих N7 позиции. Плоское соединение связывается с азотистыми основаниями посредством замещения водой одной или обеих его хлоридных групп, позволяя цисплатину образовывать моноаддукты к ДНК или РНК, межцепочечные поперечные связи ДНК, межцепочечные поперечные связи ДНК и поперечные связи ДНК-белок.[4] Когда цисплатин образует поперечные связи ДНК, он чаще образует 1,2-внутрицепочечные поперечные связи (5'-GG), но также образует 1,3-внутрицепочечные поперечные связи (5-GNG) с меньшим процентом.[5][6] Когда цисплатин образует межцепочечные сшивки (5'-GC), происходит серьезное искажение спирали ДНК из-за укороченного расстояния между гуанинами на противоположных цепях и цитозином, который выворачивается из спирали в результате взаимодействия GG.[7] Подобно азотистым ипритам, цисплатин часто используется при химиотерапевтическом лечении, особенно при раке яичка и яичников.[8]
- Хлорэтилнитрозомочевина (CENU), в частности кармустин (BCNU) представляют собой сшивающие агенты, которые широко используются в химиотерапии, особенно при опухолях головного мозга. Эти агенты отличаются от других сшивающих агентов, поскольку они алкилируют О6 гуанина с образованием О6-этаногуанин. Это промежуточное соединение затем приводит к межцепочечной перекрестной связи между парой оснований GC. Эти сшивающие агенты приводят только к небольшим искажениям спирали ДНК из-за меньшего размера молекул.
- Псоралены природные соединения (фурокумарины), присутствующие в растениях. Эти соединения вставлять в ДНК в сайтах последовательности 5'-AT и образуют тимидин аддукты при активации в присутствии Ультрафиолетовые лучи А (УФ-А).[9] Эти ковалентные аддукты образуются путем связывания 3, 4 (пирон ) или 4 ', 5' (фуран ) край псоралена к 5, 6 двойной связи тимин. Псоралены могут образовывать два типа моноаддуктов и один диаддукт (межнитевое поперечное сшивание) с тимин.[10] Эти аддукты приводят к локальным искажениям ДНК в месте интеркаляции. Псоралены используются при лечении кожных заболеваний, таких как: псориаз и витилиго.
- Митомицин С (MMC) относится к классу антибиотиков, которые широко используются в химиотерапии, часто при раке желудочно-кишечного тракта. Митомицин C может действовать как сшивающий агент только тогда, когда нуклеотид ДНК восстановился до своей хинон звенеть. Когда два dG были перегруппированы и метилированы таким образом, 5'-GC межцепочечная сшивка может быть образована с экзоаминами каждого азотистого основания. Митомицин также обладает способностью образовывать моноаддукты и внутрицепочечные сшивки с ДНК. Межцепочечные сшивки Митомицина С образуются в малой бороздке ДНК, вызывая умеренное расширение или растяжение спирали ДНК, чтобы приспособиться к присутствию молекулы внутри двух цепей.
Эндогенные агенты
- Азотистая кислота образуется как побочный продукт в желудке из пищевых источников нитритов и может привести к повреждению поперечных сшивок в ДНК за счет преобразования аминогрупп ДНК в карбонилы. Этот тип поражения чаще всего возникает между двумя гуанозинами, причем 1 из 4 дезаминированных гуанозинов приводит к межцепочечному сшиванию.[11] Он индуцирует образование межцепочечных сшивок ДНК на аминогруппа экзоциклического N2 гуанина по 5'-CG последовательностям. Это поражение слегка искажает двойную спираль.
- Бифункциональный альдегиды химические вещества, которые образуются эндогенно через перекисное окисление липидов и простогландин биосинтез.[12] Они создают этено-аддукты, образованные альдегид которые претерпевают перестройки с образованием поперечных связей на противоположных цепях ДНК. Малоновый диальдегид представляет собой прототипический пример, который может сшивать ДНК через две экзоциклические аминогруппы гуанина.[13] Другие альдегиды, такие как формальдегид и ацетилальдегид, могут вводить поперечные связи между нитями и часто действуют как экзогенные агенты, поскольку они содержатся во многих обработанных пищевых продуктах. Α, β-ненасыщенные альдегиды, такие как акролеин и кротоновый альдегид, которые часто встречаются в пестицидах, табачном дыме и автомобильных выхлопах, являются дополнительными экзогенными агентами, которые могут индуцировать поперечные связи ДНК. В отличие от других сшивающих агентов сшивание, индуцированное альдегидом, по сути является обратимым процессом. Структура ЯМР этих типов агентов в виде межцепочечных сшивок показывает, что аддукт 5'-GC приводит к незначительному искажению ДНК, однако аддукт 5'-CG дестабилизирует спираль и вызывает изгиб и скручивание ДНК.[14]
- Повреждения, связанные с перекрестным связыванием ДНК, также могут образовываться в условиях окислительного стресса, при котором свободные радикалы кислорода генерируют реактивные промежуточные соединения в ДНК, и эти поражения участвуют в старении и раке. Тандемные повреждения ДНК с большой частотой образуются под действием ионизирующего излучения и катализируемого металлом H2О2 реакции. В бескислородных условиях преобладающим поражением с двойным основанием является вид, у которого C8 гуанина связан с 5-метильной группой соседнего 3'-тимина (G [8,5-Me] T), образуя внутрицепочечные поражения.[15][16]
Сводная таблица сшивающих агентов
| Сшивающий агент | Алкилирующий агент | Структура сшивки | Предпочтительная целевая последовательность |
| Азотная горчица | 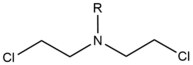 | 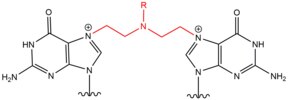 | Intrastrand; 5'-GC |
| Цисплатин |  | 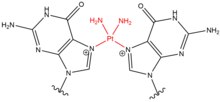 | Intrastrand; 5'-GC Interstrand; 5'-GNG |
| Кармустин (BNCU) |  | 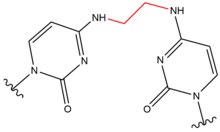 | Межстенд; Базовая пара GC |
| Митомицин С |  |  | Interstrand; 5'-GC |
| Псорален | 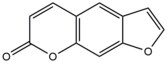 |  | Межстенд; 5'-ТА |
| Малоновый диальдегид |  |  | Interstrand; 5'-GC, 5'-CG |
| Окислительный стресс (и радиация) |  | Intrastrand; d (ГПТ) | |
| Азотистая кислота |  | Interstrand; 5'-CG |
Ремонт сшивок ДНК
Сшитая ДНК восстанавливается в клетках за счет комбинации ферментов и других факторов из эксцизионная репарация нуклеотидов (NER) путь, гомологичная рекомбинация, а базовая эксцизионная пластика (BER) путь. Чтобы восстановить межцепочечные сшивки у эукариот, эндонуклеаза 3 ’лоскута из NER, XPF-ERCC1, рекрутируется в сшитую ДНК, где он помогает «расцепить» ДНК за счет расщепления 3’-цепи в сайте сшивки. Затем 5 ’нить расщепляется либо XPF-ERCC1 или другой эндонуклеаза, образуя двухниточный разрыв (DSB), который затем может быть отремонтирован гомологичная рекомбинация путь.[17]
Сшивки ДНК обычно вызывают потерю информации о перекрывающихся последовательностях двух цепей ДНК. Следовательно, точный ремонт повреждений зависит от восстановления утерянной информации с неповрежденного гомологичная хромосома в той же камере. Извлечение может происходить путем соединения с сестринская хромосома произведенный во время предыдущего раунда репликации. В диплоидная клетка извлечение может также происходить в паре с не-сестрой гомологичная хромосома, как это происходит особенно во время мейоз.[нужна цитата ] Как только произошло спаривание, перекрестная связь может быть удалена и исправленная информация введена в поврежденную хромосому путем гомологичной рекомбинации.
Расщепление связи между дезоксирибозным сахаром в сахарно-фосфатном остове ДНК и ассоциированным с ним азотистым основанием оставляет основной сайт в двухцепочечной ДНК. Эти базовые участки часто образуются как промежуточные, а затем восстанавливаются при эксцизионной репарации основания. Однако, если этим сайтам позволить сохраняться, они могут ингибировать репликацию и транскрипцию ДНК.[18] Абазовые сайты могут реагировать с аминогруппами на белках с образованием перекрестных связей ДНК-белок или с экзоциклическими аминами других азотистых оснований с образованием межцепочечных перекрестных связей. Чтобы предотвратить межцепочечные или ДНК-белковые сшивки, ферменты пути BER плотно связывают абазический сайт и изолируют его от близлежащих реактивных групп, как показано на примере человеческой алкиладенин-ДНК-гликозилазы (AAG) и Кишечная палочка 3-метиладенин ДНК-гликозилаза II (AlkA).[19] in vitro данные продемонстрировали, что межстандартные перекрестные ссылки, индуцированные абазическим сайтом (DOB-ICL), представляют собой поражение, блокирующее репликацию и сильно ошибочное кодирование. По сравнению с несколькими другими исследованными TLS pols, pol η, вероятно, будет способствовать TLS-опосредованной репарации DOB-ICL. in vivo.[20] Используя O6-2'-дезоксигуанозин-бутилен-O6-2'-дезоксигуанозин (O6-dG-C4-O6-dG) повреждения ДНК, который представляет собой химически стабильную структуру, была исследована обходная активность нескольких ДНК-полимераз, и результаты показали, что pol η проявляет наивысшую обходную активность; однако 70% продуктов обхода были мутагенными, содержащими замены или делеции. Увеличение размера незакрепленных промежуточных продуктов репарации увеличивает частоту делеционных мутаций. [21]
Лечение Кишечная палочка с псорален -плюс-УФ свет (ПУВА ) вызывает межцепочечные перекрестные связи в клеточной ДНК. Cole et al.[22] и Синден и Коул[23] представил доказательства того, что гомологичный рекомбинационный процесс ремонта, требующий продуктов генов uvrA, uvrB, и recA можно удалить эти сшивки в Кишечная палочка. Этот процесс кажется достаточно эффективным. Даже если одной или двух нерепарированных поперечных связей достаточно для инактивации клетки, бактериальная клетка дикого типа может восстанавливать и, следовательно, восстанавливать от 53 до 71 поперечных связей псоралена. Эукариотический дрожжевые клетки также инактивируются одной оставшейся поперечной связью, но дрожжевые клетки дикого типа могут восстанавливать от 120 до 200 поперечных связей.[24]
Приложения
Сшивание ДНК и белка
Методы биохимического взаимодействия
Сшивка ДНК-белок может быть вызвана множеством химических и физических агентов, включая переходные металлы, ионизирующее излучение и эндогенные альдегиды, в дополнение к химиотерапевтические агенты.[25]Подобно перекрестному связыванию ДНК, перекрестные связи ДНК-белок представляют собой повреждения в клетках, которые часто повреждаются УФ-излучением. Эффект ультрафиолета может привести к реактивным взаимодействиям и вызвать сшивание ДНК и белков, которые с ней контактируют. Эти поперечные сшивки представляют собой очень объемные и сложные поражения. В первую очередь они возникают в областях хромосом, которые подвергаются репликации ДНК и мешают клеточным процессам.
Прогресс в методах идентификации структуры прогрессирует, и добавление возможности измерять взаимодействия между ДНК и белком является требованием для полного понимания биохимических процессов. Структуру ДНК-белковых комплексов можно картировать с помощью фото сшивание, который представляет собой фотоиндуцированное образование ковалентной связи между двумя макромолекулами или между двумя различными частями одной макромолекулы. Методология включает ковалентное связывание ДНК-связывающего участка ДНК-связывающего белка, специфичного для целевой последовательности, с фотоактивируемым сшивающим агентом, способным реагировать с нуклеотидами ДНК при воздействии УФ. Этот метод предоставляет информацию о взаимодействии между ДНК и белком в поперечной сшивке.[26]
Клинические методы лечения
Пути репарации ДНК могут привести к образованию опухолевые клетки. Рак были разработаны методы лечения с использованием сшивающих агентов ДНК для взаимодействия с азотистыми основаниями ДНК для блокирования репликации ДНК. Эти перекрестно-сшивающие агенты обладают способностью действовать как терапия с одним агентом, нацеливая и разрушая определенные нуклеотиды в раковых клетках. Этот результат останавливает цикл и рост раковых клеток; Поскольку он подавляет специфические пути репарации ДНК, этот подход имеет потенциальное преимущество в виде меньшего количества побочных эффектов.[27]
У людей основной причиной смерти от рака во всем мире является рак легких, в том числе немелкоклеточный рак легкого (НМРЛ), на долю которого приходится 85% всех случаев рака легких в США.[28] Людей с НМРЛ часто лечат терапевтическими соединениями платины (например, цисплатином, карбоплатином или оксалиплатином) (см. Химиотерапия рака легких ), которые вызывают межцепочечные сшивки ДНК. Среди людей с NSLC низкая экспрессия гена рака груди 1 (BRCA1 ) в первичной опухоли коррелирует с улучшением выживаемости после химиотерапии, содержащей платину.[29][30] Эта корреляция подразумевает, что низкий уровень BRCA1 в раке и, как следствие, низкий уровень репарации ДНК, вызывают уязвимость рака к лечению с помощью сшивающих агентов ДНК. Высокий уровень BRCA1 может защищать раковые клетки, действуя в гомологичный рекомбинационный путь репарации, который устраняет повреждения ДНК, вызванные препаратами платины. Уровень BRCA1 экспрессия потенциально является важным инструментом для адаптации химиотерапии к лечению рака легких.[29][30]
Клинические химиотерапевтические препараты могут вызывать ферментативные и неферментативные перекрестные связи ДНК-белок. Примером такой индукции являются производные платины, такие как цисплатин и оксалиплатин. Они создают неферментативные перекрестные связи ДНК-белок за счет неспецифического перекрестного сшивания белков, взаимодействующих с хроматином, с ДНК. Сшивание также возможно в других терапевтических средствах либо путем стабилизации промежуточных продуктов ковалентной ДНК-белковой реакции, либо путем создания псевдосубстрата, который захватывает фермент на ДНК. Производные камптотецина, такие как иринотекан и топотекан, нацелены и улавливают специфическую ДНК топоизомераза 1 (TOP1) путем внедрения в интерфейс фермент-ДНК. Поскольку токсичность этих препаратов зависит от захвата TOP1, клеточная чувствительность к этим соединениям напрямую зависит от уровней экспрессии TOP1. В результате функция этих препаратов заключается в том, чтобы служить в качестве ферментных ядов, а не ингибиторов. Это может быть применено для лечения опухолевых клеток с помощью ферментных ядов TOP 2.[31]
Рекомендации
- ^ Динс, AJ; Запад, Южная Каролина (24 июня 2011 г.). «Реставрация межцепочечных сшивок ДНК и рак». Обзоры природы. Рак. 11 (7): 467–80. Дои:10.1038 / nrc3088. ЧВК 3560328. PMID 21701511.
- ^ Гуайнацци, Анджело; Шерер, Орландо Д. (2010-11-01). «Использование синтетических межцепочечных сшивок ДНК для выяснения путей репарации и определения новых терапевтических мишеней для химиотерапии рака». Клеточные и молекулярные науки о жизни. 67 (21): 3683–3697. Дои:10.1007 / s00018-010-0492-6. ISSN 1420-682X. ЧВК 3732395. PMID 20730555.
- ^ Рак, клиника Кливленда. «Азотная горчица - химиотерапевтические препараты - Chemocare». chemocare.com. Получено 2017-10-09.
- ^ Jamieson, E. R .; Липпард, С. Дж. (1999-09-08). «Структура, распознавание и процессинг аддуктов цисплатин-ДНК». Химические обзоры. 99 (9): 2467–2498. Дои:10.1021 / cr980421n. ISSN 1520-6890. PMID 11749487.
- ^ Poklar N, Pilch DS, Lippard SJ, Redding EA, Dunham SU, Breslauer KJ (июль 1996 г.). «Влияние внутрицепочечного сшивания цисплатина на конформацию, термостабильность и энергетику 20-мерного дуплекса ДНК». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 93 (15): 7606–11. Дои:10.1073 / пнас.93.15.7606. ЧВК 38793. PMID 8755522.
- ^ Радд Г. Н., Хартли Дж. А., Сухами Р. Л. (1995). «Стойкость цисплатин-индуцированного межцепочечного сшивания ДНК в мононуклеарных клетках периферической крови пожилых и молодых людей». Рак-химиотерапия. Pharmacol. 35 (4): 323–6. Дои:10.1007 / BF00689452. PMID 7828275.
- ^ Косте, Ф .; Malinge, J.M .; Serre, L .; Shepard, W .; Roth, M .; Ленг, М .; Зелвер, К. (1999-04-15). «Кристаллическая структура двухцепочечной ДНК, содержащей межцепочечную перекрестную связь цисплатина с разрешением 1,63 A: гидратация на платинированном сайте». Исследования нуклеиновых кислот. 27 (8): 1837–1846. Дои:10.1093 / nar / 27.8.1837. ISSN 0305-1048. ЧВК 148391. PMID 10101191.
- ^ «Цисплатин». Национальный институт рака. 2007-03-02. Получено 2017-10-09.
- ^ Cimino, G.D .; Gamper, H.B .; Isaacs, S.T .; Херст, Дж. Э. (1985). «Псоралены как фотоактивные зонды структуры и функции нуклеиновых кислот: органическая химия, фотохимия и биохимия». Ежегодный обзор биохимии. 54: 1151–1193. Дои:10.1146 / annurev.bi.54.070185.005443. ISSN 0066-4154. PMID 2411210.
- ^ Ци Ву, Лаура А. Кристенсен, Рэнди Дж. Легерски и Карен М. Васкес, Восстановление несоответствия участвует в безошибочной обработке межцепочечных сшивок ДНК в клетках человека, EMBO Reports 6, 6, 551–557 (2005).
- ^ Киршнер, Джеймс Дж .; Sigurdsson, Snorri T .; Хопкинс, Пол Б. (1992-05-01). «Межцепочечное сшивание дуплекса ДНК азотистой кислотой: ковалентная структура сшивки dG-to-dG в последовательности 5'-CG». Журнал Американского химического общества. 114 (11): 4021–4027. Дои:10.1021 / ja00037a001. ISSN 0002-7863.
- ^ Stone, Michael P .; Чо, Ён-Джин; Хуанг, Хай; Ким, Хе Ён; Козеков Иван Д .; Козекова, Албена; Ван, Хао; Минько, Ирина Григорьевна; Ллойд, Р. Стивен (1 июля 2008 г.). «Межцепочечные перекрестные связи ДНК, индуцированные α, β-ненасыщенными альдегидами, полученными в результате перекисного окисления липидов и источников окружающей среды». Отчеты о химических исследованиях. 41 (7): 793–804. Дои:10.1021 / ar700246x. ISSN 0001-4842. ЧВК 2785109. PMID 18500830.
- ^ Niedernhofer, Laura J .; Дэниэлс, Дж. Скотт; Рузер, Кэрол А .; Грин, Рэйчел Э .; Марнетт, Лоуренс Дж. (2003-08-15). «Малоновый диальдегид, продукт перекисного окисления липидов, является мутагенным в клетках человека». Журнал биологической химии. 278 (33): 31426–31433. Дои:10.1074 / jbc.m212549200. ISSN 0021-9258. PMID 12775726.
- ^ Дули, Патрисия А .; Чжан, Минчжоу; Корбель, Грегори А .; Нечев, Любомир В .; Харрис, Констанс М .; Stone, Michael P .; Харрис, Томас М. (2008-01-08). «ЯМР-определение конформации триметиленовой межцепочечной сшивки в олигодезоксинуклеотидном дуплексе, содержащем мотив 5'-d (GpC)». Журнал Американского химического общества. 125 (1): 62–72. Дои:10.1021 / ja0207798. ISSN 0002-7863. PMID 12515507.
- ^ LC Colis; П. Райчаудхури; А.К. Басу (2008). «Мутационная специфичность индуцированных гамма-излучением гуанин-тиминовых и тимин-гуаниновых внутрицепочечных сшивок в клетках млекопитающих и трансформационный синтез за пределы гуанин-тиминового поражения ДНК-полимеразой человека эта». Биохимия. 47 (6): 8070–8079. Дои:10.1021 / bi800529f. ЧВК 2646719. PMID 18616294.
- ^ Box, Harold C .; Будзинский, Эдвин Э .; Давидзик, Жан Д .; Уоллес, Джон С .; Evans, Marianne S .; Гоби, Джейсон С. (1996). «Радиационно-индуцированное образование сшивки между основными фрагментами дезоксигуанозина и тимидина в дезоксигенированных растворах d (CpGpTpA)». Радиационные исследования. 145 (5): 641–643. Дои:10.2307/3579285. JSTOR 3579285.
- ^ Кляйн Доуэл, Дейзи; Boonen, Rick A.C.M .; Лонг, Дэвид Т .; Шиповская, Анна А .; Рэшле, Маркус; Вальтер, Йоханнес С.; Книпшер, Пак (2014). «XPF-ERCC1 действует в расцеплении межцепочечных сшивок ДНК в сотрудничестве с FANCD2 и FANCP / SLX4». Молекулярная клетка. 54 (3): 460–471. Дои:10.1016 / j.molcel.2014.03.015. ЧВК 5067070. PMID 24726325.
- ^ Ремонт ДНК и мутагенез. Фридберг, Эррол К., Фридберг, Эррол К. (2-е изд.). Вашингтон, округ Колумбия: ASM Press. 2006 г. ISBN 9781555813192. OCLC 59360087.CS1 maint: другие (связь)
- ^ Admiraal, Suzanne J .; О’Брайен, Патрик Дж. (10 марта 2015 г.). "Ферменты эксцизионной репарации оснований защищают абазовые участки в дуплексной ДНК от межцепочечных перекрестных связей". Биохимия. 54 (9): 1849–1857. Дои:10.1021 / bi501491z. ISSN 0006-2960. ЧВК 4404639. PMID 25679877.
- ^ Чжао, Линьлинь; Сюй, Вэньянь (02.12.2015). «Мутагенный обход аналога межцепочечной перекрестной связи ДНК, индуцированного окисленным абазическим повреждением, с помощью ДНК-полимераз человеческого синтеза». Биохимия. 54 (50): 7409–7422. Дои:10.1021 / acs.biochem.5b01027. ЧВК 4700817. PMID 26626537.
- ^ Чжао, Линьлинь; Сюй, Вэньянь (21.10.2016). "О6-2'-дезоксигуанозин-бутилен-O6Межцепочечные перекрестные связи -2'-дезоксигуанозиновой ДНК блокируют репликацию и вызывают мутагенные поражения ДНК ». Chem. Res. Токсикол. 29 (11): 1872–1882. Дои:10.1021 / acs.chemrestox.6b00278. ЧВК 5665164. PMID 27768841.
- ^ Коул Р.С., Левитан Д., Синден Р.Р. (1976). «Удаление сшивок между нитями псоралена из ДНК Escherichia coli: механизм и генетический контроль». J. Mol. Биол. 103 (1): 39–59. Дои:10.1016/0022-2836(76)90051-6. PMID 785009.
- ^ Синден Р. Р., Коул Р. С. (1978). «Ремонт поперечно-сшитой ДНК и выживание Escherichia coli, обработанных псораленом и светом: эффекты мутаций, влияющих на генетическую рекомбинацию и метаболизм ДНК». J. Bacteriol. 136 (2): 538–47. ЧВК 218577. PMID 361714.
- ^ Нолл Д.М., Мейсон TM, Миллер П.С. (2006). «Формирование и восстановление межцепочечных сшивок в ДНК». Chem. Rev. 106 (2): 277–301. Дои:10.1021 / cr040478b. ЧВК 2505341. PMID 16464006.
- ^ Третьякова Наталья; Грёлер, Арнольд; Цзи, Шаофэй (2015). «Сшивки ДНК-белок: образование, структурные особенности и биологические результаты». Acc Chem Res. 48 (6): 1631–44. Дои:10.1021 / acs.accounts.5b00056. ЧВК 4704791. PMID 26032357.
- ^ Pendergrast, P .; Чен, Ян; Эбрайт, Йон; Эбрайт, Ричард. «Определение ориентации ДНК-связывающего мотива в комплексе белок-ДНК путем фотошивки» (PDF). Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. Дои:10.1073 / pnas.89.21.10287. ЧВК 50323. PMID 1332042.
- ^ Смит, Кендрик; Мартин, Шетлар. "ДНК-БЕЛКОВЫЕ ПЕРЕСЕЧЕНИЯ". Цитировать журнал требует
| журнал =(помощь) - ^ Молина-младший, Ян П., Кассиви С.Д., Шильд С.Е., Аджей А.А. (2008). «Немелкоклеточный рак легкого: эпидемиология, факторы риска, лечение и выживаемость». Mayo Clin. Proc. 83 (5): 584–94. Дои:10.4065/83.5.584. ЧВК 2718421. PMID 18452692.
- ^ а б Тарон М., Розелл Р., Фелип Е., Мендес П., Суглакос Дж., Ронко М. С., Керальт С., Майо Дж., Санчес Дж. М., Санчес Дж. Дж., Маэстре Дж. (2004). «Уровни экспрессии мРНК BRCA1 как индикатор химиорезистентности при раке легких». Гм. Мол. Genet. 13 (20): 2443–9. Дои:10,1093 / hmg / ddh260. PMID 15317748.
- ^ а б Пападаки К., Сфакианаки М., Иоаннидис Г., Лагудаки Е., Трипаки М., Трифонидис К., Маврудис Д., Статопулос Е., Георгулиас В., Суглакос Дж. (2012). «Уровни экспрессии мРНК ERCC1 и BRAC1 в первичной опухоли могут предсказать эффективность химиотерапии на основе цисплатина второй линии у предварительно пролеченных пациентов с метастатическим немелкоклеточным раком легкого». J Торак Онкол. 7 (4): 663–71. Дои:10.1097 / JTO.0b013e318244bdd4. PMID 22425915.
- ^ Стингеле, Джулиан; Беллелли, Роберто; Бултон, Саймон (сентябрь 2017 г.). «Механизмы репарации ДНК-белковых сшивок». Обзоры природы Молекулярная клеточная биология. 18 (9): 563–573. Дои:10.1038 / nrm.2017.56. PMID 28655905.
внешняя ссылка
- PDB: 1AIO – Интерактивная структура для образования цисплатина и аддукта ДНК
- PDB: 204D – Интерактивная структура для псоралена и сшитой ДНК
- Псорален ультрафиолетовый свет
