Десмопластическая мелкоклеточная опухоль - Википедия - Desmoplastic small-round-cell tumor
| Десмопластическая мелкоклеточная опухоль | |
|---|---|
| Другие имена | DSRCT[1] |
 | |
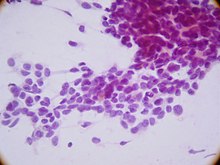
| Микрофотография десмопластической мелкоклеточной опухоли, демонстрирующей характерную десмопластическую строму и угловатые гнезда маленьких круглых клеток. H&E пятно. | |
| Специальность | Онкология |
Десмопластическая мелкоклеточная опухоль (DSRCT) - агрессивный и редкий рак что в первую очередь происходит в виде масс в брюшная полость.[2] Другие затронутые области могут включать лимфатический узел, подкладка брюшная полость, диафрагма, селезенка, печень, грудная стенка, череп, спинной мозг, толстый кишечник, тонкий кишечник, мочевой пузырь, мозг, легкие, яички, яичники и таз. Сообщенные места метастатического распространения включают печень, легкие, лимфатический узел, мозг, череп и кости. Он характеризуется слитым белком EWS-WT1.
В опухоль классифицируется как саркома мягких тканей и небольшая круглая синеклеточная опухоль. Чаще всего встречается у детей мужского пола. Заболевание редко встречается у женщин, но когда оно возникает, опухоли можно принять за рак яичников.[3]
Признаки и симптомы

Есть несколько ранних признаков того, что у пациента есть DSRCT. Пациенты часто молоды и здоровы, так как опухоли беспрепятственно растут и распространяются в брюшной полости. Это редкие опухоли, и врачи часто неправильно диагностируют симптомы. Образования в брюшной полости могут вырасти до огромных размеров, прежде чем их заметит пациент. При пальпации живота опухоли ощущаются как твердые круглые образования.
Первые симптомы заболевания часто включают вздутие живота, массу в животе, боль в животе или спине, непроходимость желудочно-кишечного тракта, отсутствие аппетита, асцит, анемия и кахексия.
Другие зарегистрированные симптомы включают неизвестные уплотнения, заболевания щитовидной железы, гормональные нарушения, свертывание крови, проблемы с почками и урологией, образования в яичках, груди, матке, влагалище и яичниках.
Генетика
Факторов риска, специфичных для данного заболевания, нет. Опухоль, по-видимому, возникает из примитивных клеток детства и считается детским раком.
Исследования показали, что существует химерная связь между DSRCT и Опухоль Вильмса и Саркома Юинга. Вместе с нейробластомой и неходжкинской лимфомой они образуют мелкоклеточные опухоли.
DSRCT связан с уникальной хромосомной транслокацией t (11; 22) (p13: q12)[4] в результате EWS-WT1 расшифровка слияния[5] это диагностика этой опухоли.[6] Этот транскрипт кодирует белок, который включает N-концевой домен трансактивации EWSR1 и ДНК-связывающий домен WT1.
Мишени продукта транслокации EWS / WT1 ENT4.[7] ENT4 также известен как PMAT.
Патология
Сущность была впервые описана патологами Уильямом Л. Джеральдом и Хуан Росай в 1989 г.[8] Патология выявляет четко очерченные узелки твердой опухоли внутри плотной десмопластической ткани. строма. Часто присутствуют участки центрального некроза. Опухолевые клетки имеют гиперхроматические ядра с повышенным соотношением ядер / цитоплазмы.[нужна цитата ]
По данным иммуногистохимии, эти клетки обладают трилинейной коэкспрессией, включая эпителиальный маркер цитокератин, мезенхимальные маркеры десмин и виментин и нейрональный маркер нейрон-специфической энолазы. Т.о., хотя первоначально предполагалось, что оно имеет мезотелиальное происхождение из-за сайтов презентации, теперь предполагается, что он возникает из клетки-предшественника с мультифенотипической дифференцировкой.
Диагностика
Дифференциальная диагностика
Поскольку это редкая опухоль, не многие семейные врачи или онкологи знакомы с этим заболеванием. DSRCT у молодых пациентов можно принять за другие опухоли брюшной полости, включая рабдомиосаркома, нейробластома, и мезентериальный карциноид. У пожилых пациентов DSRCT может напоминать лимфома, перитонеальная мезотелиома, и перитонеальный карциноматоз. У мужчин DSRCT может быть ошибочно принят за половая клетка или же Рак яичек в то время как у женщин DSRCT может быть ошибочно принят за рак яичников. DSRCT имеет общие характеристики с другими мелкоклеточными синеклеточными раками, включая саркому Юинга, острый лейкоз, мелкоклеточную мезотелиому, нейробластому, примитивная нейроэктодермальная опухоль, рабдомиосаркома, и опухоль Вильмса.
Уход
DSRCT часто поставлен неверный диагноз. Взрослых пациентов всегда следует направлять к специалисту по саркоме. Это агрессивная, редкая, быстро распространяющаяся опухоль, и как педиатрические, так и взрослые пациенты должны лечиться в центре саркомы.
Стандартного протокола лечения болезни не существует;[9] однако в недавних журналах и исследованиях сообщалось, что некоторые пациенты реагируют на высокие дозы (протокол P6) химиотерапия, поддерживающая химиотерапия, операция по уменьшению массы воды, циторедуктивная хирургия, и радиационная терапия. Другие варианты лечения включают: трансплантация гемопоэтических стволовых клеток, лучевая терапия с модуляцией интенсивности, радиочастотная абляция, стереотаксическая лучевая терапия тела, внутрибрюшинная гипертермическая химиоперфузия, и клинические испытания.
Прогноз
Прогноз для DSRCT остается плохим.[10] Прогноз зависит от стадии рака. Поскольку болезнь может быть неправильно диагностирована или оставаться невыявленной, опухоли часто разрастаются в брюшной полости и метастазировать или семя в другие части тела.
Орган или место происхождения неизвестны. DSRCT может метастазировать через лимфатические узлы или кровоток. Места метастазирования включают селезенку, диафрагму, печень, толстую и тонкую кишку, легкие, центральную нервную систему, кости, матку, мочевой пузырь, гениталии, брюшную полость и мозг.
Мультимодальный подход высокодозной химиотерапии, агрессивной хирургической резекции,[11] радиация и спасение стволовых клеток улучшают выживаемость некоторых пациентов. Отчеты показали, что пациенты сначала реагируют на химиотерапию и лечение первой линии, но рецидивы являются обычным явлением.
Некоторым пациентам в стадии ремиссии или с неоперабельной опухолью, похоже, помогает долгосрочная химиотерапия с низкими дозами, что превращает DSRCT в хроническое заболевание.
Исследование
Примеры и перспективы в этом разделе может не представлять мировое мнение предмета. (Июль 2016) (Узнайте, как и когда удалить этот шаблон сообщения) |
Фонд Стелин[12] в настоящее время предлагает пациентам DSRCT возможность бесплатно отправлять образцы своих опухолей для тестирования. Ученые-исследователи выращивают образцы на голых мышах и тестируют различные химические вещества, чтобы определить, какие из них наиболее эффективны против опухоли человека.
Пациенты с расширенным DSRCT могут иметь право на участие в клинические испытания которые исследуют новые лекарства для лечения болезни.
В Фонд Кори Монзинго это 501 (c) (3) организация который поддерживает исследования методов лечения и лечения DSRCT. Фонд Кори Монзинго финансирует онкологический центр доктора медицины Андерсона, а также может предоставлять финансирование другим некоммерческим организациям, занимающимся исследованием рака.
В 2002 году Нишио и другие,[13] создали новую линию опухолевых клеток человека, полученную из плеврального выпота пациента с типичной интраабдоминальной DSRCT, названной JN-DSRCT-1[14] которые теперь можно использовать в исследованиях.
В 2018 г. детская исследовательская больница Сент-Джуда предоставила ресурсы Сети солидных опухолей у детей, которая по запросу предоставляет доступ к ортотопическим ксенотрансплантатам, полученным от пациентов.[15]
Альтернативные названия
Это заболевание также известно как: десмопластический небольшая круглая голубоклеточная опухоль; внутрибрюшная десмопластическая маленькая круглая синеклеточная опухоль; десмопластическая мелкоклеточная опухоль; десмопластический рак; десмопластическая саркома; DSRCT.
Нет связи с перитонеальная мезотелиома это еще одно заболевание, которое иногда называют десмопластическим.
Смотрите также
- Кейт Грейнджер (1981–2016), английский врач, чей диагноз DSRCT привел к ее кампании за лучший уход за пациентами и сбор средств на исследования рака.
Рекомендации
- ^ ЗАЩИЩЕНО, INSERM US14 - ВСЕ ПРАВА. "Орфанет: Десмопластическая мелкоклеточная опухоль". www.orpha.net. Получено 17 ноября 2019.
- ^ Lee YS, Hsiao CH: Десмопластическая мелкоклеточная опухоль: клинико-патологическое, иммуногистохимическое и молекулярное исследование четырех пациентов. J Formos Med Assoc 2007; 106: 854–860.
- ^ Блэнд А.Е., Шах А.А., Писцителли Дж.Т., Бентли Р.К., Секорд А.А. (2007). «Десмопластическая мелкоклеточная опухоль, маскирующаяся под распространенный рак яичников». Int J Gynecol Cancer. 18 (4): 847–50. Дои:10.1111 / j.1525-1438.2007.01110.x. PMID 18081791.
- ^ Мерфи А.Дж., Епископ К., Перейра С. и др. (Декабрь 2008 г.). «Новый молекулярный вариант десмопластической мелкоклеточной опухоли: значение иммуноокрашивания WT1 в этой сущности». Гм. Патол. 39 (12): 1763–70. Дои:10.1016 / j.humpath.2008.04.019. PMID 18703217.
- ^ Джеральд В.Л., Хабер Д.А. (июнь 2005 г.). «Слияние гена EWS-WT1 в десмопластической мелкоклеточной опухоли». Семин. Рак Биол. 15 (3): 197–205. Дои:10.1016 / j.semcancer.2005.01.005. PMID 15826834.
- ^ Ли Ю.С., Сяо СН (2007). «Десмопластическая мелкоклеточная опухоль: клинико-патологическое, иммуногистохимическое и молекулярное исследование четырех пациентов». Дж. Формос. Med. Assoc. 106 (10): 854–60. Дои:10.1016 / S0929-6646 (08) 60051-0. PMID 17964965.[постоянная мертвая ссылка ]
- ^ Ли Х., Смолен Г.А., Бирс Л.Ф. и др. (2008). «Переносчик аденозина ENT4 является прямой мишенью продукта транслокации EWS / WT1 и высоко экспрессируется в десмопластической мелкоклеточной опухоли». PLOS ONE. 3 (6): e2353. Bibcode:2008PLoSO ... 3.2353L. Дои:10.1371 / journal.pone.0002353. ЧВК 2394657. PMID 18523561.

- ^ Джеральд, W. L .; Розай, Дж. (1989). «Случай 2. Десмопластическая мелкоклеточная опухоль с дивергентной дифференцировкой». Педиатр. Патол. 9 (2): 177–83. Дои:10.3109/15513818909022347. PMID 2473463.
- ^ Таларико Ф., Юско Д., Негри Л., Белинелли Д.: Комбинированная резекция и мультиагентная адъювантная химиотерапия для внутрибрюшной десмопластической мелкоклеточной опухоли: отчет о болезни и обзор литературы. G Chir 2007; 28: 367–370.
- ^ Лал Д.Р., Су В.Т., Волден С.Л., Ло К.С., Модак С., Ла Квалья МП (январь 2005 г.). «Результаты мультимодального лечения десмопластических мелкоклеточных опухолей». J. Pediatr. Surg. 40 (1): 251–5. Дои:10.1016 / j.jpedsurg.2004.09.046. PMID 15868593.
- ^ Таларико Ф., Юско Д., Негри Л., Белинелли Д. (октябрь 2007 г.). «Комбинированная резекция и мультиагентная адъювантная химиотерапия при внутрибрюшной десмопластической мелкоклеточной опухоли: описание случая и обзор литературы». G Чир. 28 (10): 367–70. PMID 17915050.
- ^ Официальный сайт Stehlin Foundation
- ^ Нисио, Джун; Ивасаки, Хироши; Исигуро, Масако; Одзими, Юко; Фудзита, Чикако; Янаи, Фумио; Нибу, Кейко; Мицудоме, Акихиса; Канеко, Ясухико (сентябрь 2002 г.). «Создание и характеристика новой линии клеток десмопластической мелкоклеточной опухоли человека, JN-DSRCT-1». Лабораторные исследования; Журнал технических методов и патологии. 82 (9): 1175–1182. Дои:10.1097 / 01.LAB.0000028059.92642.03. ISSN 0023-6837. PMID 12218078.
- ^ "Jn-Dsrct-1".
- ^ "Детская исследовательская больница Святого Иуды".
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |
