Неорганическая химия - Википедия - Inorganic chemistry

А: Диборан Особенности необычная связь
B: Хлорид цезия имеет архетипический Кристальная структура
C: Fp2 является металлоорганический сложный
D: Силиконовый диапазон использования от грудные импланты к Глупая замазка
E: Катализатор Граббса выиграл Нобелевская премия 2005 г. за его первооткрыватель
F: Цеолиты найти широкое применение как молекулярные сита
ГРАММ: Ацетат меди (II) удивлен теоретики с этими диамагнетизм
Неорганическая химия имеет дело с синтез и поведение неорганический и металлоорганический соединения. Это поле охватывает химические соединения которые не основаны на углероде, которые являются предметом органическая химия. Различие между этими двумя дисциплинами далеко не абсолютное, так как есть много совпадений в субдисциплине металлоорганическая химия. Он находит применение во всех аспектах химической промышленности, включая катализ, материаловедение, пигменты, поверхностно-активные вещества, покрытия, лекарства, топливо, и сельское хозяйство.[1]
Ключевые идеи

Много неорганические соединения находятся ионные соединения, состоящий из катионы и анионы присоединились ионная связь. Примеры солей (которые являются ионными соединениями): хлорид магния MgCl2, который состоит из магний катионы Mg2+ и хлористый анионы Cl−; или же оксид натрия Na2O, который состоит из натрий катионы Na+ и окись анионы O2−. В любой соли пропорции ионов таковы, что электрические заряды нейтрализуются, так что основная масса соединения электрически нейтральна. Ионы описываются их степень окисления и об их легкости образования можно судить по потенциал ионизации (для катионов) или из электронное сродство (анионы) родительских элементов.
Важными классами неорганических соединений являются оксиды, то карбонаты, то сульфаты, а галогениды. Многие неорганические соединения характеризуются высоким точки плавления. Неорганические соли обычно бедны проводники в твердом состоянии. Другие важные особенности включают их высокую температуру плавления и простоту кристаллизация. Где некоторые соли (например, NaCl ) хорошо растворимы в воде, другие (например, FeS ) не.
Простейший неорганическая реакция является двойное перемещение при смешивании двух солей ионы меняются местами без изменения степени окисления. В окислительно-восстановительные реакции один реагент, окислитель, снижает его степень окисления, а другой реагент, восстановитель, имеет повышенную степень окисления. Чистый результат - обмен электроны. Электронный обмен может происходить и косвенно, например, в батареи, ключевая концепция в электрохимия.
Когда один реагент содержит атомы водорода, реакция может происходить путем обмена протонами в кислотно-щелочная химия. В более общем определении любой химический элемент, способный связываться с электронными парами, называется Кислота Льюиса; и наоборот, любая молекула, которая стремится отдать пару электронов, называется База Льюиса. В качестве уточнения кислотно-основных взаимодействий Теория HSAB учитывает поляризуемость и размер ионов.
Неорганические соединения встречаются в природе как минералы. Почва может содержать сульфид железа в виде пирит или сульфат кальция как гипс. Неорганические соединения также могут выполнять несколько задач одновременно. биомолекулы: как электролиты (хлорид натрия ), в накопителе энергии (АТФ ) или в строительстве ( полифосфат позвоночник в ДНК ).
Первым важным искусственным неорганическим соединением было нитрат аммония для удобрения почвы через Процесс Габера. Неорганические соединения синтезируются для использования в качестве катализаторы Такие как оксид ванадия (V) и хлорид титана (III), или как реагенты в органическая химия Такие как литийалюминийгидрид.
Подразделения неорганической химии: металлоорганическая химия, кластерная химия и биоинорганическая химия. Эти области являются активными областями исследований в области неорганической химии, направленными на новые катализаторы, сверхпроводники, и терапии.
Промышленная неорганическая химия
Неорганическая химия - очень практичная область науки. Традиционно масштабы национальной экономики можно было оценить по их производству серной кислоты. Производство удобрений - еще одно практическое применение промышленной неорганической химии.
Описательная неорганическая химия
В описательной неорганической химии основное внимание уделяется классификации соединений на основе их свойств. Частично классификация фокусируется на положении в периодической таблице самого тяжелого элемента (элемента с наибольшим атомным весом) в соединении, частично путем группировки соединений по их структурному сходству.
Классификации неорганической химии:
Координационные соединения
Классические координационные соединения содержат металлы, связанные с "одинокие пары "электронов, находящихся на атомах основной группы лигандов, таких как H2O, NH3, Cl−, и CN−. В современных координационных соединениях в качестве лигандов можно использовать почти все органические и неорганические соединения. «Металл» обычно - это металл из групп 3-13, а также транс-лантаноиды и транс-актиниды, но с определенной точки зрения все химические соединения можно описать как координационные комплексы.
Стереохимия координационных комплексов может быть довольно богатой, на что указывает Вернер разделение двух энантиомеры из [Co ((OH)2Co (NH3)4)3]6+, ранняя демонстрация того, что хиральность не присуща органическим соединениям. Актуальной темой в рамках данной специализации является супрамолекулярная координационная химия.[2]
- Примеры: [Co (EDTA )]−, [Co (NH3)6]3+, TiCl4 (THF )2.
Соединения основной группы

Эти виды имеют элементы из группы I, II, III, IV, V, VI, VII, 0 (исключая водород) периодической таблицы. Из-за их часто схожей реакционной способности элементы группы 3 (Sc, Y, и Ла ) и группа 12 (Zn, CD, и Hg ) также обычно включены, а лантаноиды и актиниды иногда также включаются.[3]
Соединения основной группы были известны с начала химии, например, элементарные сера и дистиллируемый белый фосфор. Опыты на кислороде, О2, к Лавуазье и Пристли не только определил важный двухатомный газа, но открыли возможность описания соединений и реакций в соответствии с стехиометрический соотношения. Открытие практического синтеза аммиак использование железных катализаторов Карл Бош и Фриц Габер в начале 1900-х годов оказали глубокое влияние на человечество, продемонстрировав важность неорганического химического синтеза. Типичными соединениями основной группы являются SiO2, SnCl4, и н2О. Многие соединения основной группы также можно классифицировать как «металлоорганические», поскольку они содержат органические группы, например, B (CH3 )3). Соединения основной группы также встречаются в природе, например, фосфат в ДНК, и поэтому может быть отнесен к биоинорганическим. И наоборот, органические соединения, не содержащие (многих) водородных лигандов, можно классифицировать как «неорганические», такие как фуллерены, бакитубы и бинарные оксиды углерода.
- Примеры: тетранитрид тетрасеры S4N4, диборан B2ЧАС6, силиконы, бакминстерфуллерен C60.
Соединения переходных металлов
Соединения, содержащие металлы от 4 до 11 группы, считаются соединениями переходных металлов. Соединения с металлом из группы 3 или 12 иногда также включаются в эту группу, но также часто классифицируются как соединения основной группы.
Соединения переходных металлов демонстрируют богатую координационную химию, варьирующуюся от тетраэдрической для титана (например, TiCl4) до плоско-квадратного для некоторых комплексов никеля до октаэдрического для координационных комплексов кобальта. Ряд переходных металлов можно найти в биологически важных соединениях, таких как железо в гемоглобине.
- Примеры: пентакарбонил железа, тетрахлорид титана, цисплатин
Металлоорганические соединения

Обычно считается, что металлоорганические соединения содержат группу M-C-H.[4] Металл (M) в этих разновидностях может быть элементом основной группы или переходным металлом. С практической точки зрения определение металлоорганического соединения более мягкое и включает также липофильный такие комплексы как карбонилы металлов и даже металл алкоксиды.
Металлоорганические соединения в основном считаются особой категорией, потому что органические лиганды часто чувствительны к гидролизу или окислению, поэтому в металлоорганической химии используются более специализированные препаративные методы, чем это было традиционно для комплексов Вернера. Синтетическая методология, особенно способность манипулировать комплексами в растворителях с низкой координирующей способностью, позволила исследовать очень слабо координирующие лиганды, такие как углеводороды, H2, и н2. Поскольку лиганды в некотором смысле являются нефтехимическими продуктами, область металлоорганической химии извлекла огромную пользу из ее актуальности для промышленности.
- Примеры: Димер дикарбонила циклопентадиенильного железа (C5ЧАС5) Fe (CO)2CH3, Ферроцен Fe (C5ЧАС5)2, Гексакарбонил молибдена Пн (CO)6, Диборан B2ЧАС6, Тетракис (трифенилфосфин) палладий (0) Pd [P (C6ЧАС5)3]4
Кластерные соединения
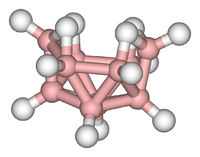

Кластеры можно найти во всех классах химические соединения. Согласно общепринятому определению, кластер состоит как минимум из треугольного набора атомов, которые непосредственно связаны друг с другом. Но диметаллические комплексы, связанные металл-металл, очень важны для этой области. Кластеры встречаются в «чистых» неорганических системах, металлоорганической химии, химии основных групп и биоинорганической химии. Различие между очень большими кластерами и сыпучими веществами становится все более размытым. Этот интерфейс - химическая основа нанонауки или нанотехнологии и, в частности, возникают в результате изучения квантовые размерные эффекты в селенид кадмия кластеры. Таким образом, большие кластеры можно описать как массив связанных атомов, промежуточных по характеру между молекулой и твердым телом.
- Примеры: Fe3(CO)12, B10ЧАС14, [Пн6Cl14]2−, 4Fe-4S
Биоинорганические соединения

По определению, эти соединения встречаются в природе, но подполе включают антропогенные виды, такие как загрязнители (например, метилртуть ) и наркотики (например, Цисплатин ).[5] Область, которая включает многие аспекты биохимии, включает множество видов соединений, например, фосфаты в ДНК, а также комплексы металлов, содержащие лиганды, которые варьируются от биологических макромолекул, обычно пептиды, до плохо определенных видов, таких как гуминовая кислота, и чтобы воды (например, согласовано с гадолиний комплексы, используемые для МРТ ). Традиционно биоинорганическая химия фокусируется на переносе электронов и энергии в белках, имеющих отношение к дыханию. Лечебная неорганическая химия включает изучение как несущественных, так и основные элементы с приложениями для диагностики и лечения.
- Примеры: гемоглобин, метилртуть, карбоксипептидаза
Твердотельные соединения
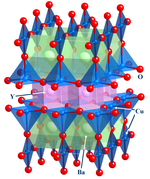
В этой важной области основное внимание уделяется структура,[6] склеивание и физические свойства материалов. На практике неорганическая химия твердого тела использует такие методы, как кристаллография чтобы получить представление о свойствах, возникающих в результате коллективного взаимодействия между субъединицами твердого тела. В химию твердого тела входят металлы и их сплавы или интерметаллические производные. Связанные поля физика конденсированного состояния, минералогия, и материаловедение.
- Примеры: кремниевые чипы, цеолиты, YBa2Cu3О7
Теоретическая неорганическая химия
Альтернативный взгляд на область неорганической химии начинается с Модель Бора атома и, используя инструменты и модели теоретическая химия и вычислительная химия, переходит в связывание простых, а затем и более сложных молекул. Точное квантово-механическое описание многоэлектронных частиц - область неорганической химии - затруднено. Эта проблема породила множество полуколичественных или полуэмпирических подходов, включая теория молекулярных орбиталей и теория поля лигандов, Параллельно с этими теоретическими описаниями используются приблизительные методики, в том числе теория функционала плотности.
Исключения из теорий, качественные и количественные, чрезвычайно важны в развитии этой области. Например, CuII2(OAc)4(ЧАС2O)2 почти диамагнитен при температуре ниже комнатной, тогда как теория кристаллического поля предсказывает, что молекула будет иметь два неспаренных электрона. Несогласие между качественной теорией (парамагнетик) и наблюдением (диамагнетизм) привело к развитию моделей «магнитной связи». Эти улучшенные модели привели к разработке новых магнитных материалов и новых технологий.
Качественные теории

Неорганическая химия извлекла большую пользу из качественных теорий. Такие теории легче изучать, поскольку они не требуют большого опыта в квантовой теории. В составе соединений основной группы, VSEPR теория убедительно предсказывает или, по крайней мере, рационализирует структуры соединений основной группы, например, объяснение того, почему NH3 пирамидальный, тогда как ClF3 имеет Т-образную форму. Для переходных металлов теория кристаллического поля позволяет понять магнетизм многих простых комплексов, например, почему [FeIII(CN)6]3− имеет только один неспаренный электрон, тогда как [FeIII(ЧАС2O)6]3+ имеет пять. Особенно эффективный качественный подход к оценке структуры и реакционной способности начинается с классификации молекул в соответствии с счет электронов, акцентируя внимание на количестве валентные электроны, обычно у центрального атома в молекуле.
Молекулярная теория групп симметрии
Центральным конструктом неорганической химии является теория молекулярная симметрия.[7] Математическая теория групп предоставляет язык для описания форм молекул в соответствии с их точечная групповая симметрия. Теория групп также позволяет факторизовать и упростить теоретические вычисления.
Спектроскопические особенности анализируются и описываются с учетом свойств симметрии, среди прочего, колебательные или электронные состояния. Знание свойств симметрии основного и возбужденного состояний позволяет прогнозировать числа и интенсивности поглощения в колебательных и электронных спектрах. Классическим применением теории групп является предсказание количества колебаний C-O в замещенных карбонильных комплексах металлов. Наиболее распространенные применения симметрии в спектроскопии включают колебательные и электронные спектры.
Теория групп подчеркивает общие черты и различия в связях между разными видами. Например, орбитали на основе металлов трансформируются одинаково для WF6 и Вт (CO)6, но энергии и населенности этих орбиталей существенно различаются. Подобные отношения существуют CO2 и молекулярный дифторид бериллия.
Термодинамика и неорганическая химия
Альтернативный количественный подход к неорганической химии фокусируется на энергии реакций. Этот подход очень традиционный и эмпирический, но это тоже полезно. Общие концепции, сформулированные в термодинамических терминах, включают: окислительно-восстановительный потенциал, кислотность, фаза изменения. Классическая концепция неорганической термодинамики - это Цикл Борна-Габера, который используется для оценки энергии элементарных процессов, таких как электронное сродство, некоторые из которых нельзя наблюдать напрямую.
Механистическая неорганическая химия
Важный аспект неорганической химии сосредоточен на путях реакций, т.е. механизмы реакции.
Элементы основной группы и лантаноиды
Механизмы основных групповых соединений 13-18 групп обычно обсуждаются в контексте органической химии (в конце концов, органические соединения являются соединениями главной группы). Элементы тяжелее C, N, O и F часто образуют соединения с большим количеством электронов, чем предсказывали ученые. Правило октета, как описано в статье о гипервалентный молекулы. По этой причине механизмы их реакций отличаются от органических соединений. Элементы легче, чем углерод (B, Быть, Ли ) а также Al и Mg часто образуют электронодефицитные структуры, электронно похожие на карбокатионы. Такие электронодефицитные виды обычно реагируют ассоциативными путями. Химический состав лантаноидов отражает многие аспекты химии алюминия.
Комплексы переходных металлов
Соединения переходных металлов и основных групп часто реагируют по-разному.[8] Важная роль d-орбиталей в связывании сильно влияет на пути и скорость замещения и диссоциации лиганда. Эти темы освещаются в статьях на координационная химия и лиганд. Наблюдаются как ассоциативные, так и диссоциативные пути.
Всеобъемлющим аспектом механистической химии переходных металлов является кинетическая лабильность комплекса, иллюстрируемая обменом свободной и связанной воды в прототипных комплексах [M (H2O)6]п +:
- [M (H2O)6]п + + 6 часов2O * → [M (H2О *)6]п + + 6 часов2О
- где H2O * обозначает изотопно обогащенная вода, например, H217О
Скорость водообмена варьируется на 20 порядков по таблице Менделеева, причем комплексы лантанидов находятся на одном полюсе, а соединения Ir (III) являются самыми медленными.
Редокс-реакции
Для переходных элементов преобладают окислительно-восстановительные реакции. Рассмотрены два класса окислительно-восстановительных реакций: реакции с переносом атома, такие как окислительное присоединение / восстановительное отщепление и электронный перенос. Фундаментальная окислительно-восстановительная реакция - это «самообмен», который включает выродиться реакция между окислителем и восстановителем. Например, перманганат и его одноэлектронный приведенный родственник манганат обменять один электрон:
- [MnO4]− + [Mn * O4]2− → [MnO4]2− + [Mn * O4]−
Реакции на лиганды
Координированные лиганды проявляют реактивность, отличную от свободных лигандов. Например, кислотность аммиачных лигандов в [Co (NH3)6]3+ повышен относительно NH3 сам. Алкены, связанные с катионами металлов, реактивны по отношению к нуклеофилам, тогда как алкены обычно не реагируют. Большой и промышленно важный район г. катализ зависит от способности металлов изменять реакционную способность органических лигандов. Гомогенный катализ происходит в растворе и гетерогенный катализ происходит когда газообразный или же растворенный субстраты взаимодействуют с поверхностями твердых тел. Традиционно гомогенный катализ считается частью металлоорганической химии и гетерогенный катализ обсуждается в контексте наука о поверхности, подраздел химии твердого тела. Но основные принципы неорганической химии те же. Переходные металлы почти уникальным образом реагируют с небольшими молекулами, такими как CO, H2, O2, а C2ЧАС4. Промышленное значение этого сырья стимулирует активную область катализа. Лиганды также могут вступать в реакции переноса лиганда, такие как трансметалляция.
Характеристика неорганических соединений
Из-за разнообразия элементов и, соответственно, разнообразных свойств получаемых производных неорганическая химия тесно связана со многими методами анализа. Старые методы, как правило, изучали объемные свойства, такие как электропроводность растворов, точки плавления, растворимость, и кислотность. С появлением квантовая теория и соответствующее расширение электронной аппаратуры, были введены новые инструменты для исследования электронных свойств неорганических молекул и твердых тел. Часто эти измерения дают представление о теоретических моделях. Например, измерения на фотоэлектронный спектр из метан продемонстрировал, что описание связи двухцентровыми двухэлектронными связями, предсказанными между углеродом и водородом, с использованием Теория Валентности Бонда не подходит для простого описания процессов ионизации. Такое понимание привело к популяризации теория молекулярных орбиталей поскольку полностью делокализованные орбитали являются более подходящим простым описанием удаления электронов и электронного возбуждения.
Наиболее часто встречающиеся техники:
- Рентгеновская кристаллография: Этот метод позволяет 3D-определение молекулярные структуры.
- Интерферометр с двойной поляризацией: Этот метод измеряет конформация и конформационное изменение молекул.
- Различные формы спектроскопия
- Ультрафиолетовая и видимая спектроскопия: Исторически это был важный инструмент, так как многие неорганические соединения сильно окрашены.
- ЯМР-спектроскопия: Помимо 1ЧАС и 13C многие другие "хорошие" ядра ЯМР (например, 11B, 19F, 31п, и 195Pt ) дают важную информацию о свойствах и структуре соединения. Также ЯМР парамагнитных частиц может дать важную структурную информацию. Протонный ЯМР также важен, потому что ядро легкого водорода нелегко обнаружить с помощью рентгеновской кристаллографии.
- ИК-спектроскопия: В основном для поглощения от карбонильные лиганды
- Электронно-ядерный двойной резонанс (ENDOR) спектроскопия
- Мессбауэровская спектроскопия
- Электронно-спиновой резонанс: ESR (или EPR) позволяет измерять окружающую среду парамагнитный металлические центры.
- Электрохимия: Циклическая вольтамперометрия и связанные методы исследуют окислительно-восстановительные характеристики соединений.
Синтетическая неорганическая химия
Хотя некоторые неорганические вещества можно получить в чистом виде в природе, большинство из них синтезируется на химических заводах и в лаборатории.
Методы неорганического синтеза можно грубо классифицировать по летучести или растворимости составляющих реагентов.[9] Растворимые неорганические соединения получают методами органический синтез. Для металлосодержащих соединений, реактивных по отношению к воздуху, Линия Шленка и бардачок техники соблюдаются. С летучими соединениями и газами манипулируют в «вакуумных коллекторах», состоящих из стеклянных трубопроводов, соединенных между собой через клапаны, из которых можно полностью откачать до 0,001 мм рт. Ст. Или меньше. Соединения конденсируются с использованием жидкий азот (b.p. 78K) или другие криогены. Твердые вещества обычно готовят в трубчатых печах, реагенты и продукты запечатывают в контейнеры, часто сделанные из плавленого кварца (аморфный SiO2), но иногда и из более специализированных материалов, таких как сварные трубы из Та или «лодочки» из Pt. Продукты и реагенты транспортируются между температурными зонами для запуска реакций.
Смотрите также
Рекомендации
- ^ «Карьера в химии: неорганическая химия». Американское химическое общество. Архивировано из оригинал на 2012-10-29.
- ^ Лен, Дж. М. (1995). Супрамолекулярная химия: концепции и перспективы. Вайнхайм: ВЧ. ISBN 978-3-527-29311-7.
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- ^ Elschenbroich, C .; Зальцер, А. (1992). Металлоорганические соединения: краткое введение (2-е изд.). Вайнхайм: Wiley-VCH. ISBN 978-3-527-28164-0.
- ^ С.Дж. Липпард; Дж. М. Берг (1994). Принципы биоинорганической химии. Милл-Вэлли, Калифорния: Университетские научные книги. ISBN 978-0-935702-73-6.
- ^ Уэллс, А.Ф. (1984). Структурная неорганическая химия. Оксфорд: Clarendon Press.
- ^ Коттон, Ф.А. (1990). Химические приложения теории групп (3-е изд.). Нью-Йорк: Джон Вили и сыновья. ISBN 978-0-471-51094-9.
- ^ R.G. Уилкинс (1991). Кинетика и механизм реакций комплексов переходных металлов. (2-е изд.). Wiley-VCH. ISBN 978-3-527-28389-7.
- ^ Girolami, G.S .; Rauchfuss, T.B .; Анжеличи, Р.Дж. (1999). Синтез и техника в неорганической химии (3-е изд.). Милл-Вэлли, Калифорния: Университетские научные книги. ISBN 978-0-935702-48-4.

