Оптической когерентной томографии - Optical coherence tomography
Эта статья поднимает множество проблем. Пожалуйста помоги Улучши это или обсудите эти вопросы на страница обсуждения. (Узнайте, как и когда удалить эти сообщения-шаблоны) (Узнайте, как и когда удалить этот шаблон сообщения)
|
| Оптической когерентной томографии | |
|---|---|
 Оптическая когерентная томография (ОКТ) изображения саркома | |
| MeSH | D041623 |
| Код ОПС-301 | 3-300 |
Оптической когерентной томографии (Октябрь) - это метод визуализации, использующий низкая когерентность свет для захвата микрометр -разрешение, двух- и трехмерное изображение изнутри оптическое рассеяние среды (например, биологическая ткань). Он используется для медицинская визуализация и промышленные неразрушающий контроль (НК). Оптическая когерентная томография основана на низкой когерентности. интерферометрия, обычно с использованием ближний инфракрасный свет. Использование относительно долгого длина волны свет позволяет ему проникать в рассеивающую среду. Конфокальная микроскопия, другой оптический метод, обычно менее глубоко проникает в образец, но с более высоким разрешением.
В зависимости от свойств источника света (суперлюминесцентные диоды, лазеры ультракоротких импульсов, и суперконтинуум лазеров), оптическая когерентная томография достигла суб-микрометр разрешение (с источниками очень широкого спектра, излучающими в диапазоне длин волн ~ 100 нм).[нужна цитата ][требуется проверка ]
Оптическая когерентная томография является одним из классов оптический томографический техники.[нужна цитата ] Имеющиеся в продаже системы оптической когерентной томографии используются в различных приложениях, включая сохранение произведений искусства и диагностическую медицину, особенно в офтальмология и оптометрия где его можно использовать для получения подробных изображений изнутри сетчатки.[нужна цитата ] В последнее время его также начали использовать в интервенционных кардиология для диагностики ишемической болезни сердца,[1] И в дерматология для улучшения диагностики.[2] Относительно недавняя реализация оптической когерентной томографии, частотная область оптическая когерентная томография, дает преимущества в сигнал-шум предусмотрена, что позволяет быстрее получать сигнал.[нужна цитата ]
Введение

Начиная с работы Адольфа Ферчера и его коллег по интерферометрии низкой, частичной когерентности или белого света для in vivo глазные измерения[3][4] в Вене в 1980-х годах визуализация биологических тканей, особенно человеческого глаза, параллельно исследовалась несколькими группами по всему миру. Первый двумерный in vivo Изображение глазного дна человека вдоль горизонтального меридиана на основе интерферометрического сканирования глубины в белом свете было представлено на конференции ICO-15 SAT в 1990 году.[5] Дальнейшая разработка в 1990 году Наохиро Танно,[6][7] затем он был профессором Университета Ямагата, и с 1991 года это называлось гетеродинной томографией отражения, а с 1991 года Хуанг и др. в проф. Джеймс Фудзимото лаборатория в Массачусетский Институт Технологий,[8] который успешно ввел термин «оптическая когерентная томография». С тех пор ОКТ с микрометрическим разрешением и возможностями визуализации поперечного сечения превратилась в выдающуюся биомедицинскую технику визуализации тканей, которая постоянно приобретает новые технические возможности, начиная с раннего обнаружения электронных сигналов, за счет использования широкополосных лазеров и линейных массивов пикселей до сверхбыстрых настраиваемых лазеров для расширить диапазон его характеристик и чувствительности.
Он особенно подходит для офтальмологических применений и других изображений тканей, требующих микрометрового разрешения и миллиметровой глубины проникновения.[9] Первый in vivo ОКТ-изображения, показывающие структуры сетчатки, были опубликованы в 1993 году, а первые эндоскопические изображения - в 1997 году.[10][11] OCT также использовался для различных сохранение искусства проекты, где он используется для анализа различных слоев рисунка. ОКТ имеет интересные преимущества перед другими системами медицинской визуализации. Медицинское УЗИ, магнитно-резонансная томография (МРТ), конфокальная микроскопия и ОКТ по-разному подходят для морфологической визуализации тканей: в то время как первые два имеют возможность визуализации всего тела, но с низким разрешением (обычно доли миллиметра), третий может обеспечивать изображения с разрешением значительно ниже 1 микрометра. (т.е. субклеточный), глубиной от 0 до 100 микрометров, а четвертый может зондировать на глубину до 500 микрометров, но с более низким (то есть архитектурным) разрешением (около 10 микрометров в поперечном направлении и несколько микрометров в глубину в офтальмологии, например, и 20 микрометров в латеральном направлении при эндоскопии).[12][13]
OCT основан на низкокогерентная интерферометрия.[14][15][страница нужна ][4] В обычной интерферометрии с длинным длина когерентности (т.е. лазерная интерферометрия) интерференция света происходит на расстоянии до метров. В ОКТ эта интерференция сокращается до микрометров благодаря использованию широкополосных источников света (то есть источников, излучающих свет в широком диапазоне частот). Свет с широкой полосой пропускания может быть получен с помощью суперлюминесцентных диодов или лазеров с очень короткими импульсами (фемтосекундные лазеры ). Белый свет - это пример широкополосного источника с меньшей мощностью.
Свет в системе ОКТ разделяется на два плеча - плечо образца (содержащее интересующий объект) и эталонное плечо (обычно зеркало). Комбинация отраженного света от плеча образца и эталонного света от эталонного плеча приводит к интерференционной картине, но только в том случае, если свет от обоих плеч прошел «одинаковое» оптическое расстояние («одинаковое» означает разницу меньше когерентности длина). Сканируя зеркало в эталонном плече, можно получить профиль отражательной способности образца (это ОКТ во временной области). Области образца, которые отражают много света, будут создавать большие помехи, чем области, которые этого не делают. Любой свет, выходящий за пределы короткой длины когерентности, не будет мешать.[16] Этот профиль отражательной способности, называемый Сканирование, содержит информацию о пространственных размерах и расположении структур внутри интересующего объекта. Томограф поперечного сечения (B-сканирование ) может быть достигнута путем бокового комбинирования серии этих осевых сканирований глубины (А-сканирование). Получение изображения лица на заданной глубине возможно в зависимости от используемого механизма обработки изображений.
Объяснение непрофессионала
Эта секция нужны дополнительные цитаты для проверка. (Март 2019 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |


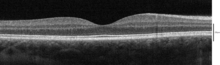
Оптическая когерентная томография, или «ОКТ», представляет собой метод получения изображений подповерхности полупрозрачных или непрозрачных материалов с разрешением, эквивалентным маломощному микроскопу. По сути, это «оптический ультразвук», отображающий отражения внутри ткани для получения изображений поперечного сечения.[17]
ОКТ привлекла внимание медицинского сообщества, поскольку позволяет получать изображения морфологии тканей с гораздо более высоким разрешением (менее 10 мкм в осевом направлении и менее 20 мкм в латеральном направлении).[18] ), чем другие методы визуализации, такие как МРТ или УЗИ.
Ключевые преимущества OCT:
- Живые изображения подповерхности с разрешением, близким к микроскопическому
- Мгновенное прямое отображение морфологии тканей
- Без подготовки образца или предмета, без контакта
- Без ионизирующего излучения
OCT обеспечивает высокое разрешение, поскольку основан на свете, а не на звуке или радиочастоте. Оптический луч направляется на ткань, и собирается небольшая часть этого света, которая отражается от подповерхностных элементов. Обратите внимание, что большая часть света не отражается, а скорее рассеивается под большими углами. При обычном формировании изображений этот диффузно рассеянный свет вносит вклад в фон, который затемняет изображение. Однако в ОКТ метод, называемый интерферометрией, используется для записи длины оптического пути полученных фотонов, что позволяет отклонить большинство фотонов, которые многократно рассеиваются перед обнаружением. Таким образом, ОКТ может создавать четкие трехмерные изображения толстых образцов, отклоняя фоновый сигнал и собирая свет, непосредственно отраженный от интересующих поверхностей.
В рамках ряда неинвазивных методов трехмерной визуализации, которые были представлены медицинскому исследовательскому сообществу, ОКТ как эхо-метод похожа на ультразвуковая визуализация. Другие методы медицинской визуализации, такие как компьютерная аксиальная томография, магнитно-резонансная томография или позитронно-эмиссионная томография, не используют принцип эхолокации.[19]
Методика ограничивается визуализацией на 1-2 мм ниже поверхности биологической ткани, потому что на больших глубинах доля света, который уходит без рассеяния, слишком мала для обнаружения. Никакой специальной подготовки биологического образца не требуется, изображения можно получить «бесконтактно» или через прозрачное окно или мембрану. Также важно отметить, что мощность лазера от инструментов низкая - используется безопасный для глаз ближний инфракрасный свет - и поэтому вероятность повреждения образца отсутствует.
Теория
Принцип ОКТ - интерферометрия с использованием белого света или низкой когерентности. Оптическая установка обычно состоит из интерферометра (рис. 1, обычно Михельсон тип) с низкокогерентным широкополосным источником света. Свет разделяется на эталонное плечо и образец и рекомбинирует соответственно.

 Рис. 1. Оптическая схема полнопольного ОКТ. Компоненты включают в себя: суперлюминесцентный диод (SLD), выпуклую линзу (L1), светоделитель 50/50 (BS), объектив камеры (CO), камеру CMOS-DSP (CAM), эталон (REF) и образец (SMP). Камера функционирует как двумерная детекторная матрица, а с помощью метода ОКТ, облегчающего сканирование в глубину, достигается неинвазивное устройство трехмерной визуализации. |

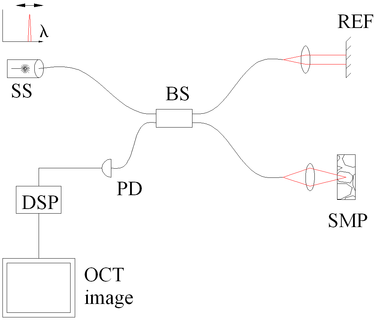 Рис. 3 Спектральная дискриминация ОКТ с качающимся источником. Компоненты включают в себя: качающийся источник или настраиваемый лазер (SS), светоделитель (BS), эталонное зеркало (REF), образец (SMP), фотодетектор (PD) и цифровую обработку сигналов (DSP). |
Область времени
В временной области ОКТ длине пути опорного плеча изменяется во времени (опорное зеркало переводится в продольном направлении). Свойство интерферометрии с низкой когерентностью состоит в том, что интерференция, то есть последовательность темных и ярких полос, достигается только тогда, когда разность хода лежит в пределах длины когерентности источника света. Эта интерференция называется автокорреляцией в симметричном интерферометре (оба плеча имеют одинаковую отражательную способность) или взаимной корреляцией в общем случае. Огибающая этой модуляции изменяется по мере изменения разности длины пути, где пик огибающей соответствует согласованию длины пути.
Интерференция двух частично когерентных световых лучей может быть выражена через интенсивность источника: , так как
где представляет собой коэффициент светоделения интерферометра, а называется комплексной степени когерентности, т.е. вмешательство огибающей и несущей в зависимости от сканирования опорного плеча или временной задержки , и чье восстановление представляет интерес для ОКТ. Из-за эффекта стробирования когерентности ОКТ комплексная степень когерентности представлена как гауссова функция, выраженная как[4]
где представляет собой спектральную ширину источника в оптической частотной области, а - центральная оптическая частота источника. В уравнении (2) огибающая Гаусса модулируется по амплитуде оптической несущей. Пик этой огибающей представляет собой расположение микроструктуры испытуемого образца с амплитудой, зависящей от отражательной способности поверхности. Оптический носитель из-за Эффект Допплера возникает в результате сканирования одного плеча интерферометра, и частота этой модуляции контролируется скоростью сканирования. Следовательно, перемещение одного плеча интерферометра выполняет две функции; сканирование по глубине и оптическая несущая с доплеровским смещением осуществляются путем изменения длины пути. В OCT оптическая несущая с доплеровским смещением имеет частоту, выражаемую как
где - центральная оптическая частота источника, - скорость сканирования изменения длины пути, а это скорость света.

Осевое и латеральное разрешение ОКТ отделены друг от друга; первая эквивалентна длине когерентности источника света, а вторая является функцией оптики. Осевое разрешение ОКТ определяется как
где и - соответственно центральная длина волны и спектральная ширина источника света.[20]
Частотный диапазон
В частотной области OCT (FD-OCT) широкополосные помехи регистрируются с помощью спектрально разделенных детекторов. Двумя общими подходами являются ОКТ с качающимся источником и спектральная область. OCT источника с разверткой кодирует оптическую частоту во времени с помощью источника со сканированием спектра. ОКТ в спектральной области использует дисперсионный детектор, такой как решетка и линейная матрица детекторов, для разделения различных длин волн. Из-за Фурье отношение (Теорема Винера-Хинчина между автокорреляции и спектральной плотности мощности) глубина сканирования может быть немедленно рассчитывается путем Фурье-преобразования из полученного спектра, без перемещения опорного плеча.[21][22] Эта функция значительно увеличивает скорость визуализации, в то время как уменьшенные потери во время одного сканирования улучшают отношение сигнал / шум пропорционально количеству элементов обнаружения. Параллельное обнаружение в нескольких диапазонах длин волн ограничивает диапазон сканирования, а полная спектральная полоса частот устанавливает осевое разрешение.[23]
Пространственно закодированный
ОКТ с пространственно-кодированной частотной областью (SEFD-OCT, спектральная область или ОКТ в Фурье-области) извлекает спектральную информацию, распределяя различные оптические частоты на полосу детектора (линейно-матричный ПЗС или КМОП) через дисперсионный элемент (см. Рис. 4). Таким образом, информация о сканировании полной глубины может быть получена за одну экспозицию. Однако преимущество FD-OCT в отношении большого отношения сигнал / шум уменьшается из-за более низкого динамического диапазона полосковых детекторов по сравнению с одиночными светочувствительными диодами, что приводит к соотношению сигнал / шум (сигнал-шум ) преимущество ~ 10 дБ на гораздо более высоких скоростях. Однако это не представляет большой проблемы при работе на длине волны 1300 нм, поскольку динамический диапазон не является серьезной проблемой в этом диапазоне длин волн.[20]
Недостатки этой технологии заключаются в сильном падении отношения сигнал / шум, которое пропорционально расстоянию от нулевой задержки, и снижению чувствительности, зависящей от глубины, по типу sinc из-за ограниченной ширины линии обнаружения. (Один пиксель обнаруживает квазипрямоугольную часть оптического частотного диапазона вместо одной частоты, преобразование Фурье приводит к поведению sinc (z)). Кроме того, диспергирующие элементы в спектроскопическом детекторе обычно не распределяют свет равномерно по частоте на детекторе, а в большинстве случаев имеют обратную зависимость. Следовательно, перед обработкой сигнал должен быть повторно дискретизирован, что не может учитывать разницу в локальной (пиксельной) полосе пропускания, что приводит к дальнейшему снижению качества сигнала. Однако падение не является серьезной проблемой при разработке ПЗС нового поколения или фотодиод массив с большим количеством пикселей.
Обнаружение гетеродина на синтетической матрице предлагает другой подход к этой проблеме без необходимости большого разброса.
Закодированное время
OCT с временной кодировкой в частотной области (TEFD-OCT или OCT с разверткой источника) пытается объединить некоторые преимущества стандартных TD и SEFD-OCT. Здесь спектральные составляющие не кодируются пространственным разделением, а кодируются во времени. Спектр либо фильтруется, либо генерируется за один последовательный шаг по частоте и восстанавливается перед преобразованием Фурье. При размещении частоты сканирования источника света (т.е. частота сканирование лазерной) оптические установки (см. Фиг.3) становится проще, чем SEFD, но проблема сканирования, по существу, в перевод с TD-OCT ссылочной руки в TEFD-OCT свет Здесь преимущество заключается в проверенной технологии обнаружения с высоким отношением сигнал / шум, в то время как источники лазера с разверткой обеспечивают очень малую мгновенную полосу пропускания (ширину линии) на очень высоких частотах (20–200 кГц). Недостатками являются нелинейность длины волны (особенно на высоких частотах сканирования), расширение ширины линии на высоких частотах и высокая чувствительность к перемещению геометрии сканирования или образца (ниже диапазона нанометров в пределах последовательных шагов частоты).
Полное поле OCT

Визуализирующий подход к височной ОКТ был разработан командой Клода Боккара в 1998 г.[24] с получением изображений без сканирования луча. В этом методе, называемом ОКТ с полным полем (FF-OCT), в отличие от других методов ОКТ, которые получают поперечные сечения образца, изображения здесь «на лице», то есть как изображения в классической микроскопии: ортогональны световому лучу освещения. .[25]
Более точно, интерференционные изображения создаются с помощью интерферометра Майкельсона, где разность длины пути изменяется за счет быстрого электрического компонента (как правило, пьезоэлектрический зеркала в опорном плече). Эти изображения, полученные камерой CCD, комбинируются при последующей обработке (или в режиме онлайн) методом интерферометрии с фазовым сдвигом, когда обычно получают 2 или 4 изображения за период модуляции, в зависимости от используемого алгоритма.[26][27]
Таким образом, "анфас" томографические изображения создаются с помощью широкопольного освещения, обеспечиваемого конфигурацией Линника интерферометра Майкельсона, в которой объектив микроскопа используется в обоих плечах. Кроме того, хотя временная когерентность источника должна оставаться низкой, как в классической ОКТ (т.е. широкий спектр), пространственная когерентность также должна быть низкой, чтобы избежать паразитных помех (т.е. источник с большим размером).[28]
Линейное поле (конфокальное) ОКТ
Конфокальная оптическая когерентная томография с линейным полем (LC-OCT) - это метод визуализации, основанный на принципе ОКТ во временной области с линейным освещением с использованием широкополосного лазера и обнаружением линий с помощью камеры с линейным сканированием.[29] LC-OCT производит B-сканы в реальном времени из нескольких A-сканов, полученных параллельно. Изображения на лицо также можно получить, сканируя линию освещения вбок.[30] Фокус постоянно регулируется во время сканирования образца по глубине, используя объектив микроскопа с высокой числовой апертурой (NA) для получения изображений с высоким поперечным разрешением. Используя суперконтинуумный лазер в качестве источника света, достигается квазиизотропное пространственное разрешение ~ 1 мкм на центральной длине волны ~ 800 нм. С другой стороны, линейное освещение и обнаружение в сочетании с использованием объектива микроскопа с высокой числовой апертурой создают конфокальный вентиль, который предотвращает обнаружение камерой большей части рассеянного света, который не влияет на сигнал. Этот конфокальный вентиль, который отсутствует в методике полнопольной ОКТ, дает LC-OCT преимущество с точки зрения чувствительности обнаружения и проникновения в сильно рассеивающие среды, такие как ткани кожи.[31] До сих пор этот метод использовался в основном для визуализации кожи в дерматологии.[32] и косметология.[33]
Схемы сканирования
Фокусировка светового луча в точку на поверхности исследуемого образца и рекомбинация отраженного света с эталоном даст интерферограмму с информацией об образце, соответствующей одному A-сканированию (только ось Z). Сканирование образца может выполняться либо сканированием света на образце, либо перемещением тестируемого образца. Линейное сканирование даст двумерный набор данных, соответствующий изображению поперечного сечения (сканирование по осям X-Z), тогда как сканирование области обеспечивает трехмерный набор данных, соответствующий объемному изображению (сканирование по осям X-Y-Z).
Единая точка
Системы, основанные на одноточечной, конфокальной или временной области ОКТ, должны сканировать образец в двух боковых измерениях и восстанавливать трехмерное изображение, используя информацию о глубине, полученную с помощью когерентного стробирования через осевую сканирующую опорную руку (рис.2). . Двумерное поперечное сканирование реализовано электромеханически путем перемещения образца.[22] используя платформу трансляции, и используя новый сканер микроэлектромеханической системы.[34]
Параллельный
Параллельное или полное поле OCT с использованием устройство с зарядовой связью Использовалась (CCD) камера, в которой образец освещается в полном поле и отображается на экране с помощью CCD, что исключает электромеханическое поперечное сканирование. Шагая по эталонному зеркалу и последовательно записывая анфас изображения в трехмерном представлении могут быть восстановлены. Трехмерная ОКТ с использованием камеры CCD была продемонстрирована в пошаговой технике,[35] используя геометрический фазовый сдвиг с Интерферометр Линника,[36] используя пару ПЗС и детектор гетеродина,[37] а также в интерферометре Линника с колеблющимся опорным зеркалом и столиком осевого трансляции.[38] Центральное место в ПЗС подхода является необходимость либо очень быстро или ПЗС-матрицы генерация носителей отдельно к опорному шаговый зеркало, чтобы отслеживать высокочастотный OCT носитель.
Матрица интеллектуальных детекторов
Двумерная матрица интеллектуальных детекторов, изготовленная с использованием 2 мкм комплементарный металл-оксид-полупроводник (CMOS), был использован для демонстрации полного поля TD-OCT.[39] Благодаря несложной оптической схеме (рис. 3), каждый пиксель матрицы интеллектуальных детекторов 58x58 пикселей действовал как отдельный фотодиод и включал в себя собственную схему аппаратной демодуляции.
Избранные приложения
Оптическая когерентная томография - это признанный метод медицинской визуализации, который используется в нескольких медицинских специальностях, включая офтальмологию и кардиологию, и широко используется в приложениях для фундаментальных научных исследований.
Офтальмология
Глазная (или офтальмологическая) ОКТ широко используется офтальмологи и Оптометристы для получения изображений высокого разрешения сетчатка и передний сегмент. Благодаря способности ОКТ отображать поперечные сечения слоев ткани с микрометрическим разрешением, ОКТ обеспечивает простой метод оценки сотовая организация, фоторецепторная целостность,[40][41][42][43] и аксональный толщина в глаукома,[44] дегенерация желтого пятна,[45] диабетический макулярный отек,[46] рассеянный склероз[47] и другие глазные болезни или системные патологии с глазными признаками.[48] Кроме того, офтальмологи используют ОКТ для оценки состояния сосудов сетчатки с помощью техники, называемой ОКТ-ангиографией (ОКТА).[49]
Кардиология и внутрисосудистые применения
В условиях кардиологии ОКТ используется для визуализации коронарные артерии для визуализации морфологии и микроструктуры просвета сосудистой стенки с разрешением, в 10 раз превышающим разрешение других существующих методов, таких как внутрисосудистое ультразвуковое исследование и рентгеновская ангиография (Интракоронарная оптическая когерентная томография ). Для этого типа применения используются волоконно-оптические катетеры диаметром около 1 мм для доступа к просвету артерии с помощью полуинвазивных вмешательств, т.е. Чрезкожное коронарное вмешательство.
О первой демонстрации эндоскопической ОКТ сообщили в 1997 году исследователи лаборатории Джеймса Фудзимото Массачусетского технологического института, в том числе проф. Гильермо Джеймс Тирни и проф. Бретт Баума.[50] Первый катетер и система для визуализации TD-OCT были коммерциализированы LightLab Imaging, Inc., компания, базирующаяся в Массачусетсе в 2006 году. Первое исследование с использованием FD-OCT было проведено лабораторией профессора Гильермо Дж. Тирни и профессора Бретта Баума, базирующейся в Массачусетская больница общего профиля в 2008.[51] Внутрисосудистая ФД-ОКТ была впервые представлена на рынке в 2009 году компанией LightLab Imaging, Inc.[52] и Терумо Корпорация представила второе решение для визуализации коронарных артерий в 2012 году. Более высокая скорость визуализации с помощью FD-OCT позволила широко использовать эту технологию визуализации для визуализации коронарных артерий. По оценкам, ежегодно выполняется более 100 000 случаев коронарной визуализации методом FD-OCT, и что рынок ежегодно увеличивается примерно на 20%.[53]
Внутрисосудистая ОКТ также была исследована для использования в нейрососудистых приложениях, включая визуализацию для руководства эндоваскулярным лечением ишемического инсульта и аневризм головного мозга.[54] Клиническое использование было ограничено проксимальной внутричерепной анатомией пациента с ограниченной извилистостью, что демонстрирует потенциал ОКТ для визуализации сосудисто-нервного заболевания.[55] В 2020 году была предложена конструкция внутрисосудистого катетера для ОКТ-визуализации, адаптированная для использования в сложной нервно-сосудистой анатомии.[56]
Дальнейшие разработки внутрисосудистой ОКТ включали комбинацию с другими методами оптической визуализации (мультимодальная визуализация). OCT был объединен с флуоресцентная молекулярная визуализация для повышения его способности одновременно обнаруживать молекулярную / функциональную и морфологическую информацию о тканях.[57] Аналогичным образом была продемонстрирована комбинация с ближней инфракрасной спектроскопией.
Онкология
Эндоскопическая ОКТ применяется для обнаружения и диагностики рак и предраковые поражения, такие как Пищевод Барретта и пищевода дисплазия.[58]
Дерматология
Первое использование ОКТ в дерматологии относится к 1997 году.[59] С тех пор ОКТ применяется для диагностики различных кожных поражений, включая карциномы.[60][61][62] Однако диагностика меланомы с помощью традиционной ОКТ затруднена, особенно из-за недостаточного разрешения изображения.[63] Новые методы ОКТ с высоким разрешением, такие как LC-OCT, могут улучшить клинический диагностический процесс, позволяя раннее обнаруживать злокачественные опухоли кожи, включая меланому, и сокращать количество хирургических иссечений доброкачественных образований.[64] Другие многообещающие области применения включают визуализацию поражений, где иссечение опасно или невозможно, и руководство хирургическим вмешательством путем выявления границ опухоли.
Стоматология
Исследователи из Токийского медицинского и стоматологического университета смогли обнаружить белые пятна на эмали вокруг и под ортодонтическими скобами с помощью ОКТ с развернутым источником.[65]
Приложения для исследований
Исследователи использовали ОКТ для получения подробных изображений мозга мышей через «окно» из диоксида циркония, которое было модифицировано, чтобы стать прозрачным и имплантировано в череп.[66] Оптическая когерентная томография также применима и все чаще используется в промышленное применение, такие как неразрушающий контроль (NDT), измерения толщины материала,[67] и, в частности, тонкие кремниевые пластины[68][69] и измерения толщины полупроводниковых пластин[70][71] определение шероховатости поверхности, визуализация поверхности и поперечного сечения[72][73] и измерения потерь объема. Системы OCT с обратной связью могут использоваться для управления производственными процессами. Благодаря высокой скорости сбора данных,[74] и субмикронное разрешение, ОКТ можно адаптировать для выполнения как в оперативном, так и в автономном режиме.[75] Из-за большого объема производимых таблеток интересной областью применения является фармацевтическая промышленность для контроля покрытия таблеток.[76] Оптоволоконные системы OCT особенно хорошо адаптируются к промышленным условиям. Ref>Валецки В.Дж., Сонди Ф., Ван А. (30 апреля 2009 г.). Сяо Х, Фань С. (ред.). «Волоконно-оптическая низкокогерентная ИК-интерферометрия для производства оборонных датчиков» (PDF). Proc. SPIE. Фотонные микроустройства / микроструктуры для зондирования. 7322: 73220К. Bibcode:2009SPIE.7322E..0кВт. Дои:10.1117/12.818381. S2CID 120168355. Они могут получить доступ и сканировать внутренности труднодоступных мест,[77] и могут работать в агрессивных средах - радиоактивных, криогенных или очень горячих.[78] В настоящее время разрабатываются новые технологии оптической биомедицинской диагностики и визуализации для решения проблем биологии и медицины.[79] По состоянию на 2014 год были предприняты попытки использовать оптическую когерентную томографию для идентификации корневых каналов в зубах, в частности канала в моляре верхней челюсти, однако нет никаких различий с современными методами стоматологического операционного микроскопа.[80][81][неосновной источник необходим ] Исследование, проведенное в 2015 году, позволило успешно использовать смартфон в качестве платформы OCT, хотя еще предстоит проделать большую работу, прежде чем такая платформа станет коммерчески жизнеспособной.[82]
Смотрите также
- Низкокогерентная интерферометрия с угловым разрешением
- Баллистический фотон
- Конфокальная микроскопия
- Интерферометрия
- Интракоронарная оптическая когерентная томография
- Leica Microsystems
- Медицинская визуализация
- Novacam Technologies
- Обнаружение оптического гетеродина
- Оптическая проекционная томография
- Терагерцовая томография
- Томография
использованная литература
- ^ Безерра Х. Г., Коста М. А., Гуаглими Дж., Роллинз А. М., Саймон Д. И. (ноябрь 2009 г.). «Интракоронарная оптическая когерентная томография: всесторонний обзор клинических и исследовательских приложений». JACC. Сердечно-сосудистые вмешательства. 2 (11): 1035–46. Дои:10.1016 / j.jcin.2009.06.019. ЧВК 4113036. PMID 19926041.
- ^ Чуа С. (2015). "Оптическая когерентная томография высокого разрешения для изучения развития болезни" (PDF). Бюллетень дерматологии. 26 (1): 2–3. Получено 28 мая 2015.
- ^ Ферчер А.Ф., Рот Э. (15 сентября 1986 г.). Мюллер GJ (ред.). «Офтальмологическая лазерная интерферометрия». Proc. SPIE. Оптическое оборудование для биомедицинских лазерных приложений. 658: 48–51. Bibcode:1986SPIE..658 ... 48F. Дои:10.1117/12.938523. S2CID 122883903.
- ^ а б c Ферчер А.Ф., Менгедохт К., Вернер В. (март 1988 г.). «Измерение длины глаза с помощью интерферометрии с частично когерентным светом». Письма об оптике. 13 (3): 186–8. Bibcode:1988OptL ... 13..186F. Дои:10.1364 / OL.13.000186. PMID 19742022.
- ^ Ферчер А.Ф. (12–16 августа 1990 г.). «Офтальмологическая интерферометрия». В von Bally G, Khanna S (ред.). Материалы Международной конференции по оптике в науках о жизни. Гармиш-Партенкирхен, Германия. С. 221–228. ISBN 0-444-89860-3.
- ^ Наохиро Танно, Цутому Итикава, Акио Саэки: «Измерение отражения световой волны», патент Японии № 2010042 (1990) (японский язык)
- ^ Синдзи Чиба; Наохиро Танно (1991). Оптическая гетеродинная томография с обратным рассеянием. 14-й симпозиум по лазерному зондированию (на японском языке).
- ^ Хуанг Д., Суонсон Э.А., Лин С.П., Шуман Дж. С., Стинсон В. Г., Чанг В. и др. (Ноябрь 1991 г.). "Оптической когерентной томографии". Наука. 254 (5035): 1178–81. Bibcode:1991Наука ... 254.1178H. Дои:10.1126 / science.1957169. ЧВК 4638169. PMID 1957169.
- ^ Зиск AM, Нгуен FT, Ольденбург AL, Marks DL, Boppart SA (2007). «Оптическая когерентная томография: обзор клинических разработок от лаборатории до постели больного». Журнал биомедицинской оптики. 12 (5): 051403. Bibcode:2007JBO .... 12e1403Z. Дои:10.1117/1.2793736. PMID 17994864. S2CID 20621284.
- ^ Ферчер А.Ф., Хитценбергер С.К., Дрекслер В., Камп Г., Саттманн Х. (июль 1993 г.). «Оптическая когерентная томография in vivo». Американский журнал офтальмологии. 116 (1): 113–4. Дои:10.1016 / S0002-9394 (14) 71762-3. PMID 8328536.
- ^ Swanson EA, Izatt JA, Hee MR, Huang D, Lin CP, Schuman JS, et al. (Ноябрь 1993 г.). «Визуализация сетчатки in vivo с помощью оптической когерентной томографии». Письма об оптике. 18 (21): 1864–6. Bibcode:1993OptL ... 18.1864S. Дои:10.1364 / OL.18.001864. PMID 19829430. S2CID 21218566.
- ^ Дрекслер В., Моргнер Ю., Ганта Р.К., Кертнер Ф.Х., Шуман Дж. С., Фудзимото Дж. Г. (апрель 2001 г.). «Офтальмологическая оптическая когерентная томография сверхвысокого разрешения». Природа Медицина. 7 (4): 502–7. Дои:10.1038/86589. ЧВК 1950821. PMID 11283681.
- ^ Кауфман С.К., Муш Д.К., Белин М.В., Коэн Э.Дж., Мейслер Д.М., Рейнхарт В.Дж. и др. (Февраль 2004 г.). «Конфокальная микроскопия: отчет Американской академии офтальмологии». Офтальмология. 111 (2): 396–406. Дои:10.1016 / j.ophtha.2003.12.002. PMID 15019397.
- ^ Ридерер SJ (2000). «Современные технические разработки магнитно-резонансной томографии». Журнал IEEE Engineering in Medicine and Biology. 19 (5): 34–41. Дои:10.1109/51.870229. PMID 11016028.
- ^ М. Борн; Э. Вольф (2000). Принципы оптики: электромагнитная теория распространения, интерференции и дифракции света. Издательство Кембриджского университета. ISBN 978-0-521-78449-8.
- ^ Fujimoto JG, Pitris C, Boppart SA, Brezinski ME (2000). «Оптическая когерентная томография: новая технология для биомедицинской визуализации и оптической биопсии». Неоплазия. 2 (1–2): 9–25. Дои:10.1038 / sj.neo.7900071. ЧВК 1531864. PMID 10933065.
- ^ Микеси М, Люсентефорте Э, Оддоне Ф, Браззелли М, Парравано М, Франчи С. и др. (Ноябрь 2015 г.). «Визуализация головки зрительного нерва и волоконного слоя для диагностики глаукомы». Кокрановская база данных систематических обзоров (11): CD008803. Дои:10.1002 / 14651858.CD008803.pub2. ЧВК 4732281. PMID 26618332.
- ^ Дрекслер В., Моргнер Ю., Кертнер Ф.Х., Питрис С., Боппарт С.А., Ли XD и др. (Сентябрь 1999 г.). «Оптическая когерентная томография сверхвысокого разрешения in vivo». Письма об оптике. OSA. 24 (17): 1221–3. Дои:10.1364 / bio.1999.jwa2. PMID 18073990.
- ^ «Оптическая когерентная томография обеспечивает лучшее разрешение, чем МРТ, и помогает диагностировать заболевания сетчатки и роговицы, а также глаукому, часть II». mastereyeassociates.com. mastereyeassociates. 13 июня 2017 г.. Получено 13 июня, 2017.
- ^ а б Гарг А (2014). ОКТ переднего и заднего сегментов: современные технологии и будущие приложения, 1-е издание.
- ^ Шмитт Дж. М. (1999). «Оптическая когерентная томография (ОКТ): обзор». IEEE Journal of Selected Topics in Quantum Electronics. 5 (4): 1205–1215. Bibcode:1999IJSTQ ... 5.1205S. Дои:10.1109/2944.796348. S2CID 6102146.
- ^ а б Ферчер А.Ф., Хитценбергер С.К., Камп Г., Эль-Заят С.Ю. (1995). «Измерение внутриглазных расстояний методом спектральной интерферометрии обратного рассеяния». Оптика Коммуникации. 117 (1–2): 43–48. Bibcode:1995OptCo.117 ... 43F. Дои:10.1016 / 0030-4018 (95) 00119-С.
- ^ де Бур JF, Leitgeb R, Wojtkowski M (июль 2017 г.). «Двадцать пять лет оптической когерентной томографии: изменение парадигмы в чувствительности и скорости, обеспечиваемое ОКТ в области Фурье [Приглашено]». Биомедицинская оптика Экспресс. 8 (7): 3248–3280. Дои:10.1364 / BOE.8.003248. ЧВК 5508826. PMID 28717565.
- ^ Beaurepaire E, Boccara AC, Lebec M, Blanchot L, Saint-Jalmes H (февраль 1998 г.). «Полнопольная оптическая когерентная микроскопия». Письма об оптике. 23 (4): 244–6. Bibcode:1998OptL ... 23..244B. Дои:10.1364 / ол.23.000244. PMID 18084473.
- ^ Дюбуа А., Боккара С. (октябрь 2006 г.). «[OCT с полным полем]». Médecine / Науки (На французском). 22 (10): 859–64. Дои:10.1051 / medsci / 20062210859. PMID 17026940.
- ^ Дюбуа А., Монерон Г., Боккара С. (2006). «Тепловая световая полнопольная оптическая когерентная томография в диапазоне длин волн 1,2 мкм» (PDF). Оптика Коммуникации. 266 (2): 738–743. Bibcode:2006OptCo.266..738D. Дои:10.1016 / j.optcom.2006.05.016.
- ^ Боккара А.С., Хармс Ф., Латрайв А (2013). «Полнопольная ОКТ: неинвазивный инструмент для диагностики и отбора тканей». Отдел новостей SPIE. Дои:10.1117/2.1201306.004933. S2CID 123478275.
- ^ Боккара А.С., Дюбуа А. (2013). "Оптической когерентной томографии". Оптика в инструментах. С. 101–123. Дои:10.1002 / 9781118574386.ch3. ISBN 9781118574386.
- ^ Дюбуа А., Левек О., Азимани Х., Дэвис А., Огиен Дж., Сирет Д., Барут А. (декабрь 2018 г.). «Конфокальная оптическая когерентная томография во временной области с линейным полем и динамической фокусировкой». Оптика Экспресс. 26 (26): 33534–33542. Bibcode:2018OExpr..2633534D. Дои:10.1364 / OE.26.033534. PMID 30650800.
- ^ Огиен Дж., Левек О., Азимани Х., Дюбуа А. (март 2020 г.). "in vivo". Биомедицинская оптика Экспресс. 11 (3): 1327–1335. Дои:10.1364 / BOE.385303. ЧВК 7075601. PMID 32206413.
- ^ Чен Ю., Хуанг С.В., Агирре А.Д., Фудзимото Дж. Г. (июль 2007 г.). «Сканирующая оптическая когерентная микроскопия высокого разрешения». Письма об оптике. 32 (14): 1971–3. Bibcode:2007 ОптL ... 32.1971C. Дои:10.1364 / OL.32.001971. PMID 17632613.
- ^ Дюбуа А., Левек О., Азимани Х., Сирет Д., Барут А., Суппа М. и др. (Октябрь 2018 г.). «Конфокальная оптическая когерентная томография с линейным полем для неинвазивной визуализации опухолей кожи с высоким разрешением». Журнал биомедицинской оптики. 23 (10): 106007. Bibcode:2018JBO .... 23j6007D. Дои:10.1117 / 1.JBO.23.10.106007. PMID 30353716.
- ^ Pedrazzani M, Breugnot J, Rouaud-Tinguely P, Cazalas M, Davis A, Bordes S, et al. (Май 2020 г.). «Сравнение изображений конфокальной оптической когерентной томографии с линейным полем с гистологическими срезами: проверка нового метода in vivo и неинвазивного количественного определения толщины поверхностной дермы». Исследования и технологии кожи. 26 (3): 398–404. Дои:10.1111 / srt.12815. PMID 31799766. S2CID 208622348.
- ^ Йео Дж. Т., Ян В. X., Чахван А., Гордон М. Л., Ци Б., Виткин И. А., Уилсон BC, Гольденберг А. А. (2005). «Микромашинный двухмерный сканер для трехмерной оптической когерентной томографии». Датчики и исполнительные механизмы A: физические. 117 (2): 331–340. Дои:10.1016 / j.sna.2004.06.021.
- ^ Dunsby C, Gu Y, French P (январь 2003 г.). «Однократная фазо-ступенчатая когерентная визуализация в широком поле». Оптика Экспресс. 11 (2): 105–15. Bibcode:2003OExpr..11..105D. Дои:10.1364 / OE.11.000105. PMID 19461712.
- ^ Рой М., Сван П., Черел Л., Шеппард CJ (2002). «Геометрический фазовращатель для малокогерентной интерференционной микроскопии». Оптика и лазеры в технике. 37 (6): 631–641. Bibcode:2002OptLE..37..631R. Дои:10.1016 / S0143-8166 (01) 00146-4.
- ^ Акиба М., Чан К.П., Танно Н. (май 2003 г.). «Полнопольная оптическая когерентная томография с помощью двухмерного гетеродинного обнаружения с помощью пары камер CCD». Письма об оптике. 28 (10): 816–8. Bibcode:2003OptL ... 28..816A. Дои:10.1364 / OL.28.000816. PMID 12779156.
- ^ Dubois A, Vabre L, Boccara AC, Beaurepaire E (февраль 2002 г.). «Полнопольная оптическая когерентная томография высокого разрешения с микроскопом Линника». Прикладная оптика. 41 (4): 805–12. Bibcode:2002ApOpt..41..805D. Дои:10.1364 / AO.41.000805. PMID 11993929.
- ^ Буркин С., Зейтц П., Салате Р.П. (апрель 2001 г.). «Оптическая когерентная топография на основе двумерной матрицы интеллектуальных детекторов». Письма об оптике. 26 (8): 512–4. Bibcode:2001OptL ... 26..512B. Дои:10.1364 / OL.26.000512. PMID 18040369.
- ^ "Азбука ОКТ". Обзор оптометрии.
- ^ Шерман Дж. (Июнь 2009 г.). «Линия целостности фоторецепторов соединяет слой нервных волокон, что является ключом к клинической диагностике». Оптометрии. 80 (6): 277–8. Дои:10.1016 / j.optm.2008.12.006. PMID 19465337.
- ^ «Внешние слои сетчатки как предикторы потери зрения». Обзор офтальмологии.
- ^ Куэнка Н., Ортуньо-Лисаран I, Пинилья I (март 2018 г.). «Клеточная характеристика ОКТ и внешних полос сетчатки с использованием специфических иммуногистохимических маркеров и клинического применения». Офтальмология. 125 (3): 407–422. Дои:10.1016 / j.ophtha.2017.09.016. HDL:10045/74474. PMID 29037595.
- ^ Гревал Д.С., Танна А.П. (март 2013 г.). «Диагностика глаукомы и обнаружение прогрессирования глаукомы с помощью оптической когерентной томографии спектральной области». Текущее мнение в офтальмологии. 24 (2): 150–61. Дои:10.1097 / ICU.0b013e32835d9e27. PMID 23328662. S2CID 39039199.
- ^ Кин ПА, Патель П.Дж., Лиакопулос С., Хойссен Ф.М., Садда С.Р., Туфаил А. (сентябрь 2012 г.). «Оценка возрастной дегенерации желтого пятна с помощью оптической когерентной томографии». Обзор офтальмологии. 57 (5): 389–414. Дои:10.1016 / j.survophthal.2012.01.006. PMID 22898648.
- ^ Вирджили Дж., Менчини Ф., Казазза Дж., Хогг Р., Дас Р. Р., Ван Х, Мичелеси М. (январь 2015 г.). «Оптическая когерентная томография (ОКТ) для выявления отека желтого пятна у пациентов с диабетической ретинопатией». Кокрановская база данных систематических обзоров. 1: CD008081. Дои:10.1002 / 14651858.CD008081.pub3. ЧВК 4438571. PMID 25564068.
- ^ Dörr J, Wernecke KD, Bock M, Gaede G, Wuerfel JT, Pfueller CF и др. (Апрель 2011 г.). «Связь поражения сетчатки и желтого пятна с атрофией мозга при рассеянном склерозе». PLOS ONE. 6 (4): e18132. Bibcode:2011PLoSO ... 618132D. Дои:10.1371 / journal.pone.0018132. ЧВК 3072966. PMID 21494659.

- ^ Айк Ках Т (2018). «Синдром CuRRL: серия случаев» (PDF). Acta Scientific Ophthalmology. 1: 9–13 - через https://actascientific.com/ASOP/pdf/ASOP-01-0016.pdf.
- ^ Kashani AH, Chen CL, Gahm JK, Zheng F, Richter GM, Rosenfeld PJ, et al. (Сентябрь 2017 г.). «Оптическая когерентная томографическая ангиография: всесторонний обзор современных методов и клинических приложений». Прогресс в исследованиях сетчатки и глаз. 60: 66–100. Дои:10.1016 / j.preteyeres.2017.07.002. ЧВК 5600872. PMID 28760677.
- ^ Tearney GJ, Brezinski ME, Bouma BE, Boppart SA, Pitris C, Southern JF, Fujimoto JG (июнь 1997 г.). «Эндоскопическая оптическая биопсия in vivo с оптической когерентной томографией». Наука. 276 (5321): 2037–9. Дои:10.1126 / science.276.5321.2037. PMID 9197265. S2CID 43035300.
- ^ Тирни Г.Дж., Ваксман С., Шишков М., Вакок Б.Дж., Сутер М.Дж., Фрейлих М.И. и др. (Ноябрь 2008 г.). «Трехмерная микроскопия коронарных артерий с помощью интракоронарной оптической визуализации в частотной области». JACC. Сердечно-сосудистые изображения. 1 (6): 752–61. Дои:10.1016 / j.jcmg.2008.06.007. ЧВК 2852244. PMID 19356512.
- ^ «LightLab запускает FD-OCT в Европе». Получено 9 сентября 2016.
- ^ Swanson E (13 июня 2016 г.). «Оптическая когерентная томография: помимо лучшего клинического лечения: экономическое влияние ОКТ». Мир Биооптики. Получено 9 сентября 2016.
- ^ Chen CJ, Kumar JS, Chen SH, Ding D, Buell TJ, Sur S и др. (Апрель 2018). "Оптическая когерентная томография: будущее применение в визуализации сосудов головного мозга". Инсульт. 49 (4): 1044–1050. Дои:10.1161 / STROKEAHA.117.019818. PMID 29491139.
- ^ Сюй Х, Ли М, Лю Р, Инь Цюй, Ши Х, Ван Ф и др. (Август 2020 г.). «Оптическая когерентная томография для оценки стеноза вертебробазилярной артерии: серия клинических случаев и обзор литературы». Журнал нейроинтервенционной хирургии. 12 (8): 809–813. Дои:10.1136 / нейринтсург-2019-015660. PMID 32066569. S2CID 211159079.
- ^ Уги Г.Дж., Маросфой М.Г., Кинг Р.М., Карофф Дж., Петерсон Л.М., Дункан Б.Х. и др. (Июль 2020 г.). «Система нейрососудистой высокочастотной оптической когерентной томографии позволяет проводить цереброваскулярную объемную микроскопию in situ». Nature Communications. 11 (1): 3851. Bibcode:2020NatCo..11.3851U. Дои:10.1038 / s41467-020-17702-7. ЧВК 7395105. PMID 32737314.
- ^ Ughi GJ, Wang H, Gerbaud E, Gardecki JA, Fard AM, Hamidi E, et al. (Ноябрь 2016 г.). «Клиническая характеристика коронарного атеросклероза с помощью двухкомпонентной ОКТ и автофлуоресцентной визуализации в ближнем инфракрасном диапазоне». JACC. Сердечно-сосудистые изображения. 9 (11): 1304–1314. Дои:10.1016 / j.jcmg.2015.11.020. ЧВК 5010789. PMID 26971006.
- ^ «ОКТ нового поколения для пищевода». Мир Биооптики. 1 мая 2013 г.. Получено 9 сентября 2016.
- ^ Welzel J, Lankenau E, Birngruber R, Engelhardt R (декабрь 1997 г.). «Оптическая когерентная томография кожи человека». Журнал Американской академии дерматологии. 37 (6): 958–63. Дои:10.1016 / S0190-9622 (97) 70072-0. PMID 9418764.
- ^ Бун М.А., Норренберг С., Джемек Г.Б., Дель Мармол В. (октябрь 2012 г.). «Визуализация базальноклеточной карциномы с помощью оптической когерентной томографии высокого разрешения: гистоморфологическая корреляция. Пилотное исследование». Британский журнал дерматологии. 167 (4): 856–64. Дои:10.1111 / j.1365-2133.2012.11194.x. PMID 22862425. S2CID 24965088.
- ^ Коулман А.Дж., Ричардсон Т.Дж., Орчард Дж., Уддин А., Чой М.Дж., Лейси К.Е. (февраль 2013 г.). «Гистологические корреляты оптической когерентной томографии при немеланомном раке кожи». Исследования и технологии кожи. 19 (1): 10–9. Дои:10.1111 / j.1600-0846.2012.00626.x. PMID 22738357. S2CID 26084419.
- ^ Ульрих М., фон Браунмюль Т., Курцен Х., Диршка Т., Келлнер С., Саттлер Э. и др. (Август 2015 г.). «Чувствительность и специфичность оптической когерентной томографии для вспомогательной диагностики непигментированной базальноклеточной карциномы: обсервационное исследование». Британский журнал дерматологии. 173 (2): 428–35. Дои:10.1111 / bjd.13853. PMID 25904111.
- ^ Левин А., Ван К., Марковиц О. (октябрь 2017 г.). «Оптическая когерентная томография в диагностике рака кожи». Дерматологические клиники. 35 (4): 465–488. Дои:10.1016 / j.det.2017.06.008. PMID 28886803.
- ^ Дюбуа А., Левек О., Азимани Х., Сирет Д., Барут А., Суппа М. и др. (Октябрь 2018 г.). «Конфокальная оптическая когерентная томография с линейным полем для неинвазивной визуализации опухолей кожи с высоким разрешением» (PDF). Журнал биомедицинской оптики. 23 (10): 106007. Bibcode:2018JBO .... 23j6007D. Дои:10.1117 / 1.JBO.23.10.106007. PMID 30353716. S2CID 53023955.
 Эта статья содержит цитаты из этого источника, который доступен под Creative Commons Attribution 3.0 Unported (CC BY 3.0) лицензия.
Эта статья содержит цитаты из этого источника, который доступен под Creative Commons Attribution 3.0 Unported (CC BY 3.0) лицензия. - ^ Велусами П., Шимада Ю., Канно З., Оно Т., Тагами Дж. (Февраль 2019 г.). «Оптическая оценка поражений белых пятен на эмали вокруг ортодонтических брекетов с использованием оптической когерентной томографии с разверткой источника (SS-OCT): исследование in vitro». Журнал стоматологических материалов. 38 (1): 22–27. Дои:10.4012 / dmj.2017-262. PMID 30158348.
- ^ Даместани Ю., Рейнольдс К.Л., Сзу Дж., Хсу М.С., Кодера Ю., Биндер Д.К. и др. (Ноябрь 2013). «Прозрачный нанокристаллический протез свода черепа из стабилизированного оксидом иттрия диоксида циркония». Наномедицина. 9 (8): 1135–8. Дои:10.1016 / j.nano.2013.08.002. PMID 23969102. Сложить резюме – Лос-Анджелес Таймс (4 сентября 2013 г.).
- ^ B1 Патент США 7116429 B1, Walecki WJ = Van P, "Определение толщины плит из материалов", выпущенный 2006-10-03.
- ^ Валецкий В.Дж., Сонди Ф. (2008). Новак Е.Л., Вольфганг О., Горецки С. (ред.). «Комплексная квантовая эффективность, коэффициент отражения, топография и метрология напряжений для производства солнечных элементов». Proc. SPIE. Интерферометрия XIV: Приложения. 7064: 70640A. Bibcode:2008SPIE.7064E..0AW. Дои:10.1117/12.797541. S2CID 120257179.
- ^ Валецкий В.Дж., Лай К., Правдивцев А., Сучков В., Ван П, Азфар Т., Вонг Т., Лау Ш., Ку А. (2005). Таннер Д.М., Рамешем Р. (ред.). «Низкокогерентный интерферометрический абсолютный дальномер для исследования МЭМС-структур». Proc. SPIE. Надежность, упаковка, тестирование и характеристика MEMS / MOEMS IV. 5716: 182. Bibcode:2005SPIE.5716..182W. Дои:10.1117/12.590013. S2CID 110785119.
- ^ Валецкий В.Дж., Лай К., Сушков В., Ван П., Лау С.Х., Ку А (2005). «Новая бесконтактная метрология толщины для backend-производства широкозонных светоизлучающих устройств». Физика Статус Solidi C. 2 (3): 984–989. Bibcode:2005PSSCR ... 2..984 Вт. Дои:10.1002 / pssc.200460606.
- ^ Валецки В., Вэй Ф, Ван П, Лай К., Ли Т., Лау Ш., Ку А. (2004). Таннер Д.М., Раджешуни Р. (ред.). «Новая низкокогерентная метрология для неразрушающего контроля микроструктур и микроструктур с высоким аспектным отношением». Proc. SPIE. Надежность, тестирование и характеристика MEMS / MOEMS III. 5343: 55. Дои:10.1117/12.530749. S2CID 123249666.
- ^ Guss G, Bass I, Hackel R, Demos SG (6 ноября 2007 г.). Трехмерное изображение с высоким разрешением участков повреждения поверхности плавленого кварца с помощью оптической когерентной томографии (PDF) (Отчет). Национальная лаборатория Лоуренса Ливермора. UCRL-PROC-236270. Архивировано из оригинал (PDF) 11 февраля 2017 г.. Получено 14 декабря, 2010.
- ^ Валецки В., Вэй Ф, Ван П, Лай К., Ли Т., Лау Ш., Ку А. (2004). Интерферометрическая метрология тонких и ультратонких полупроводниковых структур, установленных на изолирующих носителях (PDF). Конференция CS Mantech.
- ^ Валецкий В.Дж., Правдивцев А, Сантос И.И., Коо А (август 2006 г.). «Высокоскоростная высокоточная волоконно-оптическая низкокогерентная интерферометрия для мониторинга процессов шлифования и травления на месте». Proc. SPIE. Интерферометрия XIII: Приложения. 6293: 62930D. Bibcode:2006SPIE.6293E..0DW. Дои:10.1117/12.675592. S2CID 121209439.
- ^ См. Например: "ZebraOptical Optoprofiler: интерферометрический зонд".
- ^ Заявка EP 2799842, Маркл, Даниэль; Hannesschläger, Günther & Leitner, Michael et al., «Устройство и метод для мониторинга свойства покрытия твердой лекарственной формы во время процесса нанесения покрытия, формирующего покрытие твердой лекарственной формы», опубликовано 2014-11-05; Заявка ГБ 2513581; Заявка США 20140322429 A1.
- ^ Dufour M, Lamouche G, Gauthier B, Padioleau C, Monchalin JP (13 декабря 2006 г.). «Контроль труднодоступных промышленных деталей с помощью зондов малого диаметра» (PDF). Отдел новостей SPIE. Дои:10.1117/2.1200610.0467. Получено 15 декабря, 2010.
- ^ Dufour ML, Lamouche G, Detalle V, Gauthier B, Sammut P (апрель 2005 г.). «Низкокогерентная интерферометрия - передовой метод оптической метрологии в промышленности». Insight: неразрушающий контроль и мониторинг состояния. 47 (4): 216–219. CiteSeerX 10.1.1.159.5249. Дои:10.1784 / insi.47.4.216.63149. ISSN 1354-2575.
- ^ Боппарт, Стивен (11 июня 2014 г.). «Разработка новых методов оптической визуализации для клинического использования». Отдел новостей SPIE. Дои:10.1117/2.3201406.03.
- ^ Аль-Азри К., Мелита Л.Н., Стрэндж А.П., Фести Ф., Аль-Джавад М., Кук Р. и др. (Март 2016 г.). «Использование оптической когерентной томографии в диагностике дефектов эмали». Журнал биомедицинской оптики. 21 (3): 36004. Bibcode:2016JBO .... 21c6004A. Дои:10.1117 / 1.jbo.21.3.036004. PMID 26968386.
- ^ Иино Ю., Эбихара А., Йошиока Т., Кавамура Дж., Ватанабе С., Ханада Т. и др. (Ноябрь 2014 г.). «Обнаружение второго мезиобуккального канала в молярах верхней челюсти с помощью оптической когерентной томографии с разверткой источника». Журнал эндодонтии. 40 (11): 1865–8. Дои:10.1016 / j.joen.2014.07.012. PMID 25266471.
- ^ Subhash, Hrebesh M .; Хоган, Джош Н .; Лихи, Мартин Дж. (Май 2015 г.). «Многопозиционная оптическая когерентная томография для приложений для смартфонов». Отдел новостей SPIE. Дои:10.1117/2.1201503.005807.



![I = k_1 I_S + k_2 I_S + 2 sqrt { left (k_1 I_S right) cdot left (k_2 I_S right)} cdot Re left [ gamma left ( tau right) right] qquad (1)](https://wikimedia.org/api/rest_v1/media/math/render/svg/e90b482fe73988b986f3ebc89f0ff288bf6d67d9)



![gamma left ( tau right) = exp left [- left ( frac { pi Delta nu tau} {2 sqrt { ln 2}} right) ^ 2 right] cdot exp left (-j2 pi nu_0 tau right) qquad quad (2)](https://wikimedia.org/api/rest_v1/media/math/render/svg/83da0d10e1049d9b461ab144e7b9dd7e58e85c45)









