Общий синтез стрихнина - Strychnine total synthesis
Эта статья может требовать уборка встретиться с Википедией стандарты качества. Конкретная проблема: MOS (особенно CHEM-MOS и дефисы) (Март 2020 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |

Общий синтез стрихнина в химия описывает полный синтез комплекса биомолекула стрихнин. Первый зарегистрированный метод группой Роберт Бернс Вудворд в 1954 г. считается классикой в этой области исследований.[2][3][4][5]
В то время это явилось естественным завершением сложного процесса выяснение молекулярной структуры это началось с выделения стрихнина из бобов Strychnos ignatii к Пьер Жозеф Пеллетье и Жозеф Бьенэме Кавенту в 1818 г.[6] Основными участниками всех усилий были Сэр Роберт Робинсон с более чем 250 публикациями и Герман Лойкс еще 125 работ за 40 лет. Робинсон был награжден Нобелевская премия по химии в 1947 г. за работу по алкалоидам, в том числе стрихнину.
Процесс химической идентификации был завершен публикациями Робинсона в 1946 году. [7][8][9] и позже подтверждено Вудвордом в 1947 году.[10] Рентгеновские структуры создание абсолютная конфигурация стал доступен между 1947 и 1951 годами благодаря публикациям Дж. М. Бийвоет [11][12] и J.H. Робертсон [13].[14]
Вудворд опубликовал очень краткий отчет о синтезе стрихнина в 1954 году (всего 3 страницы). [15] и длинный (42 страницы) в 1963 году.[16]

Существует множество других методов, о которых сообщили исследовательские группы Магнуса,[17] Сверхчеловек,[18] Кюне,[19][20] Равал,[21] Bosch,[22][23] Воллхардт,[24][25] Мори,[26][27] Шибасаки,[28] Ли,[29] Фукуяма [30] Vanderwal [31] и Макмиллан.[32] Синтетический (+) - стрихнин также известен.[33][34] Рацемические синтезы были опубликованы Padwa в 2007 году. [35] и в 2010 году Андраде [36] и Рейссиг.[37]В своей публикации 1963 года Вудворд процитировал сэра Роберта Робинсона, который сказал: [38] по размеру молекулы это наиболее сложное из известных веществ.
Молекула
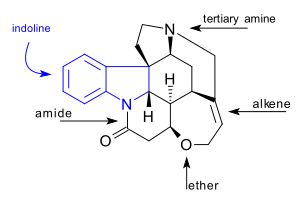
C21ЧАС22N2О2 Молекула стрихнина содержит 7 колец, включая индолин система. Оно имеет третичный амин группа, амид, алкен и эфир группа. Встречающееся в природе соединение также хиральный с 6 асимметричный углерод атомы, включая один четвертичный.
Синтез Вудворда
Кольцо II, V синтез
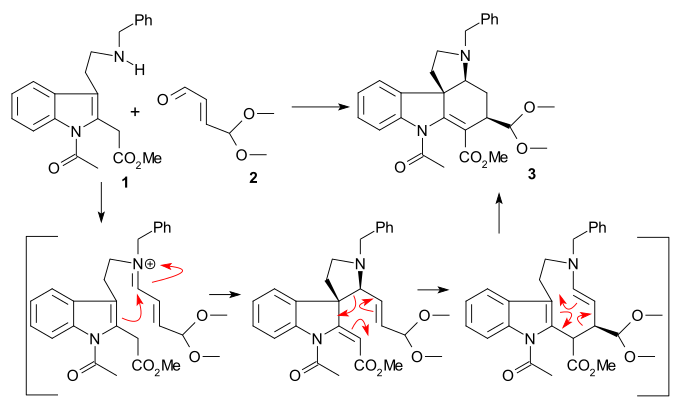
Синтез кольца II осуществлен с помощью Синтез индола по Фишеру с помощью фенилгидразин 1 и ацетофенон производное ацетовератрона 2 (катализатор полифосфорная кислота ) для получения 2-вератрилиндола 3. Вератрильная группа не только блокирует положение 2 для дальнейшего электрофильное замещение но также станет частью стрихнинового скелета. А Реакция Манниха с формальдегид и диметиламин ) произведено злак 4. Алкилирование с йодметан дал промежуточный четвертичная аммониевая соль который отреагировал цианид натрия в нуклеофильное замещение к нитрил 5 а затем в снижение с литийалюминийгидрид к триптамин 6. Аминно-карбонильная конденсация с этилглиоксилат дай я добываю 7. Реакция этого имина с ЦСЛ в пиридин к N-тозильному соединению с замкнутым кольцом 8 был описан Вудвордом как согласованный нуклеофильный енамин атаковать и формально Реакция Пикте – Шпенглера. Это соединение должно образовывать диастереомерная пара но было найдено только одно соединение, которое не исследовалось. Наконец, вновь образованная двойная связь была восстановлена на борогидрид натрия к индолин 9 с приближением атома водорода C8 с наименее затрудненной стороны (этот протон удаляется позже в последовательности и не имеет значения).
Кольцо III, IV синтез
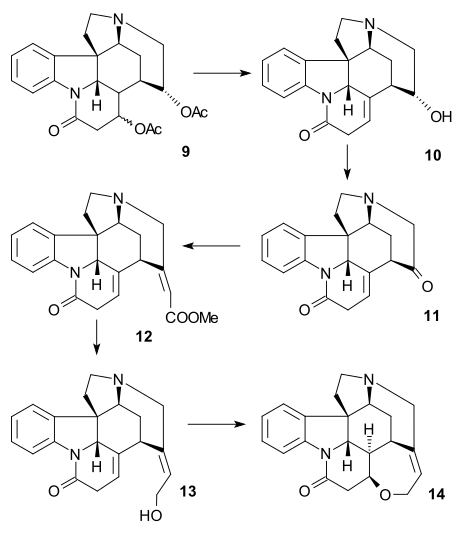
Индолин 9 был ацетилированный в N-ацетильное соединение 10 (уксусный ангидрид, пиридин ), а затем группа вератрила была открытое кольцо с озон в водных уксусная кислота к муконовый эфир 11 (что стало возможным благодаря двум электронодонорным метоксидным группам). Это пример биоинспирированный синтез уже предложен Вудвордом в 1948 году.[39] Расщепление ацетильной группы и гидролиз сложного эфира с HCl в метаноле привело к образованию пиридон сложный эфир 12 с дополнительными изомеризация из экзоциклический двойная связь с эндоциклической двойной связью (разрушающая один асимметричный центр). Последующее лечение йодистый водород и красный фосфор удалили тозильную группу и гидролизовали обе оставшиеся сложноэфирные группы с образованием двухосновная кислота 13. Ацетилирование и этерификация (диазометан ) производился ацетил диэфир 14 который затем подвергся Конденсация Дикмана с метоксид натрия в метаноле, чтобы энол 15.
Синтез кольца VII
Чтобы удалить C15 алкоголь группа, Энол 15 был преобразован в тозилат 16 (ЦСЛ, пиридин ), а затем в меркаптоэфир 17 (бензилмеркаптид натрия), который затем восстанавливали до ненасыщенного сложного эфира 18 к Никель Ренея и водород. Дальнейшее восстановление водородом / палладий на углероде дает насыщенный эфир 19. Гидролиз щелочного эфира до карбоновая кислота 20 сопровождался эпимеризация в C14.
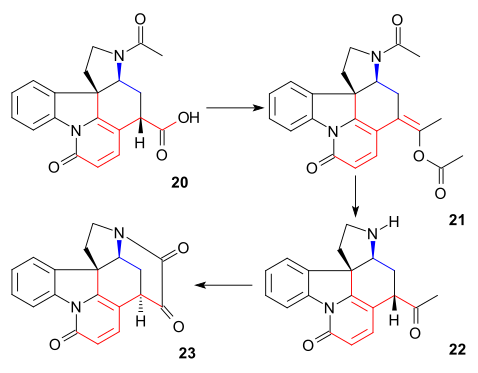
Это конкретное соединение было уже известно из исследований разложения стрихнина. До сих пор все промежуточные звенья были рацемический но хиральность была введена на данном этапе через хиральное разрешение с помощью хинидин.
Затем атом углерода C20 был введен уксусный ангидрид с образованием енолацетата 21 и свободный аминокетон 22 был получен гидролизом с соляная кислота. Кольцо VII промежуточное 23 был закрыт диоксид селена окисление, процесс, сопровождающийся снова эпимеризацией по C14.
Формирование 21 можно представить как последовательность ацилирования, депротонирования, перегруппировки с потерей углекислый газ и снова ацилирование:
Синтез кольца VI
К дикетон 23 был добавлен ацетилид натрия (вводя атомы углерода 22 и 23), чтобы получить алкин 24. Это соединение было восстановлено до аллиловый спирт 25 с использованием Катализатор Линдлара и литийалюминийгидрид удалил оставшиеся кетон группа в 26. An аллильная перегруппировка к алкоголю 27 (изострихнин) был вызван бромистый водород в уксусной кислоте с последующим гидролизом серная кислота. На заключительном этапе (-) - стрихнин 28 лечение 27 с этанолом гидроксид калия вызвали перегруппировку двойной связи C12-13 и замыкание кольца в сопряженное сложение гидроксильным анионом.
Магнус синтез
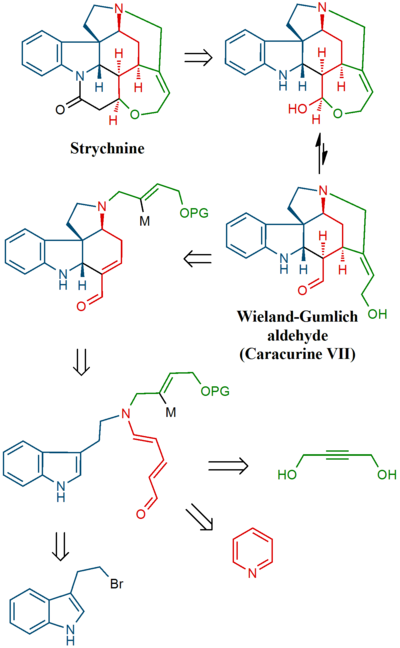
В этих усилиях первым был синтезирован один из многих продуктов распада стрихнина (промежуточное соединение), соединение, также доступное в несколько этапов из другого продукта распада, называемого Альдегид Виланда-Гумлиха. В последнем этапе сам стрихнин был синтезирован из ретрансляционного соединения.
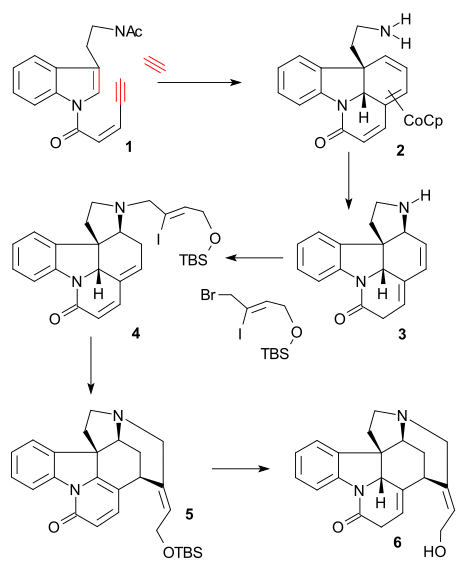
Синтез сверхчеловека
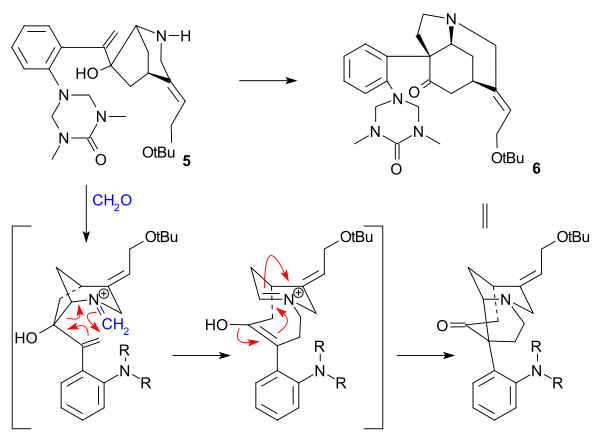
В Сверхчеловек синтез (1993) взял хиральный циклопентен соединение в качестве исходного материала, полученного ферментативным гидролиз из СНГ-1,4-диацетоксициклопент-2-ен. Этот исходный материал был преобразован в несколько этапов в триалкилстаннан 2 который затем был дополнен арил йодид 1 в Стилле реакция в присутствии монооксид углерода (трис (дибензилиденацетон) дипалладий (0), трифениларсин ). Внутренний дубль в 3 был преобразован в эпоксид с помощью трет-бутилгидропероксид, то карбонил группа затем была преобразована в алкен в Реакция Виттига используя Ph3P = CH2 и ЧАЕВЫЕ группа была гидролизована (TBAF ) и заменен на трифторацетамид группа (NH2COCF3, Неа ) в 4. Циклизация (NaH) происходило затем, раскрывая эпоксидное кольцо, и трифторацетильная группа удалялась с использованием КОН с получением азабициклооктана. 5.
Ключевым шагом был аза-Справиться Реакция Манниха инициированный амино-карбонильная конденсация с помощью формальдегид и формирование 6 при количественном выходе:
В финальной последовательности стрихнин получали через Альдегид Виланда-Гумлиха (10):
Средний 6 был ацилирован с использованием метилцианоформиат и два защитные группы (трет-бутил и) были удалены с помощью HCl / MeOH в 7. Двойная связь C8C13 была восстановлена цинк (МеОН / H+) до насыщенного сложного эфира 8 (смесь). Эпимеризация в C13 с метоксид натрия в MeOH образуется бета-эфир 9 который был восстановлен [[гидридом диизобутилалюминия]] до альдегида Виланда-Гумлиха 10. Превращение этого соединения с малоновая кислота к (-) - стрихнин 11 уже была известна как процедура.
Синтез Кюне
Проблемы синтеза Кёне 1993 г. рацемический стрихнин. Исходные соединения триптамин 1 и 4,4-диметокси акролеин 2 реагировали вместе с трифторид бора к ацеталь 3 как сингл диастереомер в амино-карбонильная конденсация / сигматропная перестройка последовательность.
Гидролиз с хлорная кислота предоставленный альдегид 4. А Реакция Джонсона – Кори – Чайковского (иодид триметилсульфония / н-бутиллитий ) превратил альдегид в эпоксид который реагировал in situ с третичным амином с образованием аммониевая соль 5 (загрязнены другими продуктами циклизации). Снижение (палладий на углероде /водород ) удалил бензил группа в алкоголь 6, больше сокращения (цианоборгидрид натрия ) и ацилирование (уксусный ангидрид / пиридин ) произведено 7 как смесь эпимеры (в C17). Замыкание кольца III на 8 затем было выполнено альдольная реакция с помощью бис (триметилсилил) амид лития (используя только эпимер с правильной конфигурацией). Еще большее сокращение (борогидрид натрия ) и ацилирование привело к эпимерному диацетату 9.
А DBU опосредованный реакция элиминации образованный олефиновый спирт 10 и последующие Окисление Сверна иметь нестабильную аминокислоту кетон 11. На последних этапах Реакция Хорнера – Уодсворта – Эммонса (метил 2- (диэтилфосфоно) ацетат) дайте акрилат сложный эфир 12 как смесь цис- и транс-изомеры которые можно было бы тренировать в правильном (транс) направлении, применяя свет в фотохимическая перегруппировка, сложноэфирная группа восстановлена (ДИБАЛ / трифторид бора ) в изострихнин 13 и рацемический стрихнин 14 был образован посредством замыкания цикла, катализируемого основанием, как в синтезе Вудворда.
В 1998 г. в синтезе Кёне хирального (-) - стрихнина исходный материал был получен из хирального триптофан.
Rawal синтез
В синтезе Rawal (1994, рацемический) амин 1 и Enone 2 были объединены в амино-карбонильная конденсация с последующим метилхлорформиат гасить до триена 3 который затем отреагировал в Реакция Дильса – Альдера (бензол 185 ° C) в гексен 4. Три сложноэфирные группы гидролизовали с использованием йодотриметилсилан образующий пентациклический лактам 5 после гашения метанола в комбинации из 7 стадий реакции (одна из них Конденсация Дикмана ). C4 сегмент 6 был добавлен в алкилирование аминов и Чертовски реакция из 7 сформированный изострихнин 8 после снятия защиты TBS.
Общая доходность (10%) на сегодняшний день является наибольшей из всех опубликованных методов. [40]
Синтез Bosch
В синтезе Bosch (1999, хиральный) олефиновая группа в дионе 1 был преобразован в альдегид к озонолиз и хиральный амин 2 был сформирован в двойном восстановительное аминирование с (S)-1-фенэтиламин. Фенилэтил заместитель был удален с помощью ClCO2CHClCH3 и Enone группа была представлена в Устранение Грико с помощью TMSI, HMDS тогда PhSeCl тогда озон а потом диизопропиламин формирование карбамат 3. С аминогруппы снимали защиту кипячением с обратным холодильником в метаноле, а затем алкилированный с помощью (Z) -BrCH2CICH = CH2OTBDMS, до третичного амина 4. Редуктивный Чертовски реакция Затем произошло метоксикарбонилирование (LiHMDS, NCCO2Мне) на трехколесный велосипед 5. Реакция с цинк пыль в 10% серная кислота удалил TBDMS защитная группа, уменьшил нитрогруппа и приводил к восстановительной амино-карбонильной циклизации за одну стадию до тетрациклической 6 (эпимерная смесь). На последнем этапе к Альдегид Виланда-Гумлиха 7 реакция с Неа в MeOH дает правильный эпимер, за которым следует ДИБА восстановление метилового эфира.
Синтез Фольхардта
Ключевой реакцией в синтезе Фоллхардта (2000, рацемический) была тримеризация алкинов из триптамин производная 1 с ацетилен и кобальтовое соединение CpCo (C2ЧАС4)2 (THF, 0 ° C) в трехколесный велосипед 2 после снятие защиты аминогруппы (КОН, МеОН / Н2О рефлюкс). Последующая реакция с нитрат железа вызвал [1,8] -сопряженное сложение в тетрацикл 3, алкилирование аминов с (Z) -1-бром-4 - [(трет-бутилдиметилсилил) окси] -2-йодобут-2-ен (см. Синтез Rawal) и карбонат лития, и изомеризация из диен система (NaOiPr, iPrOH) образована еноном 4. А Чертовски реакция как в Rawal синтезе (ацетат палладия / трифенилфосфин ), сопровождаемый ароматизация сформированный пиридон 5 и литийалюминийгидрид восстановление и снятие защиты группы TBS образует изострихнин 6.
Синтез мори
Синтез Мори ((-) chiral, 2003) был первым, содержащим асимметричная стадия реакции. Он также имеет большое количество реакций, катализируемых Pd. В этом N-тозиламин 1 отреагировал с аллилкарбонат 2 в аллильное асимметричное замещение с помощью Pd2(dba)3 и асимметричный лиганд (S-BINAPO) к хиральному вторичному амину 3. Десилилирование TBDMS группа следующая заняла место HCl к гидроксид а затем в нитрил 4 (NaCN ) через бромид (PBr3 ). Чертовски реакция (Pd (OAc)2 / Мне2PPh ) и дебромирование (Ag2CO3 ) предоставил трехколесный велосипед 5. LiALH4 Восстановление нитрила к амин и это Boc2О защита от boc амина 6 затем последовал второй аллильное окисление (Pd (OAc)2 / AcOH / бензохинон / MnO2 ) в тетрацикл 7. Гидроборирование-окисление (9-BBN / ЧАС2О2 ) дал алкоголь 8 и последующие Окисление Сверна кетон 9. Реакция с LDA / PhNTf2 дал енол трифлат 10 и трифлатная группа была удалена в алкен 11 по реакции с Pd (OAc)2 и PPh3.
Детозилирование 11 (нафталинид натрия ) и посредничество с хлорангидрид 3-бромакрилоилхлорид дает амид 12 и другой Чертовски реакция дал пентацикл 13. изомеризация двойной связи (натрий / iPrOH ), Boc группа снятие защиты (трифликовая кислота ) и алкилирование аминов с (Z) -BrCH2CICH = CH2OTBDMS (см. Равал) дал соединение 14 (идентично одному из промежуточных продуктов Фоллхардта). Заключительный чертова реакция (15) и образование снятия защиты TBDMS (-) - изострихнин 16.
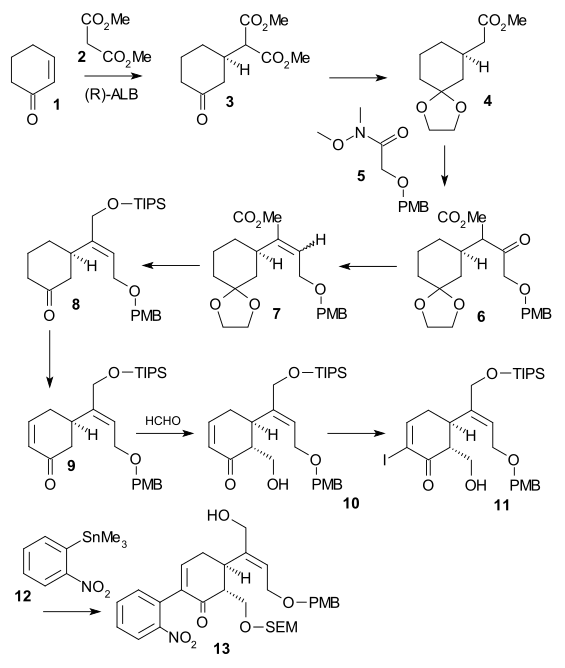
Синтез Шибасаки
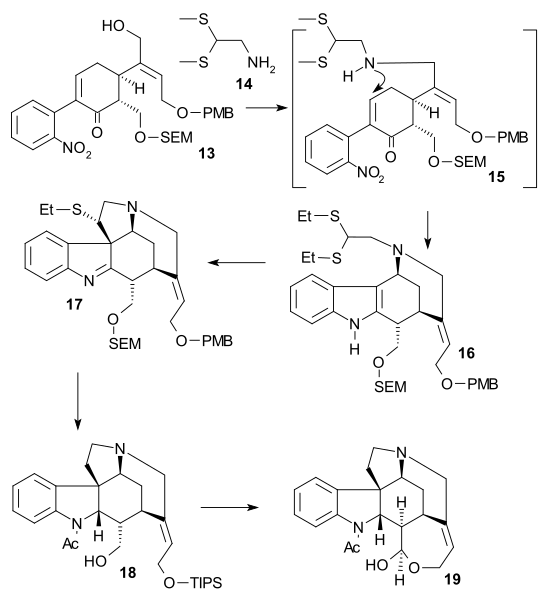
Синтез Shibasaki ((-) chiral, 2002) был вторым опубликованным методом полного синтеза стрихнина с использованием асимметричная стадия реакции. Циклогексенон 1 отреагировал диметилмалонат 2 в асимметричная реакция Майкла с помощью АлЛибис (бинафтоксид) образовывать хиральный диэфир 3. Его кетон группа была защищена как ацеталь (2-этил-2-метил-1,3-диоксолан, ЦОХ ) и карбоксильная группа была удалена (LiCl, ДМСО 140 ° C) в моноэфир 4. Фрагмент C2 был добавлен как Вайнреб амид 5 формировать PMB эфир 6 с помощью LDA. Затем кетон восстанавливали до спирта (NaBH3CN, TiCl4 ), а затем вода была устранен (DCC, CuCl ) сформировать алкен 7. После сложный эфир снижение (ДИБАЛ ) к алкоголю и его ЧАЕВЫЕ защита (СОВЕТЫ, триэтиламин ) ацетальная группа была удалена (каталитический CSA ) в кетоне 8. Enone 9 затем был сформирован Саэгуса окисление. Превращение в алкоголь 10 было достигнуто через Добавление альдола Мукаяма с помощью формальдегид, йодирование к 11 (йод, DMAP ) последовал Муфта стилла (Pd2dba3, Ph3В качестве, CuI ) включение нитробензол единица измерения 12. Алкоголь 13 был сформирован после SEM защита (SEMCl, i-Pr2NEt) и удаление TIPS (HF ).
Во второй части последовательности алкоголь 13 был преобразован в трифлат (трифликовый ангидрид, N,N-диизопропилэтиламин ), затем 2,2-бис (этилтио) этиламин 14 был добавлен сразу после цинк порошок, закрепление тандемная реакция с восстановление нитрогруппы к амину, 1,4-сложение тиоаминовой группы и амино-кето-конденсация индол 16. Реакция с DMTSF дал тиониевую атаку на C7, образуя 17, то я добываю группа тогда была уменьшенный (NaBH3CN, TiCl4 ), новая аминогруппа ацилированный (уксусный ангидрид, пиридин ), обе спиртозащитные группы удалены (NaOMe / meOH) и группа аллилового спирта снова защищена (TIPS). Это позволило удалить этилтиогруппу (NiCl2, NaBH4, EtOH / MeOH) до 18. Спирт окисляли до альдегида с помощью Окисление Париха-Деринга и удаление группы TIPS дало полуацеталь 19 называется (+) - диаболин, который ацилирован Альдегид Виланда-Гумлиха.
Li синтез
Синтез, описанный Bodwell / Li (рацемический, 2002 г.), представлял собой формальный синтез поскольку он произвел соединение, уже полученное Rawal (№ 5 в синтезе Rawal). Ключевым шагом был обратная реакция Дильса – Альдера на электронное потребление из циклофан 1 путем нагрева в N,N-диэтиланилин (отводится диазот) с последующим восстановлением двойной связи в 2 к 3 к борогидрид натрия / трифликовая кислота и удаление карбамат защитная группа (PDC / целит ) к 4.
Метод оспаривается Рейссигом (см. Синтез Рейссига).
Синтез Фукуямы
Синтез Фукуямы (хиральный (-), 2004) начался с циклического амина. 1. В какой-то момент хиральность была введена в этот исходный материал ферментативное разрешение одного из предшественников. Ацилоин 2 был сформирован Руботтовое окисление и гидролиз. Окислительное расщепление к ацетат свинца образованный альдегид 3, удаление носил группа (тиофенол / карбонат цезия ) вызвало амино-карбонильная конденсация с иминиевый ион 4 продолжая реагировать в трансаннулярный циклизация диэфир 5 который можно преобразовать в Альдегид Виланда-Гумлиха по известной химии.
Синтез Рейссига
Метод, описанный Beemelmanns & Reissig (рацемический, 2010 г.), представляет собой еще один формальный синтез, приводящий к пентациклу Равала (см. Амин 5 в методе Равала). В этом методе индол 1 был преобразован в тетрацикл 2 (вместе с побочным продуктом) в одном каскадная реакция с помощью дииодид самария и HMPA.[41] Никель Ренея / H2 восстановление дало амин 3 и реакция в одном сосуде с использованием метилхлорформиат, DMAP и ЧАЙ тогда MsCl, DMAP и ЧАЙ а потом DBU дал предшественник Равала 4 с ключевыми атомами водорода в желаемой антиконфигурации.
В прерванном промежуточном маршруте 2 был сначала сокращен до я добываю 5 затем преобразован в карбамат 6, затем дегидратируется до диена 7 (Реагент Берджесса ) и, наконец, сводится к 8 (цианоборгидрид натрия ). Атомы водорода в 8 находятся в нежелательной цис-взаимосвязи, которая противоречит результатам, полученным в 2002 г. Бодвеллом / Ли для той же реакции.
Вандервальский синтез
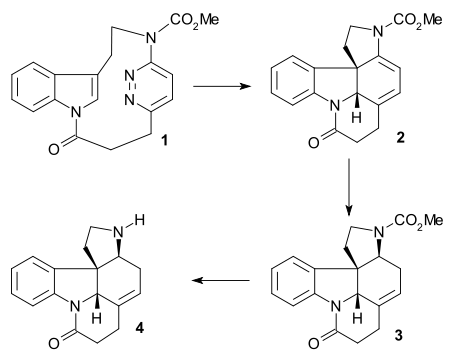
В 2011 году группа Vanderwal сообщила о кратком, самая длинная линейная последовательность 6 шагов, полный синтез стрихнина.[42] Он показал Реакция Цинке с последующей реакцией анионной бициклизации и тандемом Перестановка ручья / сопряженное сложение.
внешняя ссылка
Рекомендации
- ^ Рентгеновский снимок; Messerschmidt, M .; Scheins, S .; Люгер, П. (2005). «Плотность заряда (-) - стрихнина от 100 до 15 К, сравнение четырех наборов данных». Acta Crystallogr B. 61 (1): 115–121. Дои:10.1107 / S0108768104032781.
- ^ Nicolaou, K. C .; Соренсен, Э. Дж. (1996). Классика в полном синтезе: цели, стратегии, методы. Вайли. ISBN 978-3-527-29231-8.
- ^ К. К. Николау, Дионисиос Вурлумис, Николас Винссингер, Фил С. Баран Искусство и наука тотального синтеза на заре двадцать первого века Angewandte Chemie International Edition 2000; Том 39, выпуск 1, Страницы: 44-122
- ^ Bonjoch, Josep; Sole, Дэниел (2000). «Синтез стрихнина». Chem. Ред. 100 (9): 3455–3482. Дои:10.1021 / cr9902547. PMID 11777429.
- ^ Праудфут, Джон Р. (2013). «Схемы реакций, визуализированные в сетевой форме: синтез стрихнина в качестве примера». Журнал химической информации и моделирования. 53 (5): 1035–1042. Дои:10.1021 / ci300556b.
- ^ Пеллетье; Кавенту (1818 г.). "Note sur un nouvel alkalai (Примечание о новой щелочи)". Annales de Chimie et de Physique. 8: 323–324. Смотрите также: Пеллетье; Кавенту (1819 г.). "Mémoire sur un nouvel alcali Vegetal (la strychnine) Trouvé dans la feve de Saint-Ignace, la noix vomique и т. Д. (Воспоминания о новой растительной щелочи (стрихнине), обнаруженной в бобах Святого Игнатия, nux vomica и т. Д.) ". Annales de Chimie et de Physique. 10: 142–176.
- ^ Робинсон, Р. (1946). «Строение стрихнина». Experientia. 2 (1): 1946. Дои:10.1007 / BF02154708.
- ^ Briggs, L.H .; Опеншоу, Х.Т .; Робинсон, Роберт (1946). «Стрихнин и бруцин. Часть XLII. Состав неосерии оснований и продукты их окисления». J. Chem. Soc. 1946: 903. Дои:10.1039 / JR9460000903.
- ^ Опеншоу, Х.Т .; Робинсон, Р. (1946). «Конституция стрихнина и биогенетические отношения стрихнина и хинина». Природа. 157 (3988): 438. Bibcode:1946 г., природа. 157..438O. Дои:10.1038 / 157438a0.
- ^ Woodward, R. B .; Брем, Уоррен Дж .; Нельсон, А. Л. (1947). «СТРУКТУРА СТРИХНИНА». Варенье. Chem. Soc. 69 (9): 2250. Дои:10.1021 / ja01201a526.
- ^ Bijvoet, Schoone и Bokhoven, Kon. Нед. Акад. Мокр., 50, №8, 51, №8, 52, №2 (1947–49)
- ^ Боховен, Ц .; Schoone, J.C .; Бийвоет, Дж. М. (1951). «Фурье-синтез кристаллической структуры пентагидрата сульфата стрихнина» (PDF). Acta Crystallogr. 4 (3): 275–280. Дои:10.1107 / S0365110X51000891.
- ^ Робертсон, Дж. Х .; Биверс, К. А. (1950). «Кристаллическая структура гидробромида стрихнина». Природа. 165 (4200): 690–691. Bibcode:1950Натура.165..690р. Дои:10.1038 / 165690a0.
- ^ Робертсон, Дж. Х .; Биверс, К. А. (1951). «Кристаллическая структура бромистого водорода стрихнина». Acta Crystallogr. 4 (3): 270–275. Дои:10.1107 / S0365110X5100088X.
- ^ Woodward, R. B .; Cava, Michael P .; Ollis, W. D .; Голод, А .; Daeniker, H.U .; Шенкер, К. (1954). «ПОЛНЫЙ СИНТЕЗ СТРИХНИНА». Варенье. Chem. Soc. 76 (18): 4749–4751. Дои:10.1021 / ja01647a088.
- ^ Woodward, R. B .; Cava, M. P .; Ollis, W. D .; Голод, А .; Daeniker, H.U .; Шенкер, К. (1963). «Полный синтез стрихнина». Тетраэдр. 19 (2): 247–288. Дои:10.1016 / s0040-4020 (01) 98529-1.
- ^ Магнус, Филипп; Джайлз, Мелвин; Боннерт, Роджер; Kim, Chung S .; Маккуайр, Лесли; Мерритт, Эндрю; Викер, Найджел (1992). «Синтез стрихнина через альдегид Виланда-Гумлиха». Варенье. Chem. Soc. 114 (11): 4403–4405. Дои:10.1021 / ja00037a058.
- ^ Knight, Стивен Д .; Оверман, Ларри Э .; Пайродо, Гарри (1993). "Синтез катионных перегруппировок аза-копе. 26. Энантиоселективный полный синтез (-) - стрихнина". Варенье. Chem. Soc. 115 (20): 9293–9294. Дои:10.1021 / ja00073a057.
- ^ Kuehne, Martin E .; Сюй, Фэн (1993). «Полный синтез алкалоидов стрихнана и аспидосперматана. 3. Полный синтез (+ -) - стрихнина». J. Org. Chem. 58 (26): 7490–7497. Дои:10.1021 / jo00078a030.
- ^ Kuehne, Martin E .; Сюй, Фэн (1998). «Синтез алкалоидов стрихнанового и аспидосперматанового типов. 10. Энантиоселективный синтез (-) - стрихнина через альдегид Виланда-Гумлиха». J. Org. Chem. 63 (25): 9427–9433. Дои:10.1021 / jo9813989.
- ^ Rawal, Viresh H .; Иваса, Сейджи (1994). «Короткий стереоконтролируемый синтез стрихнина». J. Org. Chem. 59 (10): 2685–2686. Дои:10.1021 / jo00089a008.
- ^ Полный синтез (-) - стрихнина через альдегид Виланда-Гумлиха Angewandte Chemie International Edition Том 38, выпуск 3, 1999 г., страницы: 395-397 Даниэль Соле, Хосеп Бонйох, Сильвина Гарсия-Рубио, Эмма Пейдро, Хоан Бош
- ^ Соле, Даниэль; Bonjoch, Josep; Гарсия-Рубио, Сильвина; Пейдро, Эмма; Босх, Джоан (2000). «Энантиоселективный тотальный синтез альдегида Виланда-Гумлиха и (-) - стрихнина». Химия: европейский журнал. 6 (4): 655–665. Дои:10.1002 / (SICI) 1521-3765 (20000218) 6: 4 <655 :: AID-CHEM655> 3.0.CO; 2-6.
- ^ Эйхберг, Майкл Дж .; Dorta, Rosa L .; Ламоттке, Кай; Воллхардт, К. Питер С. (2000). «Формальный полный синтез (±) -стрихнина через кобальт-опосредованное [2 + 2 + 2] циклоприсоединение». Орг. Lett. 2 (16): 2479–2481. Дои:10.1021 / ol006131m.
- ^ Эйхберг, Майкл Дж .; Dorta, Rosa L .; Grotjahn, Douglas B .; Ламоттке, Кай; Шмидт, Мартин; Воллхардт, К. Питер С. (2001).«Подходы к синтезу (±) -стрихнина через кобальт-опосредованное [2 + 2 + 2] циклоприсоединение: быстрая сборка классического каркаса». Варенье. Chem. Soc. 123 (38): 9324–9337. Дои:10.1021 / ja016333t.
- ^ Наканиши, Масато; Мори, Мивако (2002). «Полный синтез (-) - стрихнина». Angewandte Chemie International Edition. 41 (11): 1934–1936. Дои:10.1002 / 1521-3773 (20020603) 41:11 <1934 :: AID-ANIE1934> 3.0.CO; 2-F.
- ^ Мори, Мивако; Наканиши, Масато; Кадзисима, Дайсуке; Сато, Йошихиро (2003). «Новый и общий синтетический путь к алкалоидам индола стрихноса: общий синтез (-) - тубифолина, (-) - дегидротубифолина и (-) - стрихнина с использованием катализируемого палладием асимметричного аллильного замещения». Варенье. Chem. Soc. 125 (32): 9801–9807. Дои:10.1021 / ja029382u.
- ^ Осима, Такаши; Сюй, Юцзюнь; Такита, Ре; Симидзу, Сатоши; Чжун, Дафан; Шибасаки, Масакацу (2002). «Энантиоселективный полный синтез (-) - стрихнина с использованием каталитической асимметричной реакции Михаэля и тандемной циклизации». Варенье. Chem. Soc. 124 (49): 14546–14547. Дои:10.1021 / ja028457r.
- ^ Bodwell, Graham J .; Ли, Цзян (2002). «Краткий формальный полный синтез (±) -стрихнина с использованием трансаннулярной реакции Дильса-Альдера с обратным электронным запросом [3] (1,3) индоло [3] (3,6) пиридазинофана». Angewandte Chemie International Edition. 41 (17): 3261–3262. Дои:10.1002 / 1521-3773 (20020902) 41:17 <3261 :: AID-ANIE3261> 3.0.CO; 2-K.
- ^ Кабураги, Й; Токуяма, H; Фукуяма, Т. (2004). «Полный синтез (-) - стрихнина». Варенье. Chem. Soc. 126 (33): 10246–10247. Дои:10.1021 / ja046407b. PMID 15315428.
- ^ Мартин, Дэвид Б. С.; Вандервол, Кристофер Д. (2011). «Синтез стрихнина по самой длинной линейной последовательности из шести шагов». Химическая наука. 2 (4): 649. Дои:10.1039 / C1SC00009H.
- ^ Джонс, Спенсер Б.; Симмонс, Брайон; Мастраккьо, Энтони; Макмиллан, Дэвид В. К. (2011). «Коллективный синтез натуральных продуктов с помощью органо-каскадного катализа». Природа. 475 (7355): 183–188. Дои:10.1038 / природа10232. ЧВК 3439143. PMID 21753848.
- ^ Knight, Стивен Д .; Оверман, Ларри Э .; Пайродо, Гарри (1995). «Асимметричный общий синтез (-) - и (+) - стрихнина и альдегида Виланда-Гумлиха». Варенье. Chem. Soc. 117 (21): 5776–5788. Дои:10.1021 / ja00126a017.
- ^ Не учитывается: неопубликованный метод Гилберт Сторк, Лекция в Школе органической химии Искьи, Искья Порб, Италия, 21 сентября1992.
- ^ Чжан, Хунцзюнь; Бунсомбат, Джутатип; Падва, Альберт (2007). «Полный синтез (±) -стрихнина посредством каскада [4 + 2] -циклоприсоединения / перегруппировки». Орг. Lett. 9 (2): 279–282. Дои:10.1021 / ol062728b. ЧВК 2587098. PMID 17217284.
- ^ Ширасани, Гопал; Павел, Тапас; Уильям Догерти младший; Кассель, Скотт; Андраде, Родриго Б. (2010). «Краткий общий синтез (±) -стрихнина и (±) -акуаммицина». Журнал органической химии. 75 (10): 3529–3532. Дои:10.1021 / jo100516g. PMID 20408591.
- ^ Beemelmanns, C .; Рейссиг, Х.-У. (2010). «Краткий формальный полный синтез стрихнина с каскадной реакцией, вызванной дииодидом самария, в качестве ключевого этапа». Angewandte Chemie International Edition. 49 (43): 8021–8025. Дои:10.1002 / anie.201003320. PMID 20848626.
- ^ Р. Робинсон "Молекулярная структура стрихнина, бруцина и вомицина. Прог. Орг. Chem., 1952; 1 ,2
- ^ Вудворд, Р. Б. (1948). «Биогенез алкалоидов Стрихноса». Природа. 162 (4108): 155–156. Bibcode:1948 Натур.162..155 Вт. Дои:10.1038 / 162155a0.
- ^ Cannon, J. S .; Оверман, Л. Э. (2012). «Нет ли конца полному синтезу стрихнина? Уроки, извлеченные из стратегии и тактики полного синтеза». Энгью. Chem. Int. Эд. 51 (18): 4288–4311. Дои:10.1002 / anie.201107385. ЧВК 3804246. PMID 22431197.
- ^ Szostak, M .; Проктер, Д. Дж. (2011). «Краткий синтез стрихнина и энглерина А: сила восстановительных циклизаций, вызванных йодидом самария». Angewandte Chemie International Edition. 50 (34): 7737–7739. Дои:10.1002 / anie.201103128. PMID 21780264.
- ^ Мартин, Дэвид Б. С.; Вандервол, Кристофер Д. (2011). «Синтез стрихнина по самой длинной линейной последовательности из шести шагов». Химическая наука. 2 (4): 649. Дои:10.1039 / C1SC00009H.