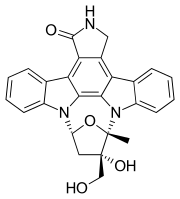
Лестауртиниб - Lestaurtinib
 | |
 | |
| Клинические данные | |
|---|---|
| Маршруты администрация | устный[1] |
| Код УВД |
|
| Фармакокинетический данные | |
| Связывание с белками | сильно связывается с белками, особенно с кислым гликопротеином α-1[1] |
| Метаболизм | ферментная система печени P450 (CYP34A)[1] |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| Химические и физические данные | |
| Формула | C26ЧАС21N3О4 |
| Молярная масса | 439.471 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| | |
Лестауртиниб (rINN под кодовым названием CEP-701) это тирозинкиназа ингибитор, структурно связанный с стауроспорин. Эта полусинтетическая производная от индолокарбазол K252a был исследован Цефалон как средство для лечения различных видов рака.[1] Это ингибитор киназы fms-подобная тирозинкиназа 3 (FLT3 ),[2] Янус киназа 2 (JAK2 ),[3] киназа рецептора тропомиозина (trk) А (TrkA ), TrkB и TrkC.[4]
Использует
Лестауртиниб прошел клинические испытания для лечения различных видов рака, включая рак поджелудочной железы и простаты, положительный результат V617F JAK2. истинная полицитемия и эссенциальный тромбоцитоз,[1] и огнеупорный нейробластома.[5] Наиболее значительные усилия были вложены в разработку лестуртиниба для лечения острый миелолейкоз (AML). 24% взрослой популяции, пораженной ОМЛ, демонстрируют мутации FLT3, которые связаны с повышенной вероятностью рецидива и смертности после лечения по сравнению с общей популяцией ОМЛ. Мутации FLT3 подавляют апоптоз в мутировавших клетках, но леставтиниб может преодолеть это подавление, подавляя активность киназы FLT3.[1]
Доклинические исследования
Лестауртиниб был идентифицирован как trk ингибитор рецепторной тирозинкиназы (RTK) с концентрацией 25 нМ, ингибирующей 50% активности тирозинкиназы (IC50). В естественных условиях испытания продемонстрировали снижение опухолевой нагрузки на 50–70% при ксенотрансплантатах рака поджелудочной железы и простаты; однако последующие клинические испытания рака поджелудочной железы и простаты не достигли указанных конечных точек. В 2001 году было показано, что лестуртиниб имеет IC50 2–3 нМ по отношению к тирозинкиназе FLT3 без значительного влияния на структурно схожие тирозинкиназы при этих концентрациях. Поскольку лейкемии обычно развиваются по нескольким путям выживания, лестуртиниб изучался в сочетании с традиционной химиотерапией; Было установлено, что, в то время как лечение лестуртинибом до химиотерапии давало антагонистические результаты, лечение лестуртинибом одновременно или после химиотерапии давало синергетические результаты. Совсем недавно была исследована эффективность лестуртиниба как ингибитора JAK2.[1]
Клинические испытания
Лестауртиниб был зарегистрирован как Новый исследуемый препарат (IND) номер 76431.[6]
Первоначальные исследования фазы I с лечауртинибом включали определение фармакокинетических параметров после однократного приема у здоровых добровольцев. Затем безопасность и переносимость были исследованы в исследовании фазы I с участием 30 добровольцев с запущенными солидными опухолями или лимфома. Хотя заметных опухолевых реакций не было, была отмечена сильная корреляция между дозой и нежелательными явлениями, при этом основным нежелательным явлением, о котором сообщалось, была желудочно-кишечная реакция. Начато исследование фазы II с участием 18 пациентов с раком поджелудочной железы для комбинированного лечения лестуртинибом и гемцитабин, но эффективность лестуртиниба не наблюдалась.[1]
В 2004 г. в исследовании фазы I / II участвовали 17 пациентов в 2 местах с рецидивирующим рефрактерным ОМЛ низкого риска с мутациями FLT3; это исследование продемонстрировало эффективное ингибирование FLT3 с помощью лестуртиниба. Многоцентровое исследование фазы II с участием 29 пациентов старше 60 лет было начато для лечения только лестуртинибом; результаты, представленные в 2006 г., показали, что первичная конечная точка полной ремиссии не была достигнута ни у одного из участников. Несмотря на эту неудачу, другое многоцентровое исследование фазы II с участием 42 пациентов сочетало лестуртиниб с традиционной химиотерапией; результаты, представленные в 2005 г., показали, что в два раза больше пациентов показали клинический ответ при лечении лестуртинибом по сравнению с пациентами, не получавшими лечения.[1] Следовательно, было начато исследование фазы III с участием 224 пациентов, получавших лестуртиниб после химиотерапии; Согласно результатам, опубликованным в отчете за 2011 год, значительных различий в ремиссии рака между пациентами, получавшими только химиотерапию, и лестуртиниб и химиотерапию, не наблюдалось.[7]
После этого исследования фазы III были начаты дополнительные клинические испытания. К ним относятся многоцентровое исследование фазы II с участием 37 пациентов с истинной полицитемией V617F JAK2 и эссенциальным тромбоцитозом; результаты, опубликованные в 2014 году, показывают, что в ходе исследования не удалось достичь конечной точки снижения нагрузки аллеля V617F JAK2 на 15% у 15% пациентов.[8] В исследовании фазы I с участием 47 пациентов в 2010 году сообщалось, что лечение рефрактерной нейробластомы хорошо переносится в рекомендуемых дозах.[5] в 2011 году было завершено дополнительное исследование фазы I у детей с рефрактерной нейробластомой.[9] В 2015 году были опубликованы результаты фазы I исследования лестуртиниба с участием пациентов с положительным результатом на V617F JAK2. миелофиброз.[10]
Коммерциализация и интеллектуальная собственность
Лестауртиниб был изучен международной фармацевтической компанией Cephalon, расположенной во Фрейзере, штат Пенсильвания.[11] Основанная в 1987 году, Cephalon к 2011 году выросла до компании из списка Fortune 1000, в которой работает 4000 сотрудников, а продукция продается 170 в 100 странах.[12]
Лестауртиниб был упомянут как один из двух онкологических препаратов, разработанных Цефалон в 2007 г. Комиссия по ценным бумагам и биржам США (SEC) отчет. Согласно этому отчету, в дополнение к заявкам на патенты, включающим методы лечения, составы и полиморфы лестуртиниба, Cephalon владела патентом на состав лестауртиниба в США, срок действия которого истекает в 2008 году. орфанный препарат статус лечения ОМЛ, отражающий значительную потребность, но минимальный рынок лечения ОМЛ.[13] После неудачных предварительных результатов клинического исследования фазы III с участием Лестауртиниба основатель и генеральный директор Cephalon Фрэнк Балдино, доктор философии, опубликовал в 2009 году следующее заявление:
Мы вложили значительные финансовые средства в это новаторское усилие по разработке лестуртиниба для этой группы пациентов с молекулярной мишенью с плохим прогнозом и небольшим количеством вариантов лечения. Пациенты с опасными для жизни заболеваниями нуждаются в таких компаниях, как Cephalon, чтобы сделать эти инвестиции и взять на себя этот риск, если мы хотим улучшить результаты лечения пациентов и общую стоимость здравоохранения.[14]
В 2011 году Cephalon была приобретена Teva Pharmaceutical Industries (NASDAQ: TEVA) за 6,8 миллиарда долларов наличными, что делает Cephalon 100% дочерней компанией Teva. Это приобретение соответствовало видению Teva по расширению ассортимента фирменных и специализированных лекарств, более чем удвоению продаж брендовых лекарств до 7 миллиардов долларов.[11][12] В своем ежегодном отчете SEC за 2011 год Teva не включила лестуртиниб в список основных онкологических препаратов, находящихся в их разработке.[15]
Значительное количество патентов связано с лестуртинибом. Патентный поиск Google дает 1 278 патентов, связанных с лезауртинибом, 6 из которых включают в себя лезстауртиниб в названии, а 8 из них принадлежат компании Cephalon. 2017 патентов связаны с CEP-701, ни один из которых не включает CEP-701 в названии, а 8 из которых принадлежат Cephalon. 13 666 патентов относятся к ингибиторам FLT3, 7 из которых включают ингибирование FLT3 в заголовке, а 3 из которых принадлежат компании Cephalon.[16] Ингибиторы FLT3, которые в настоящее время проходят клинические испытания для лечения ОМЛ, включают: сорафениб, мидостаурин, и quizartinib.[17]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм час я Шаббир М, Стюарт Р. (2010). «Лестауртиниб, многоцелевой ингибитор тирозинкиназы: от лавки до постели». Заключение эксперта по исследуемым препаратам. 19 (3): 427–36. Дои:10.1517/13543781003598862. PMID 20141349.
- ^ Кнаппер С., Бернетт А.К., Литтлвуд Т. и др. (Ноябрь 2006 г.). «Испытание фазы 2 ингибитора FLT3 лестуртиниба (CEP701) в качестве лечения первой линии для пожилых пациентов с острым миелоидным лейкозом, не подходящим для интенсивной химиотерапии». Кровь. 108 (10): 3262–70. Дои:10.1182 / кровь-2006-04-015560. PMID 16857985.
- ^ Hexner EO, Serdikoff C, Jan M, et al. (Июнь 2008 г.). «Лестауртиниб (CEP701) представляет собой ингибитор JAK2, который подавляет передачу сигналов JAK2 / STAT5 и пролиферацию первичных эритроидных клеток у пациентов с миелопролиферативными расстройствами». Кровь. 111 (12): 5663–71. Дои:10.1182 / кровь-2007-04-083402. ЧВК 2424161. PMID 17984313.
- ^ Ревилл, П., Серраделл, Н., Болос, Дж., Роза, Э. (2007). «Лестауртиниб». Наркотики будущего. 32 (3): 215. Дои:10.1358 / DOF.2007.032.03.1084137.CS1 maint: несколько имен: список авторов (связь)
- ^ а б Минтурн Дж. Э., Виллабланка Дж., Яник Г. А. и др. (Май 2010 г.). «Фаза I исследования лестуртиниба у детей с рефрактерной нейробластомой (NB): исследование Консорциума нового подхода к терапии нейробластомы (NANT)». Журнал клинической онкологии. 28 (15): 9532. Дои:10.1200 / jco.2010.28.15_suppl.9532.
- ^ «Лестауртиниб, цитарабин и идарубицин в лечении молодых пациентов с рецидивирующим или рефрактерным острым миелоидным лейкозом». ClinicalTrials.gov. Национальные институты здравоохранения США. Получено 20 ноября 2016.
- ^ Левис М., Раванди Ф., Ван Э.С. и др. (24 марта 2011 г.). «Результаты рандомизированного исследования спасительной химиотерапии с последующим лечением лестуртинибом у пациентов с мутантным ОМЛ FLT3 при первом рецидиве». Кровь. 117 (12): 3294–301. Дои:10.1182 / blood-2010-08-301796. ЧВК 3069671. PMID 21270442.
- ^ Хекснер Э., Робоз Г., Хоффман Р. и др. (Январь 2014). «Открытое исследование перорального CEP-701 (лестуртиниба) у пациентов с истинной полицитемией или эссенциальной тромбоцитемией с мутацией JAK2-V617F». Британский журнал гематологии. 164 (1): 83–93. Дои:10.1111 / bjh.12607. PMID 24903629.
- ^ Minturn JE, Evans AE, Villablanca JG, et al. (Октябрь 2011 г.). «Фаза I исследования лестуртиниба у детей с рефрактерной нейробластомой: новые подходы к исследованию консорциума по терапии нейробластомы». Химиотерапия и фармакология рака. 68 (4): 1057–65. Дои:10.1007 / s00280-011-1581-4. ЧВК 4238911. PMID 21340605.
- ^ Hexner EO, Mascarenhas J, Prchal J, et al. (2015). «Фаза I исследования повышения дозы лестуртиниба у пациентов с миелофиброзом». Лейкемия и лимфома. 56 (9): 2543–51. Дои:10.3109/10428194.2014.1001986. ЧВК 5665563. PMID 25563429.
- ^ а б Николсон, Крис. «Teva купит Cephalon за 6,8 миллиарда долларов». DealBook. Нью-Йорк Таймс. Получено 20 ноября 2016.
- ^ а б «Teva приобретет Cephalon за 6,8 миллиарда долларов». Получено 20 ноября 2016.
- ^ «Цефалон 10-К 2007». викинвест. Cephalon, Inc. Получено 20 ноября 2016.
- ^ «Цефалон предоставляет обновленную клиническую информацию о Лестауртинибе при рецидиве острого миелогенного лейкоза». PR Newswire: компания CISION. Cephalon, Inc. Получено 20 ноября 2016.
- ^ «Форма 20-F (2011)». Teva Pharmaceutical Industries Ltd. Получено 20 ноября 2016.
- ^ «Патенты Google». Получено 20 ноября 2016.
- ^ Кадия TM, Раванди Ф., Кортес Дж. И др. (22 января 2016 г.). «Новые препараты при остром миелоидном лейкозе». Анналы онкологии. 27 (5): 770–8. Дои:10.1093 / annonc / mdw015. ЧВК 4843183. PMID 26802152.
