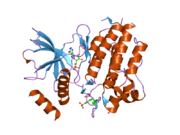Протоонкоген RET - RET proto-oncogene
В RET протоонкоген кодирует а рецепторная тирозинкиназа для членов семейство нейротрофических факторов (GDNF), полученных из линии глиальных клеток внеклеточного сигнальные молекулы.[5]RET Потеря функции мутации связаны с развитием Болезнь Гиршпрунга,[нужна цитата ] в то время как усиление функции мутации связаны с развитием различных типов человека рак, в том числе медуллярная карцинома щитовидной железы, множественные эндокринные неоплазии тип 2А и 2В, феохромоцитома и гиперплазия паращитовидных желез.[нужна цитата ]
Структура
RET это сокращение от "переставлено во время трансфекция ", как Последовательность ДНК этого ген изначально было обнаружено, что он переставлен в Фибробласт 3T3 линия клеток после трансфекции ДНК, взятой от человека лимфома клетки.[6]Человек ген RET локализован на хромосома 10 (10q11.2) и содержит 21 экзоны.[7]
Естественный альтернативное сращивание из RET ген приводит к производству 3 различных изоформы белка RET. RET51, RET43 и RET9 содержат 51, 43 и 9 аминокислоты в их C-терминал хвост соответственно.[8] Биологические роли изоформы RET51 и RET9 являются наиболее изученными in vivo поскольку это наиболее распространенные изоформы, в которых встречается RET.
Общее для каждого изоформа это домен структура. Каждый белок разделен на три домена: N-концевой внеклеточный домен с четырьмя кадгерин -подобные повторы и цистеин -богатый регион, гидрофобный трансмембранный домен и цитоплазматический тирозинкиназа домен, который разделен вставкой 27 аминокислоты. Внутри цитоплазматического тирозинкиназа домен, всего 16 тирозины (Tyrs) в RET9 и 18 в RET51. Tyr1090 и Tyr1096 присутствуют только в изоформе RET51.[9]
В внеклеточный домен RET содержит девять N-гликозилирование места. Сообщается, что полностью гликозилированный белок RET имеет молекулярный вес из 170 кДа хотя непонятно кому изоформа эта молекулярная масса относится.[10]
Активация киназы
RET - это рецептор для Лиганды семейства GDNF (GFL).[11]
Чтобы активировать RET, GFL сначала должны сформировать сложный с гликозилфосфатидилинозитол (GPI) - заякоренный корецептор. Сами корецепторы классифицируются как члены GDNF рецептор-α (GFRα) семейство белков. Различные члены семейства GFRα (СКФα1, СКФα2, СКФα3, СКФα4 ) проявляют специфическую связывающую активность в отношении конкретных GFL.[12]После образования комплекса GFL-GFRα комплекс затем объединяет две молекулы RET, запуская транс-автофосфорилирование конкретных тирозин остатки в тирозинкиназа домен каждой молекулы RET. Tyr900 и Tyr905 в пределах цикл активации (A-петля) киназного домена, как было показано, аутофосфорилирование сайты по масс-спектрометрии.[13]Фосфорилирование Tyr905 стабилизирует активную конформацию киназы, что, в свою очередь, приводит к аутофосфорилирование других остатков тирозина, в основном расположенных в С-концевой хвостовой области молекулы.[9]

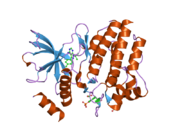
Структура, показанная слева, была взята из банк данных белков код 2IVT.[5]Структура такая же, как у димер образуется между двумя молекулами белка, каждая из которых охватывает аминокислоты 703-1012 молекулы RET, покрывая внутриклеточные RET. тирозинкиназа домен. Одна молекула белка, молекула A, показана желтым, а другая, молекула B, серым. Цикл активации окрашен в фиолетовый цвет, а выбранные остатки тирозина - в зеленый. Часть активационной петли от молекулы B отсутствует.
Фосфорилирование Tyr981 и дополнительных тирозинов Tyr1015, Tyr1062 и Tyr1096, не покрытых вышеуказанной структурой, как было показано, важны для инициации внутриклеточного преобразование сигнала процессы.
Роль передачи сигналов RET во время развития
Мыши с дефицитом GDNF, GFRα1 или самого белка RET обнаруживают серьезные дефекты в почка и кишечная нервная система развитие. Это подразумевает передачу сигнала RET как ключ к развитию нормального почки и кишечная нервная система.[9]
Клиническая значимость
Активация точечных мутаций в RET может вызвать синдром наследственного рака, известный как множественная эндокринная неоплазия 2 типа (ДУХ 2).[14] На основании клинических проявлений существует три подтипа: MEN 2A, MEN 2B и семейный медуллярная карцинома щитовидной железы (FMTC).[15] Между положением точечной мутации и фенотипом заболевания существует высокая степень корреляции.
Хромосомные перестройки, которые генерируют гибридный ген, приводящие к сопоставлению С-концевой области белка RET с N-концевой частью другого белка, также могут приводить к конститутивной активации киназы RET. Эти типы перегруппировок в первую очередь связаны с папиллярная карцинома щитовидной железы (PTC), где они составляют 10-20% случаев, и немелкоклеточный рак легкого (НМРЛ), где они составляют 2% случаев. В литературе описано несколько партнеров по слиянию, и наиболее часто встречающиеся при обоих типах рака включают: KIF5B, CCDC6 и NCOA4.
В то время как более старые ингибиторы мультикиназы, такие как кабозантиниб или вандетаниб показали умеренную эффективность в борьбе с злокачественными новообразованиями, вызванными RET, новые селективные ингибиторы (такие как селперкатиниб и пралсетиниб ) показали значительную активность как в отношении мутаций, так и слияний. Результаты исследования селперкатиниба LIBRETTO-001 показали выживаемость без прогрессирования 17,5 месяцев для ранее леченных RET-положительных НМРЛ и 22 месяцев для RET-положительных форм рака щитовидной железы, что побудило FDA одобрить оба этих показания в мае 2020 года. Несколько других селективных ингибиторов RET находятся в стадии разработки, включая TPX-0046, макроциклический ингибитор RET и Src предназначен для подавления мутаций, обеспечивающих устойчивость к действующим ингибиторам.
База данных болезней
В База данных вариантов гена RET на Университет Юты, идентифицирует (по состоянию на ноябрь 2014 г.) 166 мутаций, причастных к MEN2.
Взаимодействия
Было показано, что протоонкоген RET взаимодействовать с участием:
- DOK1,[16]
- DOK5,[17][18]
- Семейство рецепторов GDNF альфа 1,[19][20]
- GRB10,[21]
- GRB7,[22]
- Grb2,[21][23]
- SHC1,[23][24] и
- STAT3.[25][26][27]
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000165731 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000030110 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б Ноулз П.П., Мюррей-Раст Дж., Кьяер С. и др. (2006). «Структура и химическое ингибирование домена тирозинкиназы RET». J. Biol. Chem. 281 (44): 33577–87. Дои:10.1074 / jbc.M605604200. PMID 16928683.
- ^ Такахаши М., Ритц Дж., Купер Г.М. (1985). «Активация нового человеческого трансформирующего гена ret путем перестройки ДНК». Ячейка. 42 (2): 581–8. Дои:10.1016/0092-8674(85)90115-1. PMID 2992805. S2CID 13567823.
- ^ Ceccherini I, Bocciardi R, Luo Y, et al. (1993). «Структура экзона и фланкирующие интронные последовательности протоонкогена RET человека». Biochem. Биофиз. Res. Сообщество. 196 (3): 1288–1295. Дои:10.1006 / bbrc.1993.2392. PMID 7902707.
- ^ Майерс С.М., Энг С., Пондер Б.А. и др. (1995). «Характеристика вариантов сплайсинга 3 'протоонкогена RET и сайтов полиаденилирования: новый C-конец для RET». Онкоген. 11 (10): 2039–2045. PMID 7478523.
- ^ а б c Ариги Э., Боррелло М.Г., Сариола Х. (2005). «Передача сигналов тирозинкиназы RET в развитии и раке». Фактор роста цитокинов Rev. 16 (4–5): 441–67. Дои:10.1016 / j.cytogfr.2005.05.010. PMID 15982921.
- ^ Такахаши М., Асаи Н., Ивашита Т. и др. (1993). «Характеристика продуктов протоонкогенов ret, экспрессируемых в L-клетках мыши». Онкоген. 8 (11): 2925–2929. PMID 8414495.
- ^ Балох Р.Х., Эномото Х., Джонсон Э.М. и др. (2000). «Лиганды и рецепторы семейства GDNF - значение для нервного развития». Curr. Мнение. Нейробиол. 10 (1): 103–10. Дои:10.1016 / S0959-4388 (99) 00048-3. PMID 10679429. S2CID 32315320.
- ^ Айраксинен М.С., Титиевский А., Саарма М. (1999). «Передача сигналов нейротрофического фактора семейства GDNF: четыре хозяина, один слуга?». Мол. Cell. Неврологи. 13 (5): 313–25. Дои:10.1006 / mcne.1999.0754. PMID 10356294. S2CID 46427535.
- ^ Кавамото Ю., Такеда К., Окуно Ю. и др. (2004). «Идентификация сайтов аутофосфорилирования RET методом масс-спектрометрии». J. Biol. Chem. 279 (14): 14213–24. Дои:10.1074 / jbc.M312600200. PMID 14711813.
- ^ Онлайн-менделевское наследование в человеке (OMIM): МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ, ТИП IIA; MEN2A - 171400
- ^ Ци XP, Ма JM, Du ZF, Ying RB, Fei J, Jin HY, Han JS, Wang JQ, Chen XL, Chen CY, Liu WT, Lu JJ, Zhang JG, Zhang XN (2011). «Мутации зародышевой линии RET, идентифицированные секвенированием экзома в китайской множественной эндокринной неоплазии типа 2A / семейной медуллярной карциноме щитовидной железы». PLOS ONE. 6 (5): e20353. Bibcode:2011PLoSO ... 620353Q. Дои:10.1371 / journal.pone.0020353. ЧВК 3105051. PMID 21655256.
- ^ Мураками Х., Ямамура Й., Шимоно Й., Кавай К., Курокава К., Такахаши М. (сентябрь 2002 г.). «Роль Dok1 в передаче сигналов в клетке, опосредованной тирозинкиназой RET». J. Biol. Chem. 277 (36): 32781–90. Дои:10.1074 / jbc.M202336200. PMID 12087092.
- ^ Краудер Р.Дж., Эномото Х., Ян М., Джонсон Э.М., Милбрандт Дж. (Октябрь 2004 г.). «Док-6, член семьи Док-6 Novel p62, способствует Ret-опосредованному росту нейритов». J. Biol. Chem. 279 (40): 42072–81. Дои:10.1074 / jbc.M403726200. PMID 15286081.
- ^ Гримм Дж., Сакс М., Брич С., Ди Чезаре С., Шварц-Ромонд Т., Алитало К., Бирчмайер В. (июль 2001 г.). «Новые члены семейства p62dok, dok-4 и dok-5, являются субстратами тирозинкиназы рецептора c-Ret и опосредуют дифференцировку нейронов» (PDF). J. Cell Biol. 154 (2): 345–54. Дои:10.1083 / jcb.200102032. ЧВК 2150770. PMID 11470823.
- ^ Klein RD, Sherman D, Ho WH, Stone D, Bennett GL, Moffat B, Vandlen R, Simmons L, Gu Q, Hongo JA, Devaux B, Poulsen K, Armanini M, Nozaki C, Asai N, Goddard A, Phillips H , Хендерсон К.Э., Такахаши М., Розенталь А. (июнь 1997 г.). «GPI-связанный белок, который взаимодействует с Ret с образованием кандидата в рецепторы нейртурина». Природа. 387 (6634): 717–21. Дои:10.1038/42722. PMID 9192898. S2CID 4360246.
- ^ Cik M, Masure S, Lesage AS, Van Der Linden I, Van Gompel P, Pangalos MN, Gordon RD, Leysen JE (сентябрь 2000 г.). «Связывание GDNF и нейрурина с человеческими рецепторами семейства GDNF альфа 1 и 2. Влияние cRET и кооперативные взаимодействия». J. Biol. Chem. 275 (36): 27505–12. Дои:10.1074 / jbc.M000306200. PMID 10829012.
- ^ а б Панди А., Дуан Х., Ди Фьоре П.П., Диксит В.М. (сентябрь 1995 г.). «Тирозинкиназа рецептора Ret связывается с SH2-содержащим адаптерным белком Grb10». J. Biol. Chem. 270 (37): 21461–3. Дои:10.1074 / jbc.270.37.21461. PMID 7665556.
- ^ Панди А., Лю X, Диксон Дж. Э., Ди Фиоре П. П., Диксит В. М. (май 1996 г.). «Прямая связь между тирозинкиназой рецептора Ret и адаптерным белком Grb7, содержащим гомологию Src 2». J. Biol. Chem. 271 (18): 10607–10. Дои:10.1074 / jbc.271.18.10607. PMID 8631863.
- ^ а б Borrello MG, Pelicci G, Arighi E, De Filippis L, Greco A, Bongarzone I, Rizzetti M, Pelicci PG, Pierotti MA (июнь 1994). «Онкогенные версии тирозинкиназ Ret и Trk связывают адаптерные белки Shc и Grb2». Онкоген. 9 (6): 1661–8. PMID 8183561.
- ^ Ариги Э., Альберти Л., Торрити Ф., Гиццони С., Риццетти М.Г., Пеличчи Дж., Пазини Б., Бонгарзоне I, Пьютти С., Пьеротти М.А., Боррелло М.Г. (февраль 1997 г.). «Идентификация стыковочного сайта Shc на Ret тирозинкиназе». Онкоген. 14 (7): 773–82. Дои:10.1038 / sj.onc.1200896. PMID 9047384.
- ^ Юань З.Л., Гуань Ю.Дж., Ван Л., Вэй В., Кейн А.Б., Чин Ю.Э. (ноябрь 2004 г.). «Центральная роль остатка треонина в петле p + 1 рецепторной тирозинкиназы в конститутивном фосфорилировании STAT3 в метастатических раковых клетках». Мол. Cell. Биол. 24 (21): 9390–400. Дои:10.1128 / MCB.24.21.9390-9400.2004. ЧВК 522220. PMID 15485908.
- ^ Hwang JH, Kim DW, Suh JM, Kim H, Song JH, Hwang ES, Park KC, Chung HK, Kim JM, Lee TH, Yu DY, Shong M (июнь 2003 г.). «Активация сигнального преобразователя и активатора транскрипции 3 онкогенной тирозинкиназой RET / PTC (перегруппированной при трансформации / папиллярной карциноме щитовидной железы): роль в регуляции специфических генов и клеточной трансформации». Мол. Эндокринол. 17 (6): 1155–66. Дои:10.1210 / me.2002-0401. PMID 12637586.
- ^ Шуринга Дж. Дж., Войтачнио К., Хагенс В., Велленга Е., Покупает СН, Хофстра Р., Круиджер В. (август 2001 г.). «MEN2A-RET-индуцированная клеточная трансформация путем активации STAT3». Онкоген. 20 (38): 5350–8. Дои:10.1038 / sj.onc.1204715. PMID 11536047.
дальнейшее чтение
- Eng C., Маллиган LM (1997). «Мутации протоонкогена RET в синдромах множественной эндокринной неоплазии 2 типа, связанных спорадических опухолях и болезни Гиршпрунга». Гм. Мутат. 9 (2): 97–109. Дои:10.1002 / (SICI) 1098-1004 (1997) 9: 2 <97 :: AID-HUMU1> 3.0.CO; 2-M. PMID 9067749.
- Хофстра Р.М., Осинга Дж., Покупает CH (1998). «Мутации при болезни Гиршпрунга: когда мутация способствует фенотипу». Евро. J. Hum. Genet. 5 (4): 180–5. Дои:10.1159/000484760. PMID 9359036.
- Никифоров Ю.Е. (2002). «Перестройка RET / PTC в опухолях щитовидной железы». Endocr. Патол. 13 (1): 3–16. Дои:10.1385 / EP: 13: 1: 03. PMID 12114746. S2CID 23964165.
- Санторо М., Мелилло Р.М., Карломаньо Ф. и др. (2004). «Мини-обзор: RET: нормальные и ненормальные функции». Эндокринология. 145 (12): 5448–5451. Дои:10.1210 / en.2004-0922. PMID 15331579.
- Санторо М, Карломаньо Ф, Мелилло Р.М., Фуско А (2005). «Дисфункция рецептора RET при раке человека». Cell. Мол. Life Sci. 61 (23): 2954–2964. Дои:10.1007 / s00018-004-4276-8. PMID 15583857.
- Никколи-Сир П., Конте-Деволкс Б. (2005). «[Мутации RET и профилактика медуллярного рака щитовидной железы]». Анна. Эндокринол. 66 (3): 168–75. Дои:10.1016 / с0003-4266 (05) 81748-2. PMID 15988377.
- Лантьери Ф, Гризери П., Чекерини I (2006). «Молекулярные механизмы RET-индуцированного патогенеза Гиршпрунга». Анна. Med. 38 (1): 11–9. Дои:10.1080/07853890500442758. PMID 16448984. S2CID 43686346.
- Чампи Р., Никифоров Ю.Е. (2007). «Перестройки RET / PTC и мутации BRAF при онкогенезе щитовидной железы». Эндокринология. 148 (3): 936–41. Дои:10.1210 / en.2006-0921. PMID 16946010.
- Plaza-Menacho I, Burzynski GM, de Groot JW, et al. (2007). «Современные концепции генетики, передачи сигналов и терапии, связанных с RET» (PDF). Тенденции Genet. 22 (11): 627–36. Дои:10.1016 / j.tig.2006.09.005. PMID 16979782.
внешние ссылки
- GeneReviews / NCBI / NIH / UW запись о множественной эндокринной неоплазии 2 типа
- ret + протоонкоген + белки в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)