Матери против декапентаплегического гомолога 4 - Mothers against decapentaplegic homolog 4
SMAD4, также называемый Член семьи SMAD 4, Матери против декапентаплегического гомолога 4, или же DPC4 (удален при раке поджелудочной железы-4) это высококонсервативный белок, присутствующий во всех многоклеточные животные. Он принадлежит к SMAD семья фактор транскрипции белки, которые действуют как медиаторы передачи сигнала TGF-β. В TGFβ Семейство цитокинов регулирует критические процессы в течение жизненного цикла многоклеточных животных, играя важную роль во время развития эмбриона, гомеостаза тканей, регенерации и иммунной регуляции.[5]
SMAD 4 принадлежит к co-SMAD группа (общий посредник SMAD), второй класс семейства SMAD. SMAD4 - единственный известный co-SMAD у большинства многоклеточных животных. Он также принадлежит к Семья Дарвина белков, которые модулируют члены TGFβ суперсемейство белков, семейство белков, которые все играют роль в регуляции клеточных ответов. SMAD4 млекопитающих - это гомолог из Дрозофила белок "Матери против декапентаплегии "по имени Медея.[6]
SMAD4 взаимодействует с R-Smads, например SMAD2, SMAD3, SMAD1, SMAD5 и SMAD8 (также называемый SMAD9) с образованием гетеротримерных комплексов. Оказавшись в ядре, комплекс SMAD4 и двух R-SMADS связывается с ДНК и регулирует экспрессию различных генов в зависимости от клеточного контекста.[6] Внутриклеточные реакции с участием SMAD4 запускаются связыванием на поверхности клеток факторов роста из TGFβ семья. Последовательность внутриклеточных реакций с участием SMADS называется путем SMAD или путем трансформирующего фактора роста бета (TGF-β), поскольку последовательность начинается с распознавания TGF-β клетками.
Ген
У млекопитающих SMAD4 кодируется геном, расположенным на хромосома 18. У людей SMAD4 Ген содержит 54 829 пар оснований и расположен от пары № 51 030 212 до пары 51 085 041 в области 21.1 хромосомы 18.[7][8]

Протеин
SMAD4 - это 552 аминокислоты. полипептид с молекулярной массой 60,439 Да. SMAD4 имеет два функциональных домена, известных как MH1 и MH2.
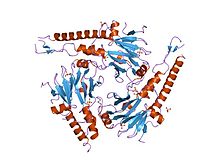
Комплекс двух SMAD3 (или двух SMAD2) и одного SMAD4 связывается непосредственно с ДНК через взаимодействия их доменов MH1. Эти комплексы рекрутируются в сайты по всему геному факторами транскрипции, определяющими клеточный клон (LDTF), которые определяют контекстно-зависимую природу действия TGF-β. Раннее понимание специфичности связывания ДНК белков Smad было получено в результате скрининга связывания олигонуклеотидов, который идентифицировал палиндромный дуплекс 5'-GTCTAGAC-3 'как высокоаффинную связывающую последовательность для SMAD3 и SMAD4 MH1 доменов.[9] Другие мотивы также были идентифицированы в промоторах и энхансерах. Эти дополнительные сайты содержат мотив CAGCC и консенсусные последовательности GGC (GC) | (CG), последние также известны как сайты 5GC.[10] 5GC-мотивы широко представлены в виде кластеров сайтов в SMAD-связанных областях по всему геному. Эти кластеры также могут содержать сайты CAG (AC) | (CC). Комплекс SMAD3 / SMAD4 также связывается с элементами промотора TPA-чувствительного гена, которые имеют мотив последовательности TGAGTCAG.[11]
Структуры
Комплексы домена MH1 с мотивами ДНК
Первой структурой SMAD4, связанной с ДНК, был комплекс с палиндромным мотивом GTCTAGAC.[12] Недавно также были определены структуры домена MH1 SMAD4, связанного с несколькими мотивами 5GC. Во всех комплексах взаимодействие с ДНК включает консервативную β-шпильку, присутствующую в домене MH1. Шпилька частично гибка в растворе, а ее высокая степень конформационной гибкости позволяет распознавать различные последовательности из 5 п.н. Эффективные взаимодействия с GC-сайтами происходят только в том случае, если нуклеотид G расположен глубоко в большой рощице и устанавливает водородные связи с гуанидиниевой группой Arg81. Это взаимодействие способствует дополнительному поверхностному контакту между шпилькой, связывающей ДНК Smad, и большой бороздкой ДНК. Другие прямые взаимодействия включают Lys88 и Gln83. Рентгеновская кристаллическая структура Trichoplax adhaerens Домены SMAD4 MH1, связанные с мотивом GGCGC, указывают на высокую сохранность этого взаимодействия у многоклеточных животных.[10]
Доменные комплексы MH2
Область MH2, соответствующая C-конец, отвечает за распознавание рецептора и ассоциацию с другими SMAD. Он взаимодействует с доменом R-SMADS MH2 и образует гетеродимеры и гетеротримеры. Некоторые опухолевые мутации, обнаруженные в SMAD4, усиливают взаимодействия между доменами MH1 и MH2.[13]
Номенклатура и происхождение названия
SMAD хорошо сохраняются у разных видов, особенно у N терминал MH1 домен и Терминал C MH2 домен Белки SMAD являются гомологами обоих Дрозофила белок MAD и C. elegans белок SMA. Название представляет собой комбинацию двух. В течение Дрозофила исследований было установлено, что мутация в гене СУМАСШЕДШИЙ в матери подавлен ген декапентаплегический в эмбрионе. Была добавлена фраза «Матери против», поскольку матери часто создают организации, выступающие против различных вопросов, например Матери против вождения в нетрезвом виде (MADD), что отражает "усиление материнского эффекта dpp ";[14] и основан на традиции необычного именования в исследовательском сообществе.[15] SMAD4 также известен как DPC4, JIP или MADH4.
Функция и механизм действия
SMAD4 - это белок, который определен как важный эффектор в пути SMAD. SMAD4 служит посредником между внеклеточными факторами роста из семейства TGFβ и генами внутри клетки. ядро. Аббревиатура co в co-SMAD означает общий посредник. SMAD4 также определяется как преобразователь сигналов.
В пути TGF-β димеры TGF-β распознаются трансмембранным рецептором, известным как рецептор типа II. Как только рецептор типа II активируется связыванием TGF-β, он фосфорилирует рецептор типа I. Рецептор I типа также является рецептор клеточной поверхности. Затем этот рецептор фосфорилирует регулируемый внутриклеточным рецептором SMADS (R-SMADS), такой как SMAD2 или SMAD3. Затем фосфорилированный R-SMADS связывается с SMAD4. Ассоциация R-SMADs-SMAD4 - это гетеромерный сложный. Этот комплекс переместится из цитоплазмы в ядро: это транслокация. SMAD4 может образовывать гетеротримерные, гетерогексамерные или гетеродимерные комплексы с R-SMADS.
SMAD4 - это основа Эрк /MAPK киназа[16] и GSK3.[17] FGF (Фактор роста фибробластов ) стимуляция пути приводит к Smad4 фосфорилирование к Эрк канонического MAPK сайт, расположенный на Threonine 277. Это событие фосфорилирования оказывает двойное влияние на активность Smad4. Во-первых, он позволяет Smad4 достичь пика транскрипционной активности за счет активации фактор роста -регулируемый домен активации транскрипции, расположенный в линкерной области Smad4, SAD (Smad-Activation Domain).[18] Второй, MAPK простые числа Smad4 для GSK3 -опосредованное фосфорилирование, которое вызывает ингибирование транскрипции, а также генерирует фосфодегрон, используемый убиквитином в качестве стыковочного сайта E3 лигаза Бета-трансдуцин Повторы, содержащие (бета-TrCP ), который полиубиквитинирует Smad4 и направляет его на деградацию в протеасома.[19] Smad4 GSK3 фосфорилирование было предложено для регулирования стабильности белка во время поджелудочной железы и рак толстой кишки прогрессия.[20]
В ядре гетеромерный комплекс связывает промоторы и взаимодействует с активаторами транскрипции. SMAD3 Комплексы / SMAD4 могут напрямую связывать SBE. Эти ассоциации слабые и требуют дополнительных факторы транскрипции такие как члены АП-1 семья, TFE3 и FoxG1 регулировать экспрессия гена.[21]
Многие лиганды TGFβ используют этот путь и впоследствии SMAD4 участвует во многих клеточных функциях, таких как дифференциация, апоптоз, гаструляция, эмбриональное развитие и клеточный цикл.
Клиническое значение
Генетические эксперименты, такие как нокаут гена (KO), которые заключаются в модификации или инактивации гена, могут быть выполнены для того, чтобы увидеть влияние дисфункционального SMAD 4 на исследуемый организм. Часто эксперименты проводят на домашней мышке (Mus musculus ).
Было показано, что у мыши KO of SMAD4, то клетки гранулезы, которые выделяют гормоны и факторы роста во время ооцит развитие, преждевременная лютеинизация и снижение уровня рецепторы фолликулостимулирующего гормона (FSHR) и более высокие уровни рецепторы лютеинизирующего гормона (LHR). Частично это может быть связано с обесценением костный морфогенетический белок-7 эффекты, поскольку BMP-7 использует сигнальный путь SMAD4.[22][23]
Делеции в генах, кодирующих SMAD1 и SMAD5 также были связаны с метастазическими опухолями гранулезных клеток у мышей.[24]
SMAD4 часто мутирует при многих раковых заболеваниях. Мутация может быть унаследована или приобретена в течение жизни человека. При унаследовании мутация затрагивает оба соматический клетки и клетки репродуктивных органов. Если SMAD 4 мутация приобретена, она будет существовать только в определенных соматических клетках. Действительно, не все клетки синтезируют SMAD 4. Белок присутствует в клетках кожи, поджелудочной железы, толстой кишки, матки и эпителия. Он также производится фибробласты. Функциональный SMAD 4 участвует в регуляции пути передачи сигнала TGF-β, который негативно регулирует рост эпителиальных клеток и внеклеточный матрикс (ECM). Когда структура SMAD 4 изменяется, экспрессия генов, участвующих в росте клеток, больше не регулируется, и пролиферация клеток может продолжаться без какого-либо подавления. Большое количество клеточных делений приводит к образованию опухолей, а затем к мультиплоидности. колоректальный рак и карцинома поджелудочной железы. Он инактивирован как минимум в 50% случаев рака поджелудочной железы.[25]
Было показано, что соматические мутации, обнаруженные при раке человека в домене MH1 SMAD 4, ингибируют ДНК-связывающую функцию этого домена.
SMAD 4 также мутировал в аутосомно-доминантный болезнь синдром ювенильного полипоза (JPS). JPS характеризуется наличием гамартоматозных полипов желудочно-кишечного тракта (ЖКТ). Эти полипы обычно доброкачественные, однако они подвержены большему риску развития. рак желудочно-кишечного тракта, особенно рак толстой кишки Выявлено около 60 мутаций, вызывающих JPS. Они были связаны с производством SMAD 4 меньшего размера с отсутствующими доменами, которые препятствуют связыванию белка с R-SMADS и формированию гетеромерный комплексы.[8]
Мутации в SMAD4 (в основном замены) могут вызвать Синдром Myhre, редкое наследственное заболевание, характеризующееся умственной отсталостью, низким ростом, необычными чертами лица и различными костными аномалиями.[26][27]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000141646 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000024515 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Массаге, Жанна (2012). «Передача сигналов TGFβ в контексте». Обзоры природы Молекулярная клеточная биология. 13 (10): 616–630. Дои:10.1038 / nrm3434. ISSN 1471-0080. ЧВК 4027049. PMID 22992590.
- ^ а б Массаге, Дж. (1998). «ПЕРЕДАЧА СИГНАЛА TGF-β». Ежегодный обзор биохимии. 67 (1): 753–791. Дои:10.1146 / annurev.biochem.67.1.753. ISSN 0066-4154. PMID 9759503.
- ^ "SMAD4 член семьи SMAD 4". Entrez Gene.
- ^ а б «СМАД 4». Сайт-справочник по генетике.
- ^ Завел Л., Дай Дж. Л., Бакхаултс П., Чжоу С., Кинзлер К. В., Фогельштейн Б., Керн С.Е. (март 1998 г.). «Человеческие Smad3 и Smad4 являются активаторами транскрипции, специфичными для последовательности». Молекулярная клетка. 1 (4): 611–617. Дои:10.1016 / с1097-2765 (00) 80061-1. PMID 9660945.
- ^ а б Мартин-Мальпартида, По; Батет, Марта; Качмарска, Зузанна; Фрейер, Регина; Гомеш, Тьяго; Арагон, Эрик; Цзоу, Илун; Ван, Цюн; Си Цяорань (12 декабря 2017 г.). «Структурная основа для широкого распознавания геномных мотивов GC из 5 п.н. факторами транскрипции SMAD». Nature Communications. 8 (1): 2070. Bibcode:2017НатКо ... 8.2070M. Дои:10.1038 / s41467-017-02054-6. ISSN 2041-1723. ЧВК 5727232. PMID 29234012.
- ^ Чжан, Инь; Фэн, Синь-Хуа; Деринк, Рик (1998). «Smad3 и Smad4 взаимодействуют с c-Jun / c-Fos, чтобы опосредовать TGF-β-индуцированную транскрипцию». Природа. 394 (6696): 909–913. Bibcode:1998Натура.394..909Z. Дои:10.1038/29814. ISSN 0028-0836. PMID 9732876. S2CID 4393852.
- ^ Бабураджендран, Нитья; Эмили, Ральф; Тан, Клара Юэ Чжэнь; Нарасимхан, Камеш; Колаткар, Прасанна Р. (2011). «Структурная основа кооперативного распознавания ДНК димерами Smad4 MH1». Исследования нуклеиновых кислот. 39 (18): 8213–8222. Дои:10.1093 / nar / gkr500. ISSN 1362-4962. ЧВК 3185416. PMID 21724602.
- ^ Хата, Акико; Lo, Roger S .; Уоттон, Дэвид; Лагна, Джорджио; Массагуэ, Жанна (1997). «Мутации, увеличивающие аутоингибирование, инактивируют опухолевые супрессоры Smad2 и Smad4». Природа. 388 (6637): 82–87. Bibcode:1997Натура.388R..82H. Дои:10.1038/40424. ISSN 0028-0836. PMID 9214507. S2CID 4407819.
- ^ Секельски Дж. Дж., Ньюфельд С. Дж., Рафтери Л. А., Чартофф Е. Х., Гелбарт В. М. (март 1995 г.). «Генетическая характеристика и клонирование матерей против dpp, гена, необходимого для декапентаплегической функции у Drosophila melanogaster». Генетика. 139 (3): 1347–58. ЧВК 1206461. PMID 7768443.
- ^ White M (26 сентября 2014 г.). «Sonic Hedgehog, DICER и проблема с именованием генов». Тихоокеанский стандарт.
- ^ Ролен Б.А., Коэн О.С., Райчоудхури М.К., Чейди Д.Н., Чжан Й., Кириакис Д.М., Алессандрини А.А., Лин Х.Й. (октябрь 2003 г.). «Фосфорилирование треонина 276 в Smad4 участвует в трансформации накопления ядер, индуцированного бета-фактором роста». Американский журнал физиологии. Клеточная физиология. 285 (4): C823–30. Дои:10.1152 / ajpcell.00053.2003. PMID 12801888.
- ^ Деманьи Х., Араки Т., Де Робертис Э.М. (октябрь 2014 г.). «Супрессор опухолей Smad4 / DPC4 регулируется фосфорилированием, которое интегрирует передачу сигналов FGF, Wnt и TGF-β». Отчеты по ячейкам. 9 (2): 688–700. Дои:10.1016 / j.celrep.2014.09.020. PMID 25373906.
- ^ де Кестекер, Марк П. (2000). «Домен активации Smad4 (SAD) представляет собой богатый пролином р300-зависимый домен активации транскрипции». Журнал биологической химии. 275 (3): 2115–2122. Дои:10.1074 / jbc.275.3.2115. PMID 10636916.
- ^ Деманьи Х, Де Робертис Э.М. (2015). «Smad4 / DPC4: барьер против развития опухоли, управляемый передачей сигналов RTK / Ras / Erk и Wnt / GSK3». Молекулярная и клеточная онкология. 3 (2): e989133. Дои:10.4161/23723556.2014.989133. ЧВК 4905428. PMID 27308623.
- ^ Деманьи Х, Де Робертис Э.М. (2015). «Точечные мутации в супрессоре опухолей Smad4 / DPC4 усиливают его фосфорилирование с помощью GSK3 и обратимо инактивируют передачу сигналов TGF-β». Молекулярная и клеточная онкология. 3 (1): e1025181. Дои:10.1080/23723556.2015.1025181. ЧВК 4845174. PMID 27308538.
- ^ Инман Дж. Дж. (Февраль 2005 г.). «Связывание Smads и активация транскрипции». Биохимический журнал. 386 (Pt 1): e1 – e3. Дои:10.1042 / bj20042133. ЧВК 1134782. PMID 15702493.
- ^ Ши Дж., Йошино О, Осуга Й, Нишии О, Яно Т., Такетани Й. (март 2010 г.). «Костный морфогенетический белок 7 (BMP-7) увеличивает экспрессию рецептора фолликулостимулирующего гормона (ФСГ) в клетках гранулезы человека». Фертильность и бесплодие. 93 (4): 1273–9. Дои:10.1016 / j.fertnstert.2008.11.014. PMID 19108831.
- ^ Пангас С.А., Ли Х, Робертсон Э.Дж., Мацук М.М. (июнь 2006 г.). «Преждевременная лютеинизация и дефекты кумулюсных клеток у мышей с нокаутом Smad4, специфичных для яичников». Молекулярная эндокринология. 20 (6): 1406–22. Дои:10.1210 / me.2005-0462. PMID 16513794.
- ^ Миддлбрук Б.С., Элдин К., Ли Х, Шивасанкаран С., Пангас С.А. (2009). «У мышей с условным нокаутом яичников Smad1-Smad5 развивается профиль заболевания, подобный ювенильной форме опухолей гранулезных клеток человека». Эндокринология. 150 (12): 5208–17. Дои:10.1210 / en.2009-0644. ЧВК 2819741. PMID 19819941.
- ^ Котран Р.С., Кумар В., Фаусто Н., Роббинс С.Л., Аббас А.К. (2005). Патологические основы болезни Роббинса и Котрана (7-е изд.). Сент-Луис, Миссури: Elsevier Saunders. ISBN 0-7216-0187-1.
- ^ "Синдром умственной отсталости Myhre". Национальная организация редких заболеваний.
- ^ Капуто V, Bocchinfuso G, Castori M, Traversa A, Pizzuti A, Stella L, Grammatico P, Tartaglia M (июль 2014 г.). «Новая мутация SMAD4, вызывающая синдром Myhre». Американский журнал медицинской генетики, часть A. 164A (7): 1835–40. Дои:10.1002 / ajmg.a.36544. PMID 24715504. S2CID 5294309.
дальнейшее чтение
- Миязоно К. (2000). «Передача сигналов TGF-бета белками Smad». Отзывы о цитокинах и факторах роста. 11 (1–2): 15–22. Дои:10.1016 / S1359-6101 (99) 00025-8. PMID 10708949.
- Врана Дж. Л., Аттисано Л. (2000). «Путь Смада». Отзывы о цитокинах и факторах роста. 11 (1–2): 5–13. Дои:10.1016 / S1359-6101 (99) 00024-6. PMID 10708948.
- Verschueren K, Huylebroeck D (2000). «Замечательная универсальность белков Smad в ядре клеток, активированных трансформирующим фактором роста бета». Отзывы о цитокинах и факторах роста. 10 (3–4): 187–99. Дои:10.1016 / S1359-6101 (99) 00012-X. PMID 10647776.
- Massagué J (1998). «Передача сигнала TGF-бета». Ежегодный обзор биохимии. 67: 753–91. Дои:10.1146 / annurev.biochem.67.1.753. PMID 9759503.
- Klein-Scory S, Zapatka M, Eilert-Micus C, Hoppe S, Schwarz E, Schmiegel W, Hahn SA, Schwarte-Waldhoff I (2008). «Высокий уровень индуцируемой реэкспрессии Smad4 в клеточной линии рака шейки матки C4-II связан с профилем экспрессии гена, который предсказывает предпочтительную роль Smad4 в составе внеклеточного матрикса». BMC Рак. 7: 209. Дои:10.1186/1471-2407-7-209. ЧВК 2186346. PMID 17997817.
- Kalo E, Buganim Y, Shapira KE, Besserglick H, Goldfinger N, Weisz L, Stambolsky P, Henis YI, Rotter V (декабрь 2007 г.). «Мутантный p53 ослабляет SMAD-зависимый сигнальный путь трансформирующего фактора роста бета1 (TGF-beta1) путем репрессии экспрессии рецептора TGF-бета типа II». Молекулярная и клеточная биология. 27 (23): 8228–42. Дои:10.1128 / MCB.00374-07. ЧВК 2169171. PMID 17875924.
- Aretz S, Stienen D, Uhlhaas S, Stolte M, Entius MM, Loff S, Back W, Kaufmann A, Keller KM, Blaas SH, Siebert R, Vogt S, Spranger S, Holinski-Feder E, Sunde L, Propping P, Фридл В. (ноябрь 2007 г.). «Высокая доля крупных геномных делеций и обновление фенотипа генотипа в 80 неродственных семьях с синдромом ювенильного полипоза». Журнал медицинской генетики. 44 (11): 702–9. Дои:10.1136 / jmg.2007.052506. ЧВК 2752176. PMID 17873119.
- Али С., Коэн С., Литтл СП, Секейра Дж. Х., Мосунджак МБ, Сиддики М.Т. (октябрь 2007 г.). «Применение SMAD4 в качестве диагностического иммуногистохимического маркера аденокарциномы поджелудочной железы и его экспрессия в других солидных опухолях». Диагностическая цитопатология. 35 (10): 644–8. Дои:10.1002 / dc.20715. PMID 17854080. S2CID 36682992.
- Милет Дж, Дехаис В., Бургейн С., Жуаноль А.М., Моссер А., Перрин М., Морсет Дж., Бриссо П., Дэвид В., Дюнье Ю., Моссер Дж. (Октябрь 2007 г.). "Общие варианты генов BMP2, BMP4 и HJV пути регуляции гепсидина модулируют пенетрантность гемохроматоза HFE". Американский журнал генетики человека. 81 (4): 799–807. Дои:10.1086/520001. ЧВК 2227929. PMID 17847004.
- Салек С., Бенесова Л., Заворал М., Носек В., Касперова Л., Рыска М., Стрнад Р., Трабулси Е., Минарик М. (июль 2007 г.). «Оценка клинической значимости исследования мутаций K-ras, p16 и p53 вместе с аллельными потерями на 9p и 18q в образцах тонкой иглы под контролем EUS у пациентов с хроническим панкреатитом и раком поджелудочной железы». Всемирный журнал гастроэнтерологии. 13 (27): 3714–20. Дои:10.3748 / wjg.v13.i27.3714. ЧВК 4250643. PMID 17659731.
- Себастьен А., Хайду М., Кис Л., Барна Г., Коппер Л. (сентябрь 2007 г.). «Smad4-независимый, PP2A-зависимый апоптотический эффект экзогенного трансформирующего фактора роста бета 1 в клетках лимфомы». Экспериментальные исследования клеток. 313 (15): 3167–74. Дои:10.1016 / j.yexcr.2007.05.028. PMID 17643425.
- Мартин М.М., Бакенбергер Дж. А., Цзян Дж., Малана Г. Э., Ноелл Д. Л., Фельдман Д. С., Элтон Т. С. (сентябрь 2007 г.). «TGF-beta1 стимулирует экспрессию человеческого рецептора AT1 в фибробластах легких путем перекрестной связи между сигнальными путями Smad, p38 MAPK, JNK и PI3K». Американский журнал физиологии. Клеточная и молекулярная физиология легких. 293 (3): L790–9. Дои:10.1152 / ajplung.00099.2007. ЧВК 2413071. PMID 17601799.
- Леви Л., Хауэлл М., Дас Д., Харкин С., Эпископу В., Хилл С.С. (сентябрь 2007 г.). «Аркадия активирует Smad3 / Smad4-зависимую транскрипцию, запуская индуцированную сигналом деградацию SnoN». Молекулярная и клеточная биология. 27 (17): 6068–83. Дои:10.1128 / MCB.00664-07. ЧВК 1952153. PMID 17591695.
- Grijelmo C, Rodrigue C, Svrcek M, Bruyneel E, Hendrix A, de Wever O, Gespach C (август 2007 г.). «Проинвазивная активность BMP-7 через SMAD4 / src-независимые и ERK / Rac / JNK-зависимые сигнальные пути в раковых клетках толстой кишки». Сотовая связь. 19 (8): 1722–32. Дои:10.1016 / j.cellsig.2007.03.008. PMID 17478078.
- Сонегава Х., Нукуи Т., Ли Д.В., Такаиси М., Сакагути М., Хах Нью-Хэмпшир (июль 2007 г.). «Вовлечение ухудшения S100C / A11-опосредованного пути в устойчивость линий клеток плоскоклеточного рака человека к подавлению роста, индуцированному TGFbeta». Журнал молекулярной медицины. 85 (7): 753–62. Дои:10.1007 / s00109-007-0180-7. PMID 17476473. S2CID 15667203.
- Шейх А.А., Вималачандран Д., Томпсон С.К., Дженкинс Р.Э., Неджади Т., Шекоу А., Кэмпбелл Ф., Додсон А., Прайм В., Црногорак-Юрчевич Т., Лемуан Н. Р., Костелло Е. (июнь 2007 г.)«Экспрессия S100A8 в моноцитах, связанных с раком поджелудочной железы, связана со статусом Smad4 раковых клеток поджелудочной железы». Протеомика. 7 (11): 1929–40. Дои:10.1002 / pmic.200700072. PMID 17469085.
- Попович Хадзия М., Королия М., Якич Разумович Дж., Павкович П., Хадзия М., Капитанович С. (апрель 2007 г.). «Мутации K-ras и Dpc4 при хроническом панкреатите: серия случаев». Хорватский медицинский журнал. 48 (2): 218–24. ЧВК 2080529. PMID 17436386.
- Лози Л., Бузурен Х., Бенхаттар Дж. (Май 2007 г.). «Потеря экспрессии Smad4 предсказывает метастазирование в печень при колоректальном раке человека». Отчеты онкологии. 17 (5): 1095–9. Дои:10.3892 / или 17.5.1095. PMID 17390050.
- Карлссон Г., Бланк Ю., Муди Дж. Л., Эхингер М., Сингбрант С., Дэн С. Х., Карлссон С. (март 2007 г.). «Smad4 имеет решающее значение для самообновления гемопоэтических стволовых клеток». Журнал экспериментальной медицины. 204 (3): 467–74. Дои:10.1084 / jem.20060465. ЧВК 2137898. PMID 17353364.
- Такано С., Канаи Ф., Джазаг А., Иджичи Х., Яо Дж., Огава Х., Эномото Н., Омата М., Накао А. (март 2007 г.). «Smad4 необходим для подавления E-кадгерина, индуцированного TGF-бета, в линии клеток рака поджелудочной железы PANC-1». Журнал биохимии. 141 (3): 345–51. Дои:10.1093 / jb / mvm039. PMID 17301079.










