Коэволюция паразита и хозяина - Host–parasite coevolution
Коэволюция паразита и хозяина это частный случай коэволюция, ответная адаптивная генетический изменение хозяин и паразит через взаимный селективное давление.
Он характеризуется реципрокным генетическим изменением и, следовательно, изменениями в аллель частоты в популяциях. Их определяют три основных типа динамики отбора: отрицательная частотно-зависимый выбор когда редкий аллель имеет избирательное преимущество; чрезмерное доминирование, вызванное преимущество гетерозиготы; и направленный выборочные зачистки рядом с выгодной мутацией.
Теории коэволюции паразитов и хозяина включают теорию географической мозаики, которая предполагает мозаичность отбора, коэволюционные горячие точки и географическое смешение; то Гипотеза Красной Королевы, который предполагает, что паразитизм способствует половое размножение в хосте; и эволюционный компромисс между передачей и вирулентностью, поскольку, если паразит убивает своего хозяина слишком быстро, паразит не может воспроизводиться.
Модельные системы включить нематоду Caenorhabditis elegans с бактерией Bacillus thuringiensis; рачок Дафния и его многочисленные паразиты; и кишечная палочка и млекопитающие (включая человека), в кишечнике которых он обитает.
Обзор
Хосты и паразиты оказывать взаимный селективное давление друг на друга, что может привести к быстрому взаимному приспособление. Для организмов с коротким временем генерации совместную эволюцию паразита и хозяина можно наблюдать в сравнительно короткие периоды времени, что позволяет изучать эволюционные изменения в реальном времени как в полевых, так и в лабораторных условиях. Таким образом, эти взаимодействия могут служить противоположным примером общепринятому представлению о том, что эволюцию можно обнаружить только в течение длительного времени.[1]
Динамика этих взаимодействий представлена в Гипотеза Красной Королевы, а именно, что и хозяин, и паразит должны постоянно меняться, чтобы идти в ногу с адаптациями друг друга.[2]
Совместная эволюция паразита и хозяина является повсеместной и имеет потенциальное значение для всех живых организмов, включая людей, домашних животных и сельскохозяйственных культур. Основные заболевания, такие как малярия, СПИД и грипп вызываются одновременно развивающимися паразитами. Лучшее понимание коэволюционной адаптации между стратегиями атаки паразитов и хозяином иммунная система может помочь в разработке новых лекарств и вакцин.[1]
Динамика отбора
Совместная эволюция паразита и хозяина характеризуется реципрокным генетическим изменением и, следовательно, изменениями в аллель частоты в популяциях. Эти изменения можно определить по трем основным типам динамики отбора.[3][1]
Отрицательный частотно-зависимый выбор
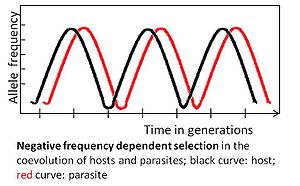
Аллель подвержен отрицательному частотно-зависимый выбор если редкий аллельный вариант имеет избирательное преимущество. Например, паразит должен адаптироваться к самому обычному хозяину. генотип, потому что он может заразить большое количество хостов. В свою очередь, редкий генотип хозяина может быть одобрен отбором, его частота возрастет и в конечном итоге станет обычным. Впоследствии паразиту следует адаптироваться к бывшему нечастому генотипу.[3][4]
Коэволюция, определяемая отрицательным частотно-зависимым отбором, происходит быстро и может происходить через несколько поколений.[3] Он поддерживает высокое генетическое разнообразие, отдавая предпочтение необычным аллелям. Этот режим выбора ожидается для многоклеточных хостов, поскольку адаптация может происходить без необходимости в новых выгодных мутации, которые реже встречаются у этих хозяев из-за относительно небольшого размера популяции и относительно длительного времени генерации.[3]
Сверхдоминантный отбор
Чрезмерное доминирование происходит, если гетерозигота фенотип имеет преимущество в фитнесе перед обоими гомозиготы (преимущество гетерозиготы, вызывая гетерозис ).[5][6] Одним из примеров является серповидноклеточная анемия. Это связано с мутация в гемоглобин ген, приводящий к образованию серповидных эритроцитов, вызывая свертывание кровеносных сосудов, ограничивая кровоток и снижая транспорт кислорода. В то же время мутация придает устойчивость к малярия, вызванный Плазмодий паразиты, которые передаются в эритроцитах после передачи человеку комары. Следовательно, гомозиготные и гетерозиготные генотипы по аллелю серповидноклеточной анемии проявляют устойчивость к малярии, в то время как гомозигота страдает фенотипом тяжелого заболевания. Альтернативная гомозигота, не несущая аллеля серповидноклеточной анемии, восприимчива к инфицированию Плазмодий. Как следствие, гетерозиготный генотип выборочно отдается предпочтению в районах с высокой заболеваемостью малярией.[7][8]
Направленный выбор

Если аллель дает преимущество в пригодности, его частота будет увеличиваться в популяции - отбор является направленным или положительным. Выборочные развертки представляют собой одну из форм направленного отбора, при котором увеличение частоты в конечном итоге приводит к фиксации выгодного аллеля. Этот процесс считается более медленным по сравнению с отрицательным частотно-зависимым отбором. Это может вызвать «гонку вооружений», состоящую из повторяющегося происхождения и фиксации новых вирулентных свойств паразитов и защитных свойств хозяина.[1]
Этот способ отбора, вероятно, будет происходить во взаимодействиях между одноклеточными организмами и вирусами из-за больших размеров популяции, короткого времени генерации, часто гаплоидных геномов и горизонтальный перенос генов, которые увеличивают вероятность возникновения и распространения полезных мутаций в популяциях.[3]
Теории
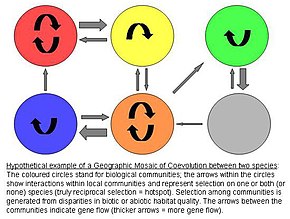
Географическая мозаика теория коэволюции
Географическая мозаичная теория коэволюции Джона Н. Томпсона выдвигает гипотезу о пространственно дивергентном коэволюционном отборе, вызывающем генетическую дифференциацию между популяциями.[9] Модель предполагает три элемента, которые вместе подпитывают коэволюцию:[10][11][12]
1) мозаика отбора среди популяций
- Естественный отбор по межвидовым взаимодействиям различается среди популяций. Таким образом, взаимодействия генотип-ген-тип-среда (G x G x E) влияют на приспособленность антагонистов. Другими словами, конкретные условия окружающей среды определяют, как любой генотип одного вида влияет на приспособленность другого вида.
2) коэволюционные горячие точки
- Коэволюционные горячие точки - это сообщества, в которых отбор по взаимодействию действительно взаимен. Эти горячие точки смешаны с так называемыми холодными пятнами, в которых только один или ни один из видов адаптируется к антагонисту.
3) географическое смешение признаков
- Между сообществами / регионами происходит постоянное «смешение» признаков по поток генов, случайный генетический дрейф, Население вымирание, или мутация. Это повторное смешение определяет точную динамику географической мозаики путем сдвига пространственного распределения потенциально коэволюционирующих аллели и черты характера.
Среди растений, Подорожник ланцетный и его паразит мучнистая роса Podosphaera plantaginis были интенсивно изучены на Аландские острова в юго-западной Финляндии.[13] P. plantaginis получает питательные вещества от своего хозяина, многолетнего растения, посылая корни в растение. В этом регионе насчитывается более 3000 популяций хозяев, где обе популяции могут развиваться свободно, в отсутствие отбора, навязанного человеком, в неоднородном ландшафте. Оба партнера могут размножаться бесполым или половым путем. Система имеет пространственно расходящуюся коэволюционную динамику в двух метапопуляции как предсказывает теория мозаики.[14][9]
Гипотеза Красной Королевы

Новозеландская пресноводная улитка Potamopyrgus antipodarum и его разные трематода паразиты представляют собой довольно особую модельную систему. Популяции P. antipodarum состоят из бесполых клонов и половых особей и поэтому могут использоваться для изучения эволюции и преимуществ половое размножение. Существует высокая корреляция между присутствием паразитов и частотой половых контактов в различных популяциях. Этот результат согласуется с Гипотеза Красной Королевы что половое размножение благоприятствует совместной эволюции паразита и хозяина.[15] В то же время сохранение секса может зависеть и от других факторов, например Трещотка Мюллера и / или предотвращение накопления вредных мутаций.
Компромисс между передачей и вирулентностью
Tribolium castaneum, красный мучной жук, является хозяином для микроспоридиан Белый нос. Этот паразитоид убивает своего хозяина для передачи, поэтому продолжительность жизни хозяина важна для успеха паразита. В свою очередь, приспособленность паразитов, скорее всего, зависит от компромисса между передачей (споровая нагрузка) и вирулентность.[16] Более высокая вирулентность увеличит потенциал для производства большего количества потомства, но более высокая нагрузка спор повлияет на продолжительность жизни хозяина и, следовательно, на скорость передачи. Этот компромисс подтверждается коэволюционными экспериментами, которые выявили снижение вирулентности, постоянный потенциал передачи и увеличение продолжительности жизни хозяина в течение определенного периода времени.[16]Дальнейшие эксперименты продемонстрировали более высокую скорость рекомбинации в хозяине во время коэволюционных взаимодействий, что может быть избирательно выгодным, поскольку должно увеличивать разнообразие генотипов хозяина.[17]
Ресурсы обычно ограничены. Следовательно, инвестиции в одну черту (например, вирулентность или иммунитет ) ограничивает инвестиции в другие особенности жизненного цикла (например, репродуктивную способность). Более того, гены часто плейотропный, имеющий несколько эффектов. Таким образом, изменение плейотропного иммунитета или гена вирулентности может автоматически влиять на другие признаки. Таким образом, существует компромисс между преимуществами и затратами адаптивных изменений, которые могут препятствовать тому, чтобы популяция хозяина стала полностью резистентной или популяция паразита была высокопатогенной. Затраты на генную плейотропию были исследованы при совместной эволюции кишечная палочка и бактериофаги. Чтобы ввести свой генетический материал, фагам необходимо связываться со специфическим рецептором бактериальной клеточной поверхности. Бактерия может предотвратить инъекцию, изменяя соответствующий сайт связывания, например в ответ на точечные мутации или делецию рецептора. Однако эти рецепторы выполняют важные функции в метаболизме бактерий. Таким образом, их потеря снизит приспособленность (то есть скорость роста населения). Как следствие, существует компромисс между преимуществами и недостатками мутированного рецептора, что приводит к полиморфизм в этом месте.[18]
Модельные системы для исследования
Нематода Caenorhabditis elegans и бактерия Bacillus thuringiensis были только недавно созданы как модельная система для изучения коэволюции паразита и хозяина. Лабораторные эксперименты по эволюции предоставили доказательства многих основных предсказаний этих коэволюционных взаимодействий, включая взаимные генетические изменения, а также увеличение скорости эволюции и генетического разнообразия.[19]
Рачок Дафния и его многочисленные паразиты стали одной из основных модельных систем для изучения коэволюции. Хозяин может быть как бесполым, так и половым (вызванным изменениями во внешней среде), поэтому половое размножение можно стимулировать в лаборатории.[3] Десятилетия совместной эволюции между Дафния великая и бактерия Пастеурия рамоса были реконструированы, реанимируя стадии покоя обоих видов из слоистых отложений пруда и подвергая хозяев из каждого слоя паразитам из прошлого, того же самого и будущих слоев. Исследование показало, что паразиты в среднем наиболее заразны со своими современными хозяевами,[20] в соответствии с отрицательным частотно-зависимым отбором.[21]
кишечная палочка, а Грамотрицательный протеобактерии, является распространенной моделью в биологических исследованиях, для которой доступны исчерпывающие данные о различных аспектах его жизненного цикла. Он широко использовался для эволюция эксперименты, в том числе связанные с коэволюция с фагами.[18] Эти исследования выявили, среди прочего, что коэволюционный приспособление может находиться под влиянием плейотропный эффекты вовлеченных гены. В частности, привязка бактериофаг к Кишечная палочка поверхность рецептор это решающий шаг в вирус инфекция цикл. А мутация в сайте связывания рецептора может вызвать сопротивление. Такие мутации часто проявляют плейотропные эффекты и могут стать причиной сопротивления. В присутствии фагов такая плейотропия может приводить к полиморфизмы в бактериальной популяции и таким образом увеличивают биоразнообразие в сообществе.[18]
Другая модельная система состоит из бактерий, колонизирующих растения и животных. Псевдомонады и это бактериофаги. Эта система позволила по-новому взглянуть на динамику коэволюционных изменений. Он показал, что коэволюция может происходить через повторяющиеся выборочные зачистки, отдавая предпочтение универсалы для обоих антагонистов.[22][23] Кроме того, совместная эволюция с фагами может способствовать аллопатрический разнообразие, потенциально увеличивающее биоразнообразие и, возможно, видообразование.[24] Коэволюция паразита и хозяина также может повлиять на основной генетика, например, за счет увеличения частота мутаций в хосте.[25]
Тропическое дерево и лиана взаимодействия также были предметом изучения. Здесь лианы рассматривались как сверхразнообразные универсальные макропаразиты, которые влияют на выживание хозяина, паразитируя на его структурной поддержке для доступа к свету навеса, узурпируя ресурсы, которые в противном случае были бы доступны их хозяину. Деревья-хозяева имеют самые разные уровни устойчивости к заражению крон лианами. [26][27]
Смотрите также
использованная литература
- ^ а б c d Woolhouse, M.E.J .; Webster, J. P .; Доминго, Э .; Charlesworth, B .; Левин, Б. Р. (декабрь 2002 г.). «Биологические и биомедицинские последствия совместной эволюции патогенов и их хозяев» (PDF). Природа Генетика. 32 (4): 569–77. Дои:10.1038 / ng1202-569. HDL:1842/689. PMID 12457190. S2CID 33145462.
- ^ Rabajante, J .; и другие. (2016). «Динамика Красной Королевы паразита-хозяина с синхронизированными по фазе редкими генотипами». Достижения науки. 2 (3): e1501548. Bibcode:2016SciA .... 2E1548R. Дои:10.1126 / sciadv.1501548. ЧВК 4783124. PMID 26973878.
- ^ а б c d е ж Эберт, Д. (2008). «Коэволюция паразитов и хозяев: выводы из модельной системы дафний и паразитов». Текущее мнение в микробиологии. 11 (3): 290–301. Дои:10.1016 / j.mib.2008.05.012. PMID 18556238.
- ^ Rabajante, J .; и другие. (2015). «Динамика Красной Королевы в системе взаимодействия нескольких хостов и нескольких паразитов». Научные отчеты. 5: 10004. Bibcode:2015НатСР ... 510004Р. Дои:10.1038 / srep10004. ЧВК 4405699. PMID 25899168.
- ^ Charlesworth, D .; Уиллис, Дж. Х. (ноябрь 2009 г.). «Генетика инбридинговой депрессии». Nat. Преподобный Жене. 10 (11): 783–96. Дои:10.1038 / nrg2664. PMID 19834483. S2CID 771357.
- ^ Карр, Д. Э .; Дудаш, М. Р. (июнь 2003 г.). «Современные подходы к генетическим основам инбридинговой депрессии у растений». Филос. Пер. R. Soc. Лондон. B Biol. Наука. 358 (1434): 1071–84. Дои:10.1098 / rstb.2003.1295. ЧВК 1693197. PMID 12831473.
- ^ "Что такое серповидноклеточная болезнь?". Национальный институт сердца, легких и крови. 12 июня 2015 г. В архиве из оригинала от 6 марта 2016 г.. Получено 8 марта 2016.
- ^ Wellems TE, Hayton K, Fairhurst RM (сентябрь 2009 г.). «Влияние малярийного паразитизма: от трупов к сообществам». J. Clin. Вкладывать деньги. 119 (9): 2496–505. Дои:10.1172 / JCI38307. ЧВК 2735907. PMID 19729847.
- ^ а б Лайне, Анна-Лииса (июль 2009 г.). «Роль коэволюции в создании биологического разнообразия - пространственно расходящиеся траектории отбора». Журнал экспериментальной ботаники. 60 (11): 2957–2970. Дои:10.1093 / jxb / erp168. PMID 19528527.
- ^ "Лаборатория Джона Н. Томпсона". Калифорнийский университет Санта-Крус. Получено 7 января 2018.
- ^ Томпсон, Джон Н. (2005). Географическая мозаика коэволюции (межвидовые взаимодействия). Издательство Чикагского университета. ISBN 978-0-226-79762-5.
- ^ Томпсон, Джон Н. (1999). «Конкретные гипотезы о географической мозаике коэволюции». Американский натуралист. 153: S1 – S14. Дои:10.1086/303208.
- ^ Субейранд, С .; Laine, A.-L .; Hanski, I .; Пенттинен, А. (2009). «Пространственно-временная структура взаимодействий хозяин-патоген в метапопуляции» (PDF). Американский натуралист. 174 (3): 308–320. Дои:10.1086/603624. PMID 19627233.
- ^ Лайне А.-Л. (2005). Связывание пространственной и эволюционной динамики в метапопуляции «растение-патоген». Кафедра биологических и экологических наук, Университет Хельсинки, Финляндия, Академическая диссертация
- ^ Йокела, Юкка; Ливли, Кертис М .; Дидал, Марк Ф .; Фокс, Дженнифер А. (7 мая 2003 г.). «Генетическая изменчивость в половых и клональных линиях пресноводной улитки». Биологический журнал Линнеевского общества. 79 (1): 165–181. Дои:10.1046 / j.1095-8312.2003.00181.x.
- ^ а б Bérénos, C .; Schmid-Hempel, P .; Вегнер, К. М. (октябрь 2009 г.). «Эволюция устойчивости хозяина и компромиссы между вирулентностью и потенциалом передачи у обязательно убивающего паразита». Журнал эволюционной биологии. 22 (10): 2049–56. Дои:10.1111 / j.1420-9101.2009.01821.x. PMID 19732263. S2CID 19399783.
- ^ Fischer, O .; Шмид-Хемпель, П. (2005). «Селекция паразитами может увеличить частоту рекомбинации хозяев». Письма о биологии. 22 (2): 193–195. Дои:10.1098 / rsbl.2005.0296. ЧВК 1626206. PMID 17148164.
- ^ а б c Bohannan, B.J.M .; Ленский, Р. Э. (2000). «Связь генетических изменений с эволюцией сообщества: выводы из исследований бактерий и бактериофагов». Письма об экологии. 3 (4): 362–77. Дои:10.1046 / j.1461-0248.2000.00161.x.[мертвая ссылка ]
- ^ Schulte, R.D .; Makus, C .; Hasert, B .; Michiels, N.K .; Шуленбург, Х. (20 апреля 2010 г.). «Множественные взаимные адаптации и быстрые генетические изменения при экспериментальной совместной эволюции животного-хозяина и его микробного паразита». PNAS. 107 (16): 7359–7364. Bibcode:2010PNAS..107.7359S. Дои:10.1073 / pnas.1003113107. ЧВК 2867683. PMID 20368449.
- ^ Decaestecker, E .; Gaba, S .; Raeymaekers, J. A .; Стокс, Р .; Van Kerckhoven, L .; Ebert, D .; Де Мистер, Л. (6 декабря 2007 г.). "Динамика паразита-хозяина" Красная Королева "в осадке пруда". Природа. 450 (7171): 870–3. Bibcode:2007Натура.450..870Д. Дои:10.1038 / природа06291. PMID 18004303. S2CID 4320335.
- ^ Gandon, S .; Buckling, A .; Decaestecker, E .; Дэй, Т. (ноябрь 2008 г.). «Совместная эволюция паразита и хозяина и модели адаптации во времени и пространстве». Журнал эволюционной биологии. 21 (6): 1861–1866. Дои:10.1111 / j.1420-9101.2008.01598.x. PMID 18717749. S2CID 31381381. Архивировано из оригинал на 2013-01-05.
- ^ Buckling, A .; Рейни, П. Б. (2002a). «Антагонистическая коэволюция бактерии и бактериофага». Труды Королевского общества B: биологические науки. 269 (1494): 931–936. Дои:10.1098 / rspb.2001.1945. ЧВК 1690980. PMID 12028776.
- ^ Brockhurst, M.A .; Morgan, A.D .; Fenton, A .; Баклинг, А. (2007). «Экспериментальная коэволюция с бактериями и фагами: модельная система Pseudomonas fluorescens». Инфекция, генетика и эволюция. 7 (4): 547–552. Дои:10.1016 / j.meegid.2007.01.005. PMID 17320489.
- ^ Buckling, A .; Рейни, П. Б. (2002b). «Роль паразитов в диверсификации симпатрических и аллопатрических хозяев». Природа. 420 (6915): 496–499. Bibcode:2002Натура 420..496Б. Дои:10.1038 / природа01164. PMID 12466840. S2CID 4411588.
- ^ Pal, C .; Macia, M.D .; Оливер, А .; Шахар И. Баклинг, А. (2007). «Коэволюция с вирусами приводит к увеличению скорости бактериальных мутаций». Природа. 450 (7172): 1079–1081. Bibcode:2007Натура.450.1079П. Дои:10.1038 / природа06350. PMID 18059461. S2CID 4373536.
- ^ Visser, Marco D .; Muller-Landau, Helene C .; Schnitzer, Stefan A .; де Крун, Ханс; Йонгеянс, Элке; Райт, С. Джозеф; Гибсон, Дэвид (2018). «Модель паразит-хозяин объясняет различия в зараженности лиан среди сопутствующих видов деревьев». Журнал экологии. 106 (6): 2435–2445. Дои:10.1111/1365-2745.12997.
- ^ Visser, Marco D .; Schnitzer, Stefan A .; Muller-Landau, Helene C .; Йонгеянс, Элке; де Крун, Ханс; Comita, Liza S .; Хаббелл, Стивен П .; Райт, С. Джозеф; Зуидема, Питер (2018). «Виды деревьев широко различаются по своей толерантности к заражению лианами: тематическое исследование дифференциальной реакции хозяина на паразитов широкого профиля». Журнал экологии. 106 (2): 781–794. Дои:10.1111/1365-2745.12815.







