Иммунная система - Википедия - Immune system
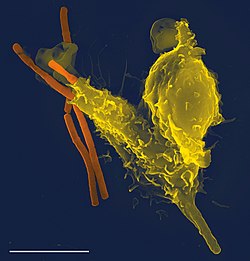
В иммунная система это сеть биологические процессы который защищает организм против болезнь. Он обнаруживает и реагирует на самые разные патогены, из вирусы к паразитические черви, а также раковые клетки и такие предметы, как дерево занозы, отличая их от собственных здоровых ткань. У многих видов есть две основные подсистемы иммунной системы. В врожденная иммунная система обеспечивает заранее настроенный ответ на широкие группы ситуаций и стимулов. В адаптивная иммунная система обеспечивает индивидуальный ответ на каждый стимул, обучаясь распознавать молекулы, с которыми он ранее сталкивался. Оба используют молекулы и клетки выполнять свои функции.
Почти у всех организмов есть какая-то иммунная система. Бактерии иметь рудиментарную иммунную систему в виде ферменты которые защищают от вирус инфекции. Другие основные иммунные механизмы возникли в древние времена. растения и животные и остаются их современными потомками. Эти механизмы включают фагоцитоз, антимикробные пептиды называется дефенсины, а система комплемента. Челюстные позвоночные, включая людей, обладают еще более сложными защитными механизмами, включая способность адаптироваться для более эффективного распознавания патогенов. Адаптивный (или приобретенный) иммунитет создает иммунологическая память что приводит к усиленному ответу на последующие встречи с тем же патогеном. Этот процесс приобретенного иммунитета является основой вакцинация.
Нарушение функции иммунной системы может вызвать аутоиммунные заболевания, воспалительные заболевания и рак. Иммунодефицит возникает, когда иммунная система менее активна, чем обычно, что приводит к повторяющимся и опасным для жизни инфекциям. У людей иммунодефицит может быть результатом генетическое заболевание Такие как тяжелый комбинированный иммунодефицит, приобретенные условия, такие как ВИЧ /СПИД, или использование иммунодепрессанты. Аутоиммунитет возникает в результате гиперактивной иммунной системы, атакующей нормальные ткани, как если бы они были чужеродными организмами. Общие аутоиммунные заболевания включают: Тиреоидит Хашимото, ревматоидный артрит, сахарный диабет 1 типа, и системная красная волчанка. Иммунология охватывает изучение всех аспектов иммунной системы.
Многослойная защита
Иммунная система защищает своего хозяина от инфекционное заболевание с многоуровневой защитой возрастающей специфичности. Физические барьеры предотвращают появление таких патогенов, как бактерии и вирусы от попадания в организм.[1] Если патоген преодолевает эти барьеры, врожденная иммунная система дает немедленный, но не конкретный ответ. Врожденная иммунная система присутствует во всех животные.[2] Если патогены успешно уклоняются от врожденной реакции, позвоночные животные обладают вторым уровнем защиты, т.е. адаптивная иммунная система, который активируется врожденной реакцией.[3] Здесь иммунная система адаптирует свой ответ во время инфекции, чтобы улучшить распознавание патогена. Этот улучшенный ответ затем сохраняется после устранения патогена в виде иммунологическая память, и позволяет адаптивной иммунной системе наращивать более быстрые и сильные атаки каждый раз, когда встречается этот патоген.[4][5]
| Врожденная иммунная система | Адаптивная иммунная система |
|---|---|
| Ответ неспецифический | Возбудитель и антиген конкретный ответ |
| Воздействие приводит к немедленному максимальному отклику | Время задержки между воздействием и максимальной реакцией |
| Клеточно-опосредованный и гуморальный составные части | Клеточно-опосредованный и гуморальный составные части |
| Нет иммунологической памяти | Воздействие приводит к иммунологической памяти |
| Встречается почти во всех формах жизни | Найдено только в челюстные позвоночные |
Как врожденный, так и адаптивный иммунитет зависят от способности иммунной системы различать собственный и чужой. молекулы. В иммунологии себя Молекулы - это компоненты организма, которые иммунная система может отличить от чужеродных веществ.[6] Наоборот, несамостоятельный молекулы - это те, которые распознаются как чужеродные молекулы. Один класс чужеродных молекул называется антигенами (первоначально названный антитело генэраторы) и определяются как вещества, которые связываются со специфическими иммунные рецепторы и вызвать иммунный ответ.[7]
Поверхностные барьеры
Некоторые барьеры защищают организмы от инфекции, включая механические, химические и биологические барьеры. Восковой кутикула большинства листьев экзоскелет насекомых, снаряды и оболочки яиц, отложенных снаружи, и кожа являются примерами механических барьеров, которые являются первой линией защиты от инфекции.[8] Организмы не могут быть полностью изолированы от окружающей среды, поэтому системы защищают отверстия тела, такие как легкие, кишечник, а мочеполовой тракт. В легкие при кашле и чихании механически выбрасываются патогены и другие раздражители от дыхательные пути. Промывочное действие слезы и моча также механически изгоняет патогены, при этом слизь секретируется дыхательными путями и желудочно-кишечный тракт служит для улавливания и запутывания микроорганизмов.[9]
Химические барьеры также защищают от инфекции. Кожа и дыхательные пути выделяют антимикробные пептиды такие как β-дефенсины.[10] Ферменты Такие как лизоцим и фосфолипаза А2 в слюна, слезы и грудное молоко являются также антибактериальные препараты.[11][12] Вагинальный выделения служат химическим барьером после менархе, когда они становятся слегка кислый, пока сперма содержит дефенсины и цинк убить патогены.[13][14] в желудок, Желудочный сок служит химической защитой от проглоченных патогенов.[15]
В мочеполовых и желудочно-кишечных трактах, комменсальный Флора служат биологическими барьерами, конкурируя с патогенными бактериями за пищу и пространство и, в некоторых случаях, изменяя условия в своей среде, например pH или доступное железо. В результате уменьшается вероятность того, что количество патогенов достигнет достаточного количества, чтобы вызвать болезнь.[16]
Врожденная иммунная система
Микроорганизмы или токсины, которые успешно попадают в организм, сталкиваются с клетками и механизмами врожденной иммунной системы. Врожденная реакция обычно возникает, когда микробы идентифицируются рецепторы распознавания образов, которые распознают компоненты, которые сохраняются среди широких групп микроорганизмов,[17] или когда поврежденные, поврежденные или подвергнутые стрессу клетки посылают сигналы тревоги, многие из которых распознаются теми же рецепторами, что и те, которые распознают патогены.[18] Врожденная иммунная защита неспецифична, то есть эти системы реагируют на патогены обычным образом.[19] Эта система не дает длительного иммунитет против возбудителя. Врожденная иммунная система является доминирующей системой защиты хозяина у большинства организмов,[2] и единственный в растениях.[20]
Иммунное зондирование
Клетки врожденной иммунной системы используют рецепторы распознавания образов распознавать молекулярные структуры, производимые патогенами.[21] Они есть белки экспрессируется, в основном, клетками врожденная иммунная система, такие как дендритные клетки, макрофаги, моноциты, нейтрофилы и эпителиальные клетки[19][22] для идентификации двух классов молекул: патоген-ассоциированные молекулярные паттерны (PAMP), которые связаны с микробными патогены, и молекулярные паттерны, связанные с повреждениями (DAMPs), которые связаны с компонентами клеток-хозяев, которые высвобождаются во время повреждения или гибели клеток.[23]
Распознавание внеклеточных или эндосомных PAMP опосредуется трансмембранные белки известный как толл-подобные рецепторы (TLR).[24] TLR имеют типичный структурный мотив: богатые лейцином повторы (LRR), которые придают им изогнутую форму.[25] Толл-подобные рецепторы были впервые обнаружены в Дрозофила и запускают синтез и секрецию цитокины и активация других программ защиты хозяина, которые необходимы как для врожденного, так и для адаптивного иммунного ответа. У людей описано десять толл-подобных рецепторов.[26]
Клетки врожденной иммунной системы имеют внутри рецепторы распознавания образов, которые обнаруживают инфекцию или повреждение клеток. Три основных класса этих «цитозольных» рецепторов: NOD-подобные рецепторы, Рецепторы, подобные RIG (ген, индуцируемый ретиноевой кислотой), и цитозольные сенсоры ДНК.[27]
Врожденные иммунные клетки

Немного лейкоциты (белые кровяные клетки) действуют как независимые одноклеточные организмы и являются вторым звеном врожденной иммунной системы. Врожденные лейкоциты включают «профессиональные» фагоциты (макрофаги, нейтрофилы, и дендритные клетки ). Эти клетки идентифицируют и устраняют патогены, либо атакуя более крупные патогены через контакт, либо поглощая, а затем убивая микроорганизмы. Другие клетки, участвующие в врожденной реакции, включают: врожденные лимфоидные клетки, тучные клетки, эозинофилы, базофилы, и естественные клетки-киллеры. [28]
Фагоцитоз - важная особенность клеточного врожденного иммунитета, осуществляемого клетками, называемыми фагоцитами, которые поглощают патогены или частицы. Фагоциты обычно патрулируют тело в поисках патогенов, но цитокины могут вызывать их в определенные места.[29] После того, как патоген был поглощен фагоцитом, он попадает в ловушку внутриклеточного везикул называется фагосома, который впоследствии сливается с другим пузырьком, называемым лизосома сформировать фаголизосома. Патоген погибает под действием пищеварительных ферментов или после респираторный взрыв это выпускает свободные радикалы в фаголизосому.[30][31] Фагоцитоз развился как средство приобретения питательные вещества, но эта роль была расширена в фагоцитах, чтобы включить поглощение патогенов в качестве защитного механизма.[32] Фагоцитоз, вероятно, представляет собой старейшую форму защиты хозяина, поскольку фагоциты были идентифицированы как у позвоночных, так и у беспозвоночных животных.[33]
Нейтрофилы и макрофаги - это фагоциты, которые путешествуют по телу в поисках вторгающихся патогенов.[34] Нейтрофилы обычно находятся в кровоток и являются наиболее распространенным типом фагоцитов, составляя от 50% до 60% от общего числа циркулирующих лейкоцитов.[35] Во время острой фазы воспаления нейтрофилы мигрируют к месту воспаления в процессе, называемом хемотаксис, и обычно являются первыми клетками, которые попадают на место заражения. Макрофаги - это универсальные клетки, которые находятся в тканях и вырабатывают множество химических веществ, включая ферменты, белки комплемента, и цитокины, хотя они также могут действовать как поглотители, которые очищают организм от изношенных клеток и другого мусора, и как антигенпрезентирующие клетки (APC), которые активируют адаптивную иммунную систему.[36]
Дендритные клетки - это фагоциты в тканях, которые контактируют с внешней средой; поэтому они расположены в основном в кожа, нос, легкие, желудок и кишечник.[37] Они названы из-за их сходства с нейронный дендриты, поскольку оба имеют множество выступов, похожих на шипы. Дендритные клетки служат связующим звеном между тканями тела и врожденной и адаптивной иммунной системами, поскольку они представить антигены к Т-клетки, один из ключевых типов клеток адаптивной иммунной системы.[37]
Гранулоциты лейкоциты, в цитоплазме которых есть гранулы. К этой категории относятся нейтрофилы, тучные клетки, базофилы и эозинофилы. Тучные клетки находятся в соединительной ткани и слизистые оболочки и регулируют воспалительную реакцию.[38] Чаще всего они связаны с аллергия и анафилаксия.[35] Базофилы и эозинофилы связаны с нейтрофилами. Они выделяют химические медиаторы, которые участвуют в защите от паразиты и играют роль в аллергических реакциях, таких как астма.[39]
Врожденные лимфоидные клетки (ILC) - это группа врожденный иммунитет клетки, которые происходят от общий лимфоидный предшественник и принадлежат к лимфоидная линия. Эти клетки характеризуются отсутствием антиген-специфических B или же Рецептор Т-клеток (TCR) из-за отсутствия ген активации рекомбинации. ILC не экспрессируют маркеры миелоидных или дендритных клеток.[40]
Естественные клетки-киллеры (NK) - лимфоциты и компонент врожденной иммунной системы, которая не атакует вторгшихся микробов напрямую.[41] Скорее, NK-клетки разрушают скомпрометированные клетки-хозяева, такие как опухолевые клетки или инфицированные вирусом клетки, распознавая такие клетки по состоянию, известному как «отсутствие себя». Этот термин описывает клетки с низким уровнем маркера клеточной поверхности, называемого MHC I (главный комплекс гистосовместимости ) - ситуация, которая может возникнуть при вирусных инфекциях клеток-хозяев.[42] Нормальные клетки организма не распознаются и не атакуются NK-клетками, потому что они экспрессируют интактные собственные антигены MHC. Эти антигены MHC распознаются рецепторами иммуноглобулинов киллерных клеток, которые, по сути, тормозят NK-клетки.[43]
Воспаление
Воспаление - одна из первых реакций иммунной системы на инфекцию.[44] Симптомами воспаления являются покраснение, отек, жар и боль, которые вызваны повышенным кровь течь в ткани. Воспаление вызывается эйкозаноиды и цитокины, которые выделяются поврежденными или инфицированными клетками. Эйкозаноиды включают простагландины которые производят высокая температура и расширение из кровеносный сосуд связано с воспалением, и лейкотриены которые привлекают определенные белые кровяные клетки (лейкоциты).[45][46] Общие цитокины включают: интерлейкины которые отвечают за связь между лейкоцитами; хемокины которые продвигают хемотаксис; и интерфероны который имеет противовирусное средство эффекты, такие как выключение синтез белка в клетке-хозяине.[47] Факторы роста и цитотоксические факторы также могут высвобождаться. Эти цитокины и другие химические вещества привлекают иммунные клетки к месту инфекции и способствуют заживлению любой поврежденной ткани после удаления патогенов.[48] Рецепторы распознавания образов, называемые инфламмасомы представляют собой мультибелковые комплексы (состоящие из NLR, адапторного белка ASC и эффекторной молекулы прокаспазы-1), которые образуются в ответ на цитозольные PAMP и DAMP, функция которых заключается в выработке активных форм воспалительных цитокинов IL-1β и IL -18.[49]
Гуморальные защиты
Система дополнения - это биохимический каскад который атакует поверхности чужеродных клеток. Он содержит более 20 различных белков и назван за его способность «дополнять» уничтожение патогенов путем антитела. Комплемент - главный гуморальный компонент врожденного иммунного ответа.[50][51] У многих видов есть системы комплемента, в том числе немлекопитающие как растения, рыба и некоторые беспозвоночные.[52] У людей этот ответ активируется связыванием комплемента с антителами, которые прикрепились к этим микробам, или связыванием белков комплемента с углеводы на поверхности микробы. Это признание сигнал вызывает быстрое убийство.[53] Скорость отклика - это результат усиления сигнала после последовательного протеолитический активация молекул комплемента, которые также являются протеазами. После того как белки комплемента первоначально связываются с микробом, они активируют свою протеазную активность, которая, в свою очередь, активирует другие протеазы комплемента и так далее. Это дает каталитический каскад, усиливающий исходный сигнал управляемым положительный отзыв.[54] Каскад приводит к выработке пептидов, которые привлекают иммунные клетки, увеличивают сосудистая проницаемость, и опсонизировать (покрыть) поверхность патогена, пометив его для уничтожения. Это отложение комплемента также может убивать клетки напрямую, нарушая их плазматическая мембрана.[50]
Адаптивная иммунная система

Адаптивная иммунная система развивалась у ранних позвоночных и обеспечивает более сильный иммунный ответ, а также иммунологическая память, где каждый патоген «запоминается» сигнатурным антигеном.[55] Адаптивный иммунный ответ является антиген-специфическим и требует распознавания специфических «чужих» антигенов во время процесса, называемого презентация антигена. Антигенная специфичность позволяет генерировать ответы, адаптированные к конкретным патогенам или инфицированным патогеном клеткам. Способность создавать эти индивидуальные ответы поддерживается в организме «клетками памяти». Если патоген заразит организм более одного раза, эти специфические клетки памяти используются для его быстрого устранения.[56]
Распознавание антигена
Клетки адаптивной иммунной системы - это особые типы лейкоцитов, называемые лимфоцитами. В-клетки и Т-клетки являются основными типами лимфоцитов и происходят из гемопоэтические стволовые клетки в Костный мозг.[57] В-клетки участвуют в гуморальный иммунный ответ, тогда как Т-клетки участвуют в клеточно-опосредованный иммунный ответ. Киллерные Т-клетки распознают только антигены, связанные с Класс I MHC молекулы, в то время как хелперные Т-клетки и регуляторные Т-клетки распознают только антигены, связанные с Класс II MHC молекулы. Эти два механизма презентации антигена отражают разные роли двух типов Т-клеток. Третий, второстепенный подтип - это γδ Т-клетки которые распознают интактные антигены, не связанные с рецепторами MHC.[58] Двойные положительные Т-клетки подвергаются воздействию широкого спектра аутоантигенов в вилочковая железа, в котором йод необходим для развития и деятельности тимуса.[59] Напротив, антигенспецифический рецептор В-клетки представляет собой молекулу антитела на поверхности В-клетки и распознает нативный (необработанный) антиген без какой-либо необходимости обработка антигена. Такие антигены могут быть большими молекулами, обнаруженными на поверхности патогенов, но также могут быть небольшими. гаптены (например, пенициллин), прикрепленный к молекуле-носителю.[60] Каждая линия B-клеток экспрессирует разные антитела, поэтому полный набор рецепторов B-клеточных антигенов представляет собой все антитела, которые может вырабатывать организм.[57] Когда В- или Т-клетки сталкиваются со своими родственными антигенами, они размножаются, и образуется множество «клонов» клеток, нацеленных на один и тот же антиген. Это называется клональный отбор.[61]
Презентация антигена Т-лимфоцитам
И В-клетки, и Т-клетки несут рецепторные молекулы, распознающие определенные мишени. Т-клетки распознают «чужую» мишень, такую как патоген, только после того, как антигены (небольшие фрагменты патогена) были обработаны и представлены в комбинации с «собственным» рецептором, называемым молекулой главного комплекса гистосовместимости (MHC).[62]
Клеточный иммунитет
Существует два основных подтипа Т-клеток: убийца Т-клетки и вспомогательная Т-клетка. Вдобавок есть регуляторные Т-клетки которые играют роль в модуляции иммунного ответа.[63]
Убийственные Т-клетки
Убийственные Т-клетки представляют собой подгруппу Т-клеток, которые убивают клетки, инфицированные вирусами (и другими патогенами), или иным образом поврежденные или дисфункциональные.[64] Как и в случае с В-клетками, каждый тип Т-клеток распознает свой антиген. Т-киллеры активируются, когда их Рецептор Т-клеток связывается с этим специфическим антигеном в комплексе с рецептором MHC Class I другой клетки. Распознаванию этого комплекса MHC: антиген помогает корецептор на Т-клетке, называемой CD8. Затем Т-клетка путешествует по телу в поисках клеток, в которых рецепторы MHC I несут этот антиген. Когда активированная Т-клетка контактирует с такими клетками, она высвобождает цитотоксины, Такие как перфорин, которые образуют поры в клетках-мишенях плазматическая мембрана, позволяя ионы, вода и токсины, чтобы войти. Попадание другого токсина под названием гранулизин (протеаза) заставляет клетку-мишень подвергаться апоптоз.[65] Убийство Т-клеток клеток-хозяев особенно важно для предотвращения репликации вирусов. Активация Т-клеток строго контролируется и обычно требует очень сильного сигнала активации MHC / антигена или дополнительных сигналов активации, обеспечиваемых «вспомогательными» Т-клетками (см. Ниже).[65]
Т-хелперы
Т-хелперы регулируют как врожденный, так и адаптивный иммунный ответ и помогают определить, какие иммунные ответы организм вырабатывает на определенный патоген.[66][67] Эти клетки не обладают цитотоксической активностью и не убивают инфицированные клетки и не уничтожают патогены напрямую. Вместо этого они контролируют иммунный ответ, заставляя другие клетки выполнять эти задачи.[68]
Хелперные Т-клетки экспрессируют Т-клеточные рецепторы, которые распознают антиген, связанный с молекулами МНС класса II. Комплекс MHC: антиген также распознается клетками-помощниками. CD4 корецептор, который набирает молекулы внутри Т-клетки (например, Lck ), которые отвечают за активацию Т-клеток. Т-хелперные Т-клетки имеют более слабую связь с комплексом МНС: антиген, чем наблюдаемые для Т-клеток-киллеров, что означает, что многие рецепторы (около 200–300) на Т-хелперных Т-клетках должны быть связаны антигеном МНС: для активации хелперных клеток, в то время как киллерные Т-клетки должны быть связаны с антигеном МНС: Т-клетки могут быть активированы путем задействования одной молекулы MHC: антигена. Активация хелперных Т-клеток также требует более длительного взаимодействия с антигенпрезентирующей клеткой.[69] Активация покоящихся хелперных Т-клеток заставляет их выделять цитокины, которые влияют на активность многих типов клеток. Сигналы цитокинов, продуцируемые Т-хелперами, усиливают микробицидную функцию макрофагов и активность Т-клеток-киллеров.[70] Кроме того, активация хелперных Т-клеток вызывает повышенную регуляцию молекул, экспрессируемых на поверхности Т-клеток, таких как лиганд CD40 (также называемый CD154 ), которые обеспечивают дополнительные стимулирующие сигналы, обычно необходимые для активации продуцирующих антитела В-клеток.[71]
Гамма-дельта Т-клетки
Гамма-дельта Т-клетки (γδ Т-клетки) обладают альтернативным Т-клеточным рецептором (TCR) в отличие от CD4 + и CD8 + (αβ) Т-клеток и имеют общие характеристики хелперных Т-клеток, цитотоксических Т-клеток и NK-клеток. Условия, которые вызывают ответы γδ Т-клеток, полностью не изучены. Как и другие «нетрадиционные» подмножества Т-клеток, несущие инвариантные TCR, такие как CD1d -ограниченный естественные Т-клетки-киллеры, γδ Т-клетки находятся на границе между врожденным и адаптивным иммунитетом.[72] С одной стороны, γδ Т-клетки являются компонентом адаптивного иммунитета, поскольку они перестроить гены TCR для создания разнообразия рецепторов, а также может развить фенотип памяти. С другой стороны, различные подмножества также являются частью врожденной иммунной системы, поскольку ограниченные рецепторы TCR или NK могут использоваться в качестве рецепторы распознавания образов. Например, большое количество человеческих Т-клеток Vγ9 / Vδ2 в течение нескольких часов реагирует на общие молекулы продуцируются микробами, и сильно ограниченные Vδ1 + Т-клетки в эпителий реагируют на стрессовые эпителиальные клетки.[58]
Гуморальный иммунный ответ
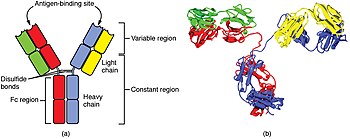
А В клетка определяет патогены, когда антитела на своей поверхности связываются со специфическим чужеродным антигеном.[74] Этот комплекс антиген / антитело захватывается В-клеткой и обрабатывается протеолиз в пептиды. Затем В-клетка отображает эти антигенные пептиды на своих поверхностных молекулах MHC класса II. Эта комбинация MHC и антигена привлекает соответствующие хелперные Т-клетки, которые высвобождают лимфокины и активирует В-клетки.[75] Когда активированная В-клетка начинает разделять, его потомок (плазматические клетки ) выделять миллионы копий антитела, распознающего этот антиген. Эти антитела циркулируют в плазме крови и лимфа, связываются с патогенами, экспрессирующими антиген, и маркируют их для разрушения активация комплемента или для поглощения и разрушения фагоцитами. Антитела также могут нейтрализовать заражение напрямую, связываясь с бактериальными токсинами или вмешиваясь в рецепторы, которые вирусы и бактерии используют для заражения клеток.[76]
Новорожденные младенцы ранее не подвергались воздействию микробов и особенно уязвимы для инфекций. Мать обеспечивает несколько уровней пассивной защиты. Во время беременности особый тип антител, называемый IgG, передается от матери к ребенку напрямую через плацента Таким образом, человеческие младенцы имеют высокий уровень антител даже при рождении с тем же диапазоном антигенной специфичности, что и их мать.[77] Грудное молоко или молозиво также содержит антитела, которые переносятся в кишечник младенца и защищают от бактериальных инфекций, пока новорожденный не сможет синтезировать свои собственные антитела.[78] Это пассивный иммунитет поскольку плод на самом деле не производит никаких клеток памяти или антител - он только их заимствует. Этот пассивный иммунитет обычно кратковременный, от нескольких дней до нескольких месяцев. В медицине защитный пассивный иммунитет также может быть передан искусственно от одного человека к другому.[79]
Иммунологическая память
Когда В-клетки и Т-клетки активируются и начинают реплицироваться, некоторые из их потомков становятся долгоживущими клетками памяти. На протяжении всей жизни животного эти клетки памяти запоминают каждый встреченный патоген и могут дать сильный ответ, если патоген обнаружен снова. Это «адаптивный», потому что он происходит в течение жизни человека как адаптация к инфекции этим патогеном и подготавливает иммунную систему к будущим вызовам. Иммунологическая память может иметь форму пассивной кратковременной памяти или активной долговременной памяти.[80]
Физиологическая регуляция

Иммунная система участвует во многих аспектах физиологической регуляции организма. Иммунная система тесно взаимодействует с другими системами, такими как эндокринный [81][82] и нервный [83][84][85] системы. Иммунная система также играет решающую роль в эмбриогенез (развитие эмбриона), а также в ткань ремонт и регенерация.[86]
Гормоны
Гормоны может действовать как иммуномодуляторы, изменяя чувствительность иммунной системы. Например, женские половые гормоны известны иммуностимуляторы как адаптивных[87] и врожденные иммунные ответы.[88] Некоторые аутоиммунные заболевания, такие как Красная волчанка поражают преимущественно женщин, и их начало часто совпадает с половое созревание. Напротив, мужские половые гормоны Такие как тестостерон кажется иммунодепрессивный.[89] Другие гормоны, по-видимому, также регулируют иммунную систему, в первую очередь пролактин, гормон роста и Витамин Д.[90][91]
Витамин Д
Когда Т-клетка встречает чужеродный возбудитель, он расширяет рецептор витамина D. По сути, это сигнальное устройство, которое позволяет Т-клетке связываться с активной формой витамина D, стероидным гормоном. кальцитриол. Т-клетки имеют симбиотические отношения с витамином D. Т-лимфоциты не только расширяют рецептор витамина D, по сути, требуя связываться со стероидным гормональным вариантом витамина D, кальцитриолом, но и Т-клетка экспрессирует ген. CYP27B1, который является геном, ответственным за преобразование предгормональной версии витамина D, кальцидиол в кальцитриол. Только после связывания с кальцитриолом Т-клетки могут выполнять свои функции. К другим клеткам иммунной системы, которые, как известно, экспрессируют CYP27B1 и таким образом активируют кальцидиол витамина D, относятся: дендритные клетки, кератиноциты и макрофаги.[92][93]
Сон и отдых
На иммунную систему влияют сон и отдых, а также недосыпание пагубно влияет на иммунную функцию.[94] Сложные петли обратной связи, включающие цитокины, Такие как интерлейкин-1 и фактор некроза опухоли-α образуются в ответ на инфекцию, по-видимому, также играют роль в регуляции небыстрых движений глаз (REM ) спать.[95] Таким образом, иммунный ответ на инфекцию может привести к изменениям цикла сна, в том числе к увеличению медленный сон относительно быстрого сна.[96]
У людей, страдающих от недосыпания, активная иммунизация может иметь меньший эффект и может привести к более низкому производству антител и более низкому иммунному ответу, чем было бы отмечено у хорошо отдохнувшего человека.[97] Кроме того, белки, такие как NFIL3, которые, как было показано, тесно связаны как с дифференцировкой Т-клеток, так и с нашими циркадными ритмами, могут быть затронуты нарушением циклов естественного света и темноты, недосыпанием и сменной работой. В результате эти сбои могут привести к увеличению хронических состояний, таких как сердечные заболевания, хроническая боль и астма.[98]
Было показано, что помимо негативных последствий недосыпания сон и взаимосвязанная циркадная система оказывают сильное регулирующее воздействие на иммунологические функции, влияющие как на врожденный, так и на адаптивный иммунитет. Во-первых, во время ранней стадии медленного сна внезапное падение уровня в крови кортизол, адреналин, и норэпинефрин вызывает повышение уровня в крови гормонов лептина, гормона роста гипофиза и пролактина. Эти сигналы вызывают провоспалительное состояние за счет выработки провоспалительных цитокинов интерлейкина-1, интерлейкин-12, TNF-альфа и IFN-гамма. Эти цитокины затем стимулируют иммунные функции, такие как активация иммунных клеток, пролиферация и дифференциация. Именно в это время у недифференцированных или менее дифференцированных, таких как наивные Т-клетки и Т-клетки центральной памяти, наблюдается пик (то есть во время медленно развивающегося адаптивного иммунного ответа). В дополнение к этим эффектам среда гормонов, вырабатываемых в это время (лептин, гормон роста гипофиза и пролактин), поддерживает взаимодействия между APC и Т-клетками, сдвиг Тчас1 / тчас2 баланс цитокинов к тому, который поддерживает Tчас1, увеличение общего Tчас пролиферация клеток и наивная миграция Т-клеток в лимфатические узлы. Считается также, что это поддерживает формирование прочной иммунной памяти за счет инициирования иммунных ответов Th1.[99]
Во время периодов бодрствования дифференцированные эффекторные клетки, такие как цитотоксические естественные клетки-киллеры и цитотоксические Т-лимфоциты, достигают пика, вызывая эффективный ответ против любых вторгающихся патогенов. Противовоспалительные молекулы, такие как кортизол и катехоламины, также пик во время активного бодрствования. Воспаление может вызвать серьезные когнитивные и физические нарушения, если оно произойдет во время бодрствования, а воспаление может возникнуть во время сна из-за присутствия мелатонин. Воспаление вызывает множество окислительный стресс и присутствие мелатонина во время сна может активно противодействовать выработке свободных радикалов в это время.[99][100]
Питание и диета
Переедание связан с такими заболеваниями, как сахарный диабет и ожирение, которые, как известно, влияют на иммунную функцию. Более умеренное недоедание, а также дефицит определенных микроэлементов и питательных веществ также могут поставить под угрозу иммунный ответ.[101]
Продукты, богатые определенными жирные кислоты может способствовать здоровой иммунной системе,[102] и недоедание плода может вызвать пожизненное нарушение иммунной системы.[103]
Ремонт и регенерация
Иммунная система, особенно ее врожденный компонент, играет решающую роль в восстановлении тканей после повреждения. Ключевые участники включают макрофаги и нейтрофилы, но другие клеточные акторы, включая γδ Т-клетки, врожденные лимфоидные клетки (ILC) и регуляторные Т-клетки (Tregs) также важны. Пластичность иммунных клеток и баланс между провоспалительными и противовоспалительными сигналами являются ключевыми аспектами эффективного восстановления тканей. Иммунные компоненты и пути также участвуют в регенерации, например, у амфибий. Согласно одной из гипотез, организмы, которые могут регенерировать, могут быть менее иммунокомпетентными, чем организмы, которые не могут регенерировать.[104]
Нарушения иммунитета человека
Сбои в защите хозяина могут быть разделены на три большие категории: иммунодефициты,[105] аутоиммунитет,[106] и гиперчувствительность.[107]
Иммунодефициты
Иммунодефициты возникают, когда один или несколько компонентов иммунной системы неактивны. Способность иммунной системы реагировать на патогены снижена как у молодых, так и у молодых людей. пожилой, при этом иммунный ответ начинает снижаться примерно к 50 годам из-за иммунное старение.[108][109] В развитые страны, ожирение, алкоголизм, употребление наркотиков - частые причины плохой иммунной функции, в то время как недоедание является наиболее частой причиной иммунодефицита у развивающиеся страны.[109] Рацион с недостаточным содержанием белка связан с нарушением клеточного иммунитета, активности комплемента, функции фагоцитов, IgA концентрации антител и выработка цитокинов. Кроме того, потеря вилочковая железа в раннем возрасте через генетическая мутация или хирургическое удаление приводит к тяжелому иммунодефициту и высокой восприимчивости к инфекции.[110] Иммунодефициты также могут передаваться по наследству илиприобретенный '.[111] Тяжелый комбинированный иммунодефицит редкий генетическое расстройство характеризуется нарушенным развитием функциональных Т-клеток и В-клеток, вызванным многочисленными генетическими мутациями.[112] Хроническая гранулематозная болезнь, куда фагоциты имеют пониженную способность уничтожать патогенные микроорганизмы, являются примером унаследованных или врожденный, иммунодефицитный. СПИД и некоторые виды рак вызывают приобретенный иммунодефицит.[113][114]
Аутоиммунитет

Сверхактивные иммунные ответы образуют другой конец иммунной дисфункции, особенно аутоиммунные расстройства. Здесь иммунная система не может правильно различать «я» и «чужое» и атакует часть тела. В нормальных условиях многие Т-клетки и антитела реагируют с «собственными» пептидами.[115] Одна из функций специализированных ячеек (расположенных в вилочковая железа и Костный мозг ) состоит в том, чтобы представить молодые лимфоциты аутоантигенами, продуцируемыми по всему телу, и устранить те клетки, которые распознают аутоантигены, предотвращая аутоиммунитет.[74] Общие аутоиммунные заболевания включают: Тиреоидит Хашимото,[116] ревматоидный артрит,[117] сахарный диабет 1 типа,[118] и системная красная волчанка.[119]
Гиперчувствительность
Гиперчувствительность это иммунный ответ, который повреждает собственные ткани организма. Он разделен на четыре класса (Тип I - IV) в зависимости от задействованных механизмов и динамики гиперчувствительной реакции. Гиперчувствительность I типа - это немедленное или анафилактический реакция, часто связанная с аллергией. Симптомы могут варьироваться от легкого дискомфорта до смерти. Гиперчувствительность I типа опосредуется: IgE, что вызывает дегрануляцию тучные клетки и базофилы при сшивании антигеном.[120]Гиперчувствительность II типа возникает, когда антитела связываются с антигенами на собственных клетках человека, маркируя их для разрушения. Это также называется антителозависимой (или цитотоксической) гиперчувствительностью и опосредуется: IgG и IgM антитела.[120]Иммунные комплексы (скопления антигенов, белков комплемента и антител IgG и IgM), депонированные в различных тканях, запускают реакции гиперчувствительности III типа.[120] Гиперчувствительность IV типа (также известная как клеточно-опосредованная или гиперчувствительность замедленного типа) обычно развивается от двух до трех дней. Реакции типа IV участвуют во многих аутоиммунных и инфекционных заболеваниях, но могут также включать контактный дерматит. Эти реакции опосредованы Т-клетки, моноциты, и макрофаги.[120]
Идиопатическое воспаление
Воспаление - одна из первых реакций иммунной системы на инфекцию,[44] но это может появиться без известной причины.
Воспаление вызывается эйкозаноиды и цитокины, которые выделяются поврежденными или инфицированными клетками. Эйкозаноиды включают простагландины которые вызывают жар и расширение кровеносных сосудов связано с воспалением, и лейкотриены которые привлекают определенные белые кровяные тельца (лейкоциты).[45][46] Общие цитокины включают: интерлейкины которые отвечают за связь между лейкоцитами; хемокины которые продвигают хемотаксис; и интерфероны обладающие противовирусным действием, например, отключение синтез белка в клетке-хозяине.[47] Факторы роста и цитотоксические факторы также могут высвобождаться. Эти цитокины и другие химические вещества привлекают иммунные клетки к месту инфекции и способствуют заживлению любой поврежденной ткани после удаления патогенов.[48]
Манипуляции в медицине

Иммунным ответом можно манипулировать для подавления нежелательных реакций, возникающих в результате аутоиммунитета, аллергии и отторжение трансплантата, и для стимуляции защитных реакций против патогенов, которые в значительной степени ускользают от иммунной системы (см. иммунизация ) или рак.[121]
Иммуносупрессия
Иммунодепрессанты используются для контроля аутоиммунных заболеваний или воспаление при чрезмерном повреждении тканей и для предотвращения отторжения после трансплантация органа.[122][123]
Противовоспалительное средство препараты часто используются для борьбы с последствиями воспаления. Глюкокортикоиды are the most powerful of these drugs and can have many undesirable побочные эффекты, Такие как центральное ожирение, гипергликемия, и остеопороз.[124] Their use is tightly controlled. Lower doses of anti-inflammatory drugs are often used in conjunction with cytotoxic or immunosuppressive drugs such as метотрексат или же азатиоприн.
Цитотоксические препараты inhibit the immune response by killing dividing cells such as activated T cells. This killing is indiscriminate and other constantly dividing cells and their organs are affected, which causes toxic side effects.[123] Immunosuppressive drugs such as cyclosporin prevent T cells from responding to signals correctly by inhibiting преобразование сигнала pathways.[125]
Immunostimulation
Вакцинация

Долгосрочное активный memory is acquired following infection by activation of B and T cells. Active immunity can also be generated artificially, through вакцинация. The principle behind vaccination (also called иммунизация ) is to introduce an антиген from a pathogen to stimulate the immune system and develop specific immunity against that particular pathogen without causing disease associated with that organism.[126] This deliberate induction of an immune response is successful because it exploits the natural specificity of the immune system, as well as its inducibility. With infectious disease remaining one of the leading causes of death in the human population, vaccination represents the most effective manipulation of the immune system mankind has developed.[57][127]
Many vaccines are based on acellular components of micro-organisms, including harmless токсин составные части.[126] Since many antigens derived from acellular vaccines do not strongly induce the adaptive response, most bacterial vaccines are provided with additional адъюванты that activate the антигенпрезентирующие клетки из врожденная иммунная система и максимизировать иммуногенность.[128]
Tumor immunology
Another important role of the immune system is to identify and eliminate опухоли. Это называется иммунный надзор. В transformed cells of tumors express антигены that are not found on normal cells. To the immune system, these antigens appear foreign, and their presence causes immune cells to attack the transformed tumor cells. The antigens expressed by tumors have several sources;[129] some are derived from онкогенный viruses like вирус папилломы человека, which causes cancer of the шейка матки,[130] вульва, влагалище, пенис, анус, mouth, and throat,[131] while others are the organism's own proteins that occur at low levels in normal cells but reach high levels in tumor cells. One example is an enzyme called tyrosinase that, when expressed at high levels, transforms certain skin cells (for example, melanocytes ) into tumors called меланомы.[132][133] A third possible source of tumor antigens are proteins normally important for regulating рост клеток and survival, that commonly mutate into cancer inducing molecules called онкогены.[129][134][135]

The main response of the immune system to tumors is to destroy the abnormal cells using killer T cells, sometimes with the assistance of helper T cells.[133][137] Tumor antigens are presented on MHC class I molecules in a similar way to viral antigens. This allows killer T cells to recognize the tumor cell as abnormal.[138] NK cells also kill tumorous cells in a similar way, especially if the tumor cells have fewer MHC class I molecules on their surface than normal; this is a common phenomenon with tumors.[139] Sometimes antibodies are generated against tumor cells allowing for their destruction by the система комплемента.[134]
Some tumors evade the immune system and go on to become cancers.[140][141] Tumor cells often have a reduced number of MHC class I molecules on their surface, thus avoiding detection by killer T cells.[138][140] Some tumor cells also release products that inhibit the immune response; for example by secreting the cytokine TGF-β, which suppresses the activity of макрофаги и лимфоциты.[140][142] Кроме того, иммунологическая толерантность may develop against tumor antigens, so the immune system no longer attacks the tumor cells.[140][141]
Paradoxically, macrophages can promote tumor growth[143] when tumor cells send out cytokines that attract macrophages, which then generate cytokines and growth factors such as tumor-necrosis factor alpha that nurture tumor development or promote stem-cell-like plasticity.[140] In addition, a combination of hypoxia in the tumor and a cytokine produced by macrophages induces tumor cells to decrease production of a protein that blocks метастаз and thereby assists spread of cancer cells.[140] Anti-tumor M1 macrophages are recruited in early phases to tumor development but are progressively differentiated to M2 with pro-tumor effect, an immunosuppressor switch. The hypoxia reduces the cytokine production for the anti-tumor response and progressively macrophages acquire pro-tumor M2 functions driven by the tumor microenvironment, including IL-4 and IL-10. [144] Иммунотерапия рака covers the medical ways to stimulate the immune system to attack cancer tumors.[145]
Predicting immunogenicity
Some drugs can cause a neutralizing immune response, meaning that the immune system produces нейтрализующие антитела that counteract the action of the drugs, particularly if the drugs are administered repeatedly, or in larger doses. This limits the effectiveness of drugs based on larger peptides and proteins (which are typically larger than 6000 Да ).[146] In some cases, the drug itself is not immunogenic, but may be co-administered with an immunogenic compound, as is sometimes the case for Таксол. Computational methods have been developed to predict the immunogenicity of peptides and proteins, which are particularly useful in designing therapeutic antibodies, assessing likely virulence of mutations in viral coat particles, and validation of proposed peptide-based drug treatments. Early techniques relied mainly on the observation that гидрофильный аминокислоты are overrepresented in эпитоп regions than гидрофобный amino acids;[147] however, more recent developments rely on машинное обучение techniques using databases of existing known epitopes, usually on well-studied virus proteins, as a Обучающий набор.[148] A publicly accessible database has been established for the cataloguing of epitopes from pathogens known to be recognizable by B cells.[149] The emerging field of биоинформатика -based studies of immunogenicity is referred to as immunoinformatics.[150] Immunoproteomics is the study of large sets of proteins (протеомика ) involved in the immune response.[151]
Evolution and other mechanisms
Evolution of the immune system
It is likely that a multicomponent, adaptive immune system arose with the first позвоночные, так как беспозвоночные do not generate lymphocytes or an antibody-based humoral response.[152] Many species, however, use mechanisms that appear to be precursors of these aspects of vertebrate immunity. Immune systems appear even in the structurally simplest forms of life, with bacteria using a unique defense mechanism, called the restriction modification system to protect themselves from viral pathogens, called бактериофаги.[153] Прокариоты also possess acquired immunity, through a system that uses CRISPR sequences to retain fragments of the genomes of phage that they have come into contact with in the past, which allows them to block virus replication through a form of РНК-интерференция.[154][155] Prokaryotes also possess other defense mechanisms.[156][157] Offensive elements of the immune systems are also present in одноклеточные эукариоты, but studies of their roles in defense are few.[158]
Рецепторы распознавания образов are proteins used by nearly all organisms to identify molecules associated with pathogens. Антимикробные пептиды called defensins are an evolutionarily conserved component of the innate immune response found in all animals and plants, and represent the main form of invertebrate systemic immunity.[152] В система комплемента and phagocytic cells are also used by most forms of invertebrate life. Рибонуклеазы и РНК-интерференция pathway are conserved across all эукариоты, and are thought to play a role in the immune response to viruses.[159]
Unlike animals, plants lack phagocytic cells, but many plant immune responses involve systemic chemical signals that are sent through a plant.[160] Individual plant cells respond to molecules associated with pathogens known as патоген-ассоциированные молекулярные паттерны or PAMPs.[161] When a part of a plant becomes infected, the plant produces a localized гиперчувствительный ответ, whereby cells at the site of infection undergo rapid апоптоз to prevent the spread of the disease to other parts of the plant. Системная приобретенная резистентность is a type of defensive response used by plants that renders the entire plant стойкий to a particular infectious agent.[160] RNA silencing mechanisms are particularly important in this systemic response as they can block virus replication.[162]
Alternative adaptive immune system
Evolution of the adaptive immune system occurred in an ancestor of the jawed vertebrates. Many of the classical molecules of the adaptive immune system (for example, иммуноглобулины и Рецепторы Т-клеток ) exist only in jawed vertebrates. Отчетливый лимфоцит -derived molecule has been discovered in primitive jawless vertebrates, такой как минога и миксина. These animals possess a large array of molecules called Variable lymphocyte receptors (VLRs) that, like the antigen receptors of jawed vertebrates, are produced from only a small number (one or two) of гены. These molecules are believed to bind pathogenic антигены in a similar way to antibodies, and with the same degree of specificity.[163]
Manipulation by pathogens
The success of any pathogen depends on its ability to elude host immune responses. Therefore, pathogens evolved several methods that allow them to successfully infect a host, while evading detection or destruction by the immune system.[164] Bacteria often overcome physical barriers by secreting enzymes that digest the barrier, for example, by using a type II secretion system.[165] Alternatively, using a type III secretion system, they may insert a hollow tube into the host cell, providing a direct route for proteins to move from the pathogen to the host. These proteins are often used to shut down host defenses.[166]
An evasion strategy used by several pathogens to avoid the innate immune system is to hide within the cells of their host (also called внутриклеточный патогенез ). Here, a pathogen spends most of its life-cycle inside host cells, where it is shielded from direct contact with immune cells, antibodies and complement. Some examples of intracellular pathogens include viruses, the пищевое отравление бактерия Сальмонелла и эукариотический parasites that cause малярия (Плазмодий виды) и лейшманиоз (Лейшмания виды). Other bacteria, such as Микобактерии туберкулеза, live inside a protective capsule that prevents лизис by complement.[167] Many pathogens secrete compounds that diminish or misdirect the host's immune response.[164] Some bacteria form биопленки to protect themselves from the cells and proteins of the immune system. Such biofilms are present in many successful infections, such as the chronic Синегнойная палочка и Burkholderia cenocepacia infections characteristic of кистозный фиброз.[168] Other bacteria generate surface proteins that bind to antibodies, rendering them ineffective; примеры включают Стрептококк (protein G), Золотистый стафилококк (protein A), and Пептострептококк Магнус (protein L).[169]
The mechanisms used to evade the adaptive immune system are more complicated. The simplest approach is to rapidly change non-essential эпитопы (аминокислоты and/or sugars) on the surface of the pathogen, while keeping essential epitopes concealed. Это называется антигенная вариация. An example is HIV, which mutates rapidly, so the proteins on its вирусный конверт that are essential for entry into its host target cell are constantly changing. These frequent changes in antigens may explain the failures of вакцина directed at this virus.[170] Паразит Trypanosoma brucei uses a similar strategy, constantly switching one type of surface protein for another, allowing it to stay one step ahead of the antibody response.[171] Masking antigens with host molecules is another common strategy for avoiding detection by the immune system. In HIV, the envelope that covers the вирион is formed from the outermost membrane of the host cell; such "self-cloaked" viruses make it difficult for the immune system to identify them as "non-self" structures.[172]
История иммунологии
Иммунология is a science that examines the structure and function of the immune system. Это происходит из лекарство and early studies on the causes of immunity to disease. The earliest known reference to immunity was during the plague of Athens в 430 г. до н. э. Фукидид noted that people who had recovered from a previous bout of the disease could nurse the sick without contracting the illness a second time.[174] В 18 веке Pierre-Louis Moreau de Maupertuis experimented with scorpion venom and observed that certain dogs and mice were immune to this venom.[175] In the 10th century, Persian physician ар-Рази (also known as Rhazes) wrote the first recorded theory of acquired immunity,[176][177] noting that a оспа bout protected its survivors from future infections. Although he explained the immunity in terms of "excess moisture" being expelled from the blood—therefore preventing a second occurrence of the disease—this theory explained many observations about smallpox known during this time.[178]
These and other observations of acquired immunity were later exploited by Луи Пастер in his development of vaccination and his proposed микробная теория болезни.[179] Pasteur's theory was in direct opposition to contemporary theories of disease, such as the теория миазмов. Он не был до тех пор Роберт Кох 1891 год доказательства, for which he was awarded a Нобелевская премия in 1905, that микроорганизмы were confirmed as the cause of инфекционное заболевание.[180] Viruses were confirmed as human pathogens in 1901, with the discovery of the желтая лихорадка virus by Уолтер Рид.[181]
Immunology made a great advance towards the end of the 19th century, through rapid developments in the study of гуморальный иммунитет и клеточный иммунитет.[182] Particularly important was the work of Пол Эрлих, который предложил side-chain theory to explain the specificity of the antigen-antibody reaction; his contributions to the understanding of humoral immunity were recognized by the award of a joint Nobel Prize in 1908, along with the founder of cellular immunology, Elie Metchnikoff.[173] In 1974, Нильс Кай Йерн разработал immune network theory; he shared a Nobel Prize in 1984 with Жорж Й. Ф. Кёлер и Сезар Мильштейн for theories related to the immune system.[183][184]
Смотрите также
- Рецептор Fc
- Immune system receptors
- Immunostimulator
- Первородный антигенный грех – when the immune system uses immunological memory upon encountering a slightly different pathogen
- Устойчивость к болезням растений
- Polyclonal response
- Опухолевые антигены
Рекомендации
- ^ Sompayrac 2019, п. 1.
- ^ а б Litman GW, Cannon JP, Dishaw LJ (November 2005). "Reconstructing immune phylogeny: new perspectives". Обзоры природы. Иммунология. 5 (11): 866–79. Дои:10.1038/nri1712. ЧВК 3683834. PMID 16261174.
- ^ Sompayrac 2019, п. 4.
- ^ Restifo NP, Gattinoni L (октябрь 2013 г.). «Клонирование эффекторных Т-клеток и Т-клеток памяти». Current Opinion in Immunology. 25 (5): 556–63. Дои:10.1016 / j.coi.2013.09.003. ЧВК 3858177. PMID 24148236.
- ^ Kurosaki T, Kometani K, Ise W (March 2015). "Memory B cells". Обзоры природы. Иммунология. 15 (3): 149–59. Дои:10.1038/nri3802. PMID 25677494. S2CID 20825732.
- ^ Sompayrac 2019, п. 11.
- ^ Sompayrac 2019, п. 146.
- ^ Alberts et al. 2002 г., сек. "Pathogens Cross Protective Barriers to Colonize the Host".
- ^ Boyton RJ, Openshaw PJ (2002). "Pulmonary defences to acute respiratory infection". Британский медицинский бюллетень. 61 (1): 1–12. Дои:10.1093/bmb/61.1.1. PMID 11997295.
- ^ Agerberth B, Gudmundsson GH (2006). "Host antimicrobial defence peptides in human disease". Актуальные темы микробиологии и иммунологии. 306: 67–90. Дои:10.1007/3-540-29916-5_3. ISBN 978-3-540-29915-8. PMID 16909918.
- ^ Moreau JM, Girgis DO, Hume EB, Dajcs JJ, Austin MS, O'Callaghan RJ (September 2001). "Phospholipase A(2) in rabbit tears: a host defense against Staphylococcus aureus". Исследовательская офтальмология и визуализация. 42 (10): 2347–54. PMID 11527949.
- ^ Hankiewicz J, Swierczek E (December 1974). "Lysozyme in human body fluids". Clinica Chimica Acta; Международный журнал клинической химии. 57 (3): 205–09. Дои:10.1016/0009-8981(74)90398-2. PMID 4434640.
- ^ Fair WR, Couch J, Wehner N (February 1976). "Prostatic antibacterial factor. Identity and significance". Урология. 7 (2): 169–77. Дои:10.1016/0090-4295(76)90305-8. PMID 54972.
- ^ Yenugu S, Hamil KG, Birse CE, Ruben SM, French FS, Hall SH (June 2003). "Antibacterial properties of the sperm-binding proteins and peptides of human epididymis 2 (HE2) family; salt sensitivity, structural dependence and their interaction with outer and cytoplasmic membranes of Escherichia coli". Биохимический журнал. 372 (Pt 2): 473–83. Дои:10.1042/BJ20030225. ЧВК 1223422. PMID 12628001.
- ^ Smith JL (2003). "The role of gastric acid in preventing foodborne disease and how bacteria overcome acid conditions". J Food Prot. 66 (7): 1292–1303. Дои:10.4315/0362-028X-66.7.1292. PMID 12870767.
- ^ Gorbach SL (Февраль 1990 г.). "Lactic acid bacteria and human health". Анналы медицины. 22 (1): 37–41. Дои:10.3109/07853899009147239. PMID 2109988.
- ^ Medzhitov R (October 2007). "Recognition of microorganisms and activation of the immune response". Природа. 449 (7164): 819–26. Bibcode:2007Natur.449..819M. Дои:10.1038/nature06246. PMID 17943118. S2CID 4392839.
- ^ Matzinger P (April 2002). "The danger model: a renewed sense of self" (PDF). Наука. 296 (5566): 301–05. Bibcode:2002Sci...296..301M. Дои:10.1126 / science.1071059. PMID 11951032. S2CID 13615808.
- ^ а б Alberts et al. 2002 г., Глава: "Врожденный иммунитет".
- ^ Iriti 2019, п. xi.
- ^ Кумар Х., Каваи Т., Акира С. (февраль 2011 г.). «Распознавание патогенов врожденной иммунной системой». International Reviews of Immunology. 30 (1): 16–34. Дои:10.3109/08830185.2010.529976. PMID 21235323. S2CID 42000671.
- ^ Шредер К., Чопп Дж. (Март 2010 г.). «Инфламмасомы». Клетка. 140 (6): 821–32. Дои:10.1016 / j.cell.2010.01.040. PMID 20303873. S2CID 16916572.
- ^ Sompayrac 2019, п. 20.
- ^ Beutler B, Jiang Z, Georgel P, Crozat K, Croker B, Rutschmann S, Du X, Hoebe K (2006). "Genetic analysis of host resistance: Toll-like receptor signaling and immunity at large". Ежегодный обзор иммунологии. 24: 353–89. Дои:10.1146 / annurev.immunol.24.021605.090552. PMID 16551253. S2CID 20991617.
- ^ Ботос И., Сегал Д.М., Дэвис Д.Р. (апрель 2011 г.). «Структурная биология Toll-подобных рецепторов». Структура. 19 (4): 447–59. Дои:10.1016 / j.str.2011.02.004. ЧВК 3075535. PMID 21481769.
- ^ Vijay K (June 2018). "Toll-like receptors in immunity and inflammatory diseases: Past, present, and future". Int Immunopharmacol. 59: 391–412. Дои:10.1016/j.intimp.2018.03.002. ЧВК 7106078. PMID 29730580.
- ^ Thompson MR, Kaminski JJ, Kurt-Jones EA, Fitzgerald KA (June 2011). "Pattern recognition receptors and the innate immune response to viral infection". Вирусы. 3 (6): 920–40. Дои:10.3390/v3060920. ЧВК 3186011. PMID 21994762.
- ^ Sompayrac 2019, стр. 1–4.
- ^ Alberts et al. 2002 г., сек. "Phagocytic Cells Seek, Engulf, and Destroy Pathogens".
- ^ Ryter A (1985). "Relationship between ultrastructure and specific functions of macrophages". Сравнительная иммунология, микробиология и инфекционные болезни. 8 (2): 119–33. Дои:10.1016/0147-9571(85)90039-6. PMID 3910340.
- ^ Langermans JA, Hazenbos WL, van Furth R (September 1994). "Antimicrobial functions of mononuclear phagocytes". Журнал иммунологических методов. 174 (1–2): 185–94. Дои:10.1016/0022-1759(94)90021-3. PMID 8083520.
- ^ May RC, Machesky LM (March 2001). "Phagocytosis and the actin cytoskeleton". Журнал клеточной науки. 114 (Pt 6): 1061–77. PMID 11228151.
- ^ Salzet M, Tasiemski A, Cooper E (2006). "Innate immunity in lophotrochozoans: the annelids". Текущий фармацевтический дизайн. 12 (24): 3043–50. Дои:10.2174/138161206777947551. PMID 16918433. S2CID 28520695.
- ^ Zen K, Parkos CA (October 2003). "Leukocyte-epithelial interactions". Текущее мнение в области клеточной биологии. 15 (5): 557–64. Дои:10.1016/S0955-0674(03)00103-0. PMID 14519390.
- ^ а б Stvrtinová, Jakubovský & Hulín 1995, Глава: Inflammation and Fever.
- ^ Rua R, McGavern DB (September 2015). "Elucidation of monocyte/macrophage dynamics and function by intravital imaging". Журнал биологии лейкоцитов. 98 (3): 319–32. Дои:10.1189/jlb.4RI0115-006RR. ЧВК 4763596. PMID 26162402.
- ^ а б Guermonprez P, Valladeau J, Zitvogel L, Théry C, Amigorena S (2002). "Antigen presentation and T cell stimulation by dendritic cells". Ежегодный обзор иммунологии. 20 (1): 621–67. Дои:10.1146/annurev.immunol.20.100301.064828. PMID 11861614.
- ^ Krishnaswamy, Ajitawi & Chi 2006, стр. 13–34.
- ^ Kariyawasam HH, Robinson DS (April 2006). "The eosinophil: the cell and its weapons, the cytokines, its locations". Семинары по респираторной медицине и реанимации. 27 (2): 117–27. Дои:10.1055/s-2006-939514. PMID 16612762.
- ^ Spits H, Cupedo T (2012). "Innate lymphoid cells: emerging insights in development, lineage relationships, and function". Ежегодный обзор иммунологии. 30: 647–75. Дои:10.1146/annurev-immunol-020711-075053. PMID 22224763.
- ^ Gabrielli S, Ortolani C, Del Zotto G, Luchetti F, Canonico B, Buccella F, Artico M, Papa S, Zamai L (2016). "The Memories of NK Cells: Innate-Adaptive Immune Intrinsic Crosstalk". Журнал иммунологических исследований. 2016: 1376595. Дои:10.1155/2016/1376595. ЧВК 5204097. PMID 28078307.
- ^ Bertok & Chow 2005, п.17.
- ^ Rajalingam 2012, Chapter: Overview of the killer cell immunoglobulin-like receptor system.
- ^ а б Kawai T, Akira S (February 2006). "Innate immune recognition of viral infection". Иммунология природы. 7 (2): 131–37. Дои:10.1038/ni1303. PMID 16424890. S2CID 9567407.
- ^ а б Miller SB (August 2006). "Prostaglandins in health and disease: an overview". Семинары по артриту и ревматизму. 36 (1): 37–49. Дои:10.1016/j.semarthrit.2006.03.005. PMID 16887467.
- ^ а б Ogawa Y, Calhoun WJ (October 2006). "The role of leukotrienes in airway inflammation". Журнал аллергии и клинической иммунологии. 118 (4): 789–98, quiz 799–800. Дои:10.1016/j.jaci.2006.08.009. PMID 17030228.
- ^ а б Le Y, Zhou Y, Iribarren P, Wang J (April 2004). "Chemokines and chemokine receptors: their manifold roles in homeostasis and disease" (PDF). Cellular & Molecular Immunology. 1 (2): 95–104. PMID 16212895.
- ^ а б Martin P, Leibovich SJ (November 2005). "Inflammatory cells during wound repair: the good, the bad and the ugly". Trends in Cell Biology. 15 (11): 599–607. Дои:10.1016/j.tcb.2005.09.002. PMID 16202600.
- ^ Platnich JM, Muruve DA (February 2019). "NOD-like receptors and inflammasomes: A review of their canonical and non-canonical signaling pathways". Архивы биохимии и биофизики. 670: 4–14. Дои:10.1016/j.abb.2019.02.008. PMID 30772258.
- ^ а б Rus H, Cudrici C, Niculescu F (2005). "The role of the complement system in innate immunity". Immunologic Research. 33 (2): 103–12. Дои:10.1385/IR:33:2:103. PMID 16234578. S2CID 46096567.
- ^ Degn SE, Thiel S (August 2013). "Humoral pattern recognition and the complement system". Скандинавский журнал иммунологии. 78 (2): 181–93. Дои:10.1111/sji.12070. PMID 23672641.
- ^ Bertok & Chow 2005, стр.112–113.
- ^ Liszewski MK, Farries TC, Lublin DM, Rooney IA, Atkinson JP (1996). "Control of the complement system". Достижения в иммунологии. 61: 201–283. Дои:10.1016/S0065-2776(08)60868-8. ISBN 978-0-12-022461-6. PMID 8834497.
- ^ Sim RB, Tsiftsoglou SA (February 2004). "Proteases of the complement system". Сделки биохимического общества. 32 (Pt 1): 21–27. Дои:10.1042/BST0320021. PMID 14748705. S2CID 24505041.
- ^ Pancer Z, Cooper MD (2006). "The evolution of adaptive immunity". Ежегодный обзор иммунологии. 24 (1): 497–518. Дои:10.1146/annurev.immunol.24.021605.090542. PMID 16551257.
- ^ Sompayrac 2019, п. 38.
- ^ а б c Janeway 2005.
- ^ а б Holtmeier W, Kabelitz D (2005). "gammadelta T cells link innate and adaptive immune responses". Химическая иммунология и аллергия. 86: 151–83. Дои:10.1159/000086659. ISBN 3-8055-7862-8. PMID 15976493.
- ^ Venturi S, Venturi M (September 2009). «Йод, тимус и иммунитет». Питание. 25 (9): 977–79. Дои:10.1016 / j.nut.2009.06.002. PMID 19647627.
- ^ Janeway, Travers & Walport 2001, сек. 12-10.
- ^ Sompayrac 2019, стр. 5–6.
- ^ Sompayrac 2019 С. 51–53.
- ^ Sompayrac 2019, pp. 7–8.
- ^ Harty JT, Tvinnereim AR, White DW (2000). "CD8+ T cell effector mechanisms in resistance to infection". Ежегодный обзор иммунологии. 18 (1): 275–308. Дои:10.1146/annurev.immunol.18.1.275. PMID 10837060.
- ^ а б Radoja S, Frey AB, Vukmanovic S (2006). "T-cell receptor signaling events triggering granule exocytosis". Critical Reviews in Immunology. 26 (3): 265–90. Дои:10.1615/CritRevImmunol.v26.i3.40. PMID 16928189.
- ^ Abbas AK, Murphy KM, Sher A (October 1996). "Functional diversity of helper T lymphocytes". Природа. 383 (6603): 787–93. Bibcode:1996Natur.383..787A. Дои:10.1038/383787a0. PMID 8893001. S2CID 4319699.
- ^ McHeyzer-Williams LJ, Malherbe LP, McHeyzer-Williams MG (2006). "Helper T cell-regulated B cell immunity". Актуальные темы микробиологии и иммунологии. 311: 59–83. Дои:10.1007/3-540-32636-7_3. ISBN 978-3-540-32635-9. PMID 17048705.
- ^ Sompayrac 2019, п. 8.
- ^ Kovacs B, Maus MV, Riley JL, Derimanov GS, Koretzky GA, June CH, Finkel TH (November 2002). "Human CD8+ T cells do not require the polarization of lipid rafts for activation and proliferation". Труды Национальной академии наук Соединенных Штатов Америки. 99 (23): 15006–11. Bibcode:2002PNAS...9915006K. Дои:10.1073/pnas.232058599. ЧВК 137535. PMID 12419850.
- ^ Alberts et al. 2002 г., Chapter. "Helper T Cells and Lymphocyte Activation".
- ^ Grewal IS, Flavell RA (1998). "CD40 and CD154 in cell-mediated immunity". Ежегодный обзор иммунологии. 16 (1): 111–35. Дои:10.1146/annurev.immunol.16.1.111. PMID 9597126.
- ^ Girardi M (January 2006). "Immunosurveillance and immunoregulation by gammadelta T cells". Журнал следственной дерматологии. 126 (1): 25–31. Дои:10.1038/sj.jid.5700003. PMID 16417214.
- ^ "Understanding the Immune System: How it Works" (PDF). Национальный институт аллергии и инфекционных заболеваний (NIAID). Архивировано из оригинал (PDF) on 3 January 2007. Получено 1 января 2007.
- ^ а б Sproul TW, Cheng PC, Dykstra ML, Pierce SK (2000). "A role for MHC class II antigen processing in B cell development". International Reviews of Immunology. 19 (2–3): 139–55. Дои:10.3109/08830180009088502. PMID 10763706. S2CID 6550357.
- ^ Parker DC (1993). "T cell-dependent B cell activation". Ежегодный обзор иммунологии. 11: 331–60. Дои:10.1146/annurev.iy.11.040193.001555. PMID 8476565.
- ^ Murphy & Weaver 2016, Chapter 10: The Humoral Immune Response.
- ^ Saji F, Samejima Y, Kamiura S, Koyama M (May 1999). "Dynamics of immunoglobulins at the feto-maternal interface". Отзывы о репродукции. 4 (2): 81–89. Дои:10.1530/ror.0.0040081. PMID 10357095.
- ^ Van de Perre P (July 2003). "Transfer of antibody via mother's milk". Вакцина. 21 (24): 3374–76. Дои:10.1016/S0264-410X(03)00336-0. PMID 12850343.
- ^ Keller MA, Stiehm ER (October 2000). "Passive immunity in prevention and treatment of infectious diseases". Обзоры клинической микробиологии. 13 (4): 602–14. Дои:10.1128/CMR.13.4.602-614.2000. ЧВК 88952. PMID 11023960.
- ^ Sompayrac 2019, п. 98.
- ^ Wick G, Hu Y, Schwarz S, Kroemer G (October 1993). "Immunoendocrine communication via the hypothalamo-pituitary-adrenal axis in autoimmune diseases". Endocrine Reviews. 14 (5): 539–63. Дои:10.1210/edrv-14-5-539. PMID 8262005.
- ^ Kroemer G, Brezinschek HP, Faessler R, Schauenstein K, Wick G (June 1988). "Physiology and pathology of an immunoendocrine feedback loop". Иммунология сегодня. 9 (6): 163–5. Дои:10.1016/0167-5699(88)91289-3. PMID 3256322.
- ^ Trakhtenberg EF, Goldberg JL (October 2011). "Immunology. Neuroimmune communication". Наука. 334 (6052): 47–8. Bibcode:2011Sci...334...47T. Дои:10.1126/science.1213099. PMID 21980100. S2CID 36504684.
- ^ Veiga-Fernandes H, Mucida D (May 2016). "Neuro-Immune Interactions at Barrier Surfaces". Клетка. 165 (4): 801–11. Дои:10.1016/j.cell.2016.04.041. ЧВК 4871617. PMID 27153494.
- ^ "Neuroimmune communication". Природа Неврология. 20 (2): 127. February 2017. Дои:10.1038/nn.4496. PMID 28092662.
- ^ Wilcox SM, Arora H, Munro L, Xin J, Fenninger F, Johnson LA, Pfeifer CG, Choi KB, Hou J, Hoodless PA, Jefferies WA (2017). "The role of the innate immune response regulatory gene ABCF1 in mammalian embryogenesis and development". PLOS ONE. 12 (5): e0175918. Bibcode:2017PLoSO..1275918W. Дои:10.1371/journal.pone.0175918. ЧВК 5438103. PMID 28542262.
- ^ Wira, Crane-Godreau & Grant 2004, Chapter: Endocrine regulation of the mucosal immune system in the female reproductive tract.
- ^ Lang TJ (December 2004). "Estrogen as an immunomodulator". Clinical Immunology. 113 (3): 224–30. Дои:10.1016/j.clim.2004.05.011. PMID 15507385.
Moriyama A, Shimoya K, Ogata I, Kimura T, Nakamura T, Wada H, Ohashi K, Azuma C, Saji F, Murata Y (July 1999). "Secretory leukocyte protease inhibitor (SLPI) concentrations in cervical mucus of women with normal menstrual cycle". Molecular Human Reproduction. 5 (7): 656–61. Дои:10.1093/molehr/5.7.656. PMID 10381821.
Cutolo M, Sulli A, Capellino S, Villaggio B, Montagna P, Seriolo B, Straub RH (2004). "Sex hormones influence on the immune system: basic and clinical aspects in autoimmunity". Волчанка. 13 (9): 635–38. Дои:10.1191/0961203304lu1094oa. PMID 15485092. S2CID 23941507.
King AE, Critchley HO, Kelly RW (February 2000). "Presence of secretory leukocyte protease inhibitor in human endometrium and first trimester decidua suggests an antibacterial protective role". Molecular Human Reproduction. 6 (2): 191–96. Дои:10.1093/molehr/6.2.191. PMID 10655462. - ^ Fimmel S, Zouboulis CC (2005). "Influence of physiological androgen levels on wound healing and immune status in men". The Aging Male. 8 (3–4): 166–74. Дои:10.1080/13685530500233847. PMID 16390741. S2CID 1021367.
- ^ Dorshkind K, Horseman ND (June 2000). "The roles of prolactin, growth hormone, insulin-like growth factor-I, and thyroid hormones in lymphocyte development and function: insights from genetic models of hormone and hormone receptor deficiency". Endocrine Reviews. 21 (3): 292–312. Дои:10.1210/er.21.3.292. PMID 10857555.
- ^ Nagpal S, Na S, Rathnachalam R (August 2005). "Noncalcemic actions of vitamin D receptor ligands". Endocrine Reviews. 26 (5): 662–87. Дои:10.1210/er.2004-0002. PMID 15798098.
- ^ von Essen MR, Kongsbak M, Schjerling P, Olgaard K, Odum N, Geisler C (April 2010). "Vitamin D controls T cell antigen receptor signaling and activation of human T cells". Иммунология природы. 11 (4): 344–49. Дои:10.1038/ni.1851. PMID 20208539. S2CID 6119729.
- ^ Sigmundsdottir H, Pan J, Debes GF, Alt C, Habtezion A, Soler D, Butcher EC (March 2007). "DCs metabolize sunlight-induced vitamin D3 to 'program' T cell attraction to the epidermal chemokine CCL27". Иммунология природы. 8 (3): 285–93. Дои:10.1038/ni1433. PMID 17259988. S2CID 9540123.
- ^ Bryant PA, Trinder J, Curtis N (June 2004). "Sick and tired: Does sleep have a vital role in the immune system?". Обзоры природы. Иммунология. 4 (6): 457–67. Дои:10.1038/nri1369. PMID 15173834. S2CID 29318345.
- ^ Krueger JM, Majde JA (May 2003). "Humoral links between sleep and the immune system: research issues". Летопись Нью-Йоркской академии наук. 992 (1): 9–20. Bibcode:2003NYASA.992....9K. Дои:10.1111/j.1749-6632.2003.tb03133.x. PMID 12794042. S2CID 24508121.
- ^ Majde JA, Krueger JM (December 2005). "Links between the innate immune system and sleep". Журнал аллергии и клинической иммунологии. 116 (6): 1188–98. Дои:10.1016/j.jaci.2005.08.005. PMID 16337444.
- ^ Taylor DJ, Kelly K, Kohut ML, Song KS (2017). "Is Insomnia a Risk Factor for Decreased Influenza Vaccine Response?". Поведенческая медицина сна. 15 (4): 270–287. Дои:10.1080/15402002.2015.1126596. ЧВК 5554442. PMID 27077395.
- ^ Krueger JM (2008). "The role of cytokines in sleep regulation". Текущий фармацевтический дизайн. 14 (32): 3408–16. Дои:10.2174/138161208786549281. ЧВК 2692603. PMID 19075717.
- ^ а б Besedovsky L, Lange T, Born J (January 2012). "Sleep and immune function". Pflügers Archiv. 463 (1): 121–37. Дои:10.1007/s00424-011-1044-0. ЧВК 3256323. PMID 22071480.
- ^ "Can Better Sleep Mean Catching fewer Colds?". Архивировано из оригинал 9 мая 2014 г.. Получено 28 апреля 2014.
- ^ Suskind RM, Lachney CL, Udall JN (1994). "Malnutrition and the Immune Response ", in Serrano-Ríos M, ed., Dairy products in human health and nutrition, CRC Press, pp. 285–300
- ^ Pond CM (July 2005). "Adipose tissue and the immune system". Простагландины, лейкотриены и незаменимые жирные кислоты. 73 (1): 17–30. Дои:10.1016/j.plefa.2005.04.005. PMID 15946832.
- ^ Langley-Evans SC, Carrington LJ (2006). "Diet and the developing immune system". Волчанка. 15 (11): 746–52. Дои:10.1177/0961203306070001. PMID 17153845. S2CID 30576003.
- ^ Godwin JW, Pinto AR, Rosenthal NA (January 2017). "Chasing the recipe for a pro-regenerative immune system". Семинары по клеточной биологии и биологии развития. Innate immune pathways in wound healing/Peromyscus as a model system. 61: 71–79. Дои:10.1016/j.semcdb.2016.08.008. ЧВК 5338634. PMID 27521522.
- ^ Sompayrac 2019, pp. 120–24.
- ^ Sompayrac 2019, pp. 114–18.
- ^ Sompayrac 2019, pp. 111–14.
- ^ Aw D, Silva AB, Palmer DB (April 2007). "Immunosenescence: emerging challenges for an ageing population". Иммунология. 120 (4): 435–46. Дои:10.1111/j.1365-2567.2007.02555.x. ЧВК 2265901. PMID 17313487.
- ^ а б Chandra RK (August 1997). "Nutrition and the immune system: an introduction". Американский журнал клинического питания. 66 (2): 460S–63S. Дои:10.1093/ajcn/66.2.460S. PMID 9250133.
- ^ Miller JF (July 2002). "The discovery of thymus function and of thymus-derived lymphocytes". Иммунологические обзоры. 185 (1): 7–14. Дои:10.1034/j.1600-065X.2002.18502.x. PMID 12190917. S2CID 12108587.
- ^ Reece 2011, п. 967.
- ^ Burg M, Gennery AR (2011). «Учебная статья: Расширяющийся клинический и иммунологический спектр тяжелого комбинированного иммунодефицита». Eur J Pediatr. 170 (5): 561–571. Дои:10.1007 / s00431-011-1452-3. ЧВК 3078321. PMID 21479529.
- ^ Joos L, Tamm M (2005). "Breakdown of pulmonary host defense in the immunocompromised host: cancer chemotherapy". Proceedings of the American Thoracic Society. 2 (5): 445–48. Дои:10.1513/pats.200508-097JS. PMID 16322598.
- ^ Copeland KF, Heeney JL (December 1996). "T helper cell activation and human retroviral pathogenesis". Микробиологические обзоры. 60 (4): 722–42. Дои:10.1128/MMBR.60.4.722-742.1996. ЧВК 239461. PMID 8987361.
- ^ Miller JF (1993). "Self-nonself discrimination and tolerance in T and B lymphocytes". Immunologic Research. 12 (2): 115–30. Дои:10.1007/BF02918299. PMID 8254222. S2CID 32476323.
- ^ «Болезнь Хашимото». Управление по охране здоровья женщин Министерства здравоохранения и социальных служб США. 12 июня 2017. В архиве из оригинала 28 июля 2017 г.. Получено 17 июля 2017.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ Smolen JS, Aletaha D, McInnes IB (October 2016). "Rheumatoid arthritis" (PDF). Ланцет. 388 (10055): 2023–2038. Дои:10.1016/S0140-6736(16)30173-8. PMID 27156434. S2CID 37973054.
- ^ Farhy LS, McCall AL (July 2015). "Glucagon - the new 'insulin' in the pathophysiology of diabetes". Текущее мнение о клиническом питании и метаболическом лечении. 18 (4): 407–14. Дои:10.1097/mco.0000000000000192. PMID 26049639. S2CID 19872862.
- ^ "Handout on Health: Systemic Lupus Erythematosus". www.niams.nih.gov. Февраль 2015 г. В архиве из оригинала 17 июня 2016 г.. Получено 12 июн 2016.
- ^ а б c d Ghaffar A (2006). "Immunology – Chapter Seventeen: Hypersensitivity States". Микробиология и иммунология онлайн. University of South Carolina School of Medicine. Получено 29 мая 2016.
- ^ Sompayrac 2019 С. 83–85.
- ^ Ciccone 2015, Глава 37.
- ^ а б Taylor AL, Watson CJ, Bradley JA (October 2005). "Immunosuppressive agents in solid organ transplantation: Mechanisms of action and therapeutic efficacy". Critical Reviews in Oncology/Hematology. 56 (1): 23–46. Дои:10.1016 / j.critrevonc.2005.03.012. PMID 16039869.
- ^ Барнс П.Дж. (март 2006 г.). «Кортикостероиды: лучшие лекарства». Европейский журнал фармакологии. 533 (1–3): 2–14. Дои:10.1016 / j.ejphar.2005.12.052. PMID 16436275.
- ^ Masri MA (июль 2003 г.). «Мозаика иммунодепрессантов». Молекулярная иммунология. 39 (17–18): 1073–77. Дои:10.1016 / S0161-5890 (03) 00075-0. PMID 12835079.
- ^ а б Рис 2011, п. 965.
- ^ Оценки смертности и DALY на 2002 г. по причинам для государств-членов ВОЗ. Всемирная организация здоровья. Проверено 1 января 2007 г.
- ^ Сингх М., О'Хаган Д. (ноябрь 1999 г.). «Достижения в области адъювантов вакцин». Природа Биотехнологии. 17 (11): 1075–81. Дои:10.1038/15058. PMID 10545912. S2CID 21346647.
- ^ а б Андерсен MH, Schrama D, Thor Straten P, Becker JC (январь 2006 г.). «Цитотоксические Т-клетки». Журнал следственной дерматологии. 126 (1): 32–41. Дои:10.1038 / sj.jid.5700001. PMID 16417215.
- ^ Бун Т., ван дер Брюгген П. (март 1996 г.). «Опухолевые антигены человека, распознаваемые Т-лимфоцитами». Журнал экспериментальной медицины. 183 (3): 725–29. Дои:10.1084 / jem.183.3.725. ЧВК 2192342. PMID 8642276.
- ^ Любоевич С, Скерлев М (2014). «Заболевания, ассоциированные с ВПЧ». Клиники дерматологии. 32 (2): 227–34. Дои:10.1016 / j.clindermatol.2013.08.007. PMID 24559558.
- ^ Кастелли С., Риволтини Л., Андреола Г., Каррабба М., Ренквист Н., Пармиани Г. (март 2000 г.). «Распознавание Т-клетками антигенов, связанных с меланомой». Журнал клеточной физиологии. 182 (3): 323–31. Дои:10.1002 / (SICI) 1097-4652 (200003) 182: 3 <323 :: AID-JCP2> 3.0.CO; 2- #. PMID 10653598.
- ^ а б Ромеро П., Cerottini JC, Speiser DE (2006). «Ответ человеческих Т-клеток на антигены меланомы». Достижения в иммунологии. 92: 187–224. Дои:10.1016 / S0065-2776 (06) 92005-7. ISBN 978-0-12-373636-9. PMID 17145305.
- ^ а б Гевара-Патиньо Дж. А., Терк М. Дж., Волчок Дж. Д., Хоутон А. Н. (2003). «Иммунитет к раку через иммунное распознавание измененного« я »: исследования меланомы». Достижения в исследованиях рака. 90: 157–77. Дои:10.1016 / S0065-230X (03) 90005-4. ISBN 978-0-12-006690-2. PMID 14710950.
- ^ Ренквист Н., Кастелли С., Роббинс П. Ф., Пармиани Г. (март 2001 г.). «Список человеческих опухолевых антигенов, распознаваемых Т-клетками». Иммунология рака, Иммунотерапия. 50 (1): 3–15. Дои:10.1007 / s002620000169. PMID 11315507. S2CID 42681479.
- ^ Морган Р.А., Дадли М.Э., Вундерлих Дж. Р. и др. (Октябрь 2006 г.). «Регресс рака у пациентов после переноса генетически модифицированных лимфоцитов». Наука. 314 (5796): 126–29. Bibcode:2006Научный ... 314..126М. Дои:10.1126 / science.1129003. ЧВК 2267026. PMID 16946036.
- ^ Герлони М, Занетти М (июнь 2005 г.). «CD4 Т-клетки в опухолевом иммунитете». Семинары Springer по иммунопатологии. 27 (1): 37–48. Дои:10.1007 / s00281-004-0193-z. PMID 15965712. S2CID 25182066.
- ^ а б Селигер Б., Ритц У, Феррон С (январь 2006 г.). «Молекулярные механизмы аномалий антигена HLA класса I после вирусной инфекции и трансформации». Международный журнал рака. 118 (1): 129–38. Дои:10.1002 / ijc.21312. PMID 16003759. S2CID 5655726.
- ^ Хаякава Y, Смит MJ (2006). «Врожденное иммунное распознавание и подавление опухолей». Достижения в исследованиях рака. 95: 293–322. Дои:10.1016 / S0065-230X (06) 95008-8. ISBN 978-0-12-006695-7. PMID 16860661.
- ^ а б c d е ж Syn NL, Teng MW, Mok TS, Soo RA (декабрь 2017 г.). «De-novo и приобретенная устойчивость к нацеливанию на иммунные контрольные точки». Ланцет. Онкология. 18 (12): e731 – e741. Дои:10.1016 / с1470-2045 (17) 30607-1. PMID 29208439.
- ^ а б Селигер Б (2005). «Стратегии уклонения от опухолевого иммунитета». BioDrugs. 19 (6): 347–54. Дои:10.2165/00063030-200519060-00002. PMID 16392887. S2CID 1838144.
- ^ Frumento G, Piazza T, Di Carlo E, Ferrini S (сентябрь 2006 г.). «Ориентация на связанную с опухолью иммуносупрессию для иммунотерапии рака». Целевые препараты для лечения эндокринных, метаболических и иммунных расстройств. 6 (3): 233–7. Дои:10.2174/187153006778250019. PMID 17017974.
- ^ Stix G (июль 2007 г.). «Злокачественное пламя. Понимание хронического воспаления, которое способствует сердечным заболеваниям, болезни Альцгеймера и множеству других болезней, может быть ключом к разгадке тайн рака» (PDF). Scientific American. 297 (1): 60–67. Bibcode:2007SciAm.297a..60S. Дои:10.1038 / scientificamerican0707-60. PMID 17695843. Архивировано из оригинал (PDF) 16 июля 2011 г.
- ^ Сервантес-Вильлаграна, Р.Д., Альборес-Гарсия, Д., Сервантес-Вильяграна, АР, Гарсия-Асевес, С.Ж. (18 июня 2020 г.). «Опухоль-индуцированный нейрогенез и уклонение от иммунитета как цели инновационных противоопухолевых методов лечения». Цель трансдукта сигнала Ther. 5 (1): 99. Дои:10.1038 / s41392-020-0205-z. ЧВК 7303203. PMID 32555170.
- ^ Ян И (сентябрь 2015 г.). «Иммунотерапия рака: использование иммунной системы для борьбы с раком». Журнал клинических исследований. 125 (9): 3335–7. Дои:10.1172 / JCI83871. ЧВК 4588312. PMID 26325031.
- ^ Член парламента Бейкер, Рейнольдс Х.М., Лумицизи Б., Брайсон С.Дж. (октябрь 2010 г.). «Иммуногенность белковых терапевтических средств: основные причины, последствия и проблемы». Самостоятельная / чужая. 1 (4): 314–322. Дои:10.4161 / self.1.4.13904. ЧВК 3062386. PMID 21487506.
- ^ Welling GW, Weijer WJ, van der Zee R, Welling-Wester S (сентябрь 1985 г.). «Прогнозирование последовательных антигенных областей в белках». Письма FEBS. 188 (2): 215–18. Дои:10.1016/0014-5793(85)80374-4. PMID 2411595.
- ^ Зёлльнер Дж, Майер Б (2006). «Подходы машинного обучения для предсказания линейных эпитопов B-клеток на белках». Журнал молекулярного распознавания. 19 (3): 200–08. Дои:10.1002 / jmr.771. PMID 16598694. S2CID 18197810.
- ^ Саха С., Бхасин М., Рагхава Г.П. (2005). «Bcipep: база данных эпитопов В-клеток». BMC Genomics. 6: 79. Дои:10.1186/1471-2164-6-79. ЧВК 1173103. PMID 15921533.
- ^ Цветок Д.Р., Дойчинова И.А. (2002). «Иммуноинформатика и прогнозирование иммуногенности». Прикладная биоинформатика. 1 (4): 167–76. PMID 15130835.
- ^ Kanduc D (сентябрь 2019 г.). «От иммунопротеомики вируса гепатита С до ревматологии через перекрестную реактивность в одной таблице». Текущее мнение в ревматологии. 31 (5): 488–492. Дои:10.1097 / BOR.0000000000000606. PMID 31356379.
- ^ а б Флайник М.Ф., Касахара М. (январь 2010 г.). «Происхождение и эволюция адаптивной иммунной системы: генетические события и давление отбора». Обзоры природы. Генетика. 11 (1): 47–59. Дои:10.1038 / nrg2703. ЧВК 3805090. PMID 19997068.
- ^ Бикл Т.А., Крюгер Д.Х. (июнь 1993 г.). «Биология рестрикции ДНК». Микробиологические обзоры. 57 (2): 434–50. Дои:10.1128 / MMBR.57.2.434-450.1993. ЧВК 372918. PMID 8336674.
- ^ Баррангу Р., Фремо С., Дево Х., Ричардс М., Боявал П., Муано С., Ромеро Д. А., Хорват П. (март 2007 г.). «CRISPR обеспечивает приобретенную устойчивость к вирусам у прокариот». Наука. 315 (5819): 1709–12. Bibcode:2007Научный ... 315.1709B. Дои:10.1126 / science.1138140. HDL:20.500.11794/38902. PMID 17379808. S2CID 3888761.
- ^ Браунс С.Дж., Джор М.М., Лундгрен М., Вестра Э.Р., Слайкхейс Р.Дж., Снидерс А.П., Дикман М.Дж., Макарова К.С., Кунин Е.В., ван дер Ост Дж. (Август 2008 г.). «Малые РНК CRISPR направляют противовирусную защиту прокариот». Наука. 321 (5891): 960–64. Bibcode:2008Sci ... 321..960B. Дои:10.1126 / science.1159689. ЧВК 5898235. PMID 18703739.
- ^ Hille F, Charpentier E (ноябрь 2016 г.). «CRISPR-Cas: биология, механизмы и актуальность». Философские труды Лондонского королевского общества. Серия B, Биологические науки. 371 (1707): 20150496. Дои:10.1098 / rstb.2015.0496. ЧВК 5052741. PMID 27672148.
- ^ Кунин Е.В. (февраль 2017 г.). «Эволюция систем антивирусной защиты, управляемых РНК и ДНК, у прокариот и эукариот: общее происхождение против конвергенции». Биология Директ. 12 (1): 5. Дои:10.1186 / s13062-017-0177-2. ЧВК 5303251. PMID 28187792.
- ^ Бейн CJ (2003). «Происхождение и эволюционные отношения между врожденными и адаптивными ветвями иммунной системы». Интегр. Комп. Биол. 43 (2): 293–99. Дои:10.1093 / icb / 43.2.293. PMID 21680436.
- ^ Страм Ю., Кузнцова Л. (июнь 2006 г.). «Ингибирование вирусов посредством РНК-интерференции». Гены вирусов. 32 (3): 299–306. Дои:10.1007 / s11262-005-6914-0. ЧВК 7088519. PMID 16732482.
- ^ а б Шнайдер Д. «Врожденный иммунитет - Лекция 4: Иммунные реакции растений» (PDF). Стэнфордский университет, факультет микробиологии и иммунологии. Получено 1 января 2007.
- ^ Джонс Дж. Д., Дангл Дж. Л. (ноябрь 2006 г.). «Иммунная система растений». Природа. 444 (7117): 323–29. Bibcode:2006Натура.444..323J. Дои:10.1038 / природа05286. PMID 17108957.
- ^ Баулкомб Д. (сентябрь 2004 г.). «Подавление РНК в растениях». Природа. 431 (7006): 356–63. Bibcode:2004Натура 431..356Б. Дои:10.1038 / природа02874. PMID 15372043. S2CID 4421274.
- ^ Альдер М.Н., Рогозин И.Б., Иер Л.М., Глазко Г.В., Купер М.Д., Пансер З. (декабрь 2005 г.). «Разнообразие и функции адаптивных иммунных рецепторов у безчелюстных позвоночных». Наука. 310 (5756): 1970–73. Bibcode:2005Наука ... 310.1970А. Дои:10.1126 / science.1119420. PMID 16373579.
- ^ а б Finlay BB, McFadden G (февраль 2006 г.). «Антииммунология: уклонение иммунной системы хозяина от бактериальных и вирусных патогенов». Клетка. 124 (4): 767–82. Дои:10.1016 / j.cell.2006.01.034. PMID 16497587. S2CID 15418509.
- ^ Чианчиотто Н.П. (декабрь 2005 г.). «Секреция типа II: система секреции белка на все времена года». Тенденции в микробиологии. 13 (12): 581–88. Дои:10.1016 / j.tim.2005.09.005. PMID 16216510.
- ^ Уинстенли С., Харт, Калифорния (февраль 2001 г.). «Системы секреции III типа и острова патогенности». Журнал медицинской микробиологии. 50 (2): 116–26. Дои:10.1099/0022-1317-50-2-116. PMID 11211218.
- ^ Finlay BB, Falkow S (июнь 1997 г.). «Возвращение к общим темам микробной патогенности». Обзоры микробиологии и молекулярной биологии. 61 (2): 136–69. Дои:10.1128/.61.2.136-169.1997. ЧВК 232605. PMID 9184008.
- ^ Кобаяши Х (2005). «Биопленки дыхательных путей: значение для патогенеза и терапии инфекций дыхательных путей». Лечение респираторной медицины. 4 (4): 241–53. Дои:10.2165/00151829-200504040-00003. PMID 16086598. S2CID 31788349.
- ^ Housden NG, Harrison S, Roberts SE, Beckingham JA, Graille M, Stura E, Gore MG (июнь 2003 г.). «Иммуноглобулин-связывающие домены: белок L из Peptostreptococcus magnus». Сделки биохимического общества. 31 (Pt 3): 716–18. Дои:10.1042 / BST0310716. PMID 12773190. S2CID 10322322.
- ^ Бертон Д. Р., Стэнфилд Р. Л., Уилсон И. А. (октябрь 2005 г.). «Антитела против ВИЧ в столкновении эволюционных титанов». Труды Национальной академии наук Соединенных Штатов Америки. 102 (42): 14943–48. Bibcode:2005ПНАС..10214943Б. Дои:10.1073 / pnas.0505126102. ЧВК 1257708. PMID 16219699.
- ^ Тейлор Дж. Э., Руденко Г. (ноябрь 2006 г.). «Смена куртки из трипаносом: что в шкафу?». Тенденции в генетике. 22 (11): 614–20. Дои:10.1016 / j.tig.2006.08.003. PMID 16908087.
- ^ Кантин Р., Метот С., Тремблей М.Дж. (июнь 2005 г.). «Грабёж и безбилетные пассажиры: включение клеточных белков вирусами в оболочке». Журнал вирусологии. 79 (11): 6577–87. Дои:10.1128 / JVI.79.11.6577-6587.2005. ЧВК 1112128. PMID 15890896.
- ^ а б "Нобелевская премия по физиологии и медицине 1908 г.". Нобелевская премия. Получено 8 января 2007.
- ^ Retief FP, Cilliers L (январь 1998 г.). «Эпидемия в Афинах, 430–426 гг. До н.э.». Южноафриканский медицинский журнал = Suid-Afrikaanse Tydskrif vir Geneeskunde. 88 (1): 50–53. PMID 9539938.
- ^ Остоя П (1954). "Maupertuis et la biologie". Revue d'histoire des Sciences et de leurs Applications. 7 (1): 60–78. Дои:10.3406 / справа.1954.3379.
- ^ Доэрти М., Робертсон М.Дж. (декабрь 2004 г.). «Некоторые ранние тенденции в иммунологии». Тенденции в иммунологии. 25 (12): 623–31. Дои:10.1016 / j.it.2004.10.008. PMID 15530829.
- ^ Сильверштейн 1989, п. 6.
- ^ Сильверштейн 1989, п. 7.
- ^ Плоткин С.А. (апрель 2005 г.). «Вакцины: прошлое, настоящее и будущее». Природа Медицина. 11 (4 Suppl): S5–11. Дои:10,1038 / нм1209. ЧВК 7095920. PMID 15812490.
- ^ Нобелевская премия по физиологии и медицине 1905 г. Nobelprize.org, проверено 8 января 2009 г.
- ^ Майор Уолтер Рид, Медицинский корпус, Армия США Медицинский центр армии Уолтера Рида. Проверено 8 января 2007 года.
- ^ Мечников Э. (1905). Иммунитет при инфекционных заболеваниях (Полнотекстовая версия: Интернет-архив). Перевод Бинни Ф.Г. Издательство Кембриджского университета. LCCN 68025143.
история гуморального иммунитета.
- ^ "Нильс К. Йерн". Нобелевская премия. Получено 27 ноября 2020.
- ^ Юделл Дж. (4 октября 2003 г.). "Он поместил идентификатор в идиотип". Отчеты EMBO (Рецензия на книгу). 4 (10): 931. Дои:10.1038 / sj.embor.embor951. ЧВК 1326409.
Библиография
- Альбертс Б., Джонсон А., Льюис Дж, Рафф М., Робертс К., Уолтерс П. (2002). Молекулярная биология клетки (Четвертое изд.). Нью-Йорк и Лондон: Наука о гирляндах. ISBN 978-0-8153-3218-3.
- Берток Л., Чоу Д., ред. (2005). Естественный иммунитет. 5 (1-е изд.). ISBN 978-0-44451-755-5.
- Ирити М (2019). Врожденный иммунитет растений 2.0. Базель: MDPI. Дои:10.3390 / books978-3-03897-581-6. ISBN 978-3-03897-580-9. OCLC 1105775088.
- Ciccone CD (2015). Фармакология в реабилитации (современные перспективы реабилитации) (5-е изд.). Компания F.A. Davis. ISBN 978-0-80364-029-0.
- Джейнвей, Калифорния, Трэверс П., Уолпорт М. (2001). Иммунобиология (5-е изд.). Наука о гирляндах.
- Джейнвей, Калифорния (2005). Иммунобиология (6-е изд.). Наука о гирляндах. ISBN 0-443-07310-4.
- Кришнасвами Г., Аджитави О., Чи Д.С. (2006). «Тучные клетки человека: обзор». Тучные клетки. Методы молекулярной биологии. 315. С. 13–34. Дои:10.1385/1-59259-967-2:013. ISBN 1-59259-967-2. PMID 16110146.
- Мерфи К., Уивер К. (2016). Иммунобиология (9-е изд.). Наука о гирляндах. ISBN 978-0-8153-4505-3.
- Раджалингам Р. (2012). Иммуногенетика. Методы молекулярной биологии. Методы молекулярной биологии ™. 882. С. 391–414. Дои:10.1007/978-1-61779-842-9_23. ISBN 978-1-61779-841-2. PMID 22665247.
- Рис Дж (2011). Кэмпбелл биология. Frenchs Forest, N.S.W: Pearson Australia. ISBN 978-1-4425-3176-5. OCLC 712136178.
- Сильверштейн AM (1989). История иммунологии. Академическая пресса. ISBN 978-0-08-092583-7.
- Сомпайрак Л. (2019). Как работает иммунная система. Хобокен, Нью-Джерси: Уайли-Блэквелл. ISBN 978-1-119-54212-4. OCLC 1083261548.
- Ствртинова В., Якубовский Ю., Хулин И. (1995). Патофизиология: принципы болезни. Вычислительный центр Словацкой академии наук: Academic Electronic Press.
- Wira CR, Crane-Godreau M, Grant K (2004). Ogra PL, Mestecky J, Lamm ME, Strober W, McGhee JR, Bienenstock J (ред.). Иммунология слизистой оболочки. Сан-Франциско: Эльзевьер. ISBN 0-12-491543-4.
внешняя ссылка
| Библиотечные ресурсы о Иммунная система |
- Электронный учебник микробиологии и иммунологии - от Университет Южной Каролины Школа медицины (уровень бакалавриата)

