Fas лиганд - Fas ligand
Fas лиганд (FasL или CD95 L или CD178) является типом II трансмембранный белок что принадлежит фактор некроза опухоли (TNF) семья. Его связывание с его рецептором вызывает апоптоз. Взаимодействия Fas-лиганд / рецептор играют важную роль в регуляции иммунная система и развитие рак.
Структура
Fas-лиганд или FasL представляет собой гомотримерный трансмембранный белок типа II, экспрессируемый на цитотоксические Т-лимфоциты. Он сигнализирует о тримеризации FasR, который охватывает мембрану «целевой» клетки. Эта тримеризация обычно приводит к апоптозу или гибели клеток.
Растворимый лиганд Fas образуется за счет расщепления связанного с мембраной FasL в консервативном сайте расщепления внешним матричная металлопротеиназа ММП-7.
Рецепторы
- FasR: The Рецептор Fas (FasR ), или CD95, является наиболее изученным членом семейства рецепторов смерти. Ген расположен на хромосома 10 у человека и 19 у мышей. Предыдущие отчеты идентифицировали целых восемь вариантов сварки, которые переведены в семь изоформы белка. Многие из этих изоформ встречаются редко. гаплотипы которые обычно связаны с болезненным состоянием. Рецептор Fas, вызывающий апоптоз, получил название изоформы 1 и относится к типу 1. трансмембранный белок. Он состоит из трех цистеин -богатые псевдоповторы, трансмембранный домен и внутриклеточный домен гибели.
- DcR3: Рецептор-ловушка 3 (DcR3 ) является недавно обнаруженным рецептором-приманкой фактор некроза опухоли суперсемейство, связывающееся с FasL, СВЕТ, и TL1A. DcR3 - растворимый рецептор, не имеющий преобразование сигнала возможности (отсюда и «приманка») и функции по предотвращению FasR -FasL взаимодействия путем конкурентного связывания с мембраносвязанным лигандом Fas и превращения их в неактивные.[5]
Передача сигналов клетки
Fas формирует сигнальный комплекс, вызывающий смерть (DISC) при связывании лиганда. Заякоренный в мембране тример лиганда Fas на поверхности соседней клетки вызывает тримеризацию рецептора Fas. Это событие также имитируется связыванием агонистического Fas антитело, хотя некоторые данные свидетельствуют о том, что апоптотический сигнал, индуцированный антителом, ненадежен при изучении передачи сигналов Fas. С этой целью было использовано несколько умных способов тримеризации антитела для исследования in vitro.
После последующего область смерти (DD), рецепторный комплекс интернализуется через клеточный эндосомный аппарат. Это позволяет молекуле адаптера Fas-ассоциированная область смерти (FADD), чтобы связать домен смерти Fas через его собственный домен смерти. FADD также содержит эффекторный домен смерти (DED) рядом с его амино-концом, что облегчает связывание с DED FADD -подобный ДВС (FLICE ), чаще называемый каспаза-8. Затем FLICE может самоактивироваться посредством протеолитического расщепления на субъединицы p10 и p18, две из которых образуют активный фермент гетеротетрамер. Затем активная каспаза-8 высвобождается из DISC в цитозоль, где она расщепляет другие эффекторные каспазы, что в конечном итоге приводит к деградации ДНК, образованию пузырей на мембранах и другим признакам апоптоза.
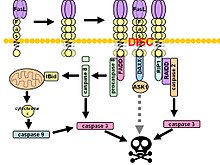
В некоторых сообщениях предполагается, что внешнего пути Fas достаточно для индукции полного апоптоза в определенных типах клеток посредством сборки DISC и последующей активации каспазы-8. Эти клетки называются клетками 1-го типа и характеризуются неспособностью антиапоптотических членов Bcl-2 семейство (а именно Bcl-2 и Bcl-xL ) для защиты от Fas-опосредованного апоптоза. Характерные клетки типа 1 включают H9, CH1, SKW6.4 и SW480, все из которых являются линиями лимфоцитов, за исключением последней, которая относится к линии аденокарциномы толстой кишки.
Доказательства перекрестного взаимодействия между внешними и внутренними путями существуют в сигнальном каскаде Fas. В большинстве типов клеток каспаза-8 катализирует расщепление проапоптотических BH3 -только белок Ставка в усеченном виде, tBid. Только BH-3 члены семейства Bcl-2 взаимодействуют исключительно с антиапоптотическими членами семейства (Bcl-2, Bcl-xL), что позволяет Бак и Bax перемещаться на внешнюю митохондриальную мембрану, тем самым повышая ее проницаемость и облегчая высвобождение проапоптотических белков, таких как цитохром с и Smac / DIABLO, антагонист ингибиторов белков апоптоза (ИПД ).
Растворимый FasL менее активен, чем его мембраносвязанный аналог, и не вызывает тримеризации рецепторов и ДИСК формирование.
Функции

Апоптоз запускается связыванием лиганда Fas-Fas, играет фундаментальную роль в регуляции иммунная система. В его функции входят:
- Т-клетка гомеостаз: активация Т-клетки приводит к их экспрессии лиганда Fas. Т-клетки изначально устойчивы к Fas-опосредованному апоптозу во время клональной экспансии, но становятся все более чувствительными, чем дольше они активируются, что в конечном итоге приводит к вызванная активацией смерть клетки (AICD). Этот процесс необходим для предотвращения чрезмерного иммунного ответа и устранения аутореактивных Т-клеток. У людей и мышей с вредными мутациями лиганда Fas или Fas развивается накопление аберрантных Т-клеток, что приводит к лимфаденопатия, спленомегалия, и Красная волчанка.
- Цитотоксические Т-клетки Мероприятия: Fas-индуцированный апоптоз и перфорин пути - два основных механизма, с помощью которых цитотоксические Т-лимфоциты вызвать гибель клеток в клетках, экспрессирующих чужеродные антигены.[6]
- Иммунная привилегия: Клетки в привилегированных иммунных зонах, таких как роговица или яички экспрессируют лиганд Fas и вызывают апоптоз инфильтрации лимфоциты. Это один из многих механизмов, используемых организмом для создания и поддержания иммунных привилегий.
- Материнская терпимость: Fas-лиганд может играть важную роль в предотвращении обмена лейкоцитами между матерью и плодом, хотя дефекты беременности еще не были связаны с неисправной системой Fas-Fas-лигандов.
- Контратака опухоли: Опухоли могут чрезмерно экспрессировать лиганд Fas и вызывать апоптоз проникновения лимфоциты, позволяя опухоли избежать воздействия иммунная реакция.[7] Повышающая регуляция лиганда Fas часто происходит после химиотерапия, из которых опухолевые клетки достигли апоптоз сопротивление.
Роль в болезни
Дефектный Fas-опосредованный апоптоз может привести к онкогенез а также лекарственная устойчивость в существующих опухолях. Мутация зародышевой линии Fas связана с аутоиммунный лимфопролиферативный синдром (ALPS), детское заболевание апоптоза.
Увеличение Fas-опосредованной передачи сигналов было вовлечено в патологию с низким риском. миелодиспластические синдромы (МДС)[8] и глиобластома.[9]
Совсем недавно, FasL-опосредованный апоптоз Т-клеток также был предложен как иммуно-ускользающий механизм, с помощью которого опухоли могут подавлять инфильтрацию Т-клеток, подобно ингибирующим иммунным контрольным точкам, таким как ПД-1 и CTLA-4.[10][11][12]
Клиническое значение
Терапевтическое обоснование подавления передачи сигналов Fas в контексте глиобластома и миелодиспластические синдромы (MDS) привели к развитию слитого белка Fas какунерцепт (APG101 ), который в настоящее время находится в стадии клинической разработки по этим показаниям.
Взаимодействия
Было показано, что лиганд Fas взаимодействовать с участием:
Смотрите также
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000117560 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск ансамбля 89: ENSMUSG00000000817 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Шейх М.С., Форнас А.Дж. (2000). «Рецепторы смерти и приманки и р53-опосредованный апоптоз». Лейкемия. 14 (8): 1509–1513. Дои:10.1038 / sj.leu.2401865. PMID 10942251.
- ^ Андерсен MH, Schrama D, Thor Straten P, Becker JC (2006). «Цитотоксические Т-клетки». J. Invest. Дерматол. 126 (1): 32–41. Дои:10.1038 / sj.jid.5700001. PMID 16417215.
- ^ Игни Ф. Х., Краммер PH (2005). «Контратака опухоли: факт или вымысел?». Cancer Immunol. Immunother. 54 (11): 1127–1136. Дои:10.1007 / s00262-005-0680-7. PMID 15889255. S2CID 19331352.
- ^ Claessens YE, Bouscary D, Dupont JM, Picard F, Melle J, Gisselbrecht S, Lacombe C, Dreyfus F, Mayeux P, Fontenay-Roupie M (2002). «Пролиферация in vitro и дифференциация эритроидных предшественников от пациентов с миелодиспластическими синдромами: доказательства Fas-зависимого апоптоза». Кровь. 99 (5): 1591–601. Дои:10.1182 / кровь.V99.5.1594. PMID 11861273.
- ^ Татибана О, Накадзава Х., Лампе Дж., Ватанабэ К., Клейхуес П., Огаки Х (1995). «Экспрессия Fas / APO-1 во время прогрессирования астроцитом». Рак Res. 55 (23): 5528–30. PMID 7585627.
- ^ Motz GT, Santoro SP, Wang LP, Garrabrant T, Lastra RR, Hagemann IS, Lal P, Feldman MD, Benencia F, Coukos G (2014). «Эндотелий опухоли FasL создает избирательный иммунный барьер, способствующий толерантности опухолей». Нат Мед. 20 (6): 607–15. Дои:10,1038 / нм.3541. ЧВК 4060245. PMID 24793239.
- ^ Чжу Дж., Повис де Тенбосше К.Г., Кане С., Колау Д., ван Барен Н., Луркин С., Шмитт-Ферхюльст А.М., Лильестрем П., Юттенхове С., Ван ден Эйнде Б.Дж. (2017). «Устойчивость к иммунотерапии рака, опосредованная апоптозом инфильтрирующих опухоль лимфоцитов». Nat Commun. 8 (1): 1404. Дои:10.1038 / s41467-017-00784-1. ЧВК 5680273. PMID 29123081.
- ^ Лакинс М.А., Горани Э., Мунир Х., Мартинс С.П., Шилдс Д.Д. (2018). «Связанные с раком фибробласты индуцируют антиген-специфическую делецию CD8 + Т-клеток для защиты опухолевых клеток». Nat Commun. 9 (1): 948. Дои:10.1038 / s41467-018-03347-0. ЧВК 5838096. PMID 29507342.
- ^ а б c d Гаджате С., Моллинедо Ф. (март 2005 г.). «Цитоскелет-опосредованный рецептор смерти и концентрация лиганда в липидных рафтах образуют кластеры, способствующие апоптозу при химиотерапии рака». J. Biol. Chem. 280 (12): 11641–7. Дои:10.1074 / jbc.M411781200. PMID 15659383.
- ^ а б c Мишо О., Чопп Дж. (Июль 2003 г.). «Индукция апоптоза, опосредованного рецептором TNF I, посредством двух последовательных сигнальных комплексов» (PDF). Ячейка. 114 (2): 181–90. Дои:10.1016 / с0092-8674 (03) 00521-х. PMID 12887920. S2CID 17145731.
- ^ Парлато С., Джаммариоли А.М., Логоцци М., Лозупоне Ф., Матаррезе П., Лучиани Ф., Фальчи М., Малорни В., Фейс С. (октябрь 2000 г.). «Связывание CD95 (APO-1 / Fas) с актиновым цитоскелетом через эзрин в Т-лимфоцитах человека: новый регуляторный механизм апоптотического пути CD95». EMBO J. 19 (19): 5123–34. Дои:10.1093 / emboj / 19.19.5123. ЧВК 302100. PMID 11013215.
- ^ а б c Гадими М.П., Санзенбахер Р., Тиде Б., Венцель Дж., Цзин К., Пломанн М., Боркхардт А., Кабелиц Д., Янссен О. (май 2002 г.). «Идентификация партнеров по взаимодействию цитозольной полипролиновой области лиганда CD95 (CD178)». FEBS Lett. 519 (1–3): 50–8. Дои:10.1016 / s0014-5793 (02) 02709-6. PMID 12023017. S2CID 26765451.
- ^ а б Венцель Дж., Санценбахер Р., Гадими М., Левицки М., Чжоу К., Каплан Д. Р., Кабелиц Д., Феллер С. М., Янссен О. (декабрь 2001 г.). «Множественные взаимодействия цитозольной полипролиновой области лиганда CD95: намек на способность фактора смерти передавать обратный сигнал». FEBS Lett. 509 (2): 255–62. Дои:10.1016 / с0014-5793 (01) 03174-х. PMID 11741599. S2CID 33084576.
- ^ Hane M, Lowin B, Peitsch M, Becker K, Tschopp J (октябрь 1995 г.). «Взаимодействие пептидов, полученных из лиганда Fas, с доменом Fyn-SH3». FEBS Lett. 373 (3): 265–8. Дои:10.1016 / 0014-5793 (95) 01051-ф. PMID 7589480. S2CID 24130275.
- ^ Starling GC, Bajorath J, Emswiler J, Ledbetter JA, Aruffo A, Kiener PA (апрель 1997 г.). «Идентификация аминокислотных остатков, важных для связывания лиганда с Fas». J. Exp. Med. 185 (8): 1487–92. Дои:10.1084 / jem.185.8.1487. ЧВК 2196280. PMID 9126929.
- ^ Schneider P, Bodmer JL, Holler N, Mattmann C, Scuderi P, Terskikh A, Peitsch MC, Tschopp J (июль 1997 г.). «Характеристика взаимодействия Fas (Apo-1, CD95) -Fas лиганд». J. Biol. Chem. 272 (30): 18827–33. Дои:10.1074 / jbc.272.30.18827. PMID 9228058.
- ^ Ю К.Ю., Квон Б., Ни Дж., Чжай Ю., Эбнер Р., Квон Б.С. (май 1999 г.). «Недавно идентифицированный член суперсемейства рецепторов фактора некроза опухоли (TR6) подавляет LIGHT-опосредованный апоптоз». J. Biol. Chem. 274 (20): 13733–6. Дои:10.1074 / jbc.274.20.13733. PMID 10318773.
- ^ Hsu TL, Chang YC, Chen SJ, Liu YJ, Chiu AW, Chio CC, Chen L, Hsieh SL (май 2002 г.). «Модуляция дифференцировки и созревания дендритных клеток с помощью рецептора-ловушки 3». J. Immunol. 168 (10): 4846–53. Дои:10.4049 / jimmunol.168.10.4846. PMID 11994433.
- ^ Питти Р.М., Марстерс С.А., Лоуренс Д.А., Рой М., Кишкель ФК, Дауд П., Хуанг А., Донахью С.Дж., Шервуд С.В., Болдуин Д.Т., Годовски П.Дж., Вуд В.И., Герни А.Л., Хиллан К.Дж., Коэн Р.Л., Годдард А.Д., Ботштейн Д. , Ашкенази А (декабрь 1998 г.). «Геномная амплификация рецептора-приманки для лиганда Fas при раке легких и толстой кишки». Природа. 396 (6712): 699–703. Дои:10.1038/25387. PMID 9872321. S2CID 4427455.
дальнейшее чтение
- Чой С., Бенвенисте Э. Н. (январь 2004 г.). «Fas-лиганд / Fas-система в головном мозге: регулятор иммунных и апоптотических реакций». Brain Res. Brain Res. Rev. 44 (1): 65–81. Дои:10.1016 / j.brainresrev.2003.08.007. PMID 14739003. S2CID 46587211.
- Толструп М., Остергард Л., Лаурсен А.Л., Педерсен С.Ф., Дуч М. (2004). «Ускользание от иммунного надзора за ВИЧ / ВИП: внимание на Неф». Curr. ВИЧ Res. 2 (2): 141–51. Дои:10.2174/1570162043484924. PMID 15078178.
внешние ссылки
- GeneReviews / NCBI / NIH / UW запись об аутоиммунном лимфопролиферативном синдроме
- Онлайн-менделевское наследование в человеке (OMIM): 601859
- Fas + лиганд + белок в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Обзор всей структурной информации, доступной в PDB для UniProt: P48023 (Член суперсемейства лиганд фактора некроза опухоли 6) на PDBe-KB.