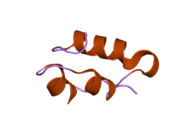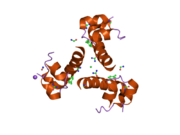Инсулин - Википедия - Insulin

Инсулин (/ˈɪп.sjʊ.лɪп/,[5][6] из латинский островок, 'остров') пептидный гормон произведено бета-клетки из островки поджелудочной железы; считается основным анаболический гормон тела.[7] Он регулирует метаболизм из углеводы, жиры и белок путем содействия абсорбции глюкоза из крови в печень, толстый и скелетные мышцы клетки.[8] В этих тканях поглощенная глюкоза превращается либо в гликоген через гликогенез или же жиры (триглицериды ) через липогенез, или, в случае печени, в оба.[8] Глюкоза производство и секреция со стороны печени сильно подавляется высокими концентрациями инсулина в крови.[9] Циркулирующий инсулин также влияет на синтез белков в самых разных тканях. Таким образом, это анаболический гормон, способствующий превращению небольших молекул в крови в большие молекулы внутри клеток. Низкий уровень инсулина в крови имеет противоположный эффект, способствуя распространению катаболизм, особенно запас жира в организме.
Бета-клетки чувствительны к уровень сахара в крови чтобы они секретировали инсулин в кровь в ответ на высокий уровень глюкозы; и подавляют секрецию инсулина при низком уровне глюкозы.[10] Инсулин усиливает усвоение глюкозы и метаболизм в клетках, тем самым снижая уровень сахара в крови. Их соседние альфа-клетки, принимая их сигналы от бета-клеток,[10] выделять глюкагон в кровь наоборот: повышенная секреция при низком уровне глюкозы в крови и пониженная секреция при высоких концентрациях глюкозы. Глюкагон повышает уровень глюкозы в крови, стимулируя гликогенолиз и глюконеогенез в печени.[8][10] Секреция инсулина и глюкагона в кровь в ответ на концентрацию глюкозы в крови является основным механизмом гомеостаз глюкозы.[10]
Снижение или отсутствие активности инсулина приводит к сахарному диабету, состоянию высокого уровня сахара в крови (гипергликемии). Есть два типа болезни. В сахарный диабет 1 типа, бета-клетки разрушаются аутоиммунная реакция так что инсулин больше не может синтезироваться или секретироваться в кровь.[11] В сахарный диабет 2 типа, разрушение бета-клеток менее выражено, чем при диабете 1 типа, и не связано с аутоиммунным процессом. Вместо этого происходит накопление амилоид в островках поджелудочной железы, что, вероятно, нарушает их анатомию и физиологию.[10] В патогенез диабета 2 типа еще не до конца изучены, но известно, что в этом участвуют уменьшение популяции островковых бета-клеток, снижение секреторной функции выживающих островковых бета-клеток и инсулинорезистентность периферических тканей.[7] Диабет 2 типа характеризуется повышенной секрецией глюкагона, которая не зависит от концентрации глюкозы в крови и не реагирует на нее. Но инсулин по-прежнему секретируется в кровь в ответ на уровень глюкозы в крови.[10] В результате в крови накапливается глюкоза.
Белок человеческого инсулина состоит из 51 аминокислоты, и имеет молекулярная масса из 5808 Да. Это гетеродимер A-цепи и B-цепи, которые связаны вместе дисульфидные связи. Структура инсулина незначительно варьируется между разновидность животных. Инсулин животного происхождения несколько отличается по эффективности (в углеводный обмен эффекты) человеческого инсулина из-за этих изменений. Свиной инсулин особенно близок к человек версия и широко использовалась для лечения диабета 1 типа до того, как человеческий инсулин можно было производить в больших количествах с помощью рекомбинантная ДНК технологии.[12][13][14][15]
Инсулин был первым открытым пептидным гормоном.[16] Фредерик Бантинг и Чарльз Герберт Бест, работая в лаборатории J.J.R. Macleod на Университет Торонто, были первыми, кто выделил инсулин из поджелудочной железы собак в 1921 году. Фредерик Сэнгер секвенировал аминокислотную структуру в 1951 году, что сделало инсулин первым полностью секвенированным белком.[17] В Кристальная структура инсулина в твердом состоянии определяли Дороти Ходжкин в 1969 году. Инсулин также является первым белком, который был химически синтезирован и произведен Технология рекомбинантной ДНК.[18] Это на Примерный перечень основных лекарственных средств ВОЗ, наиболее важные лекарства, необходимые для система здоровья.[19]
Эволюция и распространение видов
Возможно, инсулин появился более миллиарда лет назад.[20] Молекулярное происхождение инсулина восходит как минимум к простейшему одноклеточному эукариоты.[21] Помимо животных, инсулиноподобные белки также известны в царствах грибов и протистов.[20]
Инсулин производится бета-клетки из островки поджелудочной железы у большинства позвоночных и Тело Brockmann в некоторых костистая рыба.[22] Конические улитки Conus geographus и Conus tulipa, ядовитые морские улитки, которые охотятся на мелкую рыбу, используют модифицированные формы инсулина в своих коктейлях из яда. Токсин инсулина, более близкий по структуре к инсулину рыб, чем к естественному инсулину улиток, замедляет добычу рыб, снижая уровень глюкозы в их крови.[23][24]
Ген
В препроинсулин предшественник инсулина кодируется INS ген, который расположен на хромосоме 11p15.5.[25][26] У некоторых млекопитающих, таких как крысы и мыши, есть два гена инсулина, один из которых является гомологом большинства генов млекопитающих (Ins2), а другой из которых является ретропозированной копией, которая включает последовательность промотора, но в которой отсутствует интрон (Ins1). Оба гена инсулина грызунов функциональны.[27][28]
Аллели
разновидность мутанта аллели с изменениями в кодирующей области не выявлено. А читающий ген INS-IGF2 перекрывается с этим геном в 5'-области и с геном IGF2 в 3'-области.[25]
Регулирование
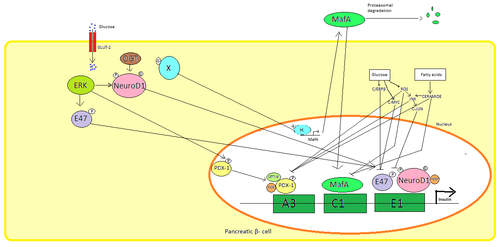
В поджелудочной β клетки, глюкоза является основным физиологическим стимулом для регуляции синтеза инсулина. Инсулин в основном регулируется через факторы транскрипции PDX1, NeuroD1, и MafA.[29][30][31][32]
Во время состояния с низким содержанием глюкозы PDX1 (белок 1 гомеобокса поджелудочной железы и двенадцатиперстной кишки) располагается на периферии ядра в результате взаимодействия с HDAC1 и 2,[33] что приводит к снижению секреции инсулина.[34] Увеличение крови глюкоза уровни причины фосфорилирование из PDX1, что приводит к ядерной транслокации и связыванию элемента A3 в промоторе инсулина.[35] При транслокации взаимодействует с коактиваторами. Шляпа p300 и SETD7. PDX1 влияет на гистон модификации через ацетилирование и деацетилирование, а также метилирование. Также говорят, что он подавляет глюкагон.[36]
NeuroD1, также известный как β2, регулирует экзоцитоз инсулина в поджелудочной железе. β клетки непосредственно вызывая выражение гены участвует в экзоцитозе.[37] Он локализован в цитозоль, но в ответ на высокий глюкоза это становится гликозилированный к OGT и / или фосфорилированный к ERK, что вызывает перемещение в ядро. В ядре β2 гетеродимеризуется с E47, связывается с элементом E1 промотора инсулина и привлекает коактиватор p300 который ацетилирует β2. Он способен взаимодействовать с другими факторами транскрипции, а также при активации гена инсулина.[37]
MafA деградирует протеасомы при низкой крови глюкоза уровни. Повышенный уровень глюкоза сделать неизвестный белок гликозилированный. Этот белок работает как фактор транскрипции для MafA неизвестным образом и MafA вывозится из клетки. MafA затем перемещается обратно в ядро, где связывается с элементом C1 промотора инсулина.[38][39]
Эти факторы транскрипции работают синергетически и в сложной структуре. Повышенная кровь глюкоза может через некоторое время разрушить связывающую способность этих белков и, следовательно, уменьшить количество секретируемого инсулина, вызывая сахарный диабет. Снижение связывающей активности может быть опосредовано: глюкоза индуцированный окислительный стресс и антиоксиданты говорят, что предотвращают снижение секреции инсулина в глюкотоксических панкреатических β клетки. Сигнальные молекулы стресса и активные формы кислорода ингибирует ген инсулина, вмешиваясь в кофакторы, связывающие факторы транскрипции, и сами факторы транскрипции.[40]
Несколько регуляторные последовательности в промоутер область гена человеческого инсулина связывается с факторы транскрипции. В целом А-боксы связываются с Pdx1 факторы, Электронные коробки связываются с NeuroD, C-блоки связываются с MafA, и элементы ответа cAMP к CREB. Это также глушители которые подавляют транскрипцию.
| Нормативная последовательность | привязка факторы транскрипции |
|---|---|
| ILPR | Par1 |
| A5 | Pdx1 |
| негативный регулирующий элемент (NRE)[42] | рецептор глюкокортикоидов, 1 октября |
| Z (перекрывая NRE и C2) | ISF |
| C2 | Pax4, MafA (?) |
| E2 | USF1 /USF2 |
| A3 | Pdx1 |
| CREB RE | CREB, CREM |
| A2 | – |
| Связывание энхансера CAAT (CEB) (частично перекрывая A2 и C1) | – |
| C1 | – |
| E1 | E2A, NeuroD1, HEB |
| A1 | Pdx1 |
| G1 | – |
Структура

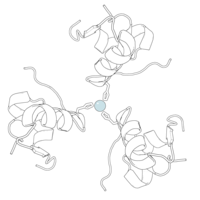
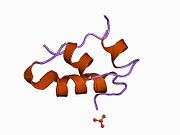
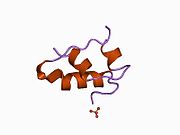
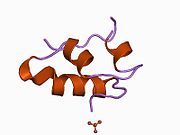
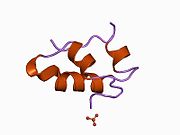
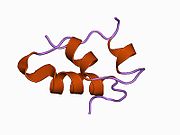
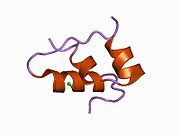
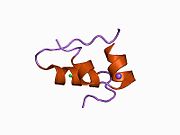
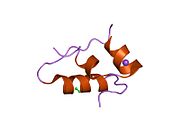
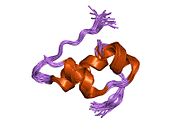
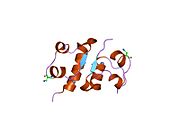
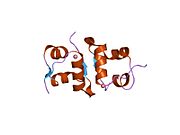
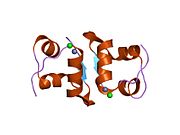
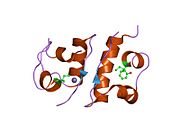
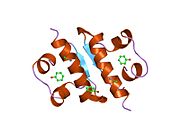
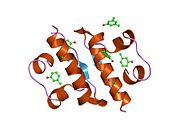
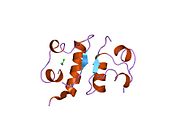
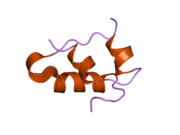
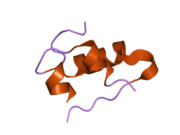
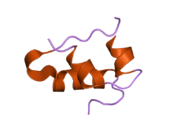
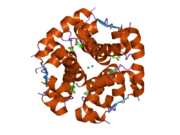
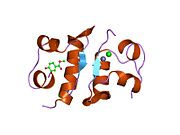
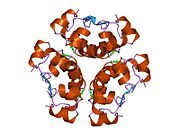
Вопреки первоначальному мнению, что гормоны, как правило, представляют собой небольшие химические молекулы, как первый пептидный гормон, известный о его структуре, инсулин оказался довольно большим.[16] Единый белок (мономер) человеческого инсулина состоит из 51 аминокислоты, и имеет молекулярная масса из 5808 Да. В молекулярная формула человеческого инсулина составляет C257ЧАС383N65О77S6.[43] Это комбинация двух пептидных цепей (димер ) назвал A-цепь и B-цепь, которые связаны между собой двумя дисульфидные связи. A-цепь состоит из 21 аминокислоты, а B-цепь состоит из 30 остатков. Связывающие (межцепочечные) дисульфидные связи образуются у остатков цистеина между положениями A7-B7 и A20-B19. Между остатками цистеина в положениях A6 и A11 существует дополнительная (внутрицепочечная) дисульфидная связь внутри A-цепи. A-цепь имеет две -спиральные области A1-A8 и A12-A19, которые антипараллельны; в то время как цепь B имеет центральную α-спираль (покрывающую остатки B9-B19), фланкированную дисульфидной связью с обеих сторон, и два β-листа (покрывающие B7-B10 и B20-B23).[16][44]
Аминокислотная последовательность инсулина сильно консервированный и лишь незначительно варьируется между видами. Бычий инсулин отличается от человеческого всего тремя аминокислота остатки и свинья инсулин в одном. Даже инсулин некоторых видов рыб достаточно похож на человеческий, чтобы быть клинически эффективным для человека. Инсулин у некоторых беспозвоночных очень похож по последовательности на человеческий инсулин и имеет сходные физиологические эффекты. Сильная гомология, наблюдаемая в последовательности инсулина у различных видов, предполагает, что он сохранялся на протяжении большей части истории эволюции животных. С-пептид проинсулин однако между видами отличается гораздо больше; это тоже гормон, но вторичный.[44]
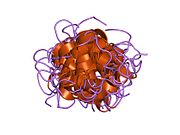
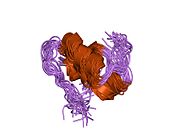
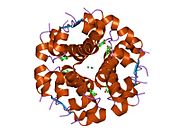
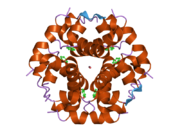
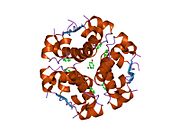
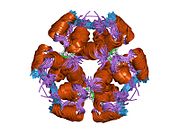
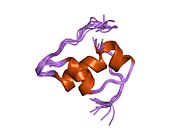
Инсулин вырабатывается и хранится в организме в виде гексамера (единицы из шести молекул инсулина), в то время как активной формой является мономер. Размер гексамера составляет около 36000 Да. Шесть молекул соединены вместе как три димерных единицы, образуя симметричную молекулу. Важной особенностью является наличие атомов цинка (Zn2+) на оси симметрии, которые окружены тремя молекулами воды и тремя остатками гистамина в положении B10.[16][44]
Гексамер представляет собой неактивную форму с долговременной стабильностью, которая служит средством защиты высокореактивного инсулина, но при этом легкодоступна. Превращение гексамера в мономер является одним из центральных аспектов рецептур инсулина для инъекций. Гексамер намного более стабилен, чем мономер, что желательно по практическим соображениям; однако мономер - это лекарство с гораздо более быстрой реакцией, поскольку скорость диффузии обратно пропорциональна размеру частиц. Быстро реагирующий препарат означает, что инъекции инсулина не должны предшествовать приемам пищи на несколько часов, что, в свою очередь, дает людям с диабетом большую гибкость в их ежедневном графике.[45] Инсулин может агрегировать и образовывать фибриллярный переплетенный бета-листы. Это может вызвать инъекцию амилоидоз, и предотвращает хранение инсулина в течение длительного времени.[46]
Синтез, физиологические эффекты и разложение
Синтез
Инсулин производится в поджелудочная железа и тело Брокмана (у некоторых рыб) и высвобождается при обнаружении любого из нескольких раздражителей. Эти стимулы включают повышение плазменных концентраций аминокислот и глюкозы в результате переваривания пищи.[47] Углеводов могут быть полимерами простых сахаров или самих простых сахаров. Если углеводы включают глюкозу, то эта глюкоза будет всасываться в кровоток, и уровень глюкозы в крови начнет повышаться. В клетках-мишенях инсулин инициирует преобразование сигнала, что имеет эффект увеличения глюкоза поглощение и хранение. Наконец, инсулин разлагается, прекращая ответ.

У млекопитающих инсулин синтезируется в бета-клетках поджелудочной железы. От одного до трех миллионов островков поджелудочной железы образуют эндокринный часть поджелудочной железы, которая в первую очередь экзокринный железа. Эндокринная часть составляет всего 2% от общей массы поджелудочной железы. Внутри островков поджелудочной железы бета-клетки составляют 65–80% всех клеток.[нужна цитата ]
Инсулин состоит из двух полипептидных цепей, А- и В-цепей, связанных между собой дисульфидными связями. Однако сначала он синтезируется как единый полипептид, называемый препроинсулин в бета-клетках. Препроинсулин содержит 24 остатка сигнальный пептид который направляет зарождающуюся полипептидную цепь к грубым эндоплазматический ретикулум (RER). Сигнальный пептид расщепляется, когда полипептид перемещается в просвет RER, образуя проинсулин.[48] В RER проинсулин складывается в правильную конформацию и образуются 3 дисульфидные связи. Примерно через 5–10 минут после сборки в эндоплазматическом ретикулуме проинсулин транспортируется в сеть транс-Гольджи (TGN), где формируются незрелые гранулы. Транспорт до ТГН может занять около 30 минут.[нужна цитата ]
Проинсулин превращается в активный инсулин под действием клеточных эндопептидаз, известных как прогормонов конвертазы (ПК1 и ПК2 ), а также экзопротеазу карбоксипептидаза E.[49] Эндопептидазы расщепляются в 2 положениях, высвобождая фрагмент, называемый С-пептид и оставив 2 пептидные цепи, B- и A-цепи, связанные двумя дисульфидными связями. Каждый сайт расщепления расположен после пары основных остатков (лизин-64 и аргинин-65 и аргинин-31 и -32). После отщепления С-пептида эти 2 пары основных остатков удаляются карбоксипептидазой.[50] В С-пептид является центральной частью проинсулина, и первичная последовательность проинсулина идет в порядке «B-C-A» (цепи B и A были идентифицированы на основе массы, а C-пептид был обнаружен позже).[нужна цитата ]
Полученный зрелый инсулин упаковывается внутри зрелых гранул в ожидании метаболических сигналов (таких как лейцин, аргинин, глюкоза и манноза) и стимуляции блуждающего нерва для экзоцитоза из клетки в кровоток.[51]
Эндогенное производство инсулина регулируется в несколько этапов пути синтеза:
- В транскрипция от ген инсулина
- В мРНК стабильность
- На трансляция мРНК
- в посттрансляционные модификации
Было показано, что инсулин и родственные ему белки вырабатываются в головном мозге, а снижение уровня этих белков связано с болезнью Альцгеймера.[52][53][54]
Высвобождение инсулина стимулируется также стимуляцией рецептора бета-2 и ингибируется стимуляцией рецептора альфа-1. Кроме того, кортизол, глюкагон и гормон роста противодействуют действию инсулина во время стресса. Инсулин также подавляет высвобождение жирных кислот гормоночувствительной липазой в жировой ткани.[8]
Релиз
Бета-клетки в островки Лангерганса высвобождение инсулина в две фазы. Высвобождение первой фазы быстро запускается в ответ на повышение уровня глюкозы в крови и длится около 10 минут. Вторая фаза - это продолжительное, медленное высвобождение новообразованных пузырьков, запускаемое независимо от сахара и достигающее пика через 2–3 часа. Снижение высвобождения инсулина в первой фазе может быть самым ранним обнаруживаемым дефектом бета-клеток, предсказывающим начало диабет 2 типа.[55] Выпуск первой фазы и чувствительность к инсулину являются независимыми предикторами диабета.[56]
Описание релиза первой фазы следующее:
- Глюкоза попадает в β-клетки через переносчики глюкозы, GLUT2. Эти переносчики глюкозы имеют относительно низкое сродство к глюкозе, гарантируя, что скорость поступления глюкозы в β-клетки пропорциональна внеклеточной концентрации глюкозы (в пределах физиологического диапазона). При низком уровне сахара в крови в β-клетки поступает очень мало глюкозы; при высоких концентрациях глюкозы в крови в эти клетки попадает большое количество глюкозы.[57]
- Глюкоза, которая попадает в β-клетку, фосфорилируется до глюкозо-6-фосфат (G-6-P) пользователя глюкокиназа (гексокиназа IV ), который не ингибируется G-6-P так, как этот продукт влияет на гексокиназы в других тканях (гексокиназа I - III). Это означает, что внутриклеточная концентрация G-6-P остается пропорциональной концентрации сахара в крови.[10][57]
- Глюкозо-6-фосфат входит гликолитический путь а затем через пируватдегидрогеназа реакция, в Цикл Кребса, где множественные высокоэнергетические АТФ молекулы образуются в результате окисления ацетил-КоА (субстрат цикла Кребса), что приводит к увеличению соотношения АТФ: АДФ внутри клетки.[58]
- Повышенное внутриклеточное соотношение АТФ: АДФ закрывает АТФ-чувствительный SUR1 /Kir6.2 калиевый канал (видеть рецептор сульфонилмочевины ). Это предотвращает ионы калия (K+) от выхода из клетки за счет облегченной диффузии, что приводит к накоплению внутриклеточных ионов калия. В результате внутренняя часть клетки становится менее отрицательной по отношению к внешней, что приводит к деполяризации поверхностной мембраны клетки.
- На деполяризация, закрытый по напряжению ион кальция (Ca2+) каналы открываются, позволяя ионам кальция перемещаться в клетку за счет облегченной диффузии.
- Концентрация ионов кальция в цитозоле может также увеличиваться за счет высвобождения кальция из внутриклеточных запасов посредством активации рецепторов рианодина.[59]
- Концентрация ионов кальция в цитозоле бета-клеток может также или дополнительно повышаться за счет активации фосфолипаза C в результате связывания внеклеточного лиганд (гормон или нейротрансмиттер) к G протеин -связанный мембранный рецептор. Фосфолипаза C расщепляет фосфолипид мембраны, фосфатидилинозитол-4,5-бисфосфат, в инозитол 1,4,5-трифосфат и диацилглицерин. Инозитол-1,4,5-трифосфат (IP3) затем связывается с рецепторными белками в плазматической мембране эндоплазматический ретикулум (ER). Это позволяет высвобождать Ca2+ ионы из ER через IP3-закрытые каналы, что повышает цитозольную концентрацию ионов кальция независимо от эффектов высокой концентрации глюкозы в крови. Парасимпатический Через этот путь действует стимуляция островков поджелудочной железы, увеличивая секрецию инсулина в кровь.[60]
- Значительно увеличенное количество ионов кальция в цитоплазме клеток вызывает выброс в кровь ранее синтезированного инсулина, который хранился во внутриклеточной среде. секреторный пузырьки.
Это основной механизм высвобождения инсулина. Другие вещества, которые, как известно, стимулируют высвобождение инсулина, включают аминокислоты аргинин и лейцин, парасимпатическое высвобождение ацетилхолин (действуя через путь фосфолипазы C), сульфонилмочевина, холецистокинин (CCK, также через фосфолипазу C),[61] и полученные из желудочно-кишечного тракта инкретины, Такие как глюкагоноподобный пептид-1 (GLP-1) и глюкозозависимый инсулинотропный пептид (ЖИП).
Высвобождение инсулина сильно подавляется норэпинефрин (норадреналин), что приводит к повышению уровня глюкозы в крови во время стресса. Похоже, что выпуск катехоламины посредством Симпатическая нервная система оказывает противоречивое влияние на высвобождение инсулина бета-клетками, потому что высвобождение инсулина ингибируется α2-адренорецепторы[62] и стимулируется β2-адренорецепторы.[63] Чистый эффект от норэпинефрин от симпатических нервов и адреналин из надпочечников на высвобождение инсулина происходит торможение из-за преобладания α-адренорецепторов.[64]
Когда уровень глюкозы снижается до обычного физиологического значения, высвобождение инсулина из β-клеток замедляется или прекращается. Если уровень глюкозы в крови падает ниже этого, особенно до опасно низкого уровня, высвобождение гипергликемических гормонов (наиболее заметно глюкагон из островка альфа-клеток Лангерганса) вызывает высвобождение глюкозы в кровь из запасов гликогена в печени, дополненных глюконеогенез если запасы гликогена истощаются. Повышая уровень глюкозы в крови, гипергликемические гормоны предотвращают или корректируют опасную для жизни гипогликемию.
Признаки нарушения высвобождения инсулина в первой фазе можно увидеть на тест толерантности к глюкозе, продемонстрированный значительным повышением уровня глюкозы в крови через 30 минут после приема глюкозы (75 или 100 г глюкозы) с последующим медленным падением в течение следующих 100 минут, чтобы оставаться выше 120 мг / 100 мл через два часа. после начала теста. У нормального человека уровень глюкозы в крови корректируется (и может быть даже немного сверхкорректирован) к концу теста. Пик инсулина - это «первая реакция» на повышение уровня глюкозы в крови, эта реакция индивидуальна и зависит от дозы, хотя ранее всегда предполагалось, что она зависит только от типа пищи.
Колебания

Даже во время пищеварения, как правило, через один или два часа после еды высвобождение инсулина из поджелудочной железы не является непрерывным, а колеблется с периодом 3–6 минут, при изменении концентрации инсулина в крови более 800 п моль / л до менее 100 пмоль / л (у крыс).[65] Считается, что этого нужно избегать подавление из рецепторы инсулина в клетках-мишенях и помогает печени извлекать инсулин из крови.[65] Это колебание важно учитывать при приеме инсулино-стимулирующих препаратов, поскольку в идеале должна быть достигнута колеблющаяся концентрация высвобождения инсулина в крови, а не постоянная высокая концентрация.[65] Это может быть достигнуто ритмичная доставка инсулина к воротная вена, при помощи световой активации доставки или трансплантация островковых клеток в печень.[65][66][67]
Уровень инсулина в крови
Уровень инсулина в крови можно измерить в международные единицы, например, мкМЕ / мл или молярная концентрация, например пмоль / л, где 1 мкМЕ / мл равно 6,945 пмоль / л.[68] Типичный уровень в крови между приемами пищи составляет 8–11 мкМЕ / мл (57–79 пмоль / л).[69]
Передача сигнала
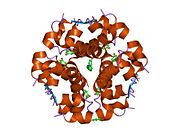
Действие инсулина инициируется его связыванием с рецептором, рецептор инсулина (IR), присутствует в клеточной мембране. Молекула рецептора содержит субъединицы α и β. Две молекулы соединяются, образуя так называемый гомодимер. Инсулин связывается с α-субъединицами гомодимера, который обращен к внеклеточной стороне клеток. Субъединицы β обладают ферментативной активностью тирозинкиназы, которая запускается связыванием инсулина. Эта активность вызывает аутофосфорилирование субъединиц β и, следовательно, фосфорилирование белков внутри клетки, известных как субстраты рецептора инсулина (IRS). Фосфорилирование IRS активирует каскад передачи сигнала, который приводит к активации других киназ, а также факторов транскрипции, которые опосредуют внутриклеточные эффекты инсулина.[70]
Каскад, который приводит к встраиванию переносчиков глюкозы GLUT4 в клеточные мембраны мышечных и жировых клеток и к синтезу гликогена в печени и мышечной ткани, а также к превращению глюкозы в триглицериды в печени, жировой ткани и лактирующих молочных железах. ткань железы действует через активацию IRS-1 фосфоинозитол-3 киназы (PI3K ). Этот фермент превращает фосфолипид в клеточной мембране по имени фосфатидилинозитол-4,5-бисфосфат (PIP2) в фосфатидилинозитол 3,4,5-трифосфат (PIP3), что, в свою очередь, активирует протеинкиназа B (ПКБ). Активированный PKB способствует слиянию GLUT4, содержащего эндосомы с клеточной мембраной, что приводит к увеличению переносчиков GLUT4 в плазматической мембране.[71] PKB также фосфорилирует киназа гликогенсинтазы (GSK), тем самым инактивируя этот фермент.[72] Это означает, что его субстрат, гликогенсинтаза (GS), не может быть фосфорилирован и остается дефосфорилированным и, следовательно, активным. Активный фермент, гликогенсинтаза (GS), катализирует лимитирующую стадию синтеза гликогена из глюкозы. Подобные дефосфорилирования влияют на ферменты, контролирующие скорость гликолиз приводит к синтезу жиров через малонил-КоА в тканях, которые могут генерировать триглицериды, а также ферменты, контролирующие скорость глюконеогенез в печени. Общий эффект этих конечных дефосфорилирования ферментов заключается в том, что в тканях, которые могут осуществлять эти реакции, стимулируется синтез гликогена и жира из глюкозы, а производство глюкозы печенью через гликогенолиз и глюконеогенез заблокированы.[73] Распад триглицеридов жировой тканью на свободные жирные кислоты и глицерин тоже подавляется.[73]
После того, как внутриклеточный сигнал, возникший в результате связывания инсулина с его рецептором, был произведен, необходимо прекращение передачи сигналов. Как указано ниже в разделе о деградации, эндоцитоз и деградация рецептора, связанного с инсулином, является основным механизмом прекращения передачи сигналов.[51] Кроме того, сигнальный путь также завершается дефосфорилированием тирозиновых остатков в различных сигнальных путях тирозинфосфатазами. Известно также, что серин / треонинкиназы снижают активность инсулина.
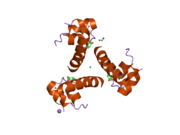
Структура инсулина–рецептор инсулина комплекс определен с использованием методик Рентгеновская кристаллография.[74]
Физиологические эффекты


Действия инсулина на глобальном уровне метаболизма человека включают:
- Увеличение клеточного потребления некоторых веществ, в первую очередь глюкозы в мышцах и жировая ткань (около двух третей клеток тела)[75]
- Увеличение в Репликация ДНК и синтез белка посредством контроля усвоения аминокислот
- Модификация активности многочисленных ферменты.
Действие инсулина (непрямое и прямое) на клетки включает:
- Стимулирует усвоение глюкозы - инсулин снижает концентрацию глюкозы в крови, вызывая потребление глюкозы по ячейкам. Это возможно, потому что инсулин вызывает введение переносчика GLUT4 в клеточные мембраны мышечной и жировой ткани, что позволяет глюкозе проникать в клетку.[70]
- Повысился синтез жира - инсулин заставляет жировые клетки поглощать глюкозу в крови, которая превращается в триглицериды; снижение инсулина вызывает обратное.[75]
- Повысился этерификация жирных кислот - заставляет жировую ткань вырабатывать нейтральные жиры (т.е. триглицериды ) из жирных кислот; снижение инсулина вызывает обратное.[75]
- Уменьшено липолиз - способствует снижению превращения запасов липидов жировых клеток в жирные кислоты и глицерин крови; снижение инсулина вызывает обратное.[75]
- Стимулирование синтеза гликогена. Когда уровень глюкозы высок, инсулин вызывает образование гликогена за счет активации фермента гексокиназы, который добавляет фосфатную группу в глюкозу, в результате чего молекула не может выйти из клетки. В то же время инсулин подавляет фермент глюкозо-6-фосфатазу, который удаляет фосфатную группу. Эти два фермента являются ключевыми для образования гликогена. Кроме того, инсулин активирует ферменты фосфофруктокиназу и гликогенсинтазу, которые отвечают за синтез гликогена.[76]
- Уменьшено глюконеогенез и гликогенолиз - снижает выработку глюкозы из неуглеводных субстратов, в первую очередь в печени (подавляющее большинство эндогенного инсулина, поступающего в печень, никогда не покидает печень); снижение инсулина вызывает производство глюкозы печенью из различных субстратов.[75]
- Уменьшено протеолиз - уменьшение расщепления белка[75]
- Уменьшено аутофагия - снижение уровня деградации поврежденных органелл. Постпрандиальные уровни полностью подавляют аутофагию.[77]
- Повышенное поглощение аминокислот - заставляет клетки поглощать циркулирующие аминокислоты; снижение инсулина тормозит всасывание.[75]
- Тонус артериальных мышц - заставляет мышцы стенки артерии расслабляться, увеличивая кровоток, особенно в микрокартериях; уменьшение инсулина снижает поток, позволяя этим мышцам сокращаться.[78]
- Повышение секреции соляной кислоты париетальными клетками желудка.[нужна цитата ]
- Повышенное поглощение калия - заставляет клетки синтезировать гликоген (очень рыхлое, «влажное» вещество, которое увеличивает содержание внутриклеточной воды и сопутствующего ей K+ ионы )[79] поглощать калий из внеклеточных жидкостей; недостаток инсулина тормозит всасывание. Увеличение клеточного поглощения калия инсулином снижает уровень калия в плазме крови. Возможно, это происходит за счет инсулино-индуцированной транслокации Na + / K + -АТФаза на поверхность клеток скелетных мышц.[80][81]
- Снижение почечной экскреции натрия.[82]
Инсулин также влияет на другие функции организма, например: сосудистая податливость и познание. Когда инсулин попадает в мозг человека, он улучшает обучение и память и, в частности, улучшает вербальную память.[83] Усиление передачи сигналов инсулина в мозг с помощью интраназального введения инсулина также усиливает острую терморегуляторную и глюкорегуляторную реакцию на прием пищи, что позволяет предположить, что инсулин центральной нервной системы способствует координации широкого спектра различных факторов. гомеостатические или регуляторные процессы в теле человека.[84] Инсулин также оказывает стимулирующее действие на гонадотропин-рилизинг гормон от гипоталамус, отдавая предпочтение плодородие.[85]
Деградация
После того, как молекула инсулина закрепилась на рецепторе и осуществила свое действие, она может быть выпущена обратно во внеклеточную среду или может быть разложена клеткой. Двумя основными участками клиренса инсулина являются печень и почки. Печень выводит большую часть инсулина при первом прохождении, тогда как почки выводят большую часть инсулина из большого круга кровообращения. Деградация обычно включает эндоцитоз комплекса инсулин-рецептор, с последующим действием фермент, разрушающий инсулин. По оценкам, молекула инсулина, эндогенно продуцируемая бета-клетками, разлагается в течение примерно одного часа после ее первоначального выброса в кровоток (инсулин период полураспада ~ 4–6 минут).[86][87]
Регулятор эндоканнабиноидного обмена
Инсулин является основным регулятором эндоканнабиноид (ЕС) метаболизм и лечение инсулином снижает внутриклеточный ЭК, 2-арахидонилглицерин (2-AG) и анандамид (AEA), которые соответствуют чувствительным к инсулину изменениям экспрессии ферментов метаболизма ЭК. In insulin-resistant адипоциты, patterns of insulin-induced enzyme expression is disturbed in a manner consistent with elevated EC синтез and reduced EC degradation. Findings suggest that insulin-resistant adipocytes fail to regulate EC metabolism and decrease intracellular EC levels in response to insulin stimulation, whereby тучный insulin-resistant individuals exhibit increased concentrations of ECs.[88][89] This dysregulation contributes to excessive нутряной жир accumulation and reduced адипонектин release from abdominal adipose tissue, and further to the onset of several cardiometabolic risk factors that are associated with obesity and диабет 2 типа.[90]
Гипогликемия
Гипогликемия, also known as "low blood sugar", is when blood sugar decreases to below normal levels.[91] This may result in a variety of симптомы including clumsiness, trouble talking, confusion, потеря сознания, припадки или смерть.[91] A feeling of hunger, sweating, shakiness and weakness may also be present.[91] Symptoms typically come on quickly.[91]
The most common cause of hypoglycemia is лекарства used to treat сахарный диабет such as insulin and sulfonylureas.[92][93] Risk is greater in diabetics who have eaten less than usual, exercised more than usual or have drunk алкоголь.[91] Other causes of hypoglycemia include почечная недостаточность, определенный tumors, Такие как инсулинома, болезнь печени, гипотиреоз, starvation, врожденная ошибка обмена веществ, severe infections, реактивная гипогликемия and a number of drugs including alcohol.[91][93] Low blood sugar may occur in otherwise healthy babies who have not eaten for a few hours.[94]
Diseases and syndromes
There are several conditions in which insulin disturbance is pathologic:
- Сахарный диабет – general term referring to all states characterized by hyperglycemia. It can be of the following types:[95]
- Тип 1 – autoimmune-mediated destruction of insulin-producing β-cells in the pancreas, resulting in absolute insulin deficiency
- Тип 2 – either inadequate insulin production by the β-cells or резистентность к инсулину or both because of reasons not completely understood.
- there is correlation with рацион питания, with sedentary lifestyle, with ожирение, with age and with метаболический синдром. Causality has been demonstrated in multiple model organisms including mice and monkeys; importantly, non-obese people do get Type 2 diabetes due to diet, sedentary lifestyle and unknown risk factors.
- it is likely that there is genetic susceptibility to develop Type 2 diabetes under certain environmental conditions
- Other types of impaired glucose tolerance (see the Сахарный диабет )
- Insulinoma – a tumor of beta cells producing excess insulin or реактивная гипогликемия.[96]
- Метаболический синдром – a poorly understood condition first called syndrome X by Джеральд Ривен. It is not clear whether the syndrome has a single, treatable cause, or is the result of body changes leading to type 2 diabetes. It is characterized by elevated blood pressure, dyslipidemia (disturbances in blood cholesterol forms and other blood lipids), and increased waist circumference (at least in populations in much of the developed world). The basic underlying cause may be the insulin resistance that precedes type 2 diabetes, which is a diminished capacity for инсулиновый ответ in some tissues (e.g., muscle, fat). It is common for morbidities such as essential гипертония, ожирение, type 2 diabetes, and сердечно-сосудистые заболевания (CVD) to develop.[97]
- Синдром поликистоза яичников – a complex syndrome in women in the reproductive years where anovulation и андроген excess are commonly displayed as гирсутизм. In many cases of PCOS, insulin resistance is present.[98]
Медицинское использование

Биосинтетический человеческий инсулин (insulin human rDNA, INN) for clinical use is manufactured by рекомбинантная ДНК технологии.[12] Biosynthetic human insulin has increased purity when compared with extractive animal insulin, enhanced purity reducing antibody formation. Researchers have succeeded in introducing the gene for human insulin into plants as another method of producing insulin ("biopharming") in сафлор.[99] This technique is anticipated to reduce production costs.
Several analogs of human insulin are available. Эти аналоги инсулина are closely related to the human insulin structure, and were developed for specific aspects of glycemic control in terms of fast action (prandial insulins) and long action (basal insulins).[100] The first biosynthetic insulin analog was developed for clinical use at mealtime (prandial insulin), Гумалог (insulin lispro),[101] it is more rapidly absorbed after subcutaneous injection than regular insulin, with an effect 15 minutes after injection. Other rapid-acting analogues are NovoRapid и Апидра, with similar profiles.[102] All are rapidly absorbed due to amino acid sequences that will reduce formation of dimers and hexamers (monomeric insulins are more rapidly absorbed). Fast acting insulins do not require the injection-to-meal interval previously recommended for human insulin and animal insulins. The other type is long acting insulin; the first of these was Лантус (insulin glargine). These have a steady effect for an extended period from 18 to 24 hours. Likewise, another protracted insulin analogue (Levemir ) is based on a fatty acid acylation approach. А миристиновая кислота molecule is attached to this analogue, which associates the insulin molecule to the abundant serum albumin, which in turn extends the effect and reduces the risk of hypoglycemia. Both protracted analogues need to be taken only once daily, and are used for type 1 diabetics as the basal insulin. A combination of a rapid acting and a protracted insulin is also available, making it more likely for patients to achieve an insulin profile that mimics that of the body's own insulin release.[103][104]
Insulin is usually taken as subcutaneous injections by single-use шприцы с иглы, via an инсулиновая помпа, or by repeated-use insulin pens with disposable needles. Inhaled insulin is also available in the U.S. market now.
Synthetic insulin can trigger adverse effects, so some people with diabetes rely on animal-source insulin.[105]
Unlike many medicines, insulin cannot be taken устно because, like nearly all other proteins introduced into the желудочно-кишечный тракт, it is reduced to fragments, whereupon all activity is lost. There has been some research into ways to protect insulin from the digestive tract, so that it can be administered orally or sublingually.[106][107]
История учебы
Открытие
In 1869, while studying the structure of the поджелудочная железа под микроскоп, Поль Лангерганс, a medical student in Берлин, identified some previously unnoticed tissue clumps scattered throughout the bulk of the pancreas.[108] The function of the "little heaps of cells", later известный как то островки Лангерганса, initially remained unknown, but Édouard Laguesse later suggested they might produce secretions that play a regulatory role in digestion.[109] Paul Langerhans' son, Archibald, also helped to understand this regulatory role.
In 1889, the physician Оскар Минковски, в сотрудничестве с Йозеф фон Меринг, removed the pancreas from a healthy dog to test its assumed role in digestion. On testing the urine, they found sugar, establishing for the first time a relationship between the pancreas and diabetes. In 1901, another major step was taken by the American physician and scientist Юджин Линдси Опи, when he isolated the role of the pancreas to the islets of Langerhans: "Diabetes mellitus when the result of a lesion of the pancreas is caused by destruction of the islands of Langerhans and occurs only when these bodies are in part or wholly destroyed".[110][111][112]
Over the next two decades researchers made several attempts to isolate the islets' secretions. В 1906 г. George Ludwig Zuelzer achieved partial success in treating dogs with pancreatic extract, but he was unable to continue his work. Between 1911 and 1912, E.L. Скотт на Чикагский университет tried aqueous pancreatic extracts and noted "a slight diminution of glycosuria", but was unable to convince his director of his work's value; it was shut down. Исраэль Кляйнер demonstrated similar effects at Рокфеллеровский университет in 1915, but Первая Мировая Война interrupted his work and he did not return to it.[113]
В 1916 г. Николае Паулеску разработал aqueous панкреатический extract which, when injected into a диабетик dog, had a normalizing effect on blood-sugar уровни. He had to interrupt his experiments because of Первая Мировая Война, and in 1921 he wrote four papers about his work carried out in Бухарест and his tests on a diabetic dog. Later that year, he published "Research on the Role of the Поджелудочная железа in Food Assimilation".[114][115]
The name "insulin" was coined by Эдвард Альберт Шарпи-Шафер in 1916 for a hypothetical molecule produced by pancreatic islets of Langerhans (Latin островок for islet or island) that controls glucose metabolism. Unbeknown to Sharpey-Schafer, Jean de Meyer had introduced very similar word "insuline" in 1909 for the same molecule.[116][117]
Extraction and purification
In October 1920, Canadian Фредерик Бантинг concluded that the digestive secretions that Minkowski had originally studied were breaking down the islet secretion, thereby making it impossible to extract successfully. A surgeon by training, Banting knew that blockages of the pancreatic duct would lead most of the pancreas to atrophy, while leaving the islets of Langerhans intact. He reasoned that a relatively pure extract could be made from the islets once most of the rest of the pancreas was gone. He jotted a note to himself: "Ligate pancreatic ducts of the dog. Keep dogs alive till acini degenerate leaving islets. Try to isolate internal secretion of these and relieve glycosuria."[118][119]

In the spring of 1921, Banting traveled to Торонто to explain his idea to J.J.R. Macleod, Professor of Physiology at the Университет Торонто. Macleod was initially skeptical, since Banting had no background in research and was not familiar with the latest literature, but he agreed to provide lab space for Banting to test out his ideas. Macleod also arranged for two undergraduates to be Banting's lab assistants that summer, but Banting required only one lab assistant. Чарльз Бест and Clark Noble flipped a coin; Best won the coin toss and took the first shift. This proved unfortunate for Noble, as Banting kept Best for the entire summer and eventually shared half his Nobel Prize money and credit for the discovery with Best.[120] On 30 July 1921, Banting and Best successfully isolated an extract ("isleton") from the islets of a duct-tied dog and injected it into a diabetic dog, finding that the extract reduced its blood sugar by 40% in 1 hour.[121][119]
Banting and Best presented their results to Macleod on his return to Toronto in the fall of 1921, but Macleod pointed out flaws with the experimental design, and suggested the experiments be repeated with more dogs and better equipment. He moved Banting and Best into a better laboratory and began paying Banting a salary from his research grants. Several weeks later, the second round of experiments was also a success, and Macleod helped publish their results privately in Toronto that November. Bottlenecked by the time-consuming task of duct-tying dogs and waiting several weeks to extract insulin, Banting hit upon the idea of extracting insulin from the fetal calf pancreas, which had not yet developed digestive glands. By December, they had also succeeded in extracting insulin from the adult cow pancreas. Macleod discontinued all other research in his laboratory to concentrate on the purification of insulin. He invited biochemist Джеймс Коллип to help with this task, and the team felt ready for a clinical test within a month.[119]

On January 11, 1922, Леонард Томпсон, a 14-year-old diabetic who lay dying at the Больница общего профиля Торонто, was given the first injection of insulin.[122][123][124][125] However, the extract was so impure that Thompson suffered a severe аллергическая реакция, and further injections were cancelled. Over the next 12 days, Collip worked day and night to improve the ox-pancreas extract. A second dose was injected on January 23, completely eliminating the glycosuria that was typical of diabetes without causing any obvious side-effects. The first American patient was Элизабет Хьюз, the daughter of U.S. Secretary of State Чарльз Эванс Хьюз.[126][127] The first patient treated in the U.S. was future woodcut artist Джеймс Д. Хэвенс;[128] Доктор John Ralston Williams imported insulin from Toronto to Рочестер, Нью-Йорк, to treat Havens.[129]
Banting and Best never worked well with Collip, regarding him as something of an interloper, and Collip left the project soon after. Over the spring of 1922, Best managed to improve his techniques to the point where large quantities of insulin could be extracted on demand, but the preparation remained impure. The drug firm Эли Лилли и компания had offered assistance not long after the first publications in 1921, and they took Lilly up on the offer in April. In November, Lilly's head chemist, Джордж Б. Уолден обнаруженный изоэлектрическое осаждение and was able to produce large quantities of highly refined insulin. Shortly thereafter, insulin was offered for sale to the general public.
Патент
Toward the end of January 1922, tensions mounted between the four "co-discoverers" of insulin and Collip briefly threatened to separately патент his purification process. Джон Дж. Фитцджеральд, director of the non-commercial public health institution Connaught Laboratories, therefore stepped in as peacemaker. The resulting agreement of 25 January 1922 established two key conditions: 1) that the collaborators would sign a contract agreeing not to take out a patent with a commercial pharmaceutical firm during an initial working period with Connaught; and 2) that no changes in research policy would be allowed unless first discussed among FitzGerald and the four collaborators.[130] It helped contain disagreement and tied the research to Connaught's public mandate.
Initially, Macleod and Banting were particularly reluctant to patent their process for insulin on grounds of medical ethics. However, concerns remained that a private third-party would hijack and monopolize the research (as Эли Лилли и компания had hinted[131]), and that safe distribution would be difficult to guarantee without capacity for quality control. С этой целью, Эдвард Кэлвин Кендалл gave valuable advice. He had isolated thyroxin на Клиника Майо in 1914 and patented the process through an arrangement between himself, the brothers Mayo, and the Университет Миннесоты, transferring the patent to the public university.[132] On April 12, Banting, Best, Collip, Macleod, and FitzGerald wrote jointly to the president of the Университет Торонто to propose a similar arrangement with the aim of assigning a patent to the Board of Governors of the University.[133] The letter emphasized that:[134]
The patent would not be used for any other purpose than to prevent the taking out of a patent by other persons. When the details of the method of preparation are published anyone would be free to prepare the extract, but no one could secure a profitable monopoly.
The assignment to the University of Toronto Board of Governors was completed on 15 January 1923, for the token payment of $1.00.[135] The arrangement was congratulated in Мировая работа in 1923 as "a step forward in medical ethics".[136] It has also received much media attention in the 2010s regarding the issue of здравоохранение и drug affordability.
Following further concern regarding Eli Lilly's attempts to separately patent parts of the manufacturing process, Connaught's Assistant Director and Head of the Insulin Division Robert Defries established a patent pooling policy which would require producers to freely share any improvements to the manufacturing process without compromising affordability.[137]
Structural analysis and synthesis

Purified animal-sourced insulin was initially the only type of insulin available for experiments and diabetics. Джон Джейкоб Абель was the first to produce the crystallised form in 1926.[138] Evidence of the protein nature was first given by Michael Somogyi, Edward A. Doisy, and Philip A. Shaffer in 1924.[139] It was fully proven when Hans Jensen and Earl A. Evans Jr. isolated the amino acids phenylalanine and proline in 1935.[140]
The amino acid structure of insulin was first characterized in 1951 by Фредерик Сэнгер,[17][141] and the first synthetic insulin was produced simultaneously in the labs of Panayotis Katsoyannis на Питтсбургский университет и Helmut Zahn в RWTH Ахенский университет в середине 1960-х гг.[142][143][144][145][146] Synthetic crystalline bovine insulin was achieved by Chinese researchers in 1965.[147] The complete 3-dimensional structure of insulin was determined by Рентгеновская кристаллография в Dorothy Hodgkin 's laboratory in 1969.[148]
The first genetically engineered, synthetic "human" insulin was produced using Кишечная палочка в 1978 г. Артур Риггс и Keiichi Itakura на Beckman Research Institute из Город надежды в сотрудничестве с Герберт Бойер в Genentech.[13][14] Genentech, founded by Swanson, Boyer and Эли Лилли и компания, went on in 1982 to sell the first commercially available biosynthetic human insulin under the brand name Хумулин.[14] The vast majority of insulin used worldwide is biosynthetic recombinant "human" insulin or its analogues.[15] Recently, another approach has been used by a pioneering group of Canadian researchers, using an easily grown сафлор plant, for the production of much cheaper insulin.[149]
Recombinant insulin is produced either in yeast (usually Saccharomyces cerevisiae ) или же Кишечная палочка.[150] In yeast, insulin may be engineered as a single-chain protein with a KexII endoprotease (a yeast homolog of PCI/PCII) site that separates the insulin A chain from a C-terminally truncated insulin B chain. A chemically synthesized C-terminal tail is then grafted onto insulin by reverse proteolysis using the inexpensive protease trypsin; typically the lysine on the C-terminal tail is protected with a chemical protecting group to prevent proteolysis. The ease of modular synthesis and the relative safety of modifications in that region accounts for common insulin analogs with C-terminal modifications (e.g. lispro, aspart, glulisine). The Genentech synthesis and completely chemical synthesis such as that by Bruce Merrifield are not preferred because the efficiency of recombining the two insulin chains is low, primarily due to competition with the precipitation of insulin B chain.
Nobel Prizes

В Нобелевская премия committee in 1923 credited the practical extraction of insulin to a team at the Университет Торонто and awarded the Nobel Prize to two men: Фредерик Бантинг и J.J.R. Macleod.[151] Они были награждены Нобелевская премия по физиологии и медицине in 1923 for the discovery of insulin. Banting, incensed that Best was not mentioned,[152] shared his prize with him, and Macleod immediately shared his with Джеймс Коллип. The patent for insulin was sold to the Университет Торонто for one dollar.
Two other Nobel Prizes have been awarded for work on insulin. Британский молекулярный биолог Фредерик Сэнгер, who determined the первичная структура of insulin in 1955, was awarded the 1958 Нобелевская премия по химии.[17] Розалин Сассман Ялоу received the 1977 Nobel Prize in Medicine for the development of the радиоиммуноанализ для инсулина.
Several Nobel Prizes also have an indirect connection with insulin. Джордж Майнот, co-recipient of the 1934 Nobel Prize for the development of the first effective treatment for злокачественная анемия, имел сахарный диабет. Доктор Уильям Кастл observed that the 1921 discovery of insulin, arriving in time to keep Minot alive, was therefore also responsible for the discovery of a cure for злокачественная анемия.[153] Dorothy Hodgkin was awarded a Nobel Prize in Chemistry in 1964 for the development of кристаллография, the technique she used for deciphering the complete molecular structure of insulin in 1969.[148]
Полемика
The work published by Banting, Best, Collip and Macleod represented the preparation of purified insulin extract suitable for use on human patients.[154] Although Paulescu discovered the principles of the treatment, his saline extract could not be used on humans; he was not mentioned in the 1923 Nobel Prize. Professor Ian Murray was particularly active in working to correct "the historical wrong" against Николае Паулеску. Murray was a professor of physiology at the Anderson College of Medicine in Глазго, Шотландия, the head of the department of Metabolic Diseases at a leading Glasgow hospital, vice-president of the British Association of Diabetes, and a founding member of the Международная федерация диабета. Murray wrote:
Insufficient recognition has been given to Paulescu, the distinguished румынский scientist, who at the time when the Toronto team were commencing their research had already succeeded in extracting the antidiabetic hormone of the pancreas and proving its efficacy in reducing the hyperglycaemia in diabetic dogs.[155]
In a private communication, Professor Арне Тизелиус, former head of the Nobel Institute, expressed his personal opinion that Paulescu was equally worthy of the award in 1923.[156]
Смотрите также
- Уход
- Anatomy and physiolology
- Other medical / diagnostic uses
- Insulin Signal Transduction pathway
- Другое использование
Рекомендации
- ^ а б c GRCh38: Ensembl release 89: ENSG00000254647 - Ансамбль, Май 2017
- ^ а б c GRCm38: Ensembl release 89: ENSMUSG00000000215 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Insulin | Meaning of Insulin by Lexico". Словари Lexico | английский.
- ^ "insulin - WordReference.com Dictionary of English". www.wordreference.com.
- ^ а б Voet D, Voet JG (2011). Биохимия (4-е изд.). Нью-Йорк: Вили.
- ^ а б c d Страйер Л. (1995). Биохимия (Четвертое изд.). Нью-Йорк: W.H. Фримен и компания. pp. 773–74. ISBN 0-7167-2009-4.
- ^ Sonksen P, Sonksen J (July 2000). "Insulin: understanding its action in health and disease". Британский журнал анестезии. 85 (1): 69–79. Дои:10.1093/bja/85.1.69. PMID 10927996.
- ^ а б c d е ж грамм Koeslag JH, Saunders PT, Terblanche E (June 2003). "A reappraisal of the blood glucose homeostat which comprehensively explains the type 2 diabetes mellitus-syndrome X complex". Журнал физиологии (published 2003). 549 (Pt 2): 333–46. Дои:10.1113/jphysiol.2002.037895. ЧВК 2342944. PMID 12717005.
- ^ American Society of Health-System Pharmacists (2009-02-01). "Insulin Injection". PubMed Health. Национальный центр биотехнологической информации, Национальная медицинская библиотека США. Получено 2012-10-12.
- ^ а б Drug Information Portal NLM – Insulin human USAN http://druginfo.nlm.nih.gov/drugportal/
- ^ а б "First Successful Laboratory Production of Human Insulin Announced". Выпуск новостей. Genentech. 1978-09-06. Получено 2016-09-26.
- ^ а б c Tof I (1994). "Recombinant DNA technology in the synthesis of human insulin". Little Tree Publishing. Получено 2009-11-03.
- ^ а б Aggarwal SR (December 2012). "What's fueling the biotech engine-2011 to 2012". Природа Биотехнологии. 30 (12): 1191–7. Дои:10.1038/nbt.2437. PMID 23222785. S2CID 8707897.
- ^ а б c d Weiss M, Steiner DF, Philipson LH (2000). "Insulin Biosynthesis, Secretion, Structure, and Structure-Activity Relationships". In Feingold KR, Anawalt B, Boyce A, Chrousos G, Dungan K, Grossman A, et al. (ред.). Эндотекст. MDText.com, Inc. PMID 25905258. Получено 2020-02-18.
- ^ а б c Stretton AO (October 2002). "The first sequence. Fred Sanger and insulin". Генетика. 162 (2): 527–32. ЧВК 1462286. PMID 12399368.
- ^ Editor (2019-01-15). "The discovery and development of insulin as a medical treatment can be traced back to the 19th century". Сахарный диабет. Получено 2020-02-17.CS1 maint: дополнительный текст: список авторов (связь)
- ^ "19th WHO Model List of Essential Medicines (April 2015)" (PDF). ВОЗ. Апрель 2015 г.. Получено 10 мая, 2015.
- ^ а б de Souza AM, López JA (2004). "Insulin or insulin-like studies on unicellular organisms: a review". Braz. Arch. Биол. Technol. 47 (6): 973–81. Дои:10.1590/S1516-89132004000600017.
- ^ LeRoith D, Shiloach J, Heffron R, Rubinovitz C, Tanenbaum R, Roth J (August 1985). "Insulin-related material in microbes: similarities and differences from mammalian insulins". Canadian Journal of Biochemistry and Cell Biology. 63 (8): 839–49. Дои:10.1139/o85-106. PMID 3933801.
- ^ Wright JR, Yang H, Hyrtsenko O, Xu BY, Yu W, Pohajdak B (2014). "A review of piscine islet xenotransplantation using wild-type tilapia donors and the production of transgenic tilapia expressing a "humanized" tilapia insulin". Ксенотрансплантация. 21 (6): 485–95. Дои:10.1111/xen.12115. ЧВК 4283710. PMID 25040337.
- ^ "Deadly sea snail uses weaponised insulin to make its prey sluggish". Хранитель. 19 января 2015.
- ^ Safavi-Hemami H, Gajewiak J, Karanth S, Robinson SD, Ueberheide B, Douglass AD, Schlegel A, Imperial JS, Watkins M, Bandyopadhyay PK, Yandell M, Li Q, Purcell AW, Norton RS, Ellgaard L, Olivera BM (February 2015). "Specialized insulin is used for chemical warfare by fish-hunting cone snails". Труды Национальной академии наук Соединенных Штатов Америки. 112 (6): 1743–48. Bibcode:2015PNAS..112.1743S. Дои:10.1073/pnas.1423857112. ЧВК 4330763. PMID 25605914.
- ^ а б "Entrez Gene: INS insulin".
- ^ Bell GI, Pictet RL, Rutter WJ, Cordell B, Tischer E, Goodman HM (March 1980). "Sequence of the human insulin gene". Природа. 284 (5751): 26–32. Bibcode:1980Natur.284...26B. Дои:10.1038/284026a0. PMID 6243748. S2CID 4363706.
- ^ "Entrez Gene: INS insulin 2".
- ^ Shiao MS, Liao BY, Long M, Yu HT (March 2008). "Adaptive evolution of the insulin two-gene system in mouse". Генетика. 178 (3): 1683–91. Дои:10.1534/genetics.108.087023. ЧВК 2278064. PMID 18245324.
- ^ Bernardo AS, Hay CW, Docherty K (November 2008). "Pancreatic transcription factors and their role in the birth, life and survival of the pancreatic beta cell" (PDF). рассмотрение. Молекулярная и клеточная эндокринология. 294 (1–2): 1–9. Дои:10.1016/j.mce.2008.07.006. PMID 18687378. S2CID 28027796.
- ^ Rutter GA, Pullen TJ, Hodson DJ, Martinez-Sanchez A (March 2015). "Pancreatic β-cell identity, glucose sensing and the control of insulin secretion". рассмотрение. Биохимический журнал. 466 (2): 203–18. Дои:10.1042/BJ20141384. PMID 25697093. S2CID 2193329.
- ^ Rutter GA, Tavaré JM, Palmer DG (June 2000). "Regulation of Mammalian Gene Expression by Glucose". рассмотрение. Новости физиологических наук. 15 (3): 149–54. Дои:10.1152/physiologyonline.2000.15.3.149. PMID 11390898.
- ^ Poitout V, Hagman D, Stein R, Artner I, Robertson RP, Harmon JS (April 2006). "Regulation of the insulin gene by glucose and d acids". рассмотрение. Журнал питания. 136 (4): 873–76. Дои:10.1093/jn/136.4.873. ЧВК 1853259. PMID 16549443.
- ^ Vaulont S, Vasseur-Cognet M, Kahn A (October 2000). "Glucose regulation of gene transcription". рассмотрение. Журнал биологической химии. 275 (41): 31555–58. Дои:10.1074/jbc.R000016200. PMID 10934218.
- ^ Christensen DP, Dahllöf M, Lundh M, Rasmussen DN, Nielsen MD, Billestrup N, Grunnet LG, Mandrup-Poulsen T (2011). "Histone deacetylase (HDAC) inhibition as a novel treatment for diabetes mellitus". Молекулярная медицина. 17 (5–6): 378–90. Дои:10.2119/molmed.2011.00021. ЧВК 3105132. PMID 21274504.
- ^ Wang W, Shi Q, Guo T, Yang Z, Jia Z, Chen P, Zhou C (June 2016). "PDX1 and ISL1 differentially coordinate with epigenetic modifications to regulate insulin gene expression in varied glucose concentrations". Молекулярная и клеточная эндокринология. 428: 38–48. Дои:10.1016/j.mce.2016.03.019. PMID 26994512.
- ^ Wang X, Wei X, Pang Q, Yi F (August 2012). "Histone deacetylases and their inhibitors: molecular mechanisms and therapeutic implications in diabetes mellitus". Акта Фармацевтика Синица B. 2 (4): 387–95. Дои:10.1016/j.apsb.2012.06.005.
- ^ а б Andrali SS, Sampley ML, Vanderford NL, Ozcan S (October 2008). "Glucose regulation of insulin gene expression in pancreatic beta-cells". рассмотрение. Биохимический журнал. 415 (1): 1–10. Дои:10.1042/BJ20081029. PMID 18778246.
- ^ Kaneto H, Matsuoka TA, Kawashima S, Yamamoto K, Kato K, Miyatsuka T, Katakami N, Matsuhisa M (July 2009). "Role of MafA in pancreatic beta-cells". Расширенные обзоры доставки лекарств. 61 (7–8): 489–96. Дои:10.1016/j.addr.2008.12.015. PMID 19393272.
- ^ Aramata S, Han SI, Kataoka K (December 2007). "Roles and regulation of transcription factor MafA in islet beta-cells". Endocrine Journal. 54 (5): 659–66. Дои:10.1507/endocrj.KR-101. PMID 17785922.
- ^ Kaneto H, Matsuoka TA (October 2012). "Involvement of oxidative stress in suppression of insulin biosynthesis under diabetic conditions". Международный журнал молекулярных наук. 13 (10): 13680–90. Дои:10.3390/ijms131013680. ЧВК 3497347. PMID 23202973.
- ^ Melloul D, Marshak S, Cerasi E (March 2002). "Regulation of insulin gene transcription". Диабетология. 45 (3): 309–26. Дои:10.1007/s00125-001-0728-y. PMID 11914736.
- ^ Jang WG, Kim EJ, Park KG, Park YB, Choi HS, Kim HJ, Kim YD, Kim KS, Lee KU, Lee IK (January 2007). "Glucocorticoid receptor mediated repression of human insulin gene expression is regulated by PGC-1alpha". Сообщения о биохимических и биофизических исследованиях. 352 (3): 716–21. Дои:10.1016/j.bbrc.2006.11.074. PMID 17150186.
- ^ "Insulin human". PubChem. Получено 26 февраля 2019.
- ^ а б c Fu Z, Gilbert ER, Liu D (January 2013). "Regulation of insulin synthesis and secretion and pancreatic Beta-cell dysfunction in diabetes". Текущие обзоры диабета. 9 (1): 25–53. Дои:10.2174/157339913804143225. ЧВК 3934755. PMID 22974359.
- ^ Dunn MF (August 2005). "Zinc-ligand interactions modulate assembly and stability of the insulin hexamer -- a review". Биометаллы. 18 (4): 295–303. Дои:10.1007/s10534-005-3685-y. PMID 16158220. S2CID 8857694.
- ^ Ivanova MI, Sievers SA, Sawaya MR, Wall JS, Eisenberg D (November 2009). "Molecular basis for insulin fibril assembly". Труды Национальной академии наук Соединенных Штатов Америки. 106 (45): 18990–5. Bibcode:2009PNAS..10618990I. Дои:10.1073/pnas.0910080106. ЧВК 2776439. PMID 19864624.
- ^ Rhoades RA, Bell DR (2009). Medical physiology : principles for clinical medicine (3-е изд.). Филадельфия: Липпинкотт Уильямс и Уилкинс. pp. 644–47. ISBN 978-0-7817-6852-8.
- ^ Kahn CR, Weir GC (2005). Joslin's Diabetes Mellitus (14-е изд.). Липпинкотт Уильямс и Уилкинс. ISBN 978-8493531836.
- ^ Steiner DF, Oyer PE (February 1967). "The biosynthesis of insulin and a probable precursor of insulin by a human islet cell adenoma". Труды Национальной академии наук Соединенных Штатов Америки. 57 (2): 473–80. Bibcode:1967PNAS...57..473S. Дои:10.1073/pnas.57.2.473. ЧВК 335530. PMID 16591494.
- ^ Creighton TE (1993). Proteins: Structures and Molecular Properties (2-е изд.). W H Freeman and Company. стр.81–83. ISBN 978-0-7167-2317-2.
- ^ а б Najjar S (2001). "Insulin Action: Molecular Basis of Diabetes". Энциклопедия наук о жизни. Джон Вили и сыновья. Дои:10.1038/npg.els.0001402. ISBN 978-0470016176.
- ^ Gustin N (2005-03-07). "Researchers discover link between insulin and Alzheimer's". EurekAlert!. Американская ассоциация развития науки. Получено 2009-01-01.
- ^ de la Monte SM, Wands JR (February 2005). "Review of insulin and insulin-like growth factor expression, signaling, and malfunction in the central nervous system: relevance to Alzheimer's disease" (PDF). Журнал болезни Альцгеймера. 7 (1): 45–61. Дои:10.3233/JAD-2005-7106. PMID 15750214.
- ^ Steen E, Terry BM, Rivera EJ, Cannon JL, Neely TR, Tavares R, Xu XJ, Wands JR, de la Monte SM (February 2005). "Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer's disease—is this type 3 diabetes?" (PDF). Журнал болезни Альцгеймера. 7 (1): 63–80. Дои:10.3233/jad-2005-7107. PMID 15750215.
- ^ Gerich JE (February 2002). "Is reduced first-phase insulin release the earliest detectable abnormality in individuals destined to develop type 2 diabetes?". Сахарный диабет. 51 (Suppl 1): S117–21. Дои:10.2337/diabetes.51.2007.s117. PMID 11815469.
- ^ Lorenzo C, Wagenknecht LE, Rewers MJ, Karter AJ, Bergman RN, Hanley AJ, Haffner SM (September 2010). «Индекс распределения, эффективность глюкозы и преобразование в диабет 2 типа: исследование инсулинорезистентного атеросклероза (IRAS)». Уход за диабетом. 33 (9): 2098–103. Дои:10.2337 / dc10-0165. ЧВК 2928371. PMID 20805282.
- ^ а б Schuit F, Moens K, Heimberg H, Pipeleers D (ноябрь 1999 г.). «Клеточное происхождение гексокиназы в островках поджелудочной железы». Журнал биологической химии (опубликовано в 1999 г.). 274 (46): 32803–09. Дои:10.1074 / jbc.274.46.32803. PMID 10551841.
- ^ Schuit F, De Vos A, Farfari S, Moens K, Pipeleers D, Brun T, Prentki M (июль 1997 г.). «Метаболическая судьба глюкозы в очищенных островковых клетках. Глюкозо-регулируемый анаплероз в бета-клетках». Журнал биологической химии (опубликовано в 1997 г.). 272 (30): 18572–79. Дои:10.1074 / jbc.272.30.18572. PMID 9228023.
- ^ Santulli G, Pagano G, Sardu C, Xie W, Reiken S, D'Ascia SL, Cannone M, Marziliano N, Trimarco B, Guise TA, Lacampagne A, Marks AR (май 2015 г.). «Канал высвобождения кальция RyR2 регулирует высвобождение инсулина и гомеостаз глюкозы». Журнал клинических исследований. 125 (5): 1968–78. Дои:10.1172 / JCI79273. ЧВК 4463204. PMID 25844899.
- ^ Страйер Л. (1995). Биохимия (Четвертое изд.). Нью-Йорк: W.H. Фримен и компания. С. 343–44. ISBN 0-7167-2009-4.
- ^ Cawston EE, Миллер LJ (март 2010 г.). «Терапевтический потенциал новых лекарств, нацеленных на рецептор холецистокинина 1 типа». Британский журнал фармакологии. 159 (5): 1009–21. Дои:10.1111 / j.1476-5381.2009.00489.x. ЧВК 2839260. PMID 19922535.
- ^ Накаки Т., Накадате Т., Като Р. (август 1980 г.). «Альфа-2-адренорецепторы, модулирующие высвобождение инсулина из изолированных островков поджелудочной железы». Архив фармакологии Наунин-Шмидеберг. 313 (2): 151–53. Дои:10.1007 / BF00498572. PMID 6252481. S2CID 30091529.
- ^ Лейден Б.Т., Дурай В., Лоу В.Л. мл. (2010). «Рецепторы, связанные с G-белками, островки поджелудочной железы и диабет». Природное образование. 3 (9): 13.
- ^ Sircar S (2007). Медицинская физиология. Штутгарт: издательская группа Thieme. С. 537–38. ISBN 978-3-13-144061-7.
- ^ а б c d е Хеллман Б., Гильф Э., Грапенгессер Э., Данск Х., Салехи А (2007). «[Колебания инсулина - клинически важный ритм. Противодиабетические средства должны увеличивать пульсирующий компонент высвобождения инсулина]». Läkartidningen (на шведском языке). 104 (32–33): 2236–39. PMID 17822201.
- ^ Сароде Б.Р., Ковер К., Тонг П.Й., Чжан С., Фридман С.Х. (ноябрь 2016 г.). «Световой контроль высвобождения инсулина и глюкозы в крови с помощью фотоактивированного депо для инъекций». Молекулярная фармацевтика. 13 (11): 3835–3841. Дои:10.1021 / acs.molpharmaceut.6b00633. ЧВК 5101575. PMID 27653828.
- ^ Джейн П.К., Карунакаран Д., Фридман С.Х. (январь 2013 г.). «Строительство фотоактивированного инсулинового депо» (PDF). Angewandte Chemie. 52 (5): 1404–9. Дои:10.1002 / anie.201207264. PMID 23208858.
- ^ Словарь единиц измерения В архиве 2013-10-28 на Wayback Machine Автор: Расс Роулетт, Университет Северной Каролины в Чапел-Хилл. 13 июня 2001 г.
- ^ Ивасе Х, Кобаяси М, Накадзима М, Такатори Т. (январь 2001 г.). «Отношение инсулина к С-пептиду можно использовать для судебно-медицинской диагностики передозировки экзогенного инсулина». Международная криминалистическая экспертиза. 115 (1–2): 123–27. Дои:10.1016 / S0379-0738 (00) 00298-X. PMID 11056282.
- ^ а б "Справочник по диабету, 4-е издание, выдержка № 4: Нормальная физиология секреции и действия инсулина". Диабет под контролем. Бесплатный еженедельный информационный бюллетень по диабету для медицинских работников. 2014-07-28. Получено 2017-06-01.
- ^ Макманус Э.Дж., Сакамото К., Армит Л.Дж., Рональдсон Л., Шпиро Н., Маркес Р., Алесси Д.Р. (апрель 2005 г.). «Роль, которую фосфорилирование GSK3 играет в передаче сигналов инсулина и Wnt, определена с помощью ноккин-анализа». Журнал EMBO. 24 (8): 1571–83. Дои:10.1038 / sj.emboj.7600633. ЧВК 1142569. PMID 15791206.
- ^ Fang X, Yu SX, Lu Y, Bast RC, Woodgett JR, Mills GB (октябрь 2000 г.). «Фосфорилирование и инактивация киназы гликогенсинтазы 3 протеинкиназой А». Труды Национальной академии наук Соединенных Штатов Америки. 97 (22): 11960–75. Bibcode:2000PNAS ... 9711960F. Дои:10.1073 / pnas.220413597. ЧВК 17277. PMID 11035810.
- ^ а б Страйер Л. (1995). Биохимия (Четвертое изд.). Нью-Йорк: W.H. Фримен и компания. С. 351–56, 494–95, 505, 605–06, 773–75. ISBN 0-7167-2009-4.
- ^ Menting JG, Whittaker J, Margetts MB, Whittaker LJ, Kong GK, Smith BJ, Watson CJ, Záková L, Kletvíková E, Jiráček J, Chan SJ, Steiner DF, Dodson GG, Brzozowski AM, Weiss MA, Ward CW, Lawrence (Январь 2013). «Как инсулин задействует свой первичный сайт связывания на рецепторе инсулина». Природа. 493 (7431): 241–45. Bibcode:2013Натура.493..241M. Дои:10.1038 / природа11781. ЧВК 3793637. PMID 23302862. Сложить резюме – Австралийская радиовещательная комиссия.
- ^ а б c d е ж грамм Димитриадис Г., Митроу П., Ламбадиари В., Марату Е., Raptis SA (август 2011 г.). «Действие инсулина в мышечной и жировой ткани». Исследования диабета и клиническая практика. 93 Приложение 1: S52–59. Дои:10.1016 / S0168-8227 (11) 70014-6. PMID 21864752.
- ^ «Физиологические эффекты инсулина». www.vivo.colostate.edu. Получено 2017-06-01.
- ^ Бергамини Э, Каваллини Г, Донати А, Гори Z (октябрь 2007 г.). «Роль аутофагии в старении: ее существенная часть в антивозрастном механизме ограничения калорийности». Летопись Нью-Йоркской академии наук. 1114 (1): 69–78. Bibcode:2007НЯСА1114 ... 69Б. Дои:10.1196 / летопись.1396.020. PMID 17934054. S2CID 21011988.
- ^ Чжэн Ц., Лю Ц. (июнь 2015 г.). «Сосудистая функция, действие инсулина и упражнения: сложное взаимодействие». Тенденции в эндокринологии и метаболизме. 26 (6): 297–304. Дои:10.1016 / j.tem.2015.02.002. ЧВК 4450131. PMID 25735473.
- ^ Крейцман С.Н., Коксон А.Ю., Саз К.Ф. (июль 1992 г.). «Накопление гликогена: иллюзии легкой потери веса, избыточного восстановления веса и искажения оценок состава тела» (PDF). Американский журнал клинического питания. 56 (1 приложение): 292S – 93S. Дои:10.1093 / ajcn / 56.1.292S. PMID 1615908. Архивировано из оригинал (PDF) на 2012-10-18.
- ^ Бензиане Б., Чибалин А.В. (сентябрь 2008 г.). «Границы: регулирование натриевого насоса в скелетных мышцах: парадигма транслокации». Американский журнал физиологии. Эндокринология и метаболизм. 295 (3): E553–58. Дои:10.1152 / ajpendo.90261.2008. PMID 18430962. S2CID 10153197.
- ^ Клаузен Т. (сентябрь 2008 г.). «Регулирующая роль транслокации Na + -K + насосов в скелетных мышцах: гипотеза или реальность?». Американский журнал физиологии. Эндокринология и метаболизм. 295 (3): E727–28, ответ автора 729. Дои:10.1152 / ajpendo.90494.2008. PMID 18775888. S2CID 13410719.
- ^ Гупта А.К., Кларк Р.В., Киршнер К.А. (январь 1992 г.). «Влияние инсулина на почечную экскрецию натрия». Гипертония. 19 (1 приложение): I78–82. Дои:10.1161 / 01.HYP.19.1_Suppl.I78. PMID 1730458.
- ^ Бенедикт С., Хальшмид М., Хатке А., Шультес Б., Фем Х.Л., Борн Дж., Керн В. (ноябрь 2004 г.). «Интраназальный инсулин улучшает память у человека» (PDF). Психонейроэндокринология. 29 (10): 1326–34. Дои:10.1016 / j.psyneuen.2004.04.003. PMID 15288712. S2CID 20321892.
- ^ Бенедикт С., Бреде С., Шёт Х. Б., Ленерт Х., Шультес Б., Борн Дж., Хальшмид М. (январь 2011 г.). «Интраназальный инсулин усиливает постпрандиальный термогенез и снижает уровень постпрандиального сывороточного инсулина у здоровых мужчин». Сахарный диабет. 60 (1): 114–18. Дои:10.2337 / db10-0329. ЧВК 3012162. PMID 20876713 [Epub'd перед печатью]
- ^ Комнинос А.Н., Джаясена С.Н., Дхилло В.С. (2014). «Взаимосвязь между кишечными и жировыми гормонами и размножением». Обновление репродукции человека. 20 (2): 153–74. Дои:10.1093 / humupd / dmt033. PMID 24173881. S2CID 18645125.
- ^ Дакворт В.К., Беннетт Р.Г., Хэмел Ф.Г. (октябрь 1998 г.). «Деградация инсулина: прогресс и потенциал». Эндокринные обзоры. 19 (5): 608–24. Дои:10.1210 / edrv.19.5.0349. PMID 9793760.
- ^ Палмер Б.Ф., Генрих В.Л. «Углеводный и инсулиновый обмен при хронической болезни почек». UpToDate, Inc.
- ^ D'Eon TM, Пирс К.А., Ройс Дж.Дж., Тайлер А., Чен Х., Тейшейра С.Р. (май 2008 г.). «Роль инсулинорезистентности адипоцитов в патогенезе увеличения эндоканнабиноидов, связанных с ожирением». Сахарный диабет. 57 (5): 1262–68. Дои:10.2337 / db07-1186. PMID 18276766.
- ^ Gatta-Cherifi B, Cota D (февраль 2016 г.). «Новое понимание роли эндоканнабиноидной системы в регулировании энергетического баланса». Международный журнал ожирения. 40 (2): 210–19. Дои:10.1038 / ijo.2015.179. PMID 26374449. S2CID 20740277.
- ^ Ди Марцо V (август 2008 г.). «Эндоканнабиноидная система при ожирении и диабете 2 типа». Диабетология. 51 (8): 1356–67. Дои:10.1007 / s00125-008-1048-2. PMID 18563385.
- ^ а б c d е ж «Гипогликемия». Национальный институт диабета, болезней органов пищеварения и почек. Октябрь 2008 г. Архивировано с оригинал 1 июля 2015 г.. Получено 28 июн 2015.
- ^ Янаи Х., Адачи Х., Кацуяма Х., Морияма С., Хамасаки Х., Сако А. (февраль 2015 г.). «Противодиабетические препараты, вызывающие заболевание, и клинические факторы, лежащие в основе гипогликемии у пациентов с диабетом». Всемирный журнал диабета. 6 (1): 30–6. Дои:10.4239 / wjd.v6.i1.30. ЧВК 4317315. PMID 25685276.
- ^ а б Шриер Р.В. (2007). Справочник по внутренним болезням реальные пациенты, реальные ответы (3-е изд.). Филадельфия: Липпинкотт Уильямс и Уилкинс. п. 119. ISBN 9780781765299. В архиве из оригинала на 1 июля 2015 г.
- ^ Перкин Р.М. (2008). Детская госпитальная медицина: учебник по ведению стационара (2-е изд.). Филадельфия: Wolters Kluwer Health / Lippincott Williams & Wilkins. п. 105. ISBN 9780781770323. В архиве из оригинала на 1 июля 2015 г.
- ^ Макдональд И.А. (ноябрь 2016 г.). «Обзор последних данных, касающихся сахаров, инсулинорезистентности и диабета». Европейский журнал питания. 55 (Дополнение 2): 17–23. Дои:10.1007 / s00394-016-1340-8. ЧВК 5174139. PMID 27882410.
- ^ Геттье Дж. М., Горден П. (март 2010 г.). «Секреция инсулина и инсулинпродуцирующие опухоли». Экспертный обзор эндокринологии и метаболизма. 5 (2): 217–227. Дои:10.1586 / eem.09.83. ЧВК 2853964. PMID 20401170.
- ^ Саклаен М.Г. (февраль 2018 г.). «Глобальная эпидемия метаболического синдрома». Текущие отчеты о гипертонии. 20 (2): 12. Дои:10.1007 / s11906-018-0812-z. ЧВК 5866840. PMID 29480368.
- ^ Эль Хайек С., Битар Л., Хамдар Л. Х., Мирза Ф. Г., Дауд Г. (2016-04-05). «Синдром поликистозных яичников: обновленный обзор». Границы физиологии. 7: 124. Дои:10.3389 / fphys.2016.00124. ЧВК 4820451. PMID 27092084.
- ^ Марсиаль Г.Г. (13 августа 2007 г.). "От SemBiosys, нового вида инсулина". Внутри Уолл-стрит. Архивировано из оригинал 17 ноября 2007 г.
- ^ Аналог инсулина
- ^ Веккьо, Игнацио; Торнали, Кристина; Брагацци, Никола Луиджи; Мартини, Мариано (23.10.2018). «Открытие инсулина: важная веха в истории медицины». Границы эндокринологии. 9: 613. Дои:10.3389 / fendo.2018.00613. ЧВК 6205949. PMID 30405529.
- ^ Гаст, Клаус; Шулер, Аня; Вольф, Мартин; Талхаммер, Аня; Берхтольд, Харальд; Нагель, Норберт; Ленхерр, Гудрун; Хаук, Геррит; Секлер, Роберт (2017). "Быстродействующие и человеческие инсулины: кинетика диссоциации гексамера при разбавлении фармацевтического состава". Фармацевтические исследования. 34 (11): 2270–2286. Дои:10.1007 / s11095-017-2233-0. ЧВК 5643355. PMID 28762200.
- ^ Ульрих, Хизер; Снайдер, Бенджамин; К. Гарг, Сатиш (2007). «Комбинирование инсулинов для оптимального контроля уровня глюкозы в крови при диабете 1 и 2 типа: акцент на инсулине глулизин». Здоровье сосудов и управление рисками. 3 (3): 245–254. ЧВК 2293970. PMID 17703632.
- ^ Серебро, Бахендека; Рамайя, Кошик; Эндрю, Сваи Бабу; Фредерик, Отиено; Баджадж, Сарита; Калра, Санджай; Charlotte, Bavuma M .; Клодин, Каригире; Махоба, Энтони (2018). «Рекомендации EADSG: инсулинотерапия при диабете». Лечение диабета. 9 (2): 449–492. Дои:10.1007 / s13300-018-0384-6. ЧВК 6104264. PMID 29508275.
- ^ "Великие дебаты: природный животный или искусственный инсулин человека?".
- ^ Вонг CY, Мартинес Дж, Дасс CR (2016). «Пероральная доставка инсулина для лечения диабета: статус-кво, проблемы и возможности». Журнал фармации и фармакологии. 68 (9): 1093–108. Дои:10.1111 / jphp.12607. PMID 27364922.
- ^ Шах РБ, Патель М., Маас Д.М., Шах В.Н. (2016). «Способы доставки инсулина: прошлое, настоящее и будущее». Международный журнал фармацевтических исследований. 6 (1): 1–9. Дои:10.4103 / 2230-973X.176456. ЧВК 4787057. PMID 27014614.
- ^ Сакула, А. (июль 1988 г.). «Поль Лангерганс (1847–1888): дань столетия». Журнал Королевского медицинского общества. 81 (7): 414–15. Дои:10.1177/014107688808100718. ЧВК 1291675. PMID 3045317.
- ^ Пети, Анри. "Эдуард Лагесс (1861–1927)". Музей региональной больницы Лилля (На французском). Получено 25 июля 2018.
- ^ Опи Э.Л. (1901). «Сахарный диабет, связанный с гиалиновой дегенерацией островов Лангерганса поджелудочной железы». Бюллетень больницы Джонса Хопкинса. 12 (125): 263–64. HDL:2027 / coo.31924069247447.
- ^ Опи Э.Л. (1901). "О связи хронического интерстициального панкреатита с островами Лангерганса и сахарным диабетом". Журнал экспериментальной медицины. 5 (4): 397–428. Дои:10.1084 / jem.5.4.397. ЧВК 2118050. PMID 19866952.
- ^ Опи Э.Л. (1901). «Связь сахарного диабета с поражением поджелудочной железы. Гиалиновая дегенерация островов Лангерганса». Журнал экспериментальной медицины. 5 (5): 527–40. Дои:10.1084 / jem.5.5.527. ЧВК 2118021. PMID 19866956.
- ^ Американский институт питания (1967). "Материалы тридцать первого ежегодного собрания Американского института питания". Журнал питания. 92 (4): 509. Дои:10.1093 / jn / 92.4.507.
- ^ Паулеско NC (31 августа 1921 г.). "Recherche sur le rôle du pancréas dans l'assimilation Nutritive". Archives Internationales de Physiologie. 17: 85–109.
- ^ Лестрадет Х (1997). "Le 75e anniversaire de la découverte de l'insuline". Диабет и метаболизм. 23 (1): 112.
- ^ де Лейва А., Брюгес Э., де Лейва-Перес А. (2011). «Открытие инсулина: продолжающиеся споры спустя девяносто лет». Endocrinología y Nutrición (английское издание). 58 (9): 449–456. Дои:10.1016 / j.endoen.2011.10.001.
- ^ Веккьо I, Торнали С., Брагацци Н.Л., Мартини М. (23.10.2018). «Открытие инсулина: важная веха в истории медицины». Границы эндокринологии. 9: 613. Дои:10.3389 / fendo.2018.00613. ЧВК 6205949. PMID 30405529.
- ^ Бантинг, Фредерик Г. (31 октября 1920 г.). «Записка от 31/20 октября из блокнота с вкладными листами 1920/21». Библиотеки Университета Торонто.
- ^ а б c Розенфельд Л. (декабрь 2002 г.). «Инсулин: открытие и противоречие». Клиническая химия. 48 (12): 2270–88. Дои:10.1093 / Clinchem / 48.12.2270. PMID 12446492.
- ^ Райт-младший (декабрь 2002 г.). «Почти знаменитый: Э. Кларк Ноубл, общая нить в открытии инсулина и винбластина». CMAJ. 167 (12): 1391–96. ЧВК 137361. PMID 12473641.
- ^ Кришнамурти К. (2002). Пионеры научных открытий. Mittal Publications. п. 266. ISBN 978-81-7099-844-0. Получено 26 июля 2011.
- ^ Bliss M (июль 1993 г.). «Переписывая историю болезни: Чарльз Бест и миф о Бантинге и Бесте» (PDF). Журнал истории медицины и смежных наук. 48 (3): 253–74. Дои:10.1093 / jhmas / 48.3.253. PMID 8409364. Архивировано из оригинал (PDF) на 2019-11-03.
- ^ Звездный еженедельник Торонто (14 января 1922 г.). «Работа над диабетом показывает прогресс в борьбе с болезнями». Библиотеки Университета Торонто.
- ^ Флетчер, А. А. (17 ноября 1962 г.). «Ранний клинический опыт применения инсулина». Журнал Канадской медицинской ассоциации. 87: 1052–5. ЧВК 1849803. PMID 13945508.
- ^ Бантинг, Фредерик Г. (декабрь 1921 - январь 1922). "Карты пациентов Леонарда Томпсона". Библиотеки Университета Торонто.
- ^ Цугер А. (4 октября 2010 г.). «Открытие первого чудо-лекарства». Нью-Йорк Таймс. Получено 2010-10-06.
Элизабет Хьюз была веселой, хорошенькой девочкой пяти футов ростом, с прямыми каштановыми волосами и всепоглощающим интересом к птицам. На диете доктора Аллен ее вес упал до 65 фунтов, затем до 52 фунтов, а затем, после приступа диареи, который чуть не убил ее весной 1922 года, до 45 фунтов. К тому времени она прожила три года, намного дольше, чем ожидалось. А потом ее мать услышала новость: в Канаде наконец-то изолировали инсулин.
- ^ Бантинг, Фредерик Г. (16 августа 1922 г.). "График для Элизабет Хьюз". Библиотеки Университета Торонто.
- ^ Вудбери, Дэвид Оукс (февраль 1963 г.). "Пожалуйста, спасите моего сына!". Библиотеки Университета Торонто.
- ^ Маркотт Б. (22 ноября 2010 г.). «Джон Уильямс из Рочестера - человек научных талантов». Демократ и хроника. Рочестер, Нью-Йорк. Компания Gannett. стр. 1B, 4B. Архивировано из оригинал 23 ноября 2010 г.. Получено 22 ноября, 2010.
- ^ Комитет по инсулину Совета управляющих Университета Торонто (25 января 1922 г.). Меморандум о сотрудничестве Антитоксиновых лабораторий Коннаута в исследованиях, проведенных доктором Бантингом, мистером Бестом и доктором Коллипом под общим руководством профессора Дж. Дж. Р. Маклеода, с целью получения экстракта поджелудочной железы, оказывающего специфическое влияние на кровь концентрация сахара ». Библиотеки Университета Торонто.
- ^ Блаженство М (2007). Открытие инсулина (25-летие изд.). Чикаго: Издательство Чикагского университета. п. 132. ISBN 9780226058993. OCLC 74987867.
Компания Lilly будет рада работать с Торонто, Клоуны написал и намекнул, возможно, намеренно, а может быть, и нет, что Торонто можно обойти: «Я до сих пор воздерживался от начала работы в наших лабораториях по этому вопросу, так как я очень хотел избежать какого-либо вмешательства в вашу сферу деятельности. и вашим коллегам, пока вы не опубликуете свои результаты. Однако я считаю, что сейчас этот вопрос настолько важен, что мы должны незамедлительно приступить к экспериментальной части вопроса, предпочтительно сотрудничая с вами и вашими коллегами ... "
- ^ Кендалл, Эдвард Кальвин (10 апреля 1922 г.). "Письмо доктору Дж. Дж. Р. Маклауду 10.04.1922". Библиотеки Университета Торонто: открытие и ранняя разработка инсулина.
- ^ Macleod, J.J.R. (28 апреля 1924 г.). "Заявление Дж. Дж. Р. Маклауда на заседании Комитета по инсулину относительно патентов и лицензионных отчислений 28.04.1924". Библиотеки Университета Торонто: открытие и ранняя разработка инсулина.
- ^ Блаженство М (2007). Открытие инсулина (25-летие изд.). Чикаго: Издательство Чикагского университета. С. 131–133. ISBN 9780226058993. OCLC 74987867.
- ^ Banting FG, Best C, Collip JS (15 января 1923 г.). «Поручение губернаторам Университета Торонто». Библиотеки Университета Торонто: открытие и ранняя разработка инсулина.
- ^ «Копия статьи: шаг вперед в медицинской этике». Библиотеки Университета Торонто: открытие и ранняя разработка инсулина. Мировая работа. Февраль 1923 г.
- ^ Блаженство М (2007). Открытие инсулина (25-летие изд.). Чикаго: Издательство Чикагского университета. п. 181. ISBN 9780226058993. OCLC 74987867.
- ^ Абель Дж. Дж. (Февраль 1926 г.). «Кристаллический инсулин». Труды Национальной академии наук Соединенных Штатов Америки. 12 (2): 132–6. Bibcode:1926ПНАС ... 12..132А. Дои:10.1073 / pnas.12.2.132. ЧВК 1084434. PMID 16587069.
- ^ Somogyi M, Doisy EA, Shaffer PA (май 1924 г.). «О приготовлении инсулина» (PDF). Журнал биологической химии. 60 (1): 31–58.
- ^ Дженсен Х., Эванс Э.А. (1 января 1935 г.). "Исследования кристаллического инсулина Xviii. Природа свободных аминогрупп в инсулине и выделение фенилаланина и пролина из кристаллического инсулина" (PDF). Журнал биологической химии. 108 (1): 1–9.
- ^ Сэнгер Ф., Таппи Х. (сентябрь 1951 г.). «Аминокислотная последовательность в фенилаланильной цепи инсулина. I. Идентификация низших пептидов из частичных гидролизатов». Биохимический журнал. 49 (4): 463–81. Дои:10.1042 / bj0490463. ЧВК 1197535. PMID 14886310.; Сэнгер Ф., Таппи Х. (сентябрь 1951 г.). «Аминокислотная последовательность в фенилаланильной цепи инсулина. 2. Исследование пептидов из ферментативных гидролизатов». Биохимический журнал. 49 (4): 481–90. Дои:10.1042 / bj0490481. ЧВК 1197536. PMID 14886311.; Сэнгер Ф., Томпсон Э.О. (февраль 1953 г.). «Аминокислотная последовательность в глицильной цепи инсулина. I. Идентификация низших пептидов из частичных гидролизатов». Биохимический журнал. 53 (3): 353–66. Дои:10.1042 / bj0530353. ЧВК 1198157. PMID 13032078.; Сэнгер Ф., Томпсон Э.О. (февраль 1953 г.). «Аминокислотная последовательность в глицильной цепи инсулина. II. Исследование пептидов из ферментативных гидролизатов». Биохимический журнал. 53 (3): 366–74. Дои:10.1042 / bj0530366. ЧВК 1198158. PMID 13032079.
- ^ Кацояннис П.Г., Фукуда К., Томецко А., Судзуки К., Тилак М. (1964). «Пептиды инсулина. X. Синтез B-цепи инсулина и его комбинация с естественным или синтетическим A-подбородком для создания инсулиновой активности». Журнал Американского химического общества. 86 (5): 930–32. Дои:10.1021 / ja01059a043.
- ^ Kung YT, Du YC, Huang W.T., Chen CC, Ke LT (ноябрь 1965 г.). «Полный синтез кристаллического бычьего инсулина». Scientia Sinica. 14 (11): 1710–6. PMID 5881570.

- ^ Марглин А., Меррифилд РБ (ноябрь 1966 г.). «Синтез бычьего инсулина твердофазным методом». Журнал Американского химического общества. 88 (21): 5051–2. Дои:10.1021 / ja00973a068. PMID 5978833.
- ^ Костин Г.Е. (январь 2004 г.). «В чем преимущество наличия меланина в частях центральной нервной системы (например, черной субстанции)?». IUBMB Life. Time Inc. 56 (1): 47–9. Дои:10.1080/15216540310001659029. PMID 14992380.
- ^ Воллмер А., Дикен М.Л., Федервиш М., Де Мейтс П. (2002). Структура инсулина и родственных белков для функционирования и фармакология. Бостон: Kluwer Academic Publishers. ISBN 978-1-4020-0655-5.
- ^ Цоу С (2015). 对 人工 合成 结晶 牛 胰岛素 的 回忆 [Память об исследовании синтеза бычьего инсулина]. 生命 科学 [Китайский вестник наук о жизни] (на китайском языке). 27 (6): 777–79.
- ^ а б Бланделл Т.Л., Катфилд Дж.Ф., Катфилд С.М., Додсон Э.Дж., Додсон Г.Г., Ходжкин Д.К. и др. (Июнь 1971 г.). «Атомные позиции в ромбоэдрических кристаллах 2-цинка инсулина». Природа. 231 (5304): 506–11. Bibcode:1971 г.Натура.231..506Б. Дои:10.1038 / 231506a0. PMID 4932997. S2CID 4158731.
- ^ "Сафлор может стать новым источником инсулина | Новости CTV". www.ctvnews.ca. Февраль 2010 г.. Получено 2019-11-12.
- ^ Кьельдсен Т. (сентябрь 2000 г.). «Секреторная экспрессия предшественников инсулина дрожжами» (PDF). Прикладная микробиология и биотехнология. 54 (3): 277–86. Дои:10.1007 / s002530000402. PMID 11030562. S2CID 9246671. Архивировано из оригинал (PDF) на 2017-09-27.
- ^ "Нобелевская премия по физиологии и медицине 1923 г.". Нобелевский фонд.
- ^ Фельман А. (22 ноября 2018 г.). "Кто открыл инсулин?". Медицинские новости сегодня.
- ^ Замок WB (1962). «Лекция Гордона Уилсона. Век любопытства по поводу пагубной анемии». Труды Американской клинической и климатологической ассоциации. 73: 54–80. ЧВК 2249021. PMID 21408623.
- ^ Бантинг Ф. Г., Лучший чемпион мира, Коллип Дж. Б., Кэмпбелл В. Р., Флетчер А. А. (март 1922 г.). «Экстракты поджелудочной железы в лечении сахарного диабета». Журнал Канадской медицинской ассоциации. 12 (3): 141–46. ЧВК 1524425. PMID 20314060.
- ^ Друри М.И. (июль 1972 г.). «Золотой юбилей инсулина». Журнал Ирландской медицинской ассоциации. 65 (14): 355–63. PMID 4560502.
- ^ Мюррей I (апрель 1971 г.). «Паулеско и выделение инсулина». Журнал истории медицины и смежных наук. 26 (2): 150–57. Дои:10.1093 / jhmas / XXVI.2.150. PMID 4930788.
дальнейшее чтение
- Законы GM, Ривен А (1999). Инсулинорезистентность: метаболический синдром X. Тотова, Нью-Джерси: Humana Press. Дои:10.1226/0896035883 (неактивно 27.11.2020). ISBN 978-0-89603-588-1.CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (связь)
- Лихи Дж. Л., Чефалу В. Т. (22 марта 2002 г.). Инсулиновая терапия (1-е изд.). Нью-Йорк: Марсель Деккер. ISBN 978-0-8247-0711-8.
- Кумар С., О'Рахилли С. (14 января 2005 г.). Инсулинорезистентность: действие инсулина и его нарушения при заболевании. Чичестер, Англия: Wiley. ISBN 978-0-470-85008-4.
- Эрлих А., Шредер К.Л. (2000-06-16). Медицинская терминология для медицинских профессий (4-е изд.). Томсон Делмар Обучение. ISBN 978-0-7668-1297-0.
- Дразнин Б, LeRoith D (сентябрь 1994). Молекулярная биология диабета: аутоиммунитет и генетика; Синтез и секреция инсулина. Тотова, Нью-Джерси: Humana Press. Дои:10.1226/0896032868 (неактивно 27.11.2020). ISBN 978-0-89603-286-6.CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (связь)
- Известные канадские врачи: сэр Фредерик Бантинг в Библиотеке и архивах Канады
- Маккидж К., Гоа К.Л. (2001). «Инсулин гларгин: обзор его терапевтического использования в качестве средства длительного действия для лечения сахарного диабета 1 и 2 типа». Наркотики. 61 (11): 1599–624. Дои:10.2165/00003495-200161110-00007. PMID 11577797. S2CID 46972328.
- де Лейва А., Брюгес Э., де Лейва-Перес А. (ноябрь 2011 г.). «[Открытие инсулина: продолжаются споры спустя 90 лет]». Эндокринология и Nutricion (на испанском). 58 (9): 449–56. Дои:10.1016 / j.endonu.2011.10.001. PMID 22036099.
- Vecchio I, Tornali C, Bragazzi NL, Martini M (2018). «Открытие инсулина: важная веха в истории медицины». Границы эндокринологии. 9: 613. Дои:10.3389 / fendo.2018.00613. ЧВК 6205949. PMID 30405529.
внешняя ссылка
- Коллекция библиотек Университета Торонто: открытие и ранняя разработка инсулина, 1920–1925 гг.
- Цифровые архивы CBC - Banting, Best, Macleod, Collip: В поисках лекарства от диабета
- Анимации действия инсулина в организме на AboutKidsHealth.ca
- Обзор всей структурной информации, доступной в PDB за UniProt: P01308 (Инсулин) в PDBe-KB.